人参多糖对育成期雄性水貂生长性能、营养物质消化率、氮代谢及血清生化指标的影响
孙伟丽 王 卓 樊燕燕 杜东升 谷海军 杨 福 李光玉*
(1.中国农业科学院特产研究所,吉林省特种经济动物分子生物学国家重点实验室,长春130112;2.牧原食品股份有限责任公司 南阳474150;3.沈阳博阳饲料有限责任公司,辽中110202;4.吉林特研生物技术有限公司,长春130112)
人参多糖对育成期雄性水貂生长性能、营养物质消化率、氮代谢及血清生化指标的影响
孙伟丽1王 卓1樊燕燕2杜东升3谷海军4杨 福1李光玉1*
(1.中国农业科学院特产研究所,吉林省特种经济动物分子生物学国家重点实验室,长春130112;2.牧原食品股份有限责任公司 南阳474150;3.沈阳博阳饲料有限责任公司,辽中110202;4.吉林特研生物技术有限公司,长春130112)
本试验旨在研究人参多糖对育成期雄性水貂生长性能、营养物质消化率、氮代谢及血清生化指标的影响。采用单因子试验设计,选择70日龄健康、体重相近的雄性水貂40只,随机分成4组,每组10个重复,每个重复1只水貂。Ⅰ组(对照组)饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ组分别在基础饲粮中添加10、50和100 mg/kg的人参多糖(干物质基础)。预试期7 d,正试期60 d。结果表明:1)Ⅳ组末重(130日龄体重)和平均日增重显著高于对照组(P<0.05);各组料重比随着人参多糖添加水平升高而逐渐降低,Ⅳ组显著低于对照组和Ⅱ组(P<0.05)。2)Ⅳ组干物质排出量极显著低于对照组和Ⅱ组(P<0.01),Ⅲ、Ⅳ组干物质消化率和粗蛋白质消化率均显著或极显著高于对照组(P<0.05或P<0.01),各组间粗脂肪消化率差异不显著(P>0.05)。3)各组间食入氮、粪氮、尿氮和氮沉积差异不显著(P>0.05);净蛋白质利用率随着人参多糖添加水平升高而逐渐升高,Ⅳ组显著高于对照组(P<0.05)。4)Ⅱ、Ⅲ、Ⅳ组血清白蛋白含量极显著高于对照组(P<0.01),Ⅳ组血清总蛋白、球蛋白、免疫球蛋白M含量显著高于对照组(P<0.05),各组间血清免疫球蛋白G、免疫球蛋白A、总胆固醇、甘油三酯和葡萄糖含量无显著差异(P>0.05)。由此可见,饲粮中添加人参多糖可提高水貂净蛋白质利用率,进而提高干物质消化率和粗蛋白质消化率,调节血清中免疫球蛋白M含量,提高免疫力,提高生长性能。
人参多糖;水貂;生长性能;营养物质消化率;血清生化指标
水貂是哺乳纲,食肉目,鼬科,鼬属动物,毛皮是其主要产品,属于珍贵毛皮动物,其肠道较短,食物消化周期短,肠道排空时间短。水貂属于肉食性动物,其饲料以动物性饲料原料为主,占70%左右,谷物性饲料仅占不到30%[1]。水貂消化道内的消化酶主要是蛋白酶和脂肪酶,其他消化酶较少,消化道内存在着大量的微生物群落,这些微生物主要在大肠中参与辅助消化食物,包括细菌、古菌和寄生虫等,其中细菌占有绝对优势[2]。水貂个体的大小直接影响皮张的尺寸,进而决定了经济生产效益。因此生产中如何提高水貂的体重和饲料的消化吸收率这些问题,具有很高的研究价值。多糖类物质具有益生元的作用,探索出能够调节水貂营养物质消化率及促进生长的物质将极大提高水貂养殖业的经济效益。研究表明,多糖、寡糖类物质如木聚糖、果寡糖(FOS)及黄芪多糖均有益生元作用,是饲料添加剂的备选材料[3]。王卓等[4]报道了在育成期水貂饲粮中添加0.9%的果寡糖具有替代150 mg/kg土霉素的效果。人参多糖(giseng polysaccharide,GPS)为人参中的主要成分之一,具有增强免疫、抗肿瘤、抗衰老、抗辐射等作用[5]。人参多糖与其他常见多糖(如灵芝多糖、黄芪多糖、香菇多糖等)相比,具有淀粉含量高、果胶成分结构复杂等特点[6]。人参多糖已被证明具有调节免疫活性的作用,人参多糖复合物可提高南美白对虾肝脏中超氧化物歧化酶(SOD)的活性,增强免疫力[7]。因此,本研究旨在探讨人参多糖应用于珍贵毛皮动物水貂饲粮中的效果,研究其对水貂生长性能、营养物质消化率、氮代谢及血清生化指标的影响,为人参多糖应用于毛皮动物功能性饲料添加剂提供理论支持。
1 材料与方法
1.1 试验材料
人参多糖由中国农业科学院特产研究所药用植物资源创新团队提供。将干燥人参根浸泡、热水煮提、2次乙醇沉淀后得到人参多糖,产率为10%。以葡萄糖(GLU)为标准品,采用苯酚硫酸法[8]测得总糖含量为90%。
1.2 试验设计与饲养管理
选取70日龄的雄性短毛黑水貂40只,平均体重为(1.05±0.09) kg,随机分为4个组,每组10个重复,每个重复1只水貂。各组水貂初始体重差异不显著(P>0.05)。采用单因子试验设计,Ⅰ组(对照组)饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ组分别在基础饲粮中添加10、50和100 mg/kg的人参多糖(干物质基础)。根据NRC(1982)并结合国内饲养经验,使用水貂常用鲜动物性饲料原料鱼、鸡肝、鸡骨架等配制基础饲粮,其组成及营养水平见表1。预试期7 d,正试期60 d。正式试验开始后,每隔2周于早晨空腹称重。试验动物采取单笼饲养,由专人进行饲养管理,每日08:00和15:00各喂食1次,自由采食并保证充足饮水。
1.3 样品采集
粪尿样品:在正试期开始30 d后,水貂生长速度较快的阶段进行消化代谢试验。每组挑选6只体重相近,采食正常的健康水貂。消化代谢试验期间饲养管理与日常饲养管理完全相同。采用全收粪法收集4 d的粪尿,尿液收集前于收集桶中加入10 mL 10%的硫酸固氮。消化代谢试验结束后,将尿液过滤收集于10 mL离心管中,保存于-20 ℃备用。全部粪样混合均匀后,取200~300 g经10%的硫酸处理后,于65 ℃烘干,粉碎后过40目筛保存备用。

表1 基础饲粮组成及营养水平Table 1 Composition and nutrient levels of the basal diet %
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 10 000 IU,VD32 000 IU,VE 100 IU,VB16 mg,VB210 mg,VB66 mg,VB120.1 mg,VK31 mg,VC 400 mg,烟酸 nicotinic acid 30 mg,D-泛酸D-pantothenic acid 40 mg,生物素 biotin 0.2 mg,叶酸 folic acid 1 mg,胆碱 choline 400 mg,Fe 82 mg,Cu 20 mg,Mn 120 mg,Zn 50 mg,I 0.5 mg,Se 0.2 mg,Co 0.3 mg。
2)代谢能和碳水化合物为计算值,其余为实测值。ME and CHO were calculated values, while the others were measured values.
血清样品:饲养试验结束后,每组分别选取6只水貂,剪趾甲方式采血,每只采血5 mL,置于促凝固管中,静置待血清析出后3 500 r/min、4 ℃离心10 min,将分离出的血清分装在1.5 mL的Eppendorf管中,置于-80 ℃中保存,备用。
1.4 指标测定
1.4.1 营养物质消化率和氮代谢
试验饲粮和粪中的干物质、粗蛋白质、粗脂肪、粗灰分以及尿中的粗蛋白质具体测定方法参照张丽英[7]的方法,营养物质消化率、氮沉积、净蛋白质利用率及蛋白质生物学价值计算公式如下:
干物质消化率(%)=[(干物质采食量-
干物质排出量)/干物质采食量]×100;
粗蛋白质消化率(%)=[(蛋白质摄入量-蛋白质
排出量)/蛋白质摄入量]×100;
粗脂肪消化率(%)=[(脂肪摄入量-脂肪
排出量)/脂肪摄入量]×100;
氮沉积(g/d)=食入氮-粪氮排出量-
尿氮排出量;
净蛋白质利用率(%)=(沉积氮/食入氮)×100;
蛋白质生物学价值(%)=[氮沉积/(食入氮-
粪氮排出量)]×100。
1.4.2 生长性能
试验期每隔2周07:00空腹称重,计算水貂各生长阶段体重,计算试验期间平均日增重、平均日采食量和料重比。
1.4.3 血清生化指标
白蛋白(ALB)、总蛋白(TP)、球蛋白(GLO)、总胆固醇(CHO)、甘油三酯(TG)和GLU含量采用全自动生化分析仪测定(Selectra E,荷兰),试剂盒购自中生北控生物科技有限公司,严格按照说明书操作。免疫球蛋白G(IgG)、免疫球蛋白A(IgA)和免疫球蛋白M(IgM)含量采用酶联免疫吸附试验(ELISA)试剂盒测定,试剂盒购自南京建成生物工程研究所。
1.5 数据处理
数据用统计软件SAS 8分析,采用GLM程序进行单因素方差分析(one-way ANOVA),差异显著性采用Duncan氏法进行多重比较,数据以平均值±标准差表示,其中P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 人参多糖对育成期水貂生长性能的影响
由表2可知,各组初始体重(70日龄体重)差异不显著(P>0.05);与对照组相比,Ⅱ、Ⅲ和Ⅳ组85和100日龄体重差异不显著(P>0.05);Ⅳ组115和130日龄体重显著高于对照组(P<0.05)。Ⅳ组平均日增重显著高于对照组(P<0.05)。各组间平均日采食量差异不显著(P>0.05)。料重比随着人参多糖添加水平增加而降低,Ⅳ组显著低于对照组和Ⅱ组(P<0.05),与Ⅲ组差异不显著(P>0.05)。
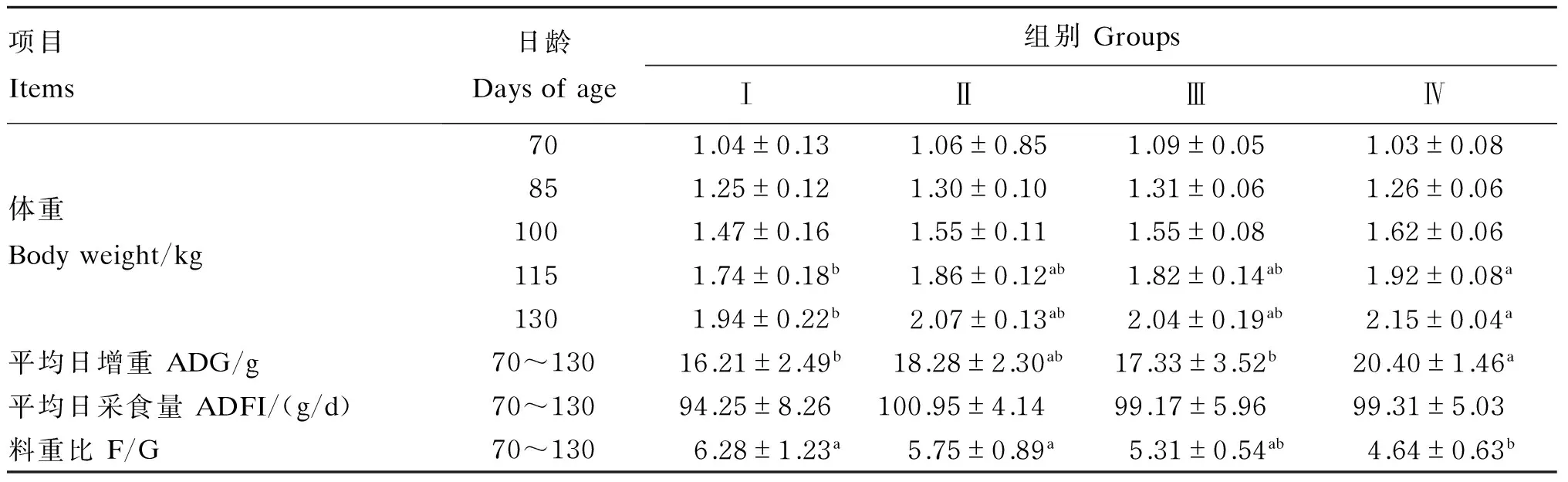
表2 人参多糖对育成期水貂生长性能的影响Table 2 Effects of GPS on growth performance of minks during growing period
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 人参多糖对育成期水貂营养物质消化率的影响
由表3可知,随着人参多糖添加水平的提高,水貂的干物质排出量逐渐降低,Ⅳ组极显著低于对照组和Ⅱ组(P<0.01),Ⅳ组和Ⅲ组之间差异不显著(P>0.05)。干物质消化率随着人参多糖添加水平的增加而升高,Ⅳ组极显著高于对照组(P<0.01),Ⅲ组显著高于对照组(P<0.05)。粗蛋白质消化率随着人参多糖添加水平的增加而升高,Ⅳ组极显著高于对照组(P<0.01),Ⅲ组显著高于对照组(P<0.05)。各组间粗脂肪消化率无显著差异(P>0.05)。
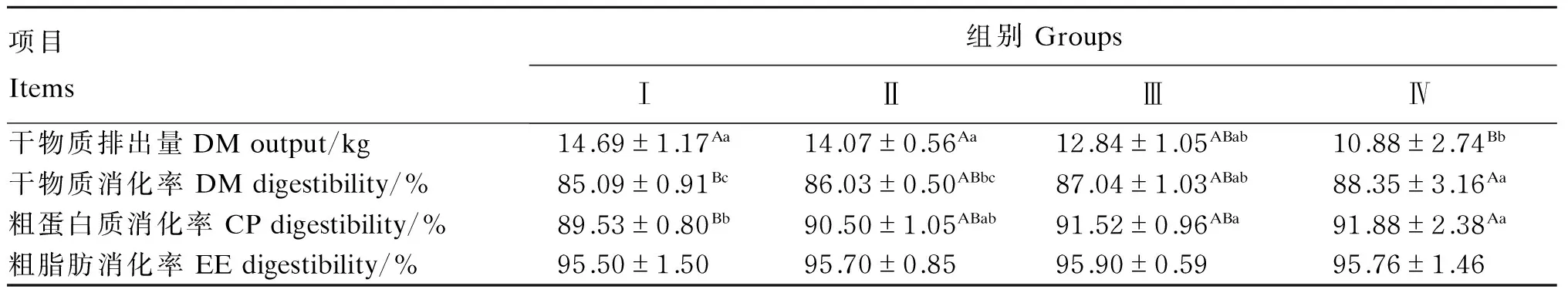
表3 人参多糖对育成期水貂营养物质消化率的影响Table 3 Effects of GPS on nutrient digestibility of minks during growing period
2.3 人参多糖对育成期水貂氮代谢的影响
由表4可知,各组间食入氮、粪氮、尿氮和氮沉积差异不显著(P>0.05);与对照组相比,Ⅳ组显著提高了净蛋白质利用率(P<0.05)。蛋白质生物学价值随着人参多糖添加水平的增加而逐渐提高,但各组间差异不显著(P>0.05)。
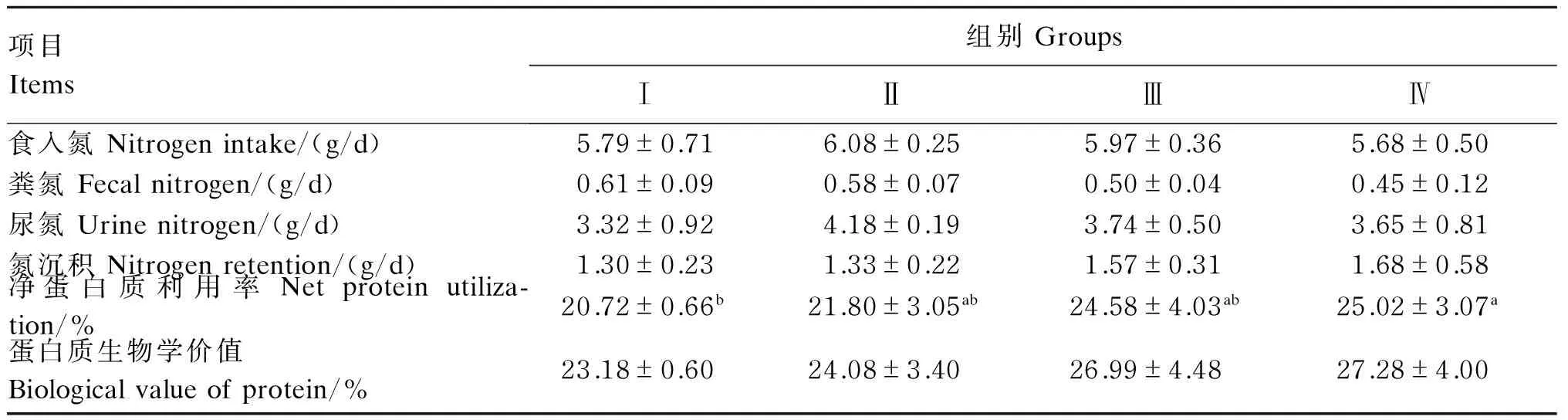
表4 人参多糖对育成期水貂氮代谢的影响Table 4 Effects of GPS on nitrogen metabolize of minks during growing period
2.4 人参多糖对育成期水貂血清生化指标的影响
由表5可知,Ⅳ组血清TP含量显著高于对照组(P<0.05)。Ⅱ、Ⅲ和Ⅳ组血清ALB含量极显著高于对照组(P<0.01),Ⅱ、Ⅲ和Ⅳ组之间差异不显著(P>0.05)。Ⅳ组血清GLO含量显著高于对照组(P<0.05)。Ⅳ组血清IgM含量显著高于对照组(P<0.05)。各组间血清IgG、IgA、CHO、TG和GLU含量差异不显著(P>0.05)。

表5 人参多糖对育成期水貂血清生化指标的影响Table 5 Effects of GPS on serum biochemical indices of minks during growing period
3 讨 论
3.1 人参多糖对育成期水貂生长性能和营养物质消化率的影响
本试验结果显示,饲粮中添加人参多糖的水貂在日龄115和130日龄时,Ⅳ组体重均显著高于对照组;Ⅳ组平均日增重显著高于对照组;各组间平均日采食量差异不显著。料重比是反映饲料转化率的重要指标,本试验料重比随着人参多糖添加水平的增加而降低,Ⅳ组显著低于对照组和Ⅱ组,与Ⅲ组差异不显著。多糖是一类结构复杂的高分子化合物,是构成生命的四大基本物质之一,同时也是一类具有免疫调节活性的生物大分子物质。人参多糖是从人参中提取的具有特殊生物活性的多糖混合物[8-9],在水产养殖中,陈勇等[10]报道人参多糖能增进消化酶的分泌及消化肠道内有益菌的繁殖,从而促进异育银鲫的消化功能。习欠云等[7]发现人参多糖复合物对南美白对虾的相对增重率并无显著作用。卢可[11]报道了在饲料中添加0.2、0.4 g/kg的松子壳多糖在一定起效时间内能显著提高奥尼罗非鱼增重率。本试验中人参多糖体现出促生长的作用,对水貂血清生化指标以及蛋白质消化率有提高作用,与自身体长相比,水貂肠道较其他哺乳动物短,食物消化排空的周期也较短。有研究表明,功能性寡糖被胃肠内有益微生物尤其是双歧杆菌利用,有益于健康微生态的形成与保持,使得动物免疫性能提高,腹泻发生率减少,代谢活动增强,采食量增大,并能促进饲料原料成分的降解和利用,在一定程度上促进机体营养物质的吸收和利用,从而有利于动物生长[12]。本试验结果显示,饲粮添加人参多糖降低了干物质排出量,粗蛋白质消化率随着人参多糖添加水平的增加而提高,Ⅳ组极显著高于对照组,Ⅲ组显著高于对照组。有多糖的作用机制研究显示,通过对肠道微生物的选择性增殖而合成多种挥发性脂肪酸和氨基酸,从而影响着机体的氮代谢[13]。人参多糖增强氮代谢的作用机制还有待于进一步研究。
3.2 人参多糖对育成期水貂血清生化指标的影响
多糖类物质是中药复杂成分之一,在中药治疗中起着重要作用。研究发现多糖及多糖复合物参与和介导了多种细胞功能的调节,它们能够刺激多种免疫细胞,促进白细胞介素、肿瘤坏死因子、干扰素等细胞因子的合成,调节抗体和补体等来调节免疫系统[14]。饲粮中添加复合多糖后,miRNA可能参与调控免疫相关基因或免疫调控蛋白C型凝集素和免疫球蛋白血蓝蛋白,以提高凡纳滨对虾免疫力[15]。人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能具有调节作用,均可以使单个核细胞(PBMC)和派伊尔结淋巴细胞(PPL)培养上清液中肿瘤坏死因子的水平升高[16],人参多糖能促进黑鲷生长并影响黑鲷非特异性免疫功能[17]。总结已有研究结果,人参多糖促进机体免疫力的途径主要有调节与免疫相关的基因表达,刺激免疫因子分泌或提高机体抗菌酶活性等。
血清生化指标反映了机体营养代谢情况和各组织器官功能,也间接反映了动物的生长性能。一般来说,血清TP、ALB含量的升高表明肝脏合成蛋白质的能力加强,血清GLB含量的升高是免疫力提高的表现[18]。刘辉等[19]研究发现,益生菌通过提高血清中TP和GLB含量,在改善肝脏的蛋白质合成和提高机体的免疫力方面具有积极的作用。免疫球蛋白是介导动物体液免疫的主要免疫分子,也是反映机体免疫功能的重要指标,血清中IgG、IgM、IgA含量的升高表明机体免疫功能增强。本试验中水貂与氮代谢相关的血清生化指标变化趋势和消化率变化趋势一致,Ⅱ、Ⅲ和Ⅳ组血清中TP和ALB含量均高于对照组,且血清ALB含量达到极显著水平,Ⅱ、Ⅲ和Ⅳ组之间差异不显著。Ⅳ组血清GLO和IgM含量显著高于对照组,Ⅱ、Ⅲ组与对照组相比差异不显著。各组间血清CHO、TG和GLU含量差异不显著。
有研究表明,酵母细胞壁中成分(如甘露寡糖、葡聚糖)可以通过活性巨噬细胞触发肠道上皮细胞或肠道相关性淋巴样组织Th-1的应答,从而增强机体免疫力[20-21]。肠道黏膜免疫系统是产生免疫耐受作用的重要部位,通过激活肠道黏膜免疫,达到免疫耐受或者免疫抑制是治疗自身免疫性疾病的可能途径之一。未来研究中应着重研究人参多糖对比抗生素对水貂腹泻率的效果,如何有效提高机体免疫力,以及研究其通过调节哪些基因或者因子等途径发挥作用。
4 结 论
饲粮中添加人参多糖提高了水貂生长性能,提高了粗蛋白质消化率和净蛋白质利用率。本试验中,水貂饲粮人参多糖添加水平为50~100 mg/kg时,提高了机体的免疫能力。
[1] 李光玉,杨福合.狐 貉 貂养殖新技术[M].北京:中国农业科学技术出版社,2006.
[2] 范忠原.家养水貂肠道微生物多样性分析[D].博士学位论文.北京:中国农业科学院,2015.
[3] 陈群,刘家昌.人参多糖、黄芪多糖、枸杞多糖的研究进展[J].淮南师范学院学报,2001,3(2):39-41.
[4] 王卓,孙伟丽,樊燕燕,等.果寡糖对育成期水貂生长性能、营养物质消化率、氮代谢和血清生化指标的影响[J].动物营养学报,2015,27(11):3613-3619.
[5] 张彬,林瑞超,冯芳.人参多糖的研究概况[J].中国药事,2004,18(9):566-569.
[6] 李珊珊,金银萍,姚春林,等.人参多糖的结构与活性研究进展[J].中国中药杂志,2014,39(24):4709-4715.
[7] 习欠云,刘小龙,方淑娴,等.人参多糖复合物对南美白对虾免疫增强效果的研究[J].饲料工业,2009,30(6):15-17.
[8] 宋利华,王红梅,萧伟.人参多糖的分级及其免疫活性初探[J].中国实验方剂学杂志,2012,18(14):162-166.
[9] 倪维华.人参多糖免疫活性及抗肿瘤作用[D].博士学位论文.长春:东北师范大学,2010.
[10] 陈勇,周洪琪.三种多糖对异育银鲫肠道、肝胰脏蛋白酶和淀粉酶活性的影响[J].上海水产大学学报,2005,14(4):468-471.
[11] 卢可.松籽壳多糖对奥尼罗非鱼免疫功能调节作用的研究[D].硕士学位论文.长春:吉林大学,2007.
[12] TOKUNAGA T,OKU T,HOSOYA N.Utilization and excretion of a new sweetener,fructooligosaccharide (Neosugar),in rats[J].The Journal of Nutrition,1989,119(4):553-559.
[13] 林英庭.影响寡糖类饲料添加剂利用效果的因素[J].畜牧与兽医,2001,33(6):15-16.
[14 ] OOI V E C,LIU F.Immunomodulation and anti-cancer activity of polysaccharide-protein complexes[J].Current Medicinal Chemistry,2000,7(7):715-729.
[15] 汪元梅,熊接华,叶瑞松,等.饲料中添加人参多糖对凡纳滨对虾miRNAs的影响[J].畜牧与兽医,2012(S1):370.
[16] 张皖东,吕诚,刘振丽,等.人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能的影响[J].中草药,2007,38(2):221-223.
[17] 李春震,胡鲲,唐雪莲,等.人参多糖对黑鲷生长性能及抗氧化酶mRNA表达的影响[J].华中农业大学学报,2015,34(6):94-100.
[18] 董晓丽,张乃锋,周盟,等.复合菌制剂对断奶仔猪生长性能、粪便微生物和血清指标的影响[J].动物营养学报,2013,25(6):1285-1292.
[19] 刘辉,季海峰,王四新,等.益生菌对生长猪生长性能、粪便微生物数量、养分表观消化率和血清免疫指标的影响[J].动物营养学报,2015,27(3):829-837.
[20] INDEGRREW W M.Yeast:could you have a business on this bug[C]//Biotechnology in the Feed Industry.Loughborough,Leics:Nottingham University Press,1999,15:27-50.
[21] SHEN Y B,PIAO X S,KIM S W,et al.Effects of yeast culture supplementation on growth performance,intestinal health,and immune response of nursery pigs[J].Journal of Animal Science,2009,87(8):2614-2624.
*Corresponding author, professor, E-mail: tcslgy @126.com
(责任编辑 武海龙)
Effects of Giseng Polysaccharide on Growth Performance,Nutrient Digestibility, Nitrogen Metabolism and Serum Biochemical Indices of Minks during Growing Period
SUN Weili1WANG Zhuo1FAN Yanyan2DU Dongsheng3GU Haijun4YANG Fu1LI Guangyu1*
(1.JilinProvincialKeyLaboratoryforMolecularBiologyofSpecialEconomicAnimals,InstituteofSpecialAnimalandPlantSciences,ChineseAcademyofAgricultureSciences,Changchun130112,China; 2.MuyuanFoodCompanyCo.Ltd.Nanyang474150,China; 3.ShenyangBoyangFeedCompany,Co.Ltd.,Liaozhong110202,China; 4.JilinTeyanBiologicalTechnologyLimitedLiabilityCompany,Changchun130112,China)
This experiment was conducted to investigate the effects of giseng polysaccharide on growth performance, nutrient digestibility, nitrogen metabolism and serum biochemical indices of minks during growing period. The experiment was designed in a single factor. Forty 70-day-old healthy male minks with similar body weight were randomly divided into 4 groups with 10 replicates per replicate and 1 mink per replicate. The control group (group Ⅰ) was fed a basal diet, and groups Ⅱ, Ⅲ and Ⅳ were fed the experimental diets supplemented with 10, 50 and 100 mg/kg giseng polysaccharide (based on dry matter), respectively. The pretest period lasted for 7 days and the formal period lasted for 60 days. The results showed as follows: 1) the final body weight (body weight at 130 days of age) and average daily gain in group Ⅳ was significantly higher than those in control group (P<0.05); the ratio of feed to gain (F/G) was decreased with the giseng polysaccharide supplemental level increasing, and the F/G of group Ⅳ was significantly lower than that in control group and group Ⅱ (P<0.05). 2) The dry matter output in group Ⅳ was significantly lower than that in control group and group Ⅱ (P<0.05), the dry matter digestibility and crude protein digestibility in groups Ⅲ and Ⅳ were significantly higher than those in control group (P<0.05 orP<0.01), no significant difference was found in crude fat digestibility among all groups (P>0.05). 3) No significant difference was found in nitrogen intake, fecal nitrogen, urine nitrogen and nitrogen retention among all groups (P>0.05); the net protein utilization was increased with the giseng polysaccharide supplemental level increasing, and the net protein utilization in group Ⅳ was significantly higher than that in control group (P<0.05). 4) The serum albumin content in groups Ⅱ, Ⅲ and Ⅳ was significantly higher than that in control group (P<0.01), the content of total protein, globulin and immunoglobulin M in serum was significantly higher than that in control group (P<0.05), no significant difference was found in the content of immunoglobulin M, immunoglobulin A, total cholesterol, triglycerides and glucose in serum among all groups (P>0.05). In conclusion, dietary supplemented with giseng polysaccharide can increase the net protein utilization of minks, then improve the dry matter digestibility and crude protein digestibility, regulate the serum immunoglobulin M content, enhance immunity, and improve the growth performance.[ChineseJournalofAnimalNutrition, 2017, 29(6):2057-2063]
giseng polysaccharide; minks; growth performance; nutrient digestibility; serum biochemical indices
10.3969/j.issn.1006-267x.2017.06.027
2016-12-01
吉林省科技发展计划项目(20150101112JC);中国农业科学院科技创新工程经费资助
孙伟丽(1982—),女,黑龙江牡丹江人,博士研究生,研究方向为特种经济动物营养与饲养。E-mail: tcsswl@163.com
*通信作者:李光玉,研究员,博士生导师,E-mail:tcslgy@126.com
S865.2+2
A
1006-267X(2017)06-2057-07

