珠江水系鱼类群落多样性空间分布格局
帅方敏,李新辉,*,刘乾甫,李跃飞,杨计平,李 捷,陈方灿
1 中国水产科学研究院珠江水产研究所, 广州 510380 2 农业部珠江中下游渔业资源环境重点野外科学观测试验站, 肇庆 526100 3 中国水产科学研究院珠江流域渔业资源养护与生态修复重点实验室, 广州 510380
珠江水系鱼类群落多样性空间分布格局
帅方敏1,2,3,李新辉1,2,3,*,刘乾甫1,2,3,李跃飞1,2,3,杨计平1,2,3,李 捷1,2,3,陈方灿1,2,3
1 中国水产科学研究院珠江水产研究所, 广州 510380 2 农业部珠江中下游渔业资源环境重点野外科学观测试验站, 肇庆 526100 3 中国水产科学研究院珠江流域渔业资源养护与生态修复重点实验室, 广州 510380
珠江是我国南方第一大河,是我国重要淡水渔业生产基地和水生生物资源基因库。珠江鱼类在维持生物多样性、提供鱼类种质资源方面举足轻重。但是到目前为止,关于其鱼类空间分布格局的研究甚少。特别是近几十年来各种水工建设和过度捕捞使得渔业资源急剧衰退,鱼类空间分布的研究显得尤为重要。2015年对珠江全流域13个站位进行了全面调查,共采集渔获物10119尾,隶属于94种72属17科。鲤科鱼类占显著优势,其次种类较多的依次为鲿科、鳅科。采用非度量多维标度排序(NMDS)方法对鱼类群落空间分布特征进行了分析,结果表明珠江鱼类被划分为3个类群,即以餐、南方拟餐、黄颡鱼等小型鱼类为主的中上游类群、以赤眼鳟、鲮鱼、广东鲂等中型鱼类为主的中下游类群和以罗非鱼为主的重要支流类群。同时发现中下游物种多样性高,上游及河口江段多样性低的格局。采用冗余分析方法(RDA)分析了鱼类多样性与环境因子的关系,发现年均气温、降雨量、年均径流量、河流宽度与透明度是珠江水系河流鱼类群落结构差异的主要影响因子,其中年均气温是影响鱼类群落分布的最关键因子之一。与历史资料对比后发现,珠江鱼类种类明显减少、空间分布也发生了巨大改变。研究是珠江水系野生渔业资源长期调查的一部分,研究结果将对渔业资源的多样性保护和可持续利用具有指导意义。
多样性;空间分布;珠江;NMDS;RDA;环境因子
空间分布格局是物种在长期进化过程中形成的一种适应性特征,集中反映了异质性生境对物种空间资源利用的影响[1-2]。近年来,随着基于系统保护理念的“新保护生物学”的兴起和发展,针对不同尺度保护对象(如群落、生态系统等)的空间分析已经成为一种必不可少的研究手段[3- 6]。鱼类群落多样性空间分布格局及其影响因素是种群生态学研究的重要问题之一[7]。河流鱼类群落的空间结构具有一定的自组织性并且遵循非随机过程[8- 9],已有研究发现环境过滤是鱼类多样性空间异质性的重要原因之一[10- 12]。对于河流鱼类,这样的环境过滤因子包括:水流速度、溶氧浓度、水温以及水体有机物质等[13- 14]。如河流水文的变化会影响鱼类的摄食策略进而影响鱼类在空间上的分布[15]。
由于全球渔业资源急剧衰退,建立在生态学基础上的科学渔业资源管理方法就显得尤为重要[16- 17]。弄清鱼类空间分布格局及其影响因素是有效管理的第一步[18]。因此,鱼类群落的时空格局分析已经成为鱼类多样性保护与水生生态研究的重要内容之一[19- 20],是渔业资源保护和可持续利用的基础。同时鱼类多样性时空格局研究不仅了解鱼类的分布情况,对于洄游轨迹[21],识别生物多样性保护的“热点”地区都具有重要意义[22]。
珠江是我国南方第一大河,是我国重要淡水渔业生产基地和水生生物资源基因库,分布鱼类约385种(包括河口鱼类),其中特有鱼类约126种,被列入国家级水产种质资源保护品种的有25种。珠江鱼类在维持生物多样性、提供鱼类种质资源方面举足轻重。但是到目前为止,关于珠江水系鱼类空间分布格局的研究甚少。只是在90年代对本流域进行过一次渔业资源方面的调查研究[23],调查发现鲤科鱼类164种,占绝对优势。但是对鱼类群落空间分布特征以及影响因素并未作系统分析,已满足不了现代渔业资源养护和科学管理的需要。特别是近几十年来,水坝、航道工程建设和过度捕捞使鱼类通道受阻、产卵场消失,导致渔业资源急剧衰退,关于珠江流域鱼类空间分布的研究显得尤为重要。因此本研究依据2015年对珠江全流域的调查数据,应用非度量多维尺度分析和多元分析方法对珠江流域现有的鱼类群落多样性、空间分布格局及鱼类群落与环境因子之间的相互关系进行分析,了解高强度梯级开发50年后鱼类群落多样性现状,同时分析了影响鱼类群落分布的环境因素,为珠江鱼类的保护和管理提供科学依据。
1 材料与方法
1.1 研究地点
珠江是中国境内第三长河流,横贯华南大地。珠江流域片位于 97°39′ —117°18′E,3°41′—29°15′N之间,北回归线横贯流域的中部,属于热带-亚热带气候。其主干流发源于云南沾益县马雄山,流经云南、贵州、广西、广东等4个省区,在磨刀门入南海,全长2217km。本研究共设采样点13个,几乎覆盖整个珠江流域的干流和重要支流。具体采样点信息及分布分别见表1和图1。河流等级的划分依据 Horton[24]提出的水系组成理论,即把流域内的干流作为一级河流,汇入干流的支流作为二级河流,汇入二级河流的支流作为三级河流,依次类推。
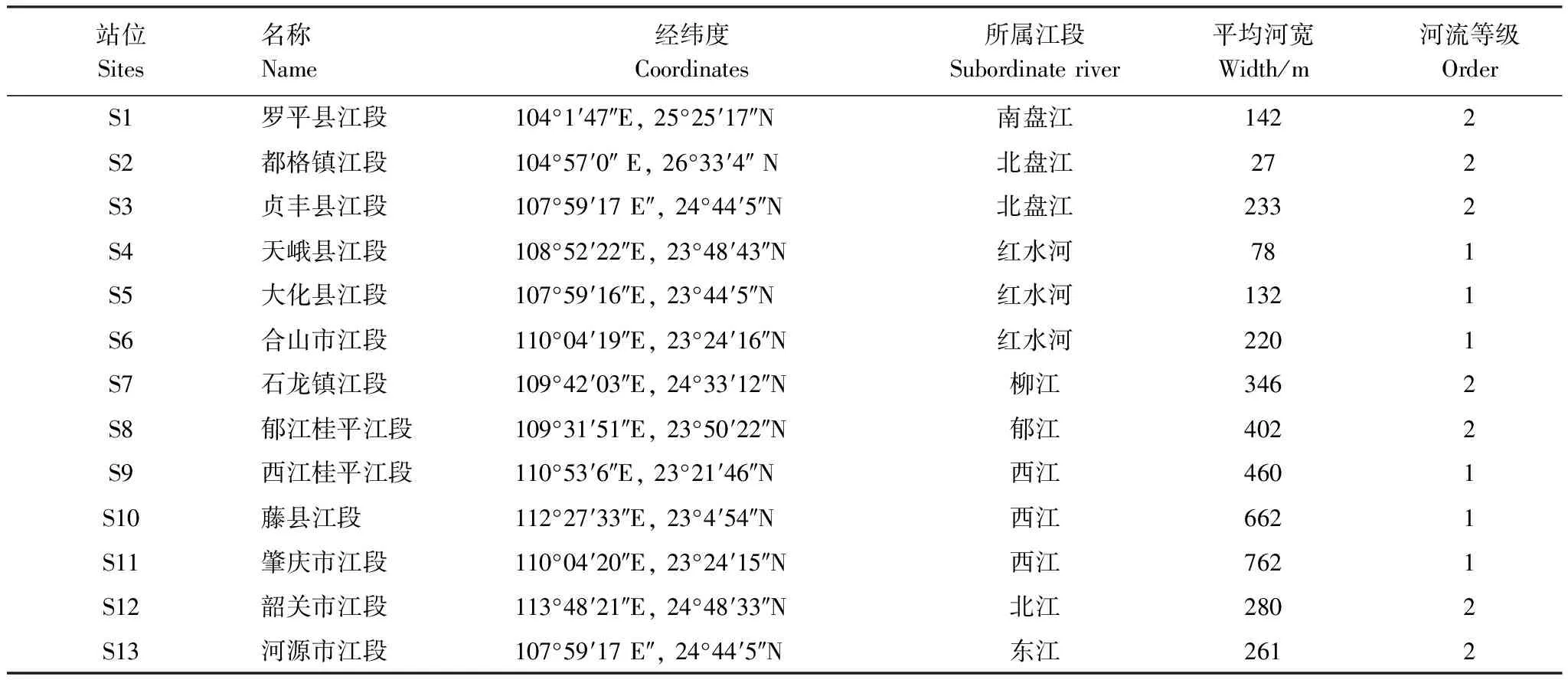
表1 各采样点具位置信息表
图1 采样点示意图Fig.1 Sample sits
1.2 数据收集
于2015 年3、6、9月和11月分别在各采样站位进行鱼类采样,每个采样点每次采样时间为1d,如遇雨天则择期再进行。采样方法为每日蹲守在各采样点码头对渔获物进行抽样购买,调查的渔具主要为虾笼、定置刺网、撒网和流刺网。每种网具各购买一船,同时统计渔船作业时间和网具大小。采集到的标本经现场拍照、称重、测体长、穿标签后带回实验室鉴定、分析和保存。鱼类鉴定依据广东淡水鱼类志[25]、广西淡水鱼类志[26]与珠江鱼类志[27]。
水温,pH,溶氧、电导率,氧化还原电位,盐度,总可溶性固体等理化因子使用YSI便携式多参数水质分析仪(6600,美国)测定。水体透明度采用塞氏盘法于现场测定。年均气温、径流量数据由珠江渔业管理委员会提供。降水量通过天气在线网址获得http://www.weatheronline.co。
1.3 数据分析
非度量多维尺度分析方法(NMDS)是一种将多维空间的研究对象(样本或变量)简化到低维空间进行定位、分析和归类,同时又保留对象间原始关系的数据分析方法,由于该方法不依赖于研究对象间精确的相似或相异性数据,仅需要研究对象之间等级关系即可,因此是一个极其灵活的排序方法[28]并且广泛应用于水生生态系统[29- 30]。非对称典范分析被认为是分析物种变量与解释变量之间复合关系的最佳选择。其中,冗余分析(RDA)其实质是将回归分析与主成分分析(PCA)相结合,从统计学的角度来评价一个或一组变量与另一组多变量数据之间的复合关系。由于其能将所有的数据进行挖掘,不需要对原数据进行相关检验,又被认为优于其他典范分析方法[31- 32],因此被广泛应用于生态学研究领域[31]。RDA分析方法能有效地对多环境指标进行统计检验,并确定对鱼类群落多样性变化具最大解释能力的最小变量组[28]。因此本研究利用NMDS分析珠江水系鱼类群落的空间分布特征,同时采用RDA分析环境变量是如何影响珠江水系鱼类群落多样性的分布的,并且找出影响最大的环境因子。本研究将不同网具采集到的渔获通过标准化(换算成单位时间单位面积的渔获数量)后再合并作为每个采样点的鱼类种群数据。由于原始数据较离散,鱼类种群数据进行Hellinger转换,栖息地环境因子进行loge(y+1) 转换[32],使得满足方差分析的正态性,其中物种变量是鱼类种群数据,解释变量是环境因子。同时分析各采样点Shannon-Wiener 指数(H′) 和物种均匀度指数(J′),其计算方法依据马克平和刘玉明[33]。所有的分析过程通过R统计软件完成。
2 结果
2.1 环境参数
珠江各采样江段的环境参数及理化因子的平均值见表1。 结果表明:从上游到下游,径流量、气温、降雨量都呈现升高的趋势。氧化还原电位、总可溶性固体、透明度显著减少(图2)。溶解氧、pH 值则表现为增加后减小的趋势。盐度和氨氮在各采样点之间没有明显的变化(图2)。S2(北盘江都格镇江段)站位的pH值呈强酸性(图2),主要是由于该河段有洗煤厂,导致水质污染严重。
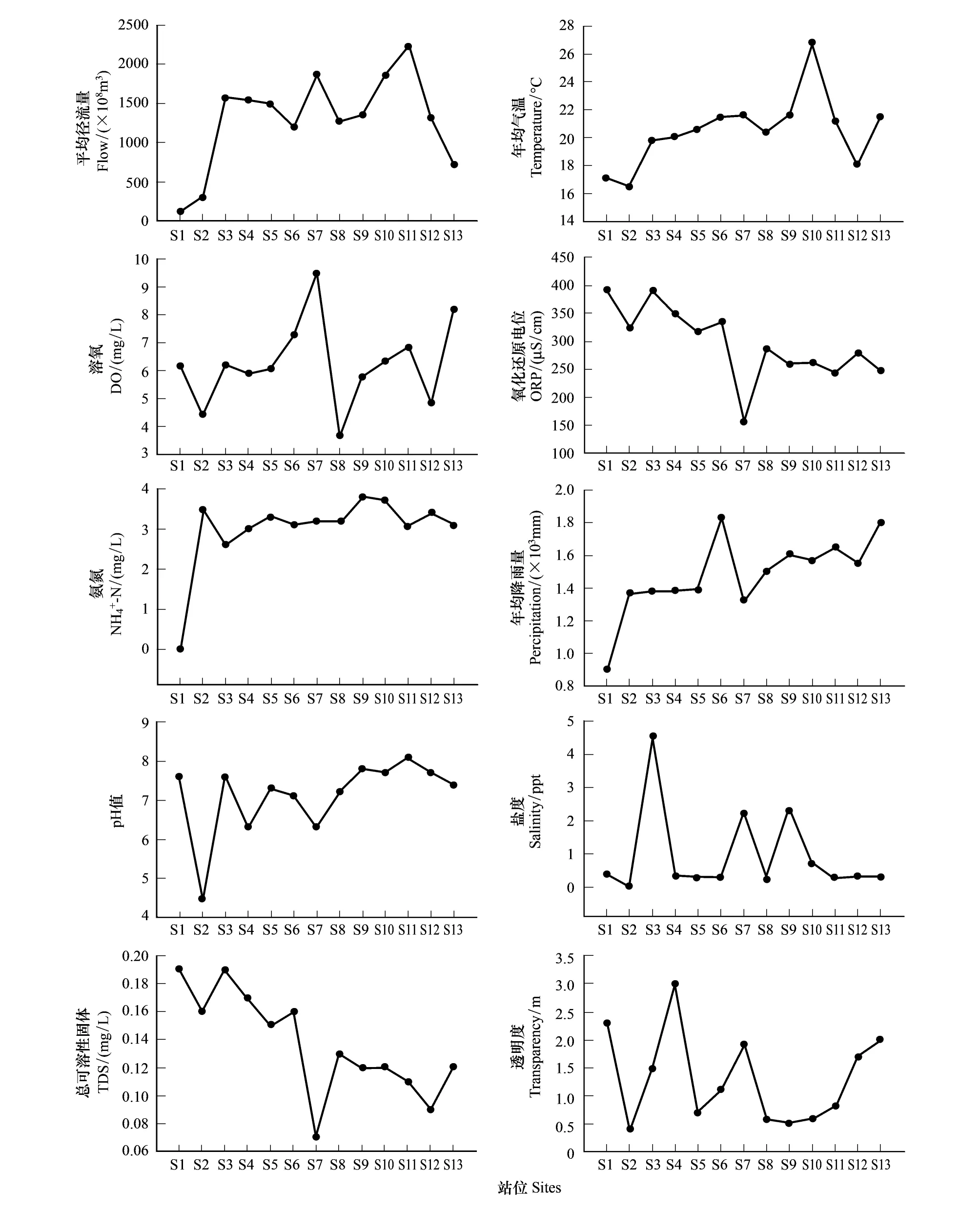
图2 各江段环境变化图Fig.2 The change of physicochemical characteristics in the different section of Pearl River
2.2 物种组成
2015年在整个流域13个采样点共采集渔获物10119尾,共鉴定94种,隶属于17科72属。以鲤形目种类最多(52 种),占总数的 55%,其次是鲈形目(16 种),占总数的 17%。以鲤科鱼类占明显优势,鲤科49 种,占总种类数的 52%,其次是鲿科7 种占总种类数的7%。这与珠江水系鱼类1989 年的区系组成一致[23]。但是在采样点S2(北盘江都格镇江段)只采到了光唇裂腹鱼(Schizothoraxlissolabiatus)一种,该地区渔业资源极度匮乏。
各个采样点之间优势种组成差异显著(表2)。餐(Hemiculterleucisculus)是整个干流及郁江、北江的唯一共有优势种。各条江段的优势种都是以小型鱼类居多,特别是南盘江、北盘江江段,以马口鱼(Opsariichthysbidens)、越鲇(Siluruscochinchinensis)等小型鱼类为主要优势种。只有在下游浔江、西江江段,以赤眼鳟(Squaliobarbuscurriculus)、广东鲂(Megalobramaterminalis)、鲮鱼(Cirrhinusmolitorella)为主要优势种。除了在南盘江江段有大量草鱼,传统的四大家鱼(青、草、鲢、鱅)都不再是优势种。入侵鱼类罗非鱼(Oreochromisniloticus)在5个江段都是主要的优势种,革胡子鲇(Clariasleather)是红水河大化江段的优势种,这都说明整个珠江流域外来水生生物入侵严重。

表2 珠江水系各调查江段鱼类群落的优势种

续表种名Species南盘江北盘江红水河西江柳江郁江东江北江S1S3S4S5S6S7S8S9S10S11S12S134 鲇形目SILURIFORMES4.1 鲿科Bagridae斑鱯Hemibagrusguttatus6.586.565.06黄颡鱼Pelteobagrusfulvidraco11.517.28瓦氏黄颡鱼Pelteobagrusvachelli9.16.589.94粗唇鮠Leiocassiscrassilabris8.269.56.634.2 胡子鲇科Clariidae革胡子鲇Clariasgariepinus14.474.3 鲇科Siluridae鲇Silurusasotus19.528.6越鲇Pterocrytiscochinchinensis40
各站位的数据表示该种类尾数百分比;由于S2站位只采到光唇裂腹鱼一种,因此不参与后续分析

图3 珠江鱼类群落结构聚类和排序分析 Fig.3 Ordination of sampling sites in a two-dimensional NMDS in the Pearl River
2.3 鱼类群落空间聚类分析
采用非度量多维标度排序(NMDS)方法对鱼类群落空间分布特征进行了聚类与排序,结果表明珠江鱼类被划分为 3 个类群, 即以餐、南方拟餐、黄颡鱼等小型鱼类为主的中上游类群(S3、S4、S5、S6)、以赤眼鳟、鲮鱼、广东鲂等中型鱼类为主的中下游类群(S7、S8、S9、S10、S11)、及以罗非鱼为主的重要支流类群(S1、S11、S12)。同时发现鱼类群落结构呈现显著空间自相关,除S1、S11、S12这三个采样点为重要支流聚为一类外,其他采样点都表现为在地理空间上相近的点聚为一类(图3)。
2.4 多样性空间特征
对珠江鱼类生物多样性进行分析后发现(图4),珠江鱼类 Shannon-Wiener 多样性指数值为1.83—2.93。从上游到下游,Shannon-Wiener 多样性指数变化较大,最大值在出现在S9(黔江桂平江段)站位,最小值出现在 S3(北盘江贞丰县江段)站位。物种均匀度指数最高值出现在S4(红水河天峨县江段),最低出现在近河口肇庆江段。空间上总体呈现出珠江中下游物种多样性高,均匀度高,上游及河口江段多样性指数低,均匀度低的趋势。

图4 珠江流域鱼类群落物种多样性、均匀度指数空间分布Fig.4 The value of Shannon-Wiener (H) and species evenness (J) of fish communities in the Pearl River
2.5 多样性与环境因子的关系
对各站位鱼类群落与各环境因子之间进行冗余对应分析(RDA)后发现气温、降雨量、径流量、河宽与透明度等环境因子因子贡献于RDA轴1,PH、溶氧等环境因子主要贡献于RDA轴2, 轴1和轴2能共同解释所有变量的64%,这对于生态学数据来讲,模拟效果较好(图5)。总体上,沿着轴1,从左到右,采样点呈现出从上游到下游的空间变化趋势。上游站位的鱼类群落结构主要受水体透明度和氧化还原电位等水体化学指标的影响,下游站位的鱼类群落结构主要受年均气温、降雨量、年均径流量与河流宽度等气候因子的影响。经过1000次随机置换检验发现,年均气温、降雨量、年均径流量、河流宽度与透明度是珠江水系河流鱼类群落结构差异的最主要影响因子(P<0. 05)。
3 讨论3.1 珠江鱼类群落演变特点
与历史资料[23]比较发现,珠江鱼类群落发生了巨大改变,主要表现为:(1)种类减少。历史资料记载珠江水系分布有鱼类 385 种,其中淡水鱼类256种。本次调查只采集到淡水鱼类91种,河口鱼类3种,虽然本次调查的次数有限,但是根据物种数多,被采集到的频率大这一原则,也说明整个珠江水系渔业资源锐减。鲥Tenualosareevesii、鯮Luciobramamacrocephalus、鳤Ochetobiuselongatus等濒危鱼类在近年的调查中未见。 其中采样点云南省曲靖市沾益县为珠江的源头,但据实地考察与走访之后发现该河段鱼类极少,也无捕鱼的渔民。采样点贵州省六盘水市水城县都格镇鱼类也极少,在本研究采样期间,只采到了裂腹鱼一种。据当地居民反应,该河段由于有洗煤厂,导致该江段水质呈强酸性,水质污染严重,鱼类资源锐减。(2)各江段主要经济鱼类发生巨大改变。历史记载,南北盘江由于流经崇山峻岭,河水湍急,主要以游泳能力强的白属鱼类为主,占当地鱼产量的50%—70%[23]。然而在本文的调查中发现在这两江段白属鱼类并不多,取而代之的是餐和越南鲇等小型鱼类。珠江中上游广西江段原以乌原鲤(Procyprismerus)、石鳜(Coreopercawhiteheadi)等为主,但是本文的调查却发现,现今以斑鱯(Mystusguttatus)、巴马拟缨(Pseudocrossocheilusbamaensis)等定居型鱼类为主。珠江中下游西江干支流,原以四大家鱼等大型鱼类为主要优势种,然而现今主要以赤眼鳟、鲮鱼、广东鲂等中型鱼类为主。除鲢在珠江流域较为常见外,青鱼、草鱼和鱅并不多见。(3)洄游性种类在珠江中上游江段消失,半洄游性鱼类数量十分稀少。 历史资料记载在珠江中上游黔江、浔江、红水河江段都分布有鲥鱼、七丝鲚(Coiliagrayi)、日本鳗鲡(Anguillajaponica)、三线舌鳎 (Cynoglossustrigrammus)、弓斑东方鲀 (Takifuguocellatus)等洄游性种类,鲥鱼、三线舌鳎已经多年未采集到,其他种类则分布在下游江段。本次调查数据与历史记载对比具体见表3。

表3 珠江水系渔业资源2015年调查结果与历史资料对比表
3.2 生物入侵严重
外来种罗非鱼已经是遍布整个流域,甚至在上游寒冷的南盘江,都有其自然种群。这说明,温度已经不能限制罗非鱼在整个珠江水系的扩散。罗非鱼从养殖水体逃逸后,在珠江水系扩散并建群[34- 35],在南盘江、红水河、东江和北江,罗非鱼已经跻身于优势种。同时革胡子鲇的种群数量也在扩大,在洪水河大化江段,其是主要优势种。珠江流域地处热带-亚热带气候带,年均温度约23℃,具有适合罗非鱼生长繁殖的自然环境[36],而珠江下游的广东省又是我国罗非鱼养殖大省,因此珠江流域已是我国罗非鱼入侵的高危地区。这说明在整个珠江流域外来水生生物安全面临严重威胁,控制形势十分严峻。
3.2 群落空间分布特征及其与环境因子的关系
鱼类群落的时空格局主要由于环境因子在时空尺度上的异质性引起,是各种环境因子(人类干扰、地理气候、水文因子、河流大小等级等)的综合反映[37- 38]。本研究中的珠江鱼类被划分为中上游类群、中下游类群和重要支流3 个类群。表明上游鱼类群落结构和下游差异显著。
影响鱼类群落分布的主要因子有很多,一般认为水深、温度、溶解氧、浑浊度、水系、河床底质类型、坡度、和河流平均宽度是影响鱼类群落分布的关键因子[39- 41]。我们的研究结果发现年均气温、降雨量、年均径流量、河流宽度与透明度是珠江水系河流鱼类群落结构差异的最主要影响因子。河宽代表调查站位鱼类群落可以自由活动的面积,河流越宽,鱼类活动空间越大,生存空间是影响鱼类群落的一个重要因素[42]。同时降雨量与径流量都是影响鱼类生存与繁殖的重要因子,珠江水系里大多数鱼类都受河流径流量的影响[43]。透明度是水体污染程度的一个综合表征,透明度过高或过低都会对鱼类的摄食、繁育有一定的影响。
在我们的研究中发现河流江段年均气温是影响鱼类群落分布的最关键因子之一。该研究结果与气候和能量假设模型的说法一致,也即能量是物种生存的重要资源,一个地区物种的承载能力取决于能量的多少。热带地区由于有更多的能量输入,因而能够形成更多的生境以及能够维持更多的物种。环境能量的增加会提高一个地区的净初级生产力,增加生物量的积累,从而为各种动物的生存提供更多的食物资源,使更多的个体能够共存,从而提高了该地区的物种多样性。同时一部分学者认为在环境能量较高的地区,动植物生理活动更加活跃,可以将更多的能量用于繁殖及养育后代,促进更多的遗传变异,产生更多的新物种。也即较高的环境能量产生更高的物种物种分化速率[44- 46]。
致谢:武智、朱书礼帮助野外数据收集,特此致谢。
[1] 王忠锁, 陈明华, 吕偲, 许崇任, 雷光春. 鄱阳湖银鱼多样性及其时空格局. 生态学报, 2006, 26(5): 1337- 1344.
[2] Hanski I. Metapopulation Ecology. New York: Oxford University Press, 1999.
[3] 江洪, 马克平, 张艳丽, 朱春全, Strittholt J R. 基于空间分析的保护生物学研究. 植物生态学报, 2004, 28(4): 562- 578.
[4] 费骥慧, 汪兴中, 邵晓阳. 洱海鱼类群落的空间分布格局. 水产学报, 2012, 36(8): 1225- 1233.
[5] 邓凯, 李丽, 吴巩胜, 周跃, 赵如. 景观空间格局对滇金丝猴猴群分布的影响. 生态学报, 2014, 34(17): 4999- 5006.
[6] 刘吉平, 吕宪国. 三江平原湿地鸟类丰富度的空间格局及热点地区保护. 生态学报, 2011, 31(20): 5894- 5902.
[7] Nakagawa H. Contribution of environmental and spatial factors to the structure of stream fish assemblages at different spatial scales. Ecology of Freshwater Fish, 2014, 23(2): 208- 223.
[8] Jackson D A, Peres-Neto P R, Olden J D. What controls who is where in freshwater fish communities-the roles of biotic, abiotic, and spatial factors. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(1): 157- 170.
[9] Ostrand K G, Wilde G R. Seasonal and spatial variation in a prairie stream-fish assemblage. Ecology of Freshwater Fish, 2002, 11(3): 137- 149.
[10] Mason N W H, Lanoiselée C, Mouillot D, Irz P, Argillier C. Functional characters combined with null models reveal inconsistency in mechanisms of species turnover in lacustrine fish communities. Oecologia, 2007, 153(2): 441- 452.
[11] Mouillot D, Dumay O, Tomasini J A. Limiting similarity, niche filtering and functional diversity in coastal lagoon fish communities. Estuarine, Coastal and Shelf Science, 2007, 71(3/4): 443- 456.
[12] Sharma S, Legendre P, De Cáceres M, Boisclair D. The role of environmental and spatial processes in structuring native and non-native fish communities across thousands of lakes. Ecography, 2011, 34(5): 762- 771.
[13] Grenouillet G, Pont D, Hérissé C. Within-basin fish assemblage structure: the relative influence of habitat versus stream spatial position on local species richness. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(1): 93- 102.
[14] Peres-Neto P, Legendre P, Dray S, Borcard D. Variation partitioning of species data matrices: estimation and comparison of fractions. Ecology, 2006, 87(10): 2614- 2625.
[15] Poff N L, Allan J D. Functional organization of stream fish assemblages in relation to hydrological variability. Ecology, 1995, 76(2): 606- 627.
[16] Sala O E, Chapin III F S, Armesto J J, Berlow E, Bloomfield J, Dirzo R, Huber-Sanwald E, Huenneke L F, Jackson R B, Kinzig A, Leemans R, Lodge D M, Mooney H A, Oesterheld M, Poff N L, Sykes M T, Walker B H, Walker M, Wall D H. Global biodiversity scenarios for the year 2100. Science, 2000, 287(5459): 1770- 1774.
[17] Dulvy N K, Sadovy Y, Reynolds J D. Extinction vulnerability in marine populations. Fish and Fisheries, 2003, 4(1): 25- 64.
[18] Tolimieri N, Levin P S. Assemblage structure of Eastern Pacific groundfishes on the U.S. continental slope in relation to physical and environmental variables. Transactions of the American Fisheries Society, 2006, 135(2): 317- 332.
[19] 李圣法, 程家骅, 严利平. 东海大陆架鱼类群落的空间结构. 生态学报, 2007, 27(11): 4377- 4386.
[20] 傅萃长. 长江流域鱼类多样性空间格局与资源分析——兼论银鱼的生物多样性与系统发育[D]. 上海: 复旦大学, 2003.
[21] 苏巍. 海州湾海域鱼类群落多样性及其与环境因子的关系[D]. 青岛: 中国海洋大学, 2014.
[22] 张殷波, 郭柳琳, 王伟, 田瑜, 李俊生. 秦岭重点保护植物丰富度空间格局与热点地区. 生态学报, 2014, 34(8): 2109- 2117.
[23] 陆奎贤. 珠江水系渔业资源. 广州: 广东科技出版社, 1990.
[24] Horton R E. Erosional development of streams and their drainage basins; hydrophysical approach to quantitative morphology. Geological Society of America Bulletin, 1945, 56(3): 275- 370.
[25] 潘炯华, 钟麟, 郑慈英, 伍汉霖, 刘家照. 广东淡水鱼类志. 广州: 广东科技出版社, 1991.
[26] 广西壮族自治区水产研究所, 中国科学院动物研究所. 广西淡水鱼类志 (第二版). 南宁: 广西人民出版社, 2006.
[27] 郑慈英. 珠江鱼类志. 北京: 科技出版社, 1989.
[28] Legendre P, Legendre L. Numerical Ecology. 3rd ed. Amsterdam, the Netherlands: Elsevier Science, 2012.
[29] Walters D M, Leigh D S, Freeman M C, Freeman B J, Pringle C M. Geomorphology and fish assemblages in a Piedmont river basin, U.S.A. Freshwater Biology, 2003, 48(11): 1950- 1970.
[30] Kilroy C, Larned S T, Biggs B J F. The non-indigenous diatomDidymospheniageminataalters benthic communities in New Zealand rivers. Freshwater Biology, 2009, 54(9): 1990—2002.
[31] Makarenkov V, Legendre P. Nonlinear redundancy analysis and canonical correspondence analysis based on polynomial regression. Ecology, 2002, 83(4): 1146- 1161.
[32] Legendre P, Gallagher E D. Ecologically meaningful transformations for ordination of species data. Oecologia, 2001, 129(2): 271- 280.
[33] 马克平, 刘玉明. 生物群落多样性的测定方法Ⅰ: α多样性的测度方法(下). 生物多样性, 1994, 2(4): 231- 239.
[34] 谭细畅, 李新辉, 李跃飞, 李捷. 尼罗罗非鱼早期发育形态及其在珠江水系的空间分布. 生物安全学报, 2012, 21(4): 295- 299.
[35] 顾党恩, 牟希东, 罗渡, 李莹莹, 杨叶欣, 徐猛, 胡隐昌. 广东省主要水系罗非鱼的建群状况. 生物安全学报, 2012, 21(4): 277- 282.
[36] Shuai F M, Li X H, Li Y F, Li J, Yang J P, Lek S. Forecasting the invasive potential of Nile tilapia (Oreochromisniloticus) in a large subtropical river using a univariate approach. Fundamental and Applied Limnology, 2015, 187(2): 165- 176.
[37] Oberdorff T, Hugueny B, Vigneron T. Is assemblage varia bility related to environmental variability? An answer for riverine fish. Oikos, 2001, 93(3): 419- 428.
[38] Pyron M, Lauer T E. Hydrological variation and fish assemblage structure in the middle Wabash River. Hydrobiologia, 2004, 525(1/3): 203- 213.
[39] Kouamélan E P, Teugels G G, N′Douba V, Gooré Bi G, Koné T. Fish diversity and its relationships with environmental variables in a West African basin. Hydrobiologia, 2003, 505(1/3): 139- 146.
[40] Brown L R. Fish communities and their associations with environmental variables, lower San Joaquin River drainage, California. Environmental Biology of Fishes, 2000, 57(3): 251- 269.
[41] Kadye W T, Magadza C H D, Moyo N A G, Kativu S. Stream fish assemblages in relation to environmental factors on a montane plateau (Nyika Plateau, Malawi). Environmental Biology of Fishes, 2008, 83(4): 417- 428.
[42] Ornellas A B, Coutinho R. Spatial and temporal patterns of distribution and abundance of a tropical fish assemblage in a seasonalSargassumbed, Cabo Frio Island, Brazil. Journal of Fish Biology, 1998, 53: 198- 208.
[43] Tan X C, Li X H, Lek S, Li Y F, Wang C, Li J, Luo J R. Annual dynamics of the abundance of fish larvae and its relationship with hydrological variation in the Pearl River. Environmental Biology of Fishes, 2010, 88(3): 217- 225.
[44] 王志恒, 唐志尧, 方精云. 物种多样性地理格局的能量假说. 生物多样性, 2009, 17(6): 613- 624.
[45] Allen A P, Gillooly J F. Assessing latitudinal gradients in speciation rates and biodiversity at the global scale. Ecology Letter, 2006, 9(8): 947- 954.
[46] Currie D J, Francis A P. Regional versus climatic effect on taxon richness in angiosperms: reply to Qian and Ricklefs. The American Naturalist, 2004, 163(5): 780- 785.
Spatial patterns of fish diversity and distribution in the Pearl River
SHUAI Fangmin1,2,3, LI Xinhui1,2,3,*, LIU Qianfu1,2,3, LI Yuefei1,2,3, YANG Jiping1,2,3, LI Jie1,2,3, CHEN Fangchan1,2,3
1PearlRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Guangzhou510380,China2ExperimentalStationforScientificObservationonFisheryResourcesandEnvironmentintheMiddleandLowerReachesofPearlRiver,MinistryofAgriculture,Zhaoqing526100,China3KeyLaboratoryoftheConservationandEcologicalRestorationofFisheryResourceinthePearlRiver,Guangzhou510380,China
The Pearl River, which is 2400 km long and flows into the South China Sea, is the longest river in subtropical southern China. The warm humid climate of the region, which promotes high species diversity, has resulted in significant aquatic biodiversity and the development of lucrative commercial fisheries. Nevertheless, studies on the spatial distribution of fish communities in the Pearl River system are limited, especially, considering the decline in global fishery resources due to numerous anthropogenic stressors, such as overfishing, dam construction, introduction of invasive species, and climate change. Thus, studies on the spatial distribution of fish species in the Pearl River are urgently needed. This study investigated the spatial patterns of fish diversity and distribution in the Pearl River Basin based on an investigation of 13 sample sites. A total of 10,119 individual fishes were collected during the study period, comprising 94 taxa representing 17 families and 72 genera. The Cyprinidae family, representing 49 taxa, accounted for 52% of the total number of fish species collected. Cyprinidae were the dominant family in the Pearl River, followed by Bagridae (7%; seven species) and Cobitidae (4%; four species). Non-metric multidimensional scaling (NMDS) was applied to the collected data and three separate groups were identified. The spatial variation in upstream fish assemblages differed significantly from that in downstream assemblages (P<0.05), although clustering and diversity showed a significant spatial autocorrelation. A significantly high species diversity was recorded in the Pearl River, but low species diversity existed in the up and downstream reaches. Redundancy analysis was used to describe the relationship between the diversity patterns of fish species and associated environmental factors. Temperature, precipitation, water discharge, river width, and water chemistry play important roles in species diversity, with the average annual temperature accounting for the largest proportion of variance. A comparison with historical data for the Pearl River revealed a dramatic decline in fish species and a significant change in the spatial distribution of fish communities. Currently, the most serious threat to the ecology of the Pearl River network is the invasion of alien species. For example, non-native tilapia are now widely distributed in most of the Pearl River system, even surviving in the cooler, upper reaches of the Nanpanjiang River. In the Hongshuihe, Beijiang, and Dongjiang Rivers, tilapia is the dominant species recorded and has frequently been collected in the middle and lower reaches of the Pearl River. The present study is part of a long-term investigation into the wild fishery resources of the Pearl River. Therefore, understanding the processes outlined in this study will assist in the conservation of fish community diversity, which is critical to the success and sustainability of commercial fisheries in the Pearl River. Regularized discriminant analysis (RDA) is used by ecologists to relate a dataset (Y) of response variables (such as species abundance) to a second dataset (X) of explanatory variables (often environmental factors) and consistently outperformed other statistical tests using all the data in this study.
diversity; spatial distribution pattern; Pearl River; NMDS; RDA; environmental factors
国家自然科学基金青年项目(31400354);中国水产科学研究院基本科研业务费项目(2015B01PT01);农业部公益性行业专项(201303048)
2016- 01- 13; 网络出版日期:2016- 12- 19
10.5846/stxb201601310222
*通讯作者Corresponding author.E-mail: lxhui01@aliyun.com
帅方敏,李新辉,刘乾甫,李跃飞,杨计平,李捷,陈方灿.珠江水系鱼类群落多样性空间分布格局.生态学报,2017,37(9):3182- 3192.
Shuai F M, Li X H, Liu Q F, Li Y F, Yang J P, Li J, Chen F C.Spatial patterns of fish diversity and distribution in the Pearl River.Acta Ecologica Sinica,2017,37(9):3182- 3192.

