无瓣海桑和秋茄人工林下土壤微生物群落研究*
杜欢杨琼,2黎双飞谭凤仪
(1. 广东内伶仃福田国家级自然保护区管理局,广东 深圳518040;2.福田-城大红树林研发中心/香港城市大学,香港九龙;3. 深圳大学 生命与海洋科学学院,广东 深圳 518060;4. 香港城市大学 生物化学系,香港 九龙)
无瓣海桑和秋茄人工林下土壤微生物群落研究*
杜欢1杨琼1,2黎双飞3谭凤仪2,4
(1. 广东内伶仃福田国家级自然保护区管理局,广东 深圳518040;2.福田-城大红树林研发中心/香港城市大学,香港九龙;3. 深圳大学 生命与海洋科学学院,广东 深圳 518060;4. 香港城市大学 生物化学系,香港 九龙)
对2 a生单种无瓣海桑(Sonneratia apetala)、单种秋茄(Kandelia obvata)和混种无瓣海桑—秋茄(1∶1)人工林下土壤理化性质、微生物群落结构、酶活性进行了研究。结果表明,单种无瓣海桑林下土壤pH值最低(5.61±0.08),土壤有机质、总磷、总氮含量在3个群落间均无显著差异;单种无瓣海桑林下土壤蛋白酶、芳基硫酸酯酶和磷酸酶的活性高于其它两种人工林,脲酶、纤维素酶和脱氢酶活性以混种林下最高(分别为190.20±28.49,19.04±4.77和93.21±14.10 μg·g-1·h-1),β-葡萄糖苷酶和芳基硫酸酯酶活性在3种人工林下差异不显著;单种无瓣海桑林下土壤中各种脂肪酸含量较高,混种林下土壤的脂肪酸含量最低;典型相关分析表明,蛋白酶活性和土壤pH、总氮含量呈显著负相关(P<0.01),磷酸酶活性与总磷含量呈显著正相关(P<0.01)。
无瓣海桑;秋茄;土壤微生物;磷脂脂肪酸;酶活性
红树林(Mangrove)是生长于热带亚热带海岸潮间带、兼具陆地生态系统和海洋生态系统的一类特殊湿地生态系统,是热带亚热带海岸生态关键区[1]。然而,由于人口增长、城市化进程加速等原因,我国红树林面积从1950年的48 266 hm2减少到1997年的14 877 hm2[2]。在20世纪80年代以来,国家对红树林的保护日益重视,开展了大量的红树林人工恢复工程,自2000年后我国红树林面积开始缓慢回升。引种造林是人工恢复红树林最有效也最快的方法,无瓣海桑(Sonneratia apetala)是目前我国人工引种栽培面积最大的红树林引入树种。
无瓣海桑天然分布于印度、孟加拉等国,是红树林速生丰产乔木树种,1985年由申达本引入我国海南东寨港,1993年初次引种到深圳市福田区,因当年冬天出现持续低于5℃的低温而全部死亡,1994年再次引入获得成功,3年后即1999年在深圳湾出现了自然更新现象,发挥了明显的生态效益[3]。引种后,国内红树林专家学者对无瓣海桑在福田区的生长状况、能量循环、群落结构、土壤微生物等生理生态特性以及对本地红树林生态系统的影响作了一系列的研究[4-8],由于无瓣海桑耐水淹能力强、生长繁殖迅速,能很快占领前缘滩涂空间,并通过林窗侵入原生林,国内外学者对其入侵性争议很大,有的认为无瓣海桑已严重危害到乡土红树林的生长[9],但更多学者认为其仅具有潜在入侵性,可用于非宜林地的引种造林,但需要加强管理[10-11]。
土壤微生物参与土壤中一切生物和生物化学反应,微生物的变化是监测土壤质量变化的重要指标。植物和土壤微生物相互作用,植物通过凋落物和根系分泌物为土壤中的微生物提供营养物质,从而间接影响土壤微生物群落的结构和功能[12];反过来,土壤微生物通过调节氮、磷等营养物质的循环而影响植物的生长[13]。研究证明,不同植物种类的土壤微生物群落不同[14]。
本研究选择深圳市福田区2 a生秋茄(Kandelia obvata)和无瓣海桑人工林,开展林下土壤理化性质、微生物群落结构和酶活性研究,从土壤微生物角度探讨外来种无瓣海桑和乡土种秋茄的不同生态特性,为评价无瓣海桑的潜在入侵性提供基础数据,同时也为红树林保护区科学管理无瓣海桑提供依据。
1 材料与方法
1.1 研究地概况
福田红树林国家级自然保护区(114°03′E,22°32′N)位于深圳湾东北部,与香港米埔自然保护区隔海相望,共同组成了国际知名的后海湾红树林湿地。气候属于亚热带季风海洋性气候,年日照时数在2 000 h左右,年平均气温22℃(极端高温37℃,极端低温0℃),年均降雨量1 600~2 300 mm,干湿季节交替明显,雨量多集中在5—9月,年均相对湿度80%左右。
潮汐为不规则半日潮, 平均潮差1.9 m。该区土壤基质为花岗岩及砂页岩, 地带性土壤以滨海盐土为主。天然红树林面积约80 hm2, 组成种类主要有本土红树种白骨壤(Avicennia marina)、秋茄、桐花树(Aegiceras corniculatum)、以及引入红树种海桑(S. caseolaris)和无瓣海桑。
1.2 采样方法
选择福田红树林保护区实验区内滩涂,于2006年5月按照1 m×1 m的密度种植无瓣海桑、秋茄和无瓣海桑—秋茄混种林(密度比为1∶1),每种处理种植面积为100 m2,所种幼苗为保护区苗圃内1 a生袋装苗。
2008年12月,在单种无瓣海桑、单种秋茄和混种无瓣海桑—秋茄林下各建立4个1 m×1 m的样方,用PVC管(Φ7.5 cm)采用对角线方法采取表层土壤(0~15 cm),在实验室分离混匀后分为3部分:一部分自然风干、研磨过60目筛(孔径0.25 mm)后做土壤理化性质分析;一部分-80 ℃冷冻干燥后做磷脂脂肪酸分析;一部分贮于4℃冰箱作土壤酶活性分析。
1.3 分析方法
土壤有机质分析采用马弗炉灼烧法;pH、盐度用YSI仪测定(1∶5土水比);总氮、总磷分析采用H2SO4—HClO4氧化法,采用碱性过硫酸钾—紫外分光光度法、钼锑抗分光光度法分别测定总氮、总磷[15]。
脱氢酶(Dehydrogenase)活性测定采用TTC还原法,蛋白酶(Protease)活性测定采用福林酚比色法,脲酶(Urease)活性测定采用奈氏比色法,纤维素酶(Cellulase)活性测定采用蒽酮比色法,磷酸酶(Phosphatase)活性测定采用p—硝基苯磷酸钠法,β—葡萄糖苷酶(ß-glucosidase)和芳基硫酸酯酶(Arylsulphatase)活性测定采用硝基酚比色法[16]。
土壤微生物磷脂脂肪酸(Phospholipid fatty acid,PLFA)分析采用温和碱性甲酯化方法[17]:取3 g冷冻干燥土壤,加入20 μL 100 mg/L的C19∶0和15 mL新配制的0.2 M KOH -甲醇溶液,于37 ℃中恒温1 h后加入3 mL 1.0 M醋酸溶液中和,移出有机相,氮气下吹干后用正己烷溶解,用GC-MS完成检测分析。以37种脂肪酸混合物(C4-C24, 18919-1 AMP)为标准进行比对,采用峰面积和内标曲线法定量脂肪酸,PLFA含量用μg·g-1表示。
1.4 数据处理
采用软件Microsoft excel 2010进行数据整理和作图,利用SPSS 13.0(Statistical Package for the Social Sciences)进行统计分析。差异性显著分析采用单变量方差分析方法(One-way ANOVA),主成分分析方法(Principal component analysis, PCA)用于脂肪酸图谱分析,判别分析方法(Discriminant analysis, DA)将无瓣海桑和秋茄人工林区分开来,采用典型相关分析方法(Canonical correlation analysis, CCA)分析土壤理化性质、微生物结构与功能之间的相关性。
2 结果与分析
2.1 不同人工林下土壤理化性质
不同人工林下的土壤理化性质不同(表1)。单种无瓣海桑林下土壤pH值最低,单种秋茄林下土壤pH值最高,2种人工林间差异显著(P<0.05),单种无瓣海桑和混种林下土壤pH差异不显著。有机质含量以单种无瓣海桑林下最高,单种秋茄林下最低,三者间差异不显著。3种林下土壤盐度差异不显著。土壤中总氮含量在单种秋茄林下最高,单种无瓣海桑林下最低,差异不显著;总磷的含量以单种秋茄林下最低。
2.2 不同人工林下土壤酶活性
土壤酶活性见表2。单种无瓣海桑林下土壤蛋白酶、芳基硫酸酯酶、磷酸酶的活性最高,混种林次之,单种秋茄林下最低,单种无瓣海桑林与混种林间差异不显著。脲酶、纤维素酶和脱氢酶活性以混种林下最高,单种秋茄林最低。3种人工林下土壤芳基硫酸酯酶和β-葡萄糖苷酶的活性无显著差异。
土壤酶活性的判别分析能较清楚的分离出单种无瓣海桑林、单种秋茄林和混种林(图1a),DF1可解释99.5%的数据信息。
典型相关分析表明(表3),蛋白酶活性和土壤pH、总氮含量呈显著负相关(P<0.05),磷酸酶活性与总磷含量呈显著正相关(P<0.05),7种酶活性与有机质、盐度的相关性不显著。
2.3 不同人工林下土壤微生物群落结构
不同人工林下土壤微生物脂肪酸含量不同(表4),单种无瓣海桑林下土壤中各种脂肪酸含量较高,混种林下土壤的脂肪酸含量最低。脂肪酸的PCA分析表明:PC1主分量对脂肪酸总体变化的贡献率为55.00%,PC2对脂肪酸商品化变化的贡献率为13.09%,即前两个主成分因子能解释68.09%的脂肪酸数据信息。根据不同脂肪酸在PC轴上的载荷值,负责PC1方向微生物群落分离的脂肪酸主要来自于不饱和脂肪酸(14∶1,16∶1,18∶2n,18∶1n),负责PC2方向微生物群落分离的脂肪酸主要来自于饱和脂肪酸(8∶0,10∶0,12∶0,15∶0)。
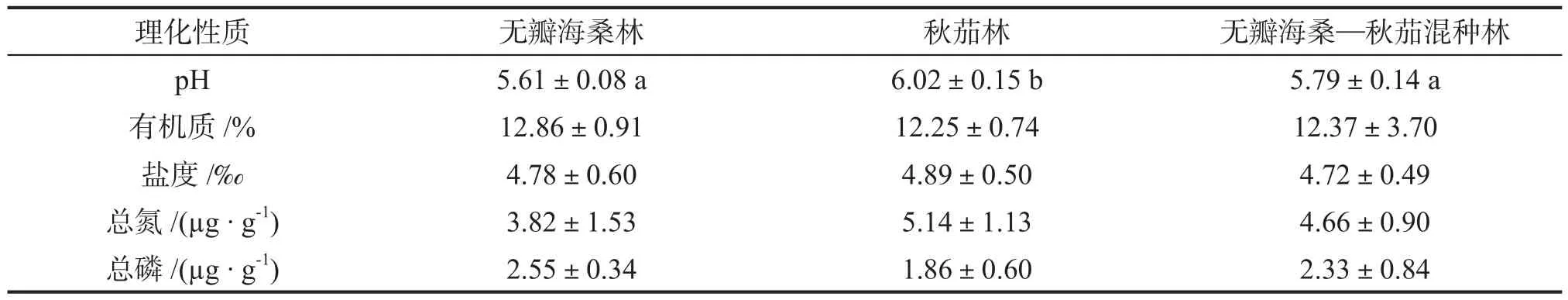
表1 不同人工林下土壤理化性质
土壤脂肪酸的判别分析能较清楚的分离出单种无瓣海桑林、单种秋茄林和混种林(图1b),DF1可解释85.1%的数据信息。
2.4 土壤微生物结构与功能的相关性
用典型相关分析分析微生物结构与功能的相关性,微生物功能用7种土壤酶活性表示,微生物结构用PLFA表示,为了适应CCA的变量要求,PLFA的数据仅采用前两个主分量PC1和PC2。结果显示纤维素酶活性与PC2呈极显著正相关(P<0.01),脱氢酶与PC2呈显著正相关(P<0.05),7种酶与PC1的相关性均不显著(表5)。
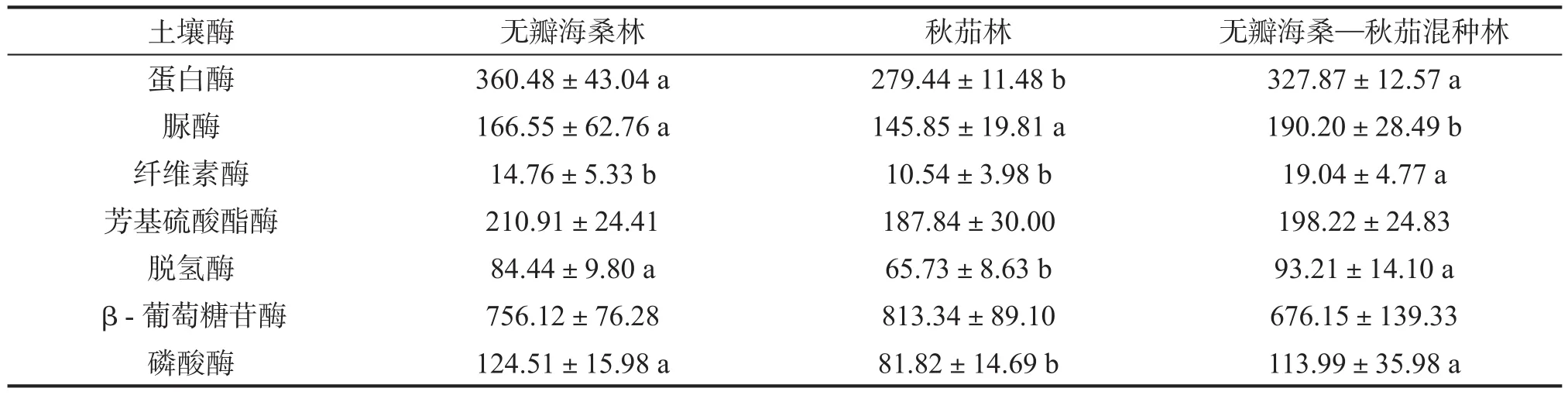
表2 不同人工林下土壤酶活性μg·g-1·h-1
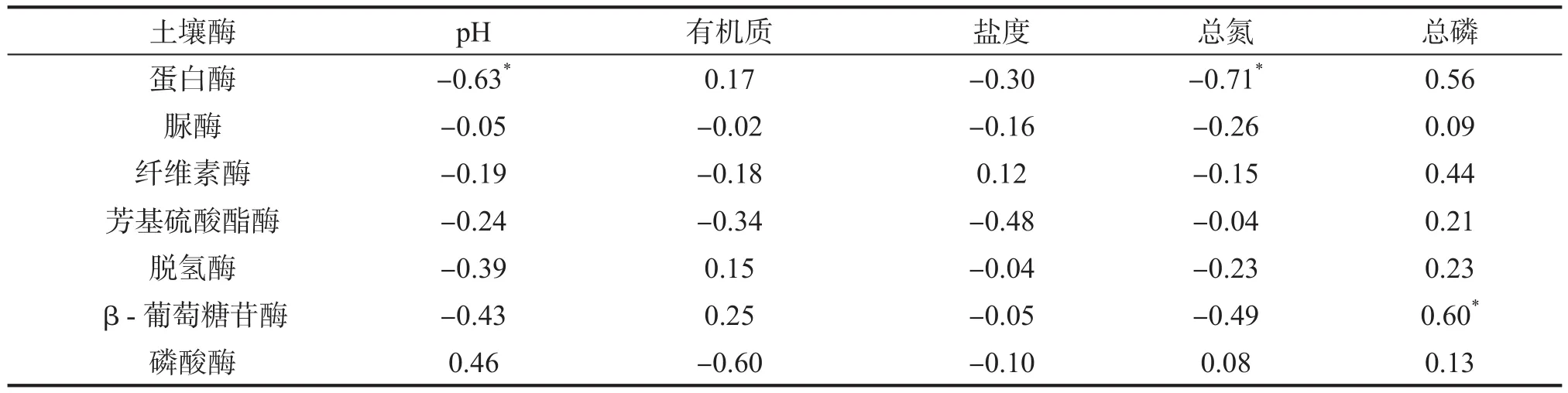
表3 土壤酶活性与理化性质的典型相关分析
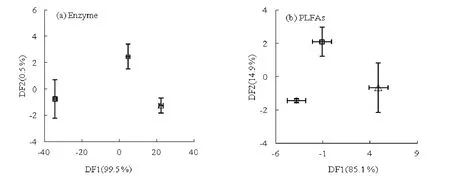
图1 土壤酶活性和PLFAs的判别分析图
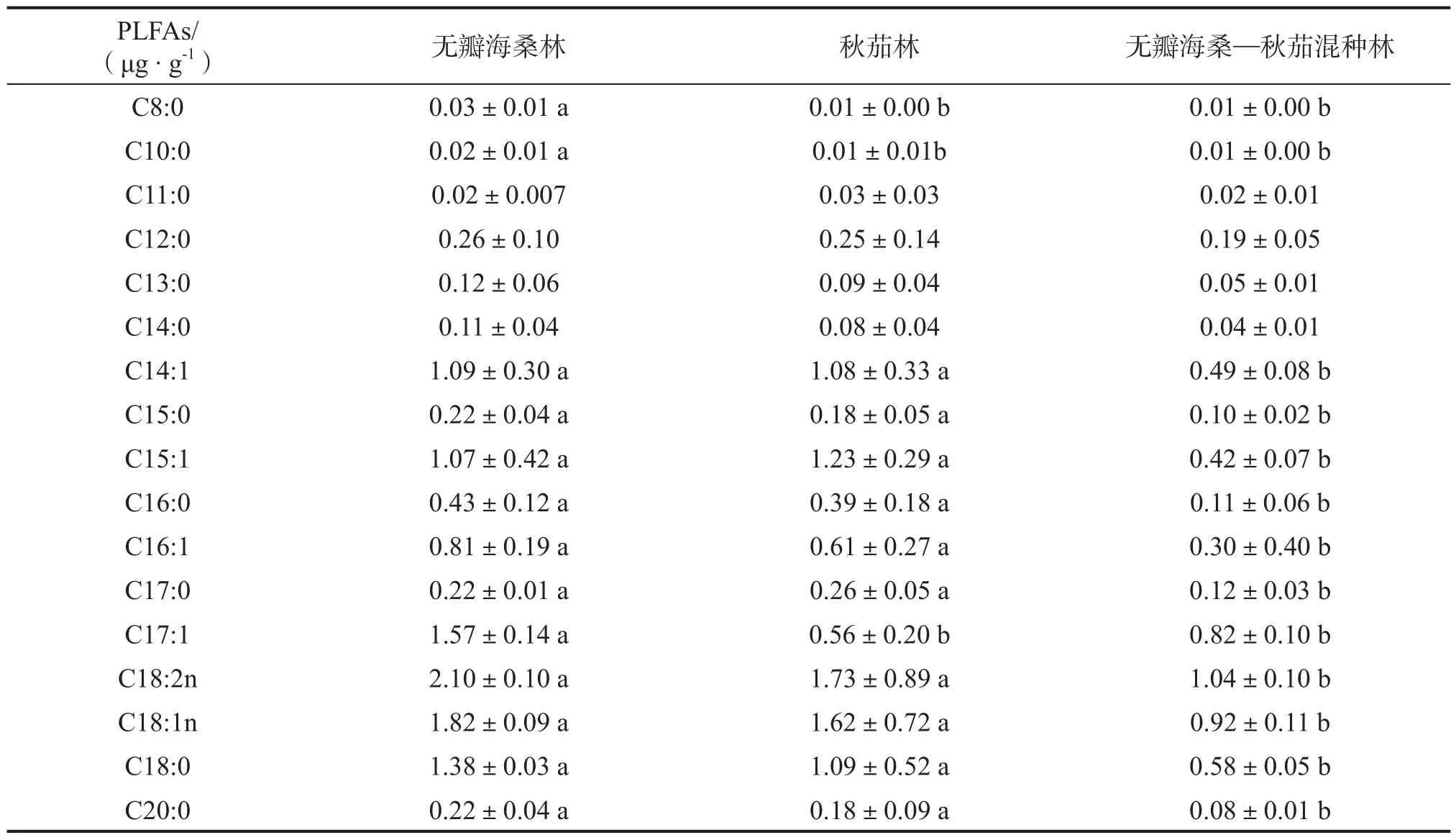
表4 不同人工林下土壤脂肪酸含量
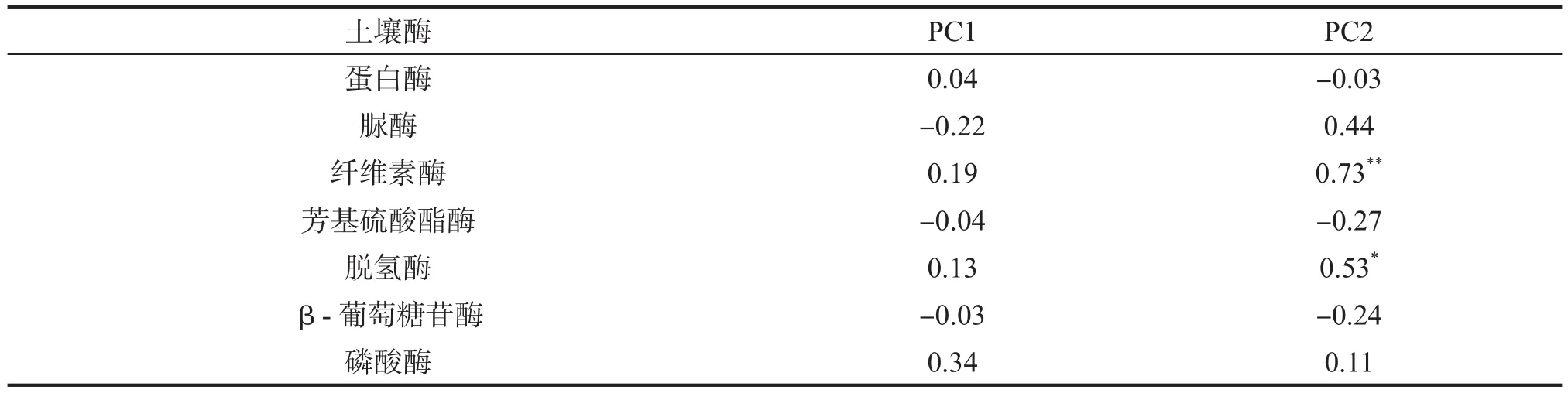
表5 不同人工林下土壤微生物结构与功能的典型相关分析
3 结论与讨论
红树植物生长发育过程中特有的硫酸化会产生大量的H+,使得红树林湿地土壤酸化,本研究中3种人工林的土壤均为酸性,其中单种无瓣海桑林下土壤酸性最强,说明相对于乡土红树植物秋茄来说,无瓣海桑对土壤的酸化能力更强。前人研究表明,无瓣海桑为红树林中的速生丰产树种,其凋落物明显高于乡土种秋茄[18],再加上无瓣海桑拥有发达的笋状气生根,这些气生根的存在使得凋落物易于在根区停留、积累和腐烂,另外,相对于乡土种秋茄,无瓣海桑的生态建成成本较低[19],从而使得林下土壤有机质含量增加。
前人研究已经证实,通过传统平板培养方法鉴定的微生物仅占微生物总数的0.1%~10.0%,大量的微生物不能培养出来,而PLFA分析方法刚好克服了这一缺陷,能真实准确反映土壤微生物群落结构[20]。本研究结果显示,种植无瓣海桑增加了土壤中细菌和真菌脂肪酸含量,它们是土壤营养循环的主要参与者,这可能是无瓣海桑能快速生长抢占生态位的机制之一。
土壤微生物通过分泌酶参与土壤生态系统营养循环各种生化过程,因此,土壤酶是土壤生态系统代谢的重要动力,酶活性是评价土壤生产力及土壤质量的重要指标[21-22]。本研究中,无瓣海桑林下土壤的脱氢酶、蛋白酶、脲酶、芳基硫酸酯酶、纤维素酶和磷酸酶活性均高于乡土植物秋茄,造成这种情况的主要原因可能是无瓣海桑的根系释放独特的化学物质进入到土壤微生态系统中,通过化感作用影响土壤理化性质及营养循环方式从而直接或间接的影响土壤微生物活性[23-25]。这进一步证明了无瓣海桑是通过改变土壤微生物群落结构功能,从而为其营造更好的生态微环境以加速其生长进程。
综上所述,同龄无瓣海桑的树高、生物量远高于秋茄[26],它通过改变土壤微生物的结构、提高土壤酶活性,从而达到改变土壤理化性质、增加可利用氮、磷营养源以满足其生长繁殖的需要,这可能是无瓣海桑生长迅速的机制之一。由于本实验为野外栽种,野外环境复杂、且受潮汐影响,不断有其它植物凋落物等营养源加入,难以确定影响生长关键营养因子的来源,加上研究周期短,需要长期跟踪监测来进一步确认,后继研究中应当针对不同生长周期的群落,探讨不同造林时间的无瓣海桑林土壤微生物群落结构功能改变与生长的正反馈作用;同时,探讨无瓣海桑的生长是否会影响本地土壤生态系统平衡、危害乡土红树植物的正常生长而造成生物入侵等议题。
[1]WANG B S, ZHANG W Y, LIANG S C, et al. Annotation on mangrove plants [J]. Marine Science Bulletin, 2004, 6(2)∶ 83-89.
[2]傅秀梅, 王亚楠, 邵长伦, 等. 中国红树林资源状况及其药用研究调查Ⅱ.资源现状、保护与管理[J]. 中国海洋大学学报(自然科学版) , 2009, 39(4)∶ 705-711.
[3]李云, 郑德璋, 陈焕雄, 等. 红树植物无瓣海桑引种的初步研究[J]. 林业科学研究, 1998, 11(1)∶ 39-44.
[4]昝启杰, 王勇军, 王伯荪. 深圳福田无瓣海桑+海桑人工林的生态影响[J].中山大学学报(自然科学版) , 2001, 40(6) ∶ 72-76.
[5]CHEN L, TAM N F Y, HUANG J, et al. Comparison of ecophysiological characteristics between introduced and indigenous mangrove species in China [J]. Estuarine, Coastal and Shelf Science, 2008, 79∶ 644-652.
[6]CHEN L Z, ZAN Q J, LI M G, et al. Litter dynamics and forest structure of the introduced Sonneratia caseolaris mangrove forest in Shenzhen, China [J]. Estuarine, Coastal and Shelf Science, 2009, 85∶ 241-246.
[7]CHEN L, ZENG X, TAM N F Y, et al. Comparing carbon sequestration and stand structure of monoculture and mixed mangrove plantations of Sonneratia caseolaris and S. apetala in Southern China[J]. Forest Ecology and Management, 2012, 284∶ 222-229.
[8]杨琼, 谭凤仪, 吴苑玲, 等. 不同林龄海桑林和无瓣海桑林根际微生物特征[J]. 生态学杂志, 2014, 33(2)∶ 296-302.
[9]REN H, LU H, SHEN W, et al. Sonneratia apetala, Buch. Ham in the mangrove ecosystems of China∶ An invasive species or restoration species? [J]. Ecological Engineering, 2009, 35(8)∶ 1243-1248.
[10]ZAN Q J, WANG B S, WANG Y J, et al. Ecological assessment on the introduced Sonneratia caseolaris and S. apetala at the mangrove forest of Shenzhen Bay, China[J]. Acta Botanica Sinica, 2003, 45 (5)∶ 544 - 551.
[11]田广红, 陈蕾伊, 彭少麟, 等. 外来红树植物无瓣海桑的入侵生态特征[J]. 生态环境学报, 2010, 19(12)∶ 3014-3020.
[12]BROZ A K, MANTER D K, VIVANCO J M. Soil fungal abundance and diversity∶ another victim of the invasive plant Centaurea maculosa [J]. ISME Journal, 2007, 1∶763-765.
[13]吴建峰, 林先贵. 土壤微生物在促进植物生长方面的作用[J]. 土壤, 2003, 35(1)∶ 18-21.
[14]BAUHUS J, PARE D, COTE L. Effects of tree species, stand age and soil type on soil microbial biomass and its activity in a southern boreal forest [J]. Soil Biology & Biochemistry, 1998, 30∶ 1077-1089.
[15]沈萍, 范秀容, 李广武.微生物学实验[M].北京∶ 高等教育出版社, 1999∶ 69-74.
[16]中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M].北京∶ 科学出版社, 1985∶ 40-59.
[17]SCHUTTER M E, DICK R P. Comparison of Fatty Acid Methyl Ester (FAME) methods for characterizing microbial communities. Soil Science Society of America Journal, 2000, 64∶ 1659-1668.
[18]LIU L, LI F, YANG Q, et al. Long-term differences in annual litter production between alien (Sonneratia apetala) and native (Kandelia obovata) mangrove species in Futian, Shenzhen, China [J]. Marine Pollution Bulletin, 2014, 85(2)∶ 747-753.
[19]LI F, YANG Q, ZAN Q, et al. Differences in leaf construction cost between alien and native mangrove species in Futian, Shenzhen, China∶ Implications for invasiveness of alien species[J]. Marine Pollution Bulletin, 2011,62(9)∶ 1957-1962.
[20]BOSSIO D A, SCOW K M, GUNAPALA N, et al. Determinants of soil microbial communities∶ effects of agricultural management, season, and soil type on phospholipid fatty acid profiles [J]. Microbial Ecology, 1998, 36 (1)∶ 1-12.
[21]曹慧, 孙辉, 杨浩, 等. 土壤酶活性及其对土壤质量的指示研究进展 [J]. 应用与环境生物学报, 2003, 9(1) ∶105-109.
[22]GE G, LI Z, FAN F, et al. Soil biological activity and their seasonal variations in response to long-term application of organic and inorganic fertilizers [J].Plant and Soil, 2010, 326(1-2)∶ 31-44.
[23]李玫, 廖宝文, 郑松发, 等. 外来种无瓣海桑化感作用研究初报[J]. 生态科学, 2002, 21(3)∶ 197-200.
[24]李玫, 廖宝文, 郑松发, 等. 无瓣海桑对乡土红树植物的化感作用[J]. 林业科学研究, 2004, 17(5)∶ 641-645.
[25]王茹华, 张启发, 周宝利, 等. 浅析植物根分泌物与根际微生物的相互作用关系[J].土壤通报, 2007, 38(1) ∶ 167-172.
[26]LUNSTRUM A, CHEN L. Soil carbon stocks and accumulation in young mangrove forests [J]. Soil Biology & Biochemistry, 2014, 75(75)∶ 223-232.
Study on Soil Microbial Community Characteristics of Sonneratia apetalaand Kandelia obvata Plantations in Shenzhen Bay
DU Huan1YANG Qiong1,2LI Shuangfei3TAM Fungyee2,4
(1. Guangdong Neilingding Futian National Nature Reserve, Shenzhen, Guangdong518040, China;2. Futian-CityU Mangrove Research and Development Centre/City University of Hong Kong, Kowloon, Hong Kong SAR, China;3. College of Life Sciences and Oceanography, Shenzhen University, Shenzhen,Guangdong518060, China;4. Department of Biology and Chemistry, City University of Hong Kong, Kowloon, Hong Kong SAR, China)
The present study examined the relationships between soil physical and chemical properties, soil microbial community structure (expressed by phospholipid fatty acids, PLFAs) and enzymatic activities in 3 types of 2-year-old plantations, which were monoculture Sonneratia apetala, monoculture Kandelia obvata and mixed plantations (with 50% of S.apetala and 50% of K.obvata) in Futian National Nature Reserve, Shenzhen Bay. Soil in mono-S.apetala was most acidic (pH-value 5.61±0.08), while the organic matter content, total phosphorus content (P) and the total nitrogen (N) content showed no significant difference among three plantations. Soil in the mono-S.apetala showed higher activities of protease, arylsulphatase, phosphatase among three plantations, and the mixed plantations had highest urease, cellulose, and dehydrogenase activities which were 190.20±28.49,19.04±4.77 and 93.21±14.10 μg·g-1·h-1, respectively. However, no significant difference was found in the activities of β-glucosidase and arylsulphatase among three plantations. The diagnostic PLFAs were the most abundant in the mono-S.apetala, but the least in the mixed plantation. The canonical correlation analysis revealedthat protease activities were significantly negatively correlated to pH-value and the content of total N, while the phosphatase showed significant positive correlation with the content of total P.
Sonneratia apetala;Kandelia obvata;soil microorganism;phospholipid fatty acid;enzymatic activity
Q14, Q93,S718.8
A
2096-2053(2017)03-0001-07
深圳市基础研究项目资助“引种后海桑和无瓣海桑根系微生物多样性研究”(JC201006030881A)。
杜欢(1981— ),女,工程师,主要从事红树林湿地生态学研究,E-mail∶45836101@qq.com。
黎双飞(1975— ),男,副教授,主要从事环境生物学研究,E-mail∶30184678@qq.com。

