九连山金斑喙凤蝶野外生物学特性观测
林宝珠,朱祥福,曾菊平,袁景西
(1.江西省九连山国家级自然保护区管理局,江西 龙南 341700; 2.江西农业大学林学院,江西 南昌 330045; 3.江西九连山森林生态系统定位观测研究站,江西 龙南 341700)
九连山金斑喙凤蝶野外生物学特性观测
林宝珠1,3*,朱祥福1,3,曾菊平2,3,袁景西1,3
(1.江西省九连山国家级自然保护区管理局,江西 龙南 341700; 2.江西农业大学林学院,江西 南昌 330045; 3.江西九连山森林生态系统定位观测研究站,江西 龙南 341700)
[目的]通过连续12 a对金斑喙凤蝶的野外调查观察,研究成虫活动规律,并利用仿生态养殖,观察金斑喙凤蝶卵和幼虫的形态特征与生活习性,研究其生物学特性,以期为金斑喙凤蝶研究与保护提供有效数据。[方法]根据2004—2012年对金斑喙凤蝶成虫活动规律的观察研究,2013—2015年,在金斑喙凤蝶成虫活动期,采用样线踏查的方法,自海拔450 m往山顶海拔1 200 m搜索,调查视野内木兰科植物分布情况,寻找卵和幼虫,收集后带回驻地进行仿生态养殖,观察其形态特征和生活习性。[结果]金斑喙凤蝶在九连山为一年二代,以蛹越冬,第一代成虫发生期为4月上旬至5月中旬,第二代成虫发生期为8月下旬至9月中旬;2013年在木兰科植物金叶含笑上发现卵和幼虫,2014和2015年在深山含笑上发现卵和幼虫,深山含笑为新发现寄主植物,目前除九连山外尚未有报道;幼虫5龄,各龄级幼虫差异较大;预蛹成蛹经历两次蜕皮过程,这是金斑喙凤蝶研究中的一项重大发现。[结论]1)金斑喙凤蝶卵和幼虫的分布与寄主植物分布密切相关,且对生境质量有较高要求,成虫活动范围主要在寄主植物分布范围及其周边;2)金斑喙凤蝶选择生长良好的金叶含笑和深山含笑叶片上产卵,或嗜食深山含笑;3)温度、湿度等环境因子对卵的孵化、幼虫的生长发育以及化蛹和羽化影响较大;4)金斑喙凤蝶雌蝶少,卵孵化率低,幼虫发育历期长,幼虫成活率低,化蛹和羽化率低等是导致其种群数量稀少的主要原因。5)据查,目前尚未有其它蝶类化蛹过程中经历两次蜕皮的报道,预蛹化蛹蜕两次皮是金斑喙凤蝶异于其他蝶类的特殊现象。
金斑喙凤蝶;九连山;形态特征;生活习性;生物学特性
金斑喙凤蝶(TeinopalpusaureusMell)隶属鳞翅目(Lepidoptera)凤蝶科(Papilionidae)喙凤蝶属(Teinopalpus)昆虫[1]。1923年Mell首次在广东连平县北部山区(即九连山主峰黄牛石南坡)发现[2]。世界自然保护联盟(1985年IUCN)列为红色名录种,《濒危野生动植物种国际贸易公约》(CITES)一级保护物种,1989年列为国家Ⅰ级重点保护野生动物[3]。金斑喙凤蝶分布于亚洲东南部沿海地区[4],已经报道有5个地理亚种[4-8],分别为:金斑喙凤蝶指名亚种(TeinopalpusaureusaureusMell)(广东)、广西亚种(T.aureusguangxiensisChou et Zhou)(广西大瑶山)、武夷亚种(T.aureuswuyiensisLee)(福建),海南亚种(T.aureushainaniLee)(海南),以及位于越南、老挝等地的斯金卡亚种(T.aureusskinkaiiMorita)[5]。国内现有金斑喙凤蝶广西亚种的生物学特性研究报道和江西井冈山金斑喙凤蝶生物学特性的研究报道[6-9]。九连山于1996年首次发现金斑喙凤蝶。2004—2015年,连续12年对该蝶进行野外观察与研究,2013年在木兰科植物金叶含笑MicheliafoveolataMerr.ex Dandy上发现其卵和幼虫,2014和2015年在深山含笑(MicheliamaudiaeDunn)上发现其卵和幼虫,深山含笑为新发现寄主植物[10],目前除九连山外尚未有其他地方报道过[4-18]。
1 研究地概况
江西九连山国家级自然保护区地处南岭山地东段,位于九连山主峰黄牛石北坡,地理坐标为24°29′18″~24°38′55″N,114°22′50″~114°31′32″E。境内海拔自300 m至主峰黄牛石1 430 m,地势南高北低。属中亚热带常绿阔叶林南缘,为中亚热带与南亚热带过渡地带,保存有较大面积的原生性常绿阔叶林,木兰科含笑属等常绿种类是其重要组成成分。九连山气候具有大陆性、海洋性又受山地影响,其性质属中亚热带湿润山地气候。年平均气温16.7℃,极端最低气温-7.4℃,极端最高气温37.0℃。年均降水量2 070.4 mm,年均相对湿度85%。区内已查明的高等植物297科2 796种,脊椎动物507种,昆虫202科1 752种[19-21]。
2 研究方法
查阅相关文献,金斑喙凤蝶寄主为木兰科植物[11-13],根据2004—2012年对金斑喙凤蝶成虫活动规律的观察研究,于2013—2015成虫活动期(4—5月和8—9月)对金斑喙凤蝶进行专项调查,采用样线(山脊、林间小道等)踏查的方法,自海拔450 m往山顶海拔1 200 m搜索,调查视野内的木兰科植物分布情况,并在金叶含笑、深山含笑、野含笑(MicheliaskinnerianaDunn)、木莲(ManglietiafordianaOliv)和乐昌含笑(MicheliachapensisDandy)树上寻找卵和幼虫,收集后带回驻地进行仿生态养殖,观察其形态特征和生活习性。
考虑方便观察,在驻地选择光照和通风条件良好的场地(海拔250 m),搭建2 m×2 m×1.8 m的养殖棚,棚内放置盆栽能起到一定的保湿和遮阴的作用。用玻璃或塑料器皿装湿沙,插入寄主鲜枝条,再放布满苔藓的方盘里,每天洒水,保持湿度。观察、拍摄幼虫的活动情况、记录进食、蜕皮、温度和湿度等。本文对金斑喙凤蝶卵和幼虫形态特征与生活习性的描述,以3 a对5粒卵和5只幼虫的实际观察数据为准,幼虫各个龄级时间取各个体该龄级的数据区间。成虫生活习性的描述,是12 a野外观察数据的总结。
3 研究结果
3.1 形态特征
3.1.1 成虫 雄蝶体长30~35 mm,翅展85~110 mm,体翅黑色,分布有绿色或黄绿色鳞片,触角为棒状,末端膨大而弯曲,前翅布满绿色鳞片,基半部较端半部绿色鳞片多,中域偏基部有一条自前缘达后缘的微弧形黄绿色横带,横带内侧有一同样宽度的黑色带纹与其相并排列;后翅中域具黄色大斑略成五边形,外缘齿状,有黄色新月斑,M3向外突起成尾突,尾突端部黄色。雌蝶个体明显大于雄蝶,体色较雄蝶稍淡,身体及前翅布满绿色鳞片,前翅中域近基部的微弧形横带呈蓝白色,后翅斑纹大,呈黄色或黄白色,后翅外缘呈锯齿状,M1、M3突起成两尾突,M3较M1长,尾突末端淡黄色(图1、2)。
3.1.2 卵 卵为半球状,粉红色,个体较大,直径2.3~2.4 mm,高2.1~2.2 mm,底部平滑。(图3)
3.1.3 幼虫 幼虫共5龄,1龄幼虫全身被稀疏刚毛,其它各龄幼虫无毛,每龄幼虫初期和末期在体色和大小上存在一定的差异,幼虫停食后至蜕皮前,根据龄级不同,虫体会缩短3~7 mm,蜕皮后体长会维持蜕皮前状态,待取食后体长恢复至停食前的状态,而后快速生长。5龄幼虫停食后虫体变化大,本文将5龄停食后至预蛹前的时段作为老熟幼虫来描述。各龄级幼虫体长、头壳宽和取食量见表1。
1龄幼虫:体长5~12 mm。刚孵化幼虫体长为5~6 mm,头壳宽1.5 mm,全身棕褐色,体表粗糙,虫体各节有一排瘤状突起,其中位于前胸节和尾节两侧的瘤状突起最大,其上簇生4~6根刚毛,其余各节瘤状突起着生1~3根刚毛,背腹中央有1块白色斜纹从背面一直延至腹部侧面下端,位于3、4、5腹节上;尾节两侧分别有一白色斑纹。第3天后,幼虫前胸呈亮褐色,1龄幼虫后期体长11~12 mm,体色较前期稍淡,虫体有光泽,蜕皮前体长8~9 mm。(图4、5)
2龄幼虫:体长9~19 mm,头壳宽2.1 mm,全身光滑无毛,蜕皮后呈黄褐色,2天后头胸部呈暗绿色,腹部为棕绿色,3、4、5腹节及尾节白斑明显,随着虫体的增长白斑也随之增大,除前胸节外,各节有规律的分布有不明显的蓝色和白色斑点,分布于背线两侧,其中,中、后胸节每侧2个,腹节每侧1个。停食前体长18~19 mm,蜕皮前体长15~16 mm。(图6、7)
3龄幼虫:体长16~29 mm,头壳宽3 mm,头部及胸为绿色,腹部黄绿色,腹部中央的白色斜纹加宽,腹部背线上有1条较明显的白色虚线纹;3龄中后期,幼虫全身绿色,密布短条状黑色斑纹,身体各节的蓝白色斑点明显,后胸节上位于外侧的两个蓝白色斑点最大,周围环绕着一圈不明显的淡棕色环形斑纹,腹足乳黄色。停食前体长27~29 mm,蜕皮前体长25 mm。(图8、9)
4龄幼虫:体长25~47 mm,外部形态和习性与3龄相似;头壳宽4.5 mm,全身无光泽,较3龄后期稍暗,胸节背部的蓝白色斑点变为蓝色,后胸节上位于外侧的2个较大的蓝白色斑缩小,棕色环形斑纹增宽,形成一对眼状斑纹。停食前体长为46~47 mm,蜕皮前体长为40 mm。(图9、10)
5龄幼虫:体长40~75 mm,爬行时最长可达85 mm,头壳宽6.5 mm,全身绿色,腹部中央的白色斜纹在第2天消失,身体各节密布的黑色短条状斑纹明显;胸足紫红色,腹足及腹部腹面乳黄色,腹部各节的气门明显,腹背部的蓝白色斑点变为蓝色,形成自胸节至尾节整齐排列的两排蓝色斑,第5、6腹节外侧各有一白色斑点;眼状斑中间的蓝白色斑再次缩小,外围的棕色包围圈变成紫红色;腹足于第6~7天变成淡黄色,第8~9天各节间呈淡黄色,胸足紫红色;第10~11天腹足及节间变黄,腹背部略呈黄绿色,近老熟时,腹背部出现锈色斑块。(图11、12)
老熟幼虫:体长65~75 mm。幼虫停食后8~13 h内,身体变化快,腹背部的锈色斑块变为紫红色斑并不断增大增多,头部仍为绿色。8~13 h后,幼虫排出大量棕色液体,虫体变成通体黄色,仅有前、中胸节背部仍有小块绿色,胸腹背部各节分布大小不等的紫红色斑块,眼状斑紫红色(图13)。
3.1.4 蛹 预蛹:黄绿色,头部、胸和胸足及6~10腹节为棕褐色,呈C状悬挂枝条上,缢丝银白色。(图14)
蛹: 缢蛹。长37~42 mm,宽18~20 mm,高16~19 mm(含喙状突起)。蛹整体为绿色,背面(朝下面)扁而宽阔,近似菱形,头部向前突起,背面腹部轮廓呈抛物线状,前中胸侧面有1对褐色气门,中胸背面有1个十分明显的喙状突起,突出蛹体6~8 mm,尖端钝圆,与蛹体呈近直角,稍向后倾。缢丝绕在后胸,似将后胸分为2节。蛹背面中央有一条褐色斑线,自喙状突起中间一直延至尾节。后胸背线两侧有两对褐色斑,靠近中线的斑小,靠近侧线外的褐色斑呈疤状突起。第1~3腹节略呈淡黄绿色,第1腹节两侧有两个褐色斑,靠近中线的斑小成点状;侧面看,第2~4腹节突起成驼背状,第2~8腹节两侧各有1个绿色气门,除2、3腹节的气门位于腹节背面外,其余位于腹节侧面,腹部背侧线分别有一条绿色带纹,从第3腹节一直延至腹部末端;腹面(朝上面)绿色,较正面略深,头胸部能看见类似足翅状痕,第5、6节各有1对明显灰白色环状斑,第7节有一对不明显灰白色斑纹,腹部两侧有一条灰白色带纹,从第3腹节一直延伸至腹部末端,亚腹部处分别有一条灰白色斑纹从第3腹节1一直延伸至第9节,第9、10腹节腹面分布有生殖孔和肛门。(图17)

表1 金斑喙凤蝶各龄级幼虫体长、头壳、取食量及蛹观察数据
注:幼虫初期体长为刚孵化或刚蜕皮后的长度,后期体长为停食前的长度,蜕皮前体长为停食后幼虫静息一段时间体长缩短后的长度;取食量是以幼虫取食后的叶片在方格纸上描下缺刻或以相近大小的叶片减去吃剩部分得出数据。取食面积大小与叶片的厚薄也有关系,叶厚则取食面积小些。
3.2 生物学特性
3.2.1 年生活史 金斑喙凤蝶属完全变态昆虫,一生要经过卵、幼虫、蛹、成虫4个阶段。在九连山为1年2代,第1代成虫发生期为4月上旬至5月中旬;第2代成虫发生期为8月下旬至9月中旬。以蛹越冬。
3.2.2 生活习性
(1)寄主 目前国内已报道的金斑喙凤蝶寄主植物有1995年吴焰玉在海南五指山发现的乐东拟单性木兰Parakmerialotungensis(Chun et C. H. Tsoong) Y. W. Law[11],广西大瑶山的光叶拟单性木兰Parakmerianitida(W. W. Sm.) Y. W. Law和广东含笑MicheliachapensisDandy[12],江西井冈山的金叶含笑[13]。经调查发现,九连山金斑喙凤蝶寄主植物为木兰科植物金叶含笑和深山含笑。
(2) 成虫 成虫种群调查:12 a间4—5月野外调查41 d,18 d观察到成虫或卵和幼虫,其中观察到雌蝶4次;8—9月野外调查30 d,观察到成虫或空卵5 d,其中观察到雌蝶1次。根据10多年的观察记录以及2013—2015年专项调查分析,金斑喙凤蝶在九连山一年发生二代。第一代成虫发生在4月上旬至5月中旬;第二代成虫发生在8月下旬至9月中旬。雌蝶数量明显少于雄蝶,成虫数量春季多于秋季。养殖观察,受活动空间和水源限制,羽化后成虫成活期为10 d。野外观察记录见表2。

表2 九连山金斑喙凤蝶发生生境、时间、虫态与数量调查记录
a.生境主要包括山顶矮林/草甸(AC,矮林主要由木荷、箭竹、满山红等林木构成);原生性常绿阔叶林(原生林YS,主要由栲树、甜槠、青冈、木荷、米槠、南岭栲、鹿角栲、罗浮栲、含笑等林木构成);次生性常绿阔叶林(次生林CS,主要由枫香、拟赤杨、枫杨、甜槠、米槠等林木构成);松杉林(SS,主要由马尾松、杉木、柳杉等林木构成);毛竹林(MZ,主要由毛竹等林木构成);农田居住地(NT,无林木区)等类型。b.行为主要包括成虫求偶(雄蝶追逐雌蝶)、访花、汲水、停息、产卵及幼虫栖息、取食等。
成虫水平分布:成虫水平分布活动范围约20 km2,东西水平距离约6 km,南北水平距离约3.5 km。东西方向,在一定海拔范围,水平距离较长;南北方向,受垂直梯度限制,在一定海拔范围,水平距离较短。金斑喙凤蝶在林中飞翔或停留在树枝、溪涧石上。偶尔在毛竹林中有成虫活动。
成虫垂直分布:金斑喙凤蝶在九连山垂直分布范围较大,海拔分布较低。成虫垂直分布活动范围为海拔580~1 200 m,与生境内金叶含笑、深山含笑海拔分布相似。天气晴朗时,早晨8点左右雄蝶开始成群聚集出现于海拔1 000 m左右的山脊或山顶,逐渐绕山头向上飞行,在海拔1 000~1 200 m的各个山头飞行或停息,雄蝶停息时间有时长达30 min。雌蝶大约11点半出现在山顶,时间极短,后追逐离去,12点以后,山顶未见有成虫活动。海拔580~700 m处能观察到单只雄蝶或雌蝶活动。
(3)卵 雌蝶选择光照较好的金叶含笑或深山含笑叶面上产卵,单粒散产于寄主植物叶面近主脉处,一枝一叶一卵。3 a收集到7粒卵,2粒收集时已坏死。观察5粒卵,成功孵化3粒,孵化率60%。由于未观察到野外产卵时间,养殖观察卵期为8~13 d(见表3);卵初期为粉红色,后渐变成深紫色再转混浊状浅紫色,孵化前2 d,卵呈乳白色混浊状,孵化前1 d,卵壳白色透明,透过卵壳可见内部黑色胚胎;孵化时幼虫从侧面咬破卵壳爬出,卵壳侧面留下直径约1.5 mm的圆孔。(图4)
(4)幼虫 观察5只幼虫(含孵化3只),一只1龄时排便不畅,发育不良,1龄时间长达16 d后死亡,一只5龄时拉稀死亡,幼虫成活率60%。各龄级幼虫期有一定差异,相同环境下,因个体不同,同龄级时间也有所差别,幼虫虫期为38~43 d。幼虫警觉性很高,当其爬行或取食时树枝稍有震动,会立即停止活动,头壳钩起缩体静伏,而微风则不影响其活动。
吐丝:幼虫有吐丝习性,爬行时留下一路细丝,并在取食叶片上吐丝,再次取食同一叶片时,会沿丝路爬行过去;取食完沿丝路回到休息叶片。幼虫在休息的叶片上布满丝垫,丝垫为银白色。(图8)
切叶:3龄以后的幼虫有切叶的习性,其吃食过不再吃的叶片,会在叶片基部切断叶柄,并把留在枝条上的叶柄断面咬平。切叶习性也因个体不同,有的自3龄后期开始切叶,有的自4龄开始,1、2龄幼虫未发现切叶现象。(图10)
取食:幼虫取食半革质化和革质化叶片,未见取食嫩叶,取食一般从叶尖开始(1龄偶尔在叶缘取食),1~2龄幼虫取食时从叶尖沿主脉的一边往叶中部吃出一长条形缺刻,3~5龄从叶尖开始取食至叶中部后,往主脉两边取食叶片,大部分叶片会剩下约1/4~1/3,有时只剩半截主脉。正常每天取食3~4次,偶尔5次;取食多在白天进行,观察取食386次,有3个取食高峰,分别是5:00—7:00为72次,占18.7%,11:00—13:00为51次,占13.2%,19:00—21:00为66次,占17.1%,除此之外,13:30左右和17:30左右也是吃食的小高峰,见图1取食时间按时间段统计,即23-1(0),1-3(2),…21-23(22))。当幼虫准备蜕皮时,蜕皮前最后两次取食间隔较短,最后一次取食时间较平时取食时间长3~5 min,取食的叶量也较平时多。最后一次取食至蜕皮时间间隔为36~53 h(1.5~2 d)。
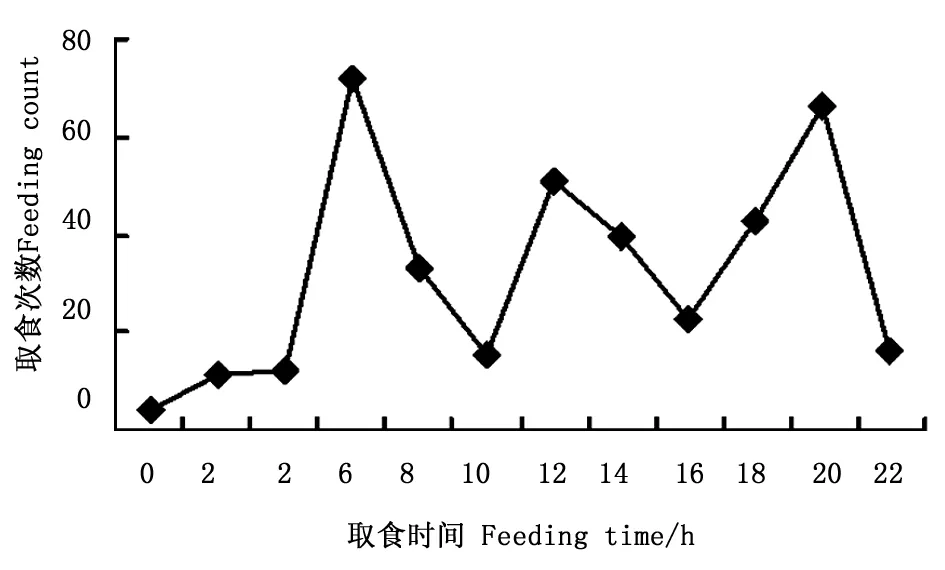

图1 金斑喙凤蝶各时间段取食次数折线图Fig.1 Line of larval feeding counts during 24 h in Teinopalpus aureus
蜕皮:一般在4:00—10:00和19:00—22:00进行,阴雨天偶尔也在中午进行,蜕皮时,幼虫缓缓扭动身体,使老皮与虫体剥离,后Y腺不时伸出,使头壳处老皮开裂,此时可见新虫体头部和胸部蜕出,旧头壳顶于新头壳上,新头壳明显比旧头壳大许多,当头部旧皮完全开裂后,幼虫摔动头部,将头壳摔掉; 此时幼虫不断蠕动身体,缓缓向前爬动,使蜕滑向尾部,然后翘起尾部左右摔动,使蜕脱落。自虫体蠕动至蜕皮完成的过程约1 h,而老皮从头壳处裂开至蜕皮完成只需5~8 min。蜕皮完成后约1 h,幼虫开始掉头吃蜕,吃完整张蜕约10 min。(图6、9)
粪便:新鲜粪便为棕黑色,干时为褐色,半球形,中空,似窝窝头状,由细小的碎叶片组成。
1龄幼虫:虫期为6~9 d,幼虫从卵壳爬出,静息约1 h后开始取食卵壳。之后在叶面爬行找适合休息的叶片,一般会选择背光或较隐敝的叶片,一边爬行一边吐丝,在休息的地方布上丝垫。取食卵壳2~3 h后第1次取食叶片,取食叶片约2~3 mm2。后随着虫体增大食量不断增大。一次取食时间约5~8 min,蜕皮前最后一次取食时间10~15 min;最后一次取食至蜕皮时间间隔为36~46 h。1龄取食叶量为270~350 mm2。
2龄幼虫:虫期6~7 d。蜕皮后静息40~50 min开始吃蜕,吃完整张蜕约需要10 min;4~5 h后开始取食叶片,时间约8 min。最后一次取食至蜕皮时间间隔为36~38 h。2龄取食叶量为1 110~1 260 mm2。
3龄幼虫:虫期5~10 d。蜕皮后静息40~60 min开始吃蜕,时间约10 min。3龄幼虫生长较快,食量增大。最后一次取食至蜕皮时间间隔为38~39 h。3龄取食叶量为4 110~4 270 mm2,开始有切叶现象。
4龄幼虫:虫期6~10 d。形态特征及习性与3龄相似,体重和食量增加较快,每次取食叶片的时间为13~22 min。最后一次取食至蜕皮时间间隔为50~53 h。取食叶量15 900~18 700 mm2。
5龄幼虫:虫期10~14 d。蜕皮后70~100 min后开始吃蜕,时间约10 min;吃完蜕8~9 h后第一次取食叶片。5龄幼虫生长迅速,食量大,虫体变化大。取食时间为15~25 min,当虫体节间和腹足变黄、幼虫背部开始出现锈色斑块时,幼虫仍在取食。取食叶量为72 300~98 700 mm2。
老熟幼虫:老熟幼虫虫期约1 d。幼虫最后一次取食后,掉头朝上(向叶柄)停留在取食叶片上,8~13 h后,幼虫倒退着将尾部伸出叶片外,排出大量棕褐色液体,棕褐色液体里有许多叶片碎沫,然后从枝条爬至地面,在地面、纱帐和枝条上不停的快速爬行,寻找适合化蛹的枝条,选择好化蛹的位置后,首先将整段小枝布满丝垫,然后头朝上将尾部固定在小枝上,第2、3、4对腹足吸附在枝条上,胸足和第1对腹足悬空,头不停的来回扭动拉出长丝绕过虫体作缢丝,将身体悬挂,形成预蛹。
(5) 蛹 预蛹1~2 d后化蛹。3只预蛹,1只在化蛹第二次蜕皮时蛹体未被缢丝挂住脱落,两只化蛹成功,化蛹率67%。预蛹成蛹经历两次蜕皮:第一次蜕皮时,预蛹颤动、蠕动使第一层老皮与虫体剥离,从预蛹表面可以看到一层皱皱的薄皮,而后虫体摆动,蜕由头部开裂后往腹部滑至第8、9腹节处,这时,虫体由预蛹时的C形伸直成一字形,体绿色,腹足在第一次蜕皮时蜕离虫体,胸足则仍留在虫体上;第一次蜕皮完成后约80 min开始第二次蜕皮,皮自前胸背部开裂,露出喙状突起和头部,虫体左右摆动,蜕由头胸部向腹部滑至第一层蜕处,最后两层蜕一起脱离。刚成蛹时蛹体柔软,正面绿色,腹面黄绿色,一段时间后,蛹体硬化,腹面颜色由黄绿色变成绿色,仅第1~3腹节略呈淡黄绿色。在九连山,第1代蛹发生于6月上中旬至8月中下旬,为夏蛹。第2代蛹发生于10月上中旬至次年4月上中旬,为越冬蛹。受养殖地温、湿度影响,蛹期为87~113 d。(图15、16)
(6) 羽化 2只蛹,1只87 d后蛹体开始变化,却未羽化,解剖后发现已近羽化成蝶却未破蛹而出,1只113 d后羽化。整个蛹期蛹体基本上没有变化,偶尔会有一次“点头”行为。羽化前3~5 d,背面(朝下面)节间颜色逐渐变深,其余变化不大,羽化前1~2 d节间变成黑色,头部一约5 mm近圆形状的区域变薄,虫体腹面似翅足状区域变成近黑色。观察蛹于凌晨3点羽化。羽化时,成虫将头部近圆形变薄区域推开,腹面似胸足与翅相连处开裂,成虫爬出时该区域似盖翻起,喙状突起裂开,同时带出大量褐色液体。刚羽化的成虫在蛹壳旁静息,翅湿,约1 h后翅逐渐干燥展开,早晨6点飞离枝条,但第一次飞行距离不远。(图18)

表3 金斑喙凤蝶卵、幼虫、预蛹、蛹观察记录表
4 讨论
金斑喙凤蝶属高海拔树冠型昆虫,寄主植物多为10~25 m的高大乔木。在九连山,其活动区域离驻地远,地势险峻,气候条件复杂,尤其是5~6月份雷雨天气较多,野外观察金斑喙凤蝶的生活习性难度很大。为了便于24小时观察,选择在驻地仿生态养殖,观察其幼虫的形态特征和生活习性。由于该物种濒危稀少,寻找和收集十分困难,以至研究虫量偏少,未能同时做不同环境下的养殖对比。养殖地的海拔高度、气温、湿度、日照及降雨等与野外栖息地有一定的差异,幼虫在养殖状态下的生活习性与野外自然状态下的生活习性可能存在差异,野外自然状态下的生活习性还需要进一步观察研究。

5 结论
(1)野外样线踏查共记录到木兰科植物369株,包括金叶含笑、深山含笑、木莲、野含笑等树种。其中,记录到金叶含笑与深山含笑寄主植物260株。这些木兰科植物主要分布在AC、YS、CS与SS生境中,而87.8%的个体分布在YS生境中。然而,金叶含笑与深山含笑两种寄主植物只在AC与YS生境有记录,且94.6%的个体出现在YS生境。从海拔高度分布上看,仅有11.9%的木兰科植物个体分布在<700 m海拔区,而64.8%与23.3%的个体则分别发生在>700 m与>1 000 m海拔区。值得提及的是,在<700 m海拔区,记录到的个体皆为幼苗或幼树,且光照条件差。金斑喙凤蝶成虫求偶行为多在海拔较高的山顶聚集出现,成虫求偶时对海拔高有一定的要求。调查发现海拔700~1 200 m寄主植物分布范围有卵和幼虫分布,且成虫常在寄主植物分布范围及周边活动。九连山金斑喙凤蝶生境为原生性常绿阔叶林,而在临近或更远生境为次生林、残次林,其中有深山含笑、金叶含笑寄主植物分布区域,但未调查到金斑喙凤蝶分布。金斑喙凤蝶卵和幼虫的分布与寄主植物分布密切相关,且对生境质量有较高要求,成虫活动范围主要在寄主植物分布范围及其周边。
(2)2013年野外大部分深山含笑叶面覆盖一层烟煤尘状物,金叶含笑生长良好,野外调查时在金叶含笑上发现卵和幼虫。2014年金叶含笑叶面有烟煤尘状物,深山含笑生长良好,在深山含笑上发现卵和幼虫。2015年,金叶含笑和深山含笑均生长良好,仅在深山含笑上发现卵和幼虫。在九连山,金斑喙凤蝶选择叶片生长良好的寄主植物,或嗜食深山含笑。
(3)卵的孵化需要一定的温、湿度,温度对幼虫的影响,主要表现在气温达33℃以上时,幼虫不活跃,取食量减少;温度和湿度对幼虫蜕皮、化蛹和羽化有一定的影响,2014年幼虫在干树技上化蛹,虽然采取了遮阴措施,但盆栽植物较少,未采取保湿措施,空气干燥,羽化失败;2015年在养殖棚里加放了多株高1 m左右的盆栽植物,幼虫在植物枝条上化蛹,气温33℃以上时在地面放置冰块,相对湿度低于40%时采取加湿措施,蛹成功羽化。温度、湿度等环境因子,对卵的孵化、幼虫的生长发育以及化蛹和羽化影响较大。
(4)养殖金斑喙凤蝶卵期8~13 d,幼虫期38~43 d,蛹期87~113 d,化蛹经历两次蜕皮,3~4 h完成;而观察海拔1 000 m收集的碎斑青凤蝶Graphiumchironides(Honrath),卵期5 d,虫期23 d,蛹期12 d,化蛹过程蜕皮一次,约1 h完成;低海拔(250 m)收集的木兰青凤蝶Graphiumdoson(Felder et Felder),卵期3 d,虫期19 d,蛹期10 d,化蛹过程蜕皮一次,约1 h完成。金斑喙凤蝶雌蝶少,卵孵化率低,幼虫发育历期长,遭遇天敌机率高,幼虫成活率低,化蛹和羽化率低等是导致其种群数量稀少的主要原因。
(5)观察预蛹成蛹须经历两次蜕皮,这是金斑喙凤蝶研究中的一项重大发现。据查,目前尚未有蝶类化蛹过程中经历两次蜕皮的报道,预蛹化蛹蜕两次皮是金斑喙凤蝶异于其他蝶类的特殊现象。
6 保护策略及建议
目前,国内已知的金斑喙凤蝶分布点均在保护相对完好的常绿阔叶林或针阔混交林中。在自然选择作用下,金斑喙凤蝶对其阔叶林生境的适用性行为特征非常明显[18],这种适用性无疑有利于该蝴蝶种群在常绿阔叶林生境的繁衍生息,然而这种适用性使得金斑喙凤蝶对高质量的生境具有明显的依赖性[18]。因此,研究保护金斑喙凤蝶的策略首先要研究如何保护金斑喙凤蝶赖以生存的常绿阔叶林生境,从而为金斑喙凤蝶的繁衍生息提供了良好的基础条件。建议:1)加强对金斑喙凤蝶栖息地的保护管理,维护常绿阔叶林生境的完整性和连续性,防止金斑喙凤蝶生境遭受破坏。2)进一步加大周边地区的天然常阔叶林的保护,特别是深山含笑、金叶含笑的保护,促进生态环境的恢复,扩大金斑喙凤蝶适宜生存的范围。
[1] 周 尧.中国蝶类志[M].郑州:河南科学技术出版社,1994:181-183.
[2] Mell R. Noch unbeschriebeneLepidopterenausSudchina(II)[J].Deutsche Entomologische Zeitschrift.,1923:153-160.
[3] 中华人民共和国林业部野生动物和森林植物保护司.中国野生动物保护管理法规文件汇编[R].北京:中国林业出版,1994.
[4] Igarashi S.Life history ofTeinopalpusaureusin Vietnam in comparison with that ofT.imperialis[J].Butterflies,2001,30: 4-24 .
[5] Morita S.A new subspecies ofTeinopalpusaureusMell,1923 from Vietnam (Lepidoptera:Papilionidae)[J]. Wallace,1998,4(2):13-15.
[6] 曾菊平,周善义,罗保庭,等.金斑喙凤蝶广西种生活史研究[J].广西科学,2007,14(3):323-326.
[7] 曾菊平,周善义,罗保庭,等.广西大瑶山濒危物种金斑喙凤蝶(广西亚种)的形态学、生物学特征[J].昆虫知识,2008,45(3):457-464.
[8] 何桂强,贾凤海,赵 健,等.井冈山金斑喙凤蝶形态学特征观察及生物学特性研究[J].江西林业科技,2014,42(2):34-42.
[9] 贾凤海,陈春泉,何桂强.江西蝶类生活史研究(井冈山卷)[M].江西科技出版社,2014:66-74.
[10] 曾菊平,林宝珠,朱祥福,等.发现濒危种金斑喙凤蝶寄主植物——南方广布种深山含笑[J].江西农业大学学报,2014,36(3):550-555.
[11] 陈仁利, 顾茂彬.金斑喙凤蝶研究中存在的问题与展望[J].环境昆虫学报, 2009, 31(01):80-84 .
[12] 曾菊平,周善义,李常春,等.金斑喙凤蝶广西亚种的蛹及寄主植物的发现[J].昆虫知识,2005,42(1):71-73.
[13] 何桂强,贾凤海.井冈山金斑喙凤蝶 Teinopalpus aureus Mell 种群数量调查和寄主发现[J].南昌工程学院学报,2012,31(4):68-70.
[14] 黄寿山,田明义,王 敏,等.中国金斑喙凤蝶研究进展[J].武夷科学,2002,(18):(120-124).
[15] 何达崇,蒋国芳,颜增光,等.金斑喙凤蝶成虫交配和取食行为观察[J].广西科学,2000,7(1):78-79.
[16] 曾菊平,周善义,梁艳丽,等.金斑喙凤蝶蛹的生态研究[J].当代昆虫学研究——中国昆虫学会成立60周年纪念大会暨学术讨论会论文集,2004,701-703.
[17] 蒋国芳,何达崇,颜增光.金斑喙凤蝶雄虫触角感觉器的扫描电镜观察[J].广西科学,2000,7(2):144-146,149.
[18] 曾菊平,周善义,丁 健,等.濒危物种金斑喙凤蝶的行为特征及其对生境的适应性[J].生态学报,2012,32(20) : 6527-6534.
[19] 刘信中,肖忠优,马建华.江西九连山自然保护区科学考察与森林生态系统研究[M].北京:中国林业出版社.2002:287-311.
[20] 林宝珠,高友英,朱祥福,等.九连山国家级保护区蝴蝶资源再调查及名录增补[J].江西林业科技,2011,(04):44-45.
[21] 林宝珠,胡华林,朱祥福,等.江西九连山国家级自然保护区蜻蜓资源调查初报[J].江西林业科技,2011,(04):41-43.
(责任编辑:崔 贝)
Research on Biological Characteristics ofTeinoplpusaureusin Jiulianshan
LIN Bao-zhu1, 3, ZHU Xiang-fu1, 3, ZENG Ju-ping2, 3, YUAN Jing-xi1,3
(1. Administration Bureau of Jiulianshan National Nature Reserve, Longnan 341700, Jiangxi , China; 2. College of Forestry, Jiangxi Agricultural University, Nanchang 330045, Jiangxi, China; 3. Jiulianshan Forest Ecosystem Observation Station, Longnan 341700, Jiangxi, China)
[Objective]Based on field observation to study the adult active regularity ofTeinoplpusaureusand their biological traits such as morphological characteristics and living habit of eggs and larvae by using bionic feeding experiments, so as to provide valid data for the study and protection ofT.aureus. [Method]The field observations for the adult active regularity ofT.aureuswere conducted from 2004 to 2012. In 2013~2015, all the Magnoliaceae host trees were investigated and the eggs and larvae ofT.aureuswere collected under the leaves along the ridge from 450 to 1200 m above sea level by using route research method. The morphological characteristics and living habit of the eggs and larva collected from the host plant leaves were observed by using bionic feeding experiments. [Result] The results show that theT.aureushas two generations per year in Jiulianshan. The overwintering morph is its pupa and the adult stage of first generation usually occurs between early April and mid-May. The adult period of second generation usually occurs between late August and mid-September, however. In 2013, the eggs and larvae were found under the leaves ofM.foveolata(Magnoliaceae). In 2014~2015, the eggs and larvae ofT.aureusunder the leaves ofMicheliamaudiaeimplies thatM.maudiaeshould be another new host plant forT.aureus. For now, the discovery is reported for the first time. The larvae ofT.aureusundergo 5 instars and the difference of various instar larvae is significant. An important discovery for this study shows that the pupation of prepupae will undergo two molts in the region. [Conclusion] The conclusion indicates that:(1) the distribution of eggs and larvae ofT.aureusare closely related with the distribution of host plants grew in favorable habitats; (2) the femaleT.aureuslays eggs on healthy leaves ofM.foveolataandM.maudiaeand the larvae will chew on the leaves ofM.maudiae; (3) the environmental factors, such as temperature and humidity, may have a significant impact on the egg hatch, the larvae development, the pupation and the emergence of adults; (4) lack of female, low egg hatchability, longer larvae stage, low survival rate of larvae, low pupation rate, low eclosion rate and so on are the main reasons for their scarcity in this region; (5) the pupation of prepupae with two molts in other butterflies have not been reported so far and this is a special phenomenon that distinguishes from other butterflies.
Teinoplpusaureus; Jiulianshan; morphological characteristics; living habit; biological trait
10.13275/j.cnki.lykxyj.2017.03.006
2016-08-18
江西省自然科学基金项目(20132BAB214024)
S763.42
A
1001-1498(2017)03-0399-10
* 通讯作者:林宝珠,女(1964—),高级工程师,长期从事自然保护区管理与研究工作。E-mail:lbzh903@163.com

