氟罗沙星注射液与两种抗感染中药注射液配伍稳定性研究
胡瑜+卢涛
【摘要】 目的 探讨氟罗沙星注射液与两种抗感染中药注射液配伍的稳定性。方法 观察氟罗沙星与双黄连注射液及鱼腥草注射液配伍后, 其外观、颗粒数及pH值的变化情况, 并采用紫外分光光度计检测配伍后液体中氟罗沙星的稳定性。结果 双黄连注射液与氟罗沙星注射液混合后, 溶液呈透明红棕色;鱼腥草注射液与氟罗沙星注射液混合后, 溶液出现轻微浑浊。双黄连注射液与氟罗沙星注射液配伍后6 h内pH值及微粒数目变化较小, 较为稳定, 并且氟罗沙星含量无明显变化。氟罗沙星注射液与双黄连注射液配伍后第0、1、2、4、5 h测定5%葡萄糖注射液中氟罗沙星的含量分别为100.00%、100.48%、98.01%、99.50%、107.10%, 各時间点氟罗沙星含量无明显变化(RSD=0.66%)。结论 氟罗沙星注射液不宜与鱼腥草配伍, 与双黄连注射液配伍后, pH值及微粒数目变化较小, 稳定性较好。
【关键词】 氟罗沙星;双黄连;鱼腥草;中药注射液;配伍;稳定性
DOI:10.14163/j.cnki.11-5547/r.2017.13.060
中药注射液中一般含有多种、复杂成分, 其有效成分的溶解度与溶液的pH值息息相关, 因此pH值出现变化时, 溶液极易出现各种物理或者化学反应导致有效成分失效[1]。如果注射液的稳定性不高, 则容易甚至出现浑浊或者产生沉淀等现象, 在使用时, 造成微循环阻塞, 因而进一步对人类机体产生副作用等。氟罗沙星属于一类新型的抗菌药物, 属于氟喹诺酮类药物。氟罗沙星的抗菌谱较为广泛, 具有较强的抗菌活性, 而且作用时效较长, 因此被广泛用于临床治疗。目前, 氟罗沙星常与其他抗感染的药物联用, 因此对联用药物的配伍稳定性研究具有重要的意义[2]。本文就氟罗沙星与双黄连注射液及鱼腥草注射液分别配伍后的稳定性进行了研究探讨, 以提供科学依据, 支持临床合理配伍用药。
1 材料与方法
1. 1 仪器与药品 pHS-2C数字酸度计(杭州东星仪器厂), UV-2501PC型紫外分光光度计(上海成光仪器有限公司), GWJ-3型智能微粒检测仪(天津大学精密仪器厂), 氟罗沙星注射液(扬子江药业集团有限公司, 批号04072001), 双黄连注射液(哈药集团中药二厂, 批号Z13020772), 鱼腥草注射液(正大青春宝药业有限公司, 0012072), 5%葡萄糖注射液(安徽丰原淮海制药有限公司, H20144478)。
1. 2 方法
1. 2. 1 外观变化 模拟临床用药剂量, 将20 ml鱼腥草注射液、40 ml双黄连注射液分别加入250 ml 5%葡萄糖溶液中, 震荡摇匀, 观察混合后溶液的外观、颜色及浑浊情况等。分别取2 ml氟罗沙星注射液分别加入上述两种溶液中, 摇晃均匀后, 观察混合后溶液的外观、颜色及浑浊情况等。
1. 2. 2 pH值及微粒数检测 模拟临床用药剂量, 将20 ml鱼腥草注射液、40 ml双黄连注射液分别加入250 ml 5%葡萄糖注射液中, 摇晃均匀, 测定溶液的pH值, 计算直径>10 μm、25 μm的微粒数目。分别取2 ml氟罗沙星注射液分别加入上述两种溶液中, 摇晃均匀后, 同上测定pH值及微粒数量, 并观察8 h内其pH值及微粒数目的变化情况。
1. 2. 3 药物含量测定
1. 2. 3. 1 制备储备液 配制溶液A:用5%葡萄糖注射液精密配制200 mg/L的氧氟沙星溶液。配制溶液B:精密量取1 ml氟罗沙星注射液及0.8 ml双黄连注射液, 用5%葡萄糖注射液稀释到500 ml, 制备成200 mg/L的氟罗沙星标准溶液。配制溶液C:精密量取0.8 ml双黄连注射液, 用5%葡萄糖注射液稀释到500 ml。
1. 2. 3. 2 选择测定波长 精密量取2.5 ml A溶液, 用5%葡萄糖注射液将其稀释到100 ml, 并作为空白对照;扫描空白液后发现氟罗沙星在292 nm出有最大吸收峰。再以C溶液作为空白, 扫描后发现双黄连在280 nm及270 nm处有吸收峰出现。再用等吸收双波长消去法, 测点B溶液中氟罗沙星的质量浓度。
1. 2. 3. 3 制备标准曲线 分别精密量取A溶液1.5、2.0、2.5、3.0、4.0 ml, 并用5%葡萄糖注射液将其稀释到100 ml, 制备标准溶液(质量浓度分别为:3、4、5、6、8 mg/L)。以5%葡萄糖注射液作为空白对照, 在波长292 nm处测定标准溶液中氟罗沙星的吸收度[3]。分别精密量取B溶液1.5、2.0、2.5、3.0、4.0 ml, 并用5%葡萄糖注射液将其稀释到100 ml, 制备标准溶液(质量浓度分别为:3 、4、5、6、8 mg/L)。以5%葡萄糖注射液作为空白对照, 在波长280 nm及270 nm处测定标准溶液中溶液的吸收度。
1. 2. 3. 4 稳定性测试 模拟临床用药剂量, 将40 ml双黄连注射液分别加入250 ml 5%葡萄糖注射液中, 摇晃均匀, 分别取2 ml氟罗沙星注射液分别加入上述溶液中, 摇晃均匀。分别在0、1、2、4、6 h五个时间点, 从原溶液中吸取1 ml溶液, 再用5%葡萄糖注射液稀释至250 ml, 摇晃均匀, 在测定其吸收度。并根据吸收度及标准曲线计算对应的质量浓度。将0 h处的质量浓度记为100%, 此后每个时间点的药物质量浓度均与0 h处的质量浓度作对比, 并以百分比的形式表达含量变化[4]。
2 结果
2. 1 外观 双黄连注射液加入5%葡萄糖注射液后, 呈现淡红棕色透明外观;加入氟罗沙星注射液后, 溶液仍为澄清棕红色。鱼腥草注射液加入5%葡萄糖注射液后, 呈现无色透明状;加入氟罗沙星注射液后, 溶液出现轻微浑浊现象。
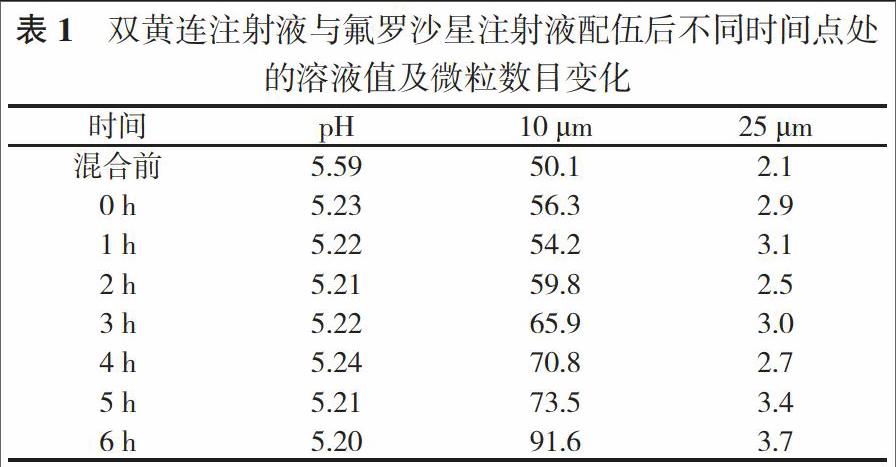
2. 2 pH值及微粒数目变化 双黄连注射液与氟罗沙星注射液配伍后, 溶液的pH值及在0、1、2、3、4、5、6 h这六个时间点处的变化情况, 见表1。实验结果表明, 适量注射液与氟罗沙星注射液配伍后pH值未出现显著性变化, 同时微粒数目也并未出现明显增加的情况, 均符合药典规定。
2. 3 含量测定 以标准溶液的质量浓度为横坐标, 对应的吸收度为纵坐标, 对结果进行回归, 并得到相应的标准曲线方程式。由结果可知, 氟罗沙星的标准曲线方程为:C=11.5312A-0.199, r=0.9999(n=5), 其线性范围是3~8 mg/L。同理, 双黄连的标准曲线方程为:C=39.1512A-0.064, r=0.9995(n=5), 其线性范围是3~8 mg/L。
2. 4 稳定性考察 由实验结果可知, 氟罗沙星注射液与双黄连注射液配伍后, 溶液在6 h内均能保持稳定。氟罗沙星注射液与双黄连注射液配伍后第0、1、2、4、5 h测定5%葡萄糖注射液中氟罗沙星的含量分别为100.00%、100.48%、98.01%、99.50%、107.10%, 各时间点氟罗沙星含量无明显变化(RSD=0.66%)。
3 討论
鱼腥草注射液在用5%葡萄糖注射液稀释后出现了轻微的浑浊现象, 可能是由于加入了氟罗沙星后, 溶液出现了反应导致溶液中有不溶物产生, 因此导致溶液出现浑浊。由此可知, 鱼腥草注射液与氟罗沙星注射液配伍后, 能否应用于临床还有待进一步的研究证明。实验结果表明, 双黄连注射液与氟罗沙星注射液配伍混合后, 溶液在6 h内能够保持稳定, 未见外观、pH值、微粒数目等明显变化, 同时检测到配伍后溶液中的氟罗沙星含量稳定[5-9]。但是, 配伍后双黄连注射液的有效成分是否改变, 配伍后溶液是否具有毒性等, 均仍待进一步的研究。
参考文献
[1] 朱丽萍, 余干林, 陈水平, 等. 氟罗沙星注射液治疗细菌性感染的疗效和安全性评价. 中国医药科学, 2012, 2(3):107.
[2] 许丽贞, 陈燕丽, 邹艳. 奥硝唑注射液与头孢哌酮钠他巴唑钠、氟罗沙星之间存在配伍禁忌. 中国误诊学杂志, 2011, 11(4):826.
[3] 许威, 李翔. 氟罗沙星注射液无菌检查方法的探讨. 安徽医药, 2011, 15(10):1228-1229.
[4] 黄国整. 氟罗沙星注射液与香丹注射液的配伍禁忌一例报告. 临床合理用药杂志, 2012, 5(6):161.
[5] 邓金雁. 萘普生钠氯化钠注射液与注射用氟罗沙星存在配伍禁忌. 山西医药杂志, 2011, 40(13):657.
[6] 祝永明, 李士敏, 吴筱丹,等. 氟罗沙星注射液与抗感染中药注射液配伍的稳定性. 中国临床药学杂志, 2004, 13(2):90-93.
[7] 于露, 刘玉辉. 氟罗沙星葡萄糖注射液与抗菌药配伍后的稳定性研究. 工企医刊, 2010, 23(4):83-84.
[8] 陈瑛, 张锋, 韩莹旻. 氟罗沙星注射液与常用药物配伍稳定性. 实用药物与临床, 2006, 9(1):40-42.
[9] 梁翠霞, 吴丽霞. 左氧氟沙星注射液与两种中药注射液配伍的稳定性研究. 中国民族民间医药, 2015(9):14-15.
[收稿日期:2017-04-06]

