以4单位病毒为标准物质定量新城疫病毒RT-PCR检测试剂盒的最低检出量
刘 爽,张如民,王晓东,张兴进,张 浩,宫枫举,邵 钰,邵卫星,,孙学强,
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛立见诊断技术发展中心,山东青岛 266114;3. 郑州职业技术学院,河南郑州 450121)
以4单位病毒为标准物质定量新城疫病毒RT-PCR检测试剂盒的最低检出量
刘 爽1,张如民3,王晓东2,张兴进2,张 浩2,宫枫举2,邵 钰2,邵卫星1,2,孙学强1,2
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛立见诊断技术发展中心,山东青岛 266114;3. 郑州职业技术学院,河南郑州 450121)
本实验首次以4单位病毒为标准物质,定量新城疫病毒RT-PCR检测试剂盒的最低检出量,用新城疫病毒LaSota株接种SPF鸡胚,制备尿囊液,经血凝试验测定滴度为27;将尿囊液倍比稀释后,提取各稀释度样品核酸,用新城疫病毒RT-PCR检测试剂盒进行扩增,结果多数样品均可检出特定长度的核酸。用该尿囊液制备4单位病毒为标准物质,倍比稀释后,提取各稀释度病毒核酸,对新城疫病毒RT-PCR检测试剂盒的最低检出量进行定量,结果表明该试剂盒的最低检出量为4单位病毒的1:32倍。该方法对于新城疫病毒RT-PCR检测试剂盒等分子生物学诊断试剂的研发、生产、质量控制和比对具有参考意义。
新城疫病毒;RT-PCR;4单位病毒;标准物质;最低检出量
新城疫(Newcastle Disease,ND)俗称亚洲鸡瘟、伪鸡瘟等,是由新城疫病毒(Newcastle Disease Virus,NDV)引起的,主要侵害鸡等250多种禽类的一种急性、高度接触性烈性传染病[1]。ND是世界卫生组织(OIE)须通报动物疫病,是我国一类动物疫病,也是《国家中长期动物疫病防治规划》确定的优先防治病种之一[2]。ND的初步诊断须根据现场的主要临床症状和剖检病理变化做出,然后经实验室反转录聚合酶链式反应(RT-PCR)检测确定为疑似,最后由国家参考实验室通过病毒分离和鉴定进行确诊[3]。因此,新城疫病毒RT-PCR检测试剂盒的最低检出量对于确定临床疑似样品至关重要。
聚合酶链式反应(PCR)是一种基于模板体外扩增特定DNA片段的分子生物学技术,至今已发展到第3代[4]。最初PCR技术主要在科研领域应用,因其特异性强、灵敏度高,以及检测速度快、高通量等优点,现已被广泛应用于医学诊断、兽医诊断、水产以及微生物检测等许多领域。目前关于NDV的RT-PCR和荧光定量RT-PCR检测方法的研究报道较多[5-6],但大多数研究集中于单一或者多重RT-PCR引物和探针的设计、PCR体系的配制和优化[7-8],以及临床样品的检测分析和鉴别诊断[9],也有部分研究对其建立方法的特异性和敏感性进行了初步验证。
标准物质对于兽医诊断制品的生产和质量管理意义较大。农业部《兽医诊断制品生产质量管理规范》对已有国家标准物质的采购、自制以及储存使用等做出了明确要求。同时,该规范还要求自制无国家标准的工作标准物质的,应当建立制备技术规范,必须制定工作标准物质的质量标准以及制备、鉴别、检验等操作规程[10]。国家和省(直辖市、自治区)动物疫病预防控制中心每年都进行兽医系统实验室检测能力比对,也不同程度开展各种兽医诊断制品的比对和筛选工作,从而选出能够满足国家动物疫病监测工作需要的兽医诊断制品[11]。因此,最理想的标准物质应当来源稳定、制备工艺简单、质量可控、定量准确。
本试验根据国家标准的相关内容,通过NDV血凝试验,制备4单位病毒为标准物质,然后对4单位病毒进行倍比稀释,提取病毒核酸。利用相对定量的病毒核酸,对检测试剂(盒)的最低检出量进行定量。该方法对于新城疫病毒 RT-PCR检测试剂盒等分子生物学诊断试剂的研发、生产、质量控制和比对具有参考意义。
1 材料与方法
1.1 材料
NDV LaSota株,本实验室保存;SPF种蛋,购自山东无特定病原鸡实验种鸡场;含病毒核酸提取试剂的新城疫病毒 RT-PCR检测试剂盒,青岛立见诊断技术发展中心研制。
1.2 方法
1.2.1 NDV尿囊液的制备。取-80 ℃保存的种毒,用生理盐水进行5 000倍稀释,按0.2 mL/枚接种于12枚9日龄SPF鸡胚,37 ℃孵育72 h,置4 ℃过夜后收取尿囊液,混匀后分装,-20 ℃保存备用。
1.2.2 血凝滴度(HA)的测定。参照《新城疫诊断技术》(GB⁄T 16550—2008)附录B,配制1%的鸡红细胞悬液,主要步骤:采集3只SPF公鸡抗凝血3 mL,加入20 mL磷酸盐缓冲液,混匀后1 500 r/min离心,弃上清和白细胞层;重复洗涤离心3次,最后吸取压积红细胞,按体积比加入磷酸盐缓冲液,配制成1%的鸡红细胞悬液,4 ℃保存备用。取-20 ℃保存的NDV尿囊液5 mL,连续倍比稀释至210,分别依次编号为0~10;然后参照《新城疫诊断技术》(GB⁄T 16550—2008)测定11个样品的血凝滴度(HA),重复3次,取均值。
1.2.3 4单位病毒的配制。取-20 ℃保存的血凝滴度为27的NDV尿囊液1 mL,按照《新城疫诊断技术》(GB⁄T 16550—2008),用磷酸盐缓冲液稀释配制4单位病毒;取4单位病毒5 mL,用磷酸盐缓冲液倍比稀释至28,编号为F0~F8。
1.2.4 病毒核酸的提取。取11个编号为0~10样品和9个编号为F0~F8样品各200 µL,参照试剂盒说明书提取NDV核酸,最后用60 µL 无RNA酶双蒸水洗脱,获得的核酸样品为前稀释核酸样品,编号为R0~R10和RF0~RF8。取R0样品30 µL,用30 µL无RNA酶双蒸水倍比稀释至210,获得的核酸样品为后稀释核酸样品,编号依次为R1'~R10'。
1.2.5 RT-PCR扩增和电泳。取各核酸样品3 µL,参照说明书配制总体积为25 µL的RT-PCR反应体系,同时设空白对照。PCR反应程序:(1)42 ℃35 min;(2)95 ℃ 3 min;(3)94 ℃ 30 s,55 ℃30 s;72 ℃ 30 s,共35个循环;(4)72 ℃ 7 min;(5)降温至16 ℃保存。配制2%琼脂糖凝胶,将RTPCR产物加入上样缓冲液混合后,上样5 µL,110 V电泳40 min,在凝胶成像系统下观察结果。
2 结果
2.1 NDV尿囊液制备和血凝单位测定
将NDV LaSota株种毒接种SPF胚后,剔除48 h内死亡的鸡胚,48 h至收获时死亡1枚,共收取尿囊液约80 mL。血凝试验时以红细胞完全凝集的最大稀释倍数为病毒血凝滴度,11个尿囊液样品的血凝滴度呈现倍比梯度,编号7~10样品血凝滴度为1:20(表1)。
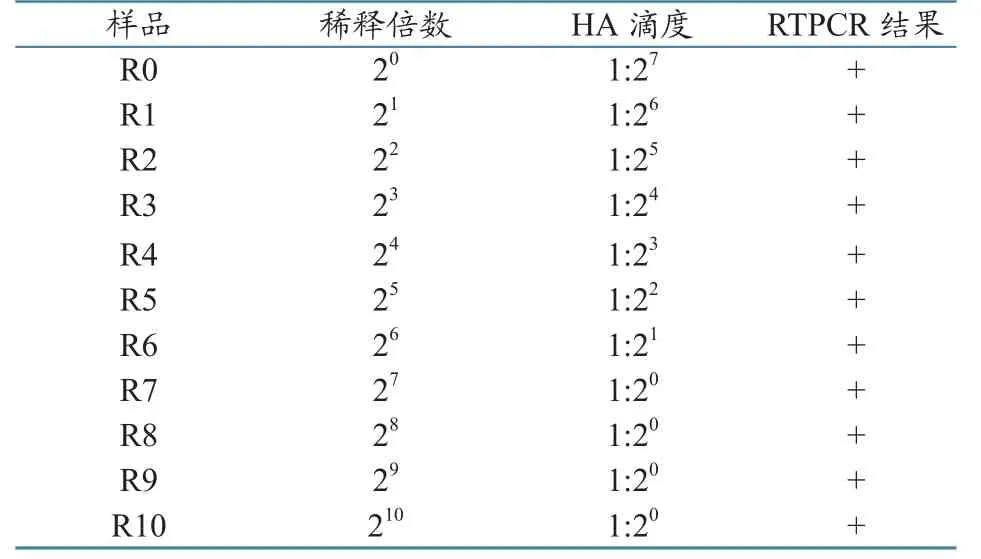
表1尿囊液的稀释倍数、血凝滴度及稀释后提取核酸的RT-PCR结果
2.2 RT-PCR和电泳
参照新城疫病毒RT-PCR检测试剂盒说明书,配制25 μL反应体系,对样品R0~R10和R1'~ R10'进行35个循环扩增后,将其产物加入载样缓冲液,各取5 µL,用2%琼脂糖凝胶进行电泳,40 min后在凝胶成像系统下观察。在空白对照成立的前提下,前稀释核酸样品中的R0~R7均出现清晰的长度为535 bp的特异性扩增条带,判为阳性,而且随着样品中核酸模板浓度的降低,PCR产物的丰度依次降低,R8、R9和R10在相同位置也出现模糊条带,判为阳性(图1和表1);后稀释核酸样品R0'~R8'均出现清晰的长度为535 bp扩增条带,判为阳性,而且PCR产物的丰度同样出现递降,R9'和R10'在同样位置未出现特定长度条带,判为阴性(图1、图2)。
4单位病毒经过倍比稀释后制备的核酸样品RF0、RF1、RF2的RT-PCR扩增产物,在电泳后出现清晰的特定长度条带,RF3、RF4和RF5的扩增产物出现较弱条带,其他未见同等大小条带(图2)。因此,该新城疫病毒RT-PCR检测试剂盒的最低检出量为NDV 4单位病毒1:32倍稀释。
3 讨论
NDV引起的ND已成为世界养禽业最关注的疾病之一。虽然NDV只有1个血清型,但不同毒株的毒力差异较大。对临床初步判断为“可疑”的病例,需要用RT-PCR方法确定是否为“疑似”,所以新城疫病毒RT-PCR检测试剂盒的研发和应用对于ND防控工作具有重要意义。

图1以两种方法制备的核酸样品为模板的RT-PCR扩增产物电泳图

图2 NDV 4单位病毒制备的核酸样品RT-PCR产物电泳图
新城疫病毒RT-PCR检测试剂盒作为一种特殊的兽用生物制品,其研制和新兽药证书的申报有其特殊性,敏感性是其研究的关键指标之一。《兽医诊断制品试验研究技术指导原则》要求确定制品的最低检出量。新城疫病毒RT-PCR检测试剂盒的检测靶标主要是临床“可疑”病例的组织或者拭子样品中的病毒核酸。在靶标物质的检测过程中,涉及到样品核酸的提取、反转录酶将病毒核酸反转录为cDNA,以及Taq酶对核酸样品中起始cDNA的扩增。因此,试剂盒的核酸提取效率、反转录酶的活性和反转录效率以及Taq酶的扩增效率是影响试剂盒最低检出量的核心技术环节。理想的标准物质,不仅能对上述3个指标进行评价,而且其制备用的原(材)料应有足够的数量,其均匀性、纯净性、稳定性、特异性、一致性以及特性量值范围等应满足标准物质的用途。
标准物质制备用的候选物可以是天然的,也可以是人工制备的,但对其有效成分必须进行量值标定。目前关于NDV RT-PCR或荧光定量RT-PCR检测方法的研究,大多以含有该方法靶标序列的质粒等核酸建立的标准曲线,来评价最低检出量[13]。标准曲线法可以理解为使用人工制备的核酸作为标准物质,其有效成分(DNA或者进一步制备的RNA)量值是通过理论计算出来的,而并非实验标定。以质粒及其衍生物为标准物质来定量新城疫病毒 RT-PCR检测试剂盒的最低检出量,不能完全反映试剂盒的核酸提取效率或反转录酶的效率。
与质粒相比,以天然的NDV作为标准物质更有实际意义。这是因为其制备用的候选物来源稳定,并且能够满足试剂盒3个核心技术环节的定量需要,最关键的是病毒的量值标定方法已得到公认。NDV的量值标定方法有细胞半数感染量(TCID50)、鸡胚半数感染量(EID50)和血凝滴度(HA)测定等[12],其中TCID50和EID50受毒株的毒力和活病毒数量影响较大,而且试验操作繁琐[13];HA是基于NDV颗粒表面的血凝素H而建立的一种病毒含量测定方法,其试验操作简便,判定方法已得到行业公认,而且1%鸡红细胞和4单位病毒的配制方法已有相应的国标[3]。因此,以血凝滴度定量制备的4单位病毒为标准物质,更能满足NDV RT-PCR检测试剂盒研发、生产、质控和比对的需求。
本试验采用NDV LaSota株为主要研究对象,根据《新城疫诊断技术》(GB⁄T 16550—2008),用血凝试验方法来定量病毒含量。试验用的病毒未被灭活,且控制冻融次数,这避免了不同类型灭活剂、灭活方法以及反复冻融对病毒血凝滴度和病毒核酸稳定性的影响,从而降低了病毒血凝滴度与病毒核酸拷贝数之间的数据偏离。当然关于病毒血凝滴度与病毒核酸拷贝数之间的准确量化关系,还有待于研究。本试验采用了2种方法,即先稀释病毒再提取核酸和先提取核酸再进行稀释,探索4单位病毒作为标准物质的不同使用方法的可行性。另外,由于不同毒株血凝素的差异,相同数量NDV颗粒的血凝滴度也不尽相同,所以本实验根据试剂盒的靶标序列,选择NDV LaSota株制备标定4单位病毒为标准物质,对试剂盒的最低检出量进行定量,从而能够满足本试剂盒敏感性研究的需要。
综上所述,标准物质是兽医诊断制品研发、生产、质控和比对的必需生物材料。由于检测方法原理的差异,不同诊断制品对标准物质的要求也不同,但是大多数标准物质都需要量值标定。本试验采用4单位病毒为标准物质,定量新城疫病毒 RT-PCR检测试剂盒的最低检出量,对新城疫病毒RT-PCR检测试剂盒的研发、生产和质控进行了实践性探索,也为多种NDV分子生物学类检测试剂盒评价用标准物质的制备,提供了一种新的标定方法。
[1] 陆承平. 兽医微生物学[M]. 5版. 北京:中国农业出版社,2013:555.
[2] 国务院. 国家中长期动物疫病防治规划:国办发〔2012〕31号[A]. 北京:国务院办公厅,2012-05-20.
[3] 农业部. 新城疫诊断技术:GB/T 16550-2008 [S]. 北京:中国标准出版社,2008-12-31.
[4] 金宇良. PCR技术的研究进展[J]. 现代农业科技,2012(10):47-48.
[5] 龚振华,马育芳,蒋正军,等. 用RT-PCR检测新城疫病毒的研究[J]. 中国动物检疫,1998(2):5-8.
[6] 宋长绪,刘福安. 用PCR检测鸡新城疫病毒的初步试验[J].中国兽医科学,1995(10):20-20.
[7] 唐小飞,谢芝勋,刘加波,等. 多重RT-PCR快速检测鉴别新城疫病毒强毒株和弱毒疫苗株方法的建立[J]. 中国兽医科学,2005,35(11):888-891.
[8] 赵建梅,魏荣,王志亮,等. 一步法多重RT-PCR检测新城疫、禽流感、传染性支气管炎病毒试验的研究[J]. 中国动物检疫,2003,20(1):22-24.
[9] 张鹤晓,高志强,赖平安,等. 新城疫病毒通用型实时RT-PCR检测方法的建立与应用[J]. 中国畜牧兽医文摘,2006,26(4):53-56.
[10] 农业部. 兽医诊断制品生产质量管理规范:中华人民共和国农业部公告第2334号[A]. 北京:农业部,2015-12-09.
[11] 农业部. 农业部关于印发《2016年国家动物疫病监测与流行病学调查计划》的通知[A]. 北京:农业部兽医局,2016-03-30.
[12] 姚火春. 兽医微生物学实验指导[M]. 2版. 北京:中国农业出版社,2012:128.
[13] JANG J,HONG S H,KIM I H. Validation of a real-time RT-PCR method to quantify Newcastle Disease Virus(NDV)titer and comparison with other quantifiable methods [J]. Journal of microbiology and biotechnology,2011,21(1):100-108.
(责任编辑:朱迪国)
Using 4-HAU as the Reference to Determine the Limits of Detection of RT-PCR kit for Newcastle Disease Virus
Liu Shuang1,Zhang Rumin3,Wang Xiaodong2,Zhang Xingjin2,Zhang Hao2,Gong Fengju2,Shao Yu2,Shao Weixing1,2,Sun Xueqiang1,2
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Qingdao Regen Diagnostics Development Center,Qingdao,Shandong 266114;3. Zhengzhou Technical College,Zhengzhou,Henan 450121)
It is the fi rst report to use 4-HAU(hemagglutining unit)of Newcastle Disease virus(NDV)as reference material to determine the limits of detection(LOD)of RT-PCR kits for NDV. The SPF embryos were inoculated with the NDV LaSota strain. The allantoic fl uid containing NDV was collected and the HA titer was determined as 27. The fl uid was 2-fold diluted and the RNA was extracted. Using NDV RT-PCR detection kit,specif i c band with expected length could be amplif i ed from most of the RNA samples. The allantoic fl uid was diluted to contain 4-HAU virus and was set as the reference. After series of 2-fold dilution,RNA was extracted and used to determine the LOD of the RTPCR kit. The results showed that the LOD of the RT-PCR kits for NDV was 1:32 dilution of the reference material. The method could provide references for research,development,production,quality control and comparison of molecular biological diagnostics,such as NDV RT-PCR kit.
NDV;RT-PCR;4-HAU;reference material;limits of detection
S852.65
:B
:1005-944X(2017)06-0094-04
10.3969/j.issn.1005-944X.2017.06.027
科技部科技基础性工作专项(2012FY111000)

