H7亚型流感病毒通用及区分强弱毒RT-PCR方法的建立
蒋文明,彭 程,李金平,王素春,侯广宇,袁万哲,陈继明
(1. 中国动物卫生与流行病学中心,山东青岛 266032;
2. 河北农业大学动物医学院,河北保定 071001)
H7亚型流感病毒通用及区分强弱毒RT-PCR方法的建立
蒋文明1,彭 程1,李金平1,王素春1,侯广宇1,袁万哲2,陈继明1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;
2. 河北农业大学动物医学院,河北保定 071001)
为建立可以区分H7亚型流感病毒强弱毒的方法,根椐Genbank和GISAID中H7病毒的HA基因序列,设计2条特异性引物,建立了扩增H7病毒HA裂解位点区域的通用RT-PCR方法。在此基础上,在裂解位点处设计1条引物,建立了可以区分H7强弱毒的RT-PCR方法。该方法对弱毒株可以扩增出约337 bp的片段,对强毒株可以扩增出约349 bp和227 bp的片段,对其他常见亚型流感病毒的RT-PCR扩增均为阴性。敏感性试验结果表明,该RT-PCR方法的检测下限为1 fg的H7N9病毒模板。该方法对10份实验室已鉴定好的H7N9病毒进行对比验证,两者的符合率为100%。试验结果表明,该方法具有特异、快速、敏感、准确的特点,可用于H7亚型流感病毒的快速检测,同时还可区分强弱毒,对H7N9病毒,尤其是高致病性病毒的早期诊断和有效防控可提供有效技术支撑。
流感病毒;H7N9;RT-PCR;强毒株
2013年3月发生的“H7N9事件”给家禽业带来了巨大的冲击和经济损失[1],但病毒遗传信息和动物实验都证明家禽中分离的H7N9病毒对家禽是无致病力的。尽管如此,仍存在变异成高致病性毒株的风险。2017年以来,某些地区的家禽发生了H7N9高致病性流感疫情,说明某些家禽中的H7N9病毒已经从低致病性毒株变异为高致病性毒株。
及早发现H7N9病毒是切实保障养禽业健康发展的前提。因此,建立H7N9病毒强毒株的快速检测方法十分必要。虽然已有可同时鉴别H7亚型和N9亚型的双重RT-PCR方法[2],但该方法不能对高致病性H7N9病毒做出诊断。本研究在此基础上,建立了一种新的RT-PCR方法,不仅可以扩增H7亚型流感病毒,还可以区分强毒株与弱毒株。
1 材料与方法
1.1 病毒
H7N9、H7N2、H7N3、H5N6、H9N2等亚型流感病毒均由本实验室分离保存。
1.2 主要试剂
QIAamp Viral RNA Mini Kit,购自Qiagen公司;HiScript II One Step RT-PCR Kit、DL2000 Plus DNA Marker,购自Vazyme公司。
1.3 引物设计
根据GenBank和GISAID数据库中发表的序列,针对H7流感病毒基因序列保守区设计1对引物,使其能够扩增HA1、HA2裂解位点区域(表1)。同时,根据裂解位点处的核苷酸序列,设计1条引物,使其能够扩增H7强毒的HA基因。
1.4 H7通用RT-PCR方法的建立
根据QIAamp Viral RNA Mini Kit操作说明提取病毒RNA,用微量核酸分析仪测定病毒RNA含量。将RNA作10倍比稀释,取2.0 μL稀释后的RNA模板,加入到22.0 μL RT-PCR预混液中,包括:2 × RT-PCR Buffer 12.5 μL,引物H7F1/H7R1各1.0 μL(10 μmol/L),Enzyme Mix 1.25 μL,ddH2O 7.25 μL。RT-PCR反应条件为:50 ℃ 30 min,94 ℃ 2 min,然后进行35个循环(94 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s),最后72 ℃延伸5 min。PCR产物经琼脂糖凝胶电泳分析。
1.5 与行业标准中引物的比较
以10倍比稀释的RNA为模板,分别以引物H7F1/H7R1、H7F2/H7R2和H7F3/H7R3进行扩增,PCR产物经琼脂糖凝胶电泳分析。
1.6 区分H7强弱毒RT-PCR方法的建立及优化
以引物H7F1/H7R1/H7RQ进行扩增,对下游引物H7R1的终浓度分别设定为0.04、0.08、0.12、0.16和0.20 μmol/L,然后进行RT-PCR反应。将PCR产物经琼脂糖凝胶电泳,确定最适引物浓度。
1.7 RT-PCR方法的特异性
利用优化的RT-PCR方法分别检测H7N2、H7N3、H7N9、H5N6、H9N2等常见亚型的流感病毒,检验该方法的特异性。
1.8 RT-PCR方法的敏感性
用微量核酸分析以上测定的H7N9病毒RNA含量,然后作10倍比稀释,利用优化的RT-PCR方法,对不同稀释度的RNA进行扩增,检验该方法的敏感性。
1.9 RT-PCR方法的准确性
利用建立的RT-PCR方法对实验室分离并已测序鉴定的10株H7N9病毒进行检测,检验该方法的准确性。

表1 扩增H7亚型的引物
2 结果
2.1 通用RT-PCR扩增结果
2.0%的琼脂糖凝胶电泳结果表明,H7F1/ H7R1引物可以从含有H7N9病毒的尿囊液中扩增得到H7亚型特异的基因片段,获得与预期片段大小相符的条带(图1)。敏感性试验结果表明,H7F1/H7R1引物对的检测下限为1 fg。
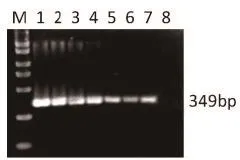
图1 H7亚型通用引物的敏感性试验
2.2 与行业标准的对比
2.0%的琼脂糖凝胶电泳结果表明,H7F2/ H7R2引物对的检测下限为10 fg,H7F3/H7R3引物对的检测下限为10 fg(图2)。

图2行业标准中H7亚型通用引物的敏感性试验
2.3 区分强弱毒RT-PCR方法的建立及优化
通过对下游引物H7R1的浓度优化,确定RTPCR中H7F1、H7RQ最佳引物浓度分别为0.4 μmol/L,H7R1最佳引物浓度为0.08 μmol/L(图3)。
2.4 RT-PCR方法的特异性
利用建立的双重RT-PCR方法,分别对H7N9、H7N2、H7N3、H5N6、H9N2、IBV、NDV、IBDV、ILTV等病毒进行检测,结果显示该方法只能扩增H7亚型的流感病毒,对其它亚型流感病毒和其他常见禽病病毒扩增均为阴性,且对SPF鸡胚扩增结果也为阴性(图4),表明该方法具有良好的特异性。

图3不同引物浓度对H7N9病毒RNA模板的扩增

图4 RT-PCR方法对不同亚型流感病毒RNA的扩增
2.5 RT-PCR方法的敏感性
将提取的RNA依次做10倍比稀释,每个稀释度取2 μL作为模板进行扩增。结果显示1 fg的H7N9可扩增出特异性条带(图5),说明该方法具有良好的敏感性。
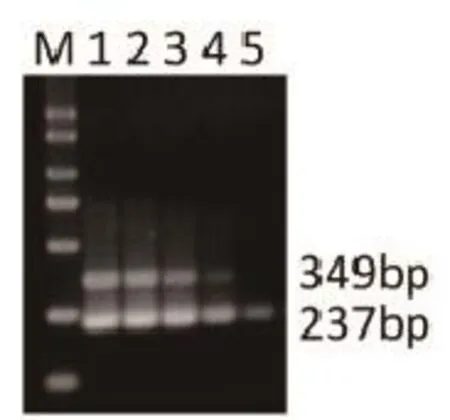
图5 RT-PCR对不同浓度H7N9病毒RNA模板的扩增
2.6 RT-PCR方法的准确性
对实验室分离鉴定的10株H7N9病毒进行检测,结果显示,该双重RT-PCR方法均可以进行良好的扩增(图6),说明该方法具有良好的准确性。
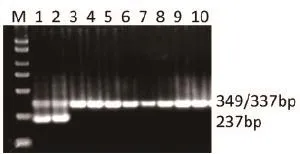
图6 RT-PCR方法对实验室分离鉴定的H7N9病毒检测结果
3 讨论
随着病毒的进化,某些H7N9病毒已经从低致病性变异为高致病性毒株,对养禽业危害巨大。
2014年建立的同时检测H7亚型和N9亚型的双重RT-PCR方法,既可确定H7N9亚型流感病毒,也可鉴别单个H7亚型或N9亚型流感病毒。但该方法只能确定是否为H7亚型病毒,而不能确定是高致病性毒株还是低致病性毒株。本研究根据GenBank和GISAID数据库中发表的H7亚型病毒HA基因序列,针对HA基因序列保守区设计1对引物,使其能够扩增HA1、HA2裂解位点区域,a其可以作为H7亚型病毒的通用检测引物。对扩增产物进行测序分析,即可确定该病毒是否已发生变异。
为进一步更直观地对H7亚型高致病性病毒进行检测,根据裂解位点处的核苷酸序列,设计1条引物,使其能够扩增H7强毒的HA基因。这样,如果检测的是弱毒株,则该方法只能扩增出约337 bp的片段;如果检测的是强毒株,则能扩增出约349 bp和227 bp的片段。
敏感性试验结果表明,本方法最低能检出1 fg的H7N9病毒模板,证明该方法的敏感性较高。与行业标准《禽流感病毒RT-PCR检测方法》(NY/ T 772—2013)和(NY/T 772—2004)中的检测引物相比,敏感性更高,而且行业标准中的引物不能扩增HA裂解位点区域,即使扩增出H7片段,也不能通过测序等方法鉴定出强弱毒。
本研究建立的RT-PCR方法,对于H7病毒强毒株和弱毒株的检测均可出现与试验设计大小相符的条带,而对于其他亚型流感病毒的扩增结果均为阴性,表现出较好的特异性;样品符合性试验结果表明,该方法表现出较高的准确性。
本研究建立的区分H7亚型流感病毒强弱毒的RT-PCR检测方法,具有特异性强、敏感性高、操作简单等优点。在同一反应体系中,加入3条引物,即可通过电泳快速区分强弱毒,省时省力。如果反应体系中只加入上下游2条引物,则可以作为H7亚型病毒的通用检测方法,进一步对扩增产物进行测序,可以确定病毒的变异情况,即使病毒裂解位点进一步发生变异,该方法仍然可以有效扩增和进行下游信息分析。该方法不仅实现了对H7病毒的快速检测,同时还可区分强弱毒,对H7N9病毒,尤其是高致病性病毒的早期诊断和有效防控具有重要意义。
[1] 蒋文明. 从“H7N9禽流感”命名说开去[J]. 中国动物检疫,2014,8(31):80-82.
[2] 蒋文明,李金平,于美芳,等. 双重RT-PCR快速检测H7N9流感病毒方法的建立[J]. 中国动物检疫,2015,32(5):65-68.
[3] 农业部. 禽流感病毒RT-PCR检测方法:NY/T 772—2013 [S]. 北京:中国标准出版社,2014.
[4] 农业部. 禽流感病毒RT-PCR检测方法:NY/T 772—2004 [S]. 北京:中国标准出版社,2004.
(责任编辑:朱迪国)
Establishment of a General Method for Distinguishing Inf l uenza RT-PCR Virus from H7 Subtype and Distinguishing between Virulent and Attenuated Inf l uenza Viruses
Jiang Wenming1,Peng Cheng1,Li Jinping1,Wang Suchun1,Hou Guangyu1,Yuan Wanzhe2,Chen Jiming1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. College of Animal Medicine,Agriculture University of Hebei,Baoding,Hebei 071001)
In order to establish a method of distinguishing virulent and attenuated strains of H7 subtype inf l uenza virus rapidly,two specif i c primers were designed according to the conserved regions on the HA sequences of H7 subtype virus in Genbank and GISAID. On this basis,a reverse transcription-polymerase chain reaction (RT-PCR)method was established for amplif i cating the region and spanning the cleavage site of HA. The attenuated strain can be amplif i ed to fragments measured about 337 bp,and can be amplif i ed to fragments measured about 349 bp and 227 bp for the virulent strain. The method was negative for RT-PCR amplif i cation of other common subtype inf l uenza viruses. Sensitivity test showed that the detection limit of the RT-PCR method was 1 fg for the H7N9 virus templates. With 10 H7N9 virus strains identif i ed in the laboratory,the coincidence rate was 100%. It was showed that the established RT-PCR method was specif i c,rapid,sensitive,and accurate,and it could be used for rapid detection of H7 subtype inf l uenza virus. It was used to distinguish virulent and attenuated strains,so to provide technical support for early diagnosis and effective prevention and control for H7N9 virus,especially highly pathogenic virus.
inf l uenza virus;H7N9;RT-PCR;virulent strains
S855.65
:A
:1005-944X(2017)06-0090-04
10.3969/j.issn.1005-944X.2017.06.026
科技部科技基础性工作专项(2012FY111000)

