霍乱O139血清群多糖结合疫苗的生物合成研究
黄竞,董岩,潘超,胡显文,曾明,吴军,朱力,王恒樑
1.军事医学科学院 生物工程研究所,北京 100071;
2.中国食品药品检定研究院 卫生部生物技术产品检定方法及其标准化重点实验室,北京 100050
霍乱O139血清群多糖结合疫苗的生物合成研究
黄竞1,董岩2,潘超1,胡显文1,曾明2,吴军1,朱力1,王恒樑1
1.军事医学科学院 生物工程研究所,北京 100071;
2.中国食品药品检定研究院 卫生部生物技术产品检定方法及其标准化重点实验室,北京 100050
目的:霍乱是由霍乱弧菌引起的一种烈性传染病,其防治已成为一个全球性的公共卫生问题。其中1992年出现的O139血清群是除O1外另一种病原体,发病数日益增多。因此,有必要寻找一种安全有效适用于各种人群的疫苗。方法:敲除霍乱弧菌O139血清群93-3株脂多糖合成途径中O抗原连接酶基因waaL,在周间质产生游离的多糖,之后转入包含来自脑膜炎奈瑟球菌的糖基转移酶和霍乱毒素B亚单位(CTB)编码序列的共表达载体,经IPTG诱导后制备全菌蛋白样品,利用抗His抗体检测糖蛋白的表达,利用Ni柱和离子交换柱对糖蛋白进行纯化,并对其进行糖定量和蛋白定量。结果:以未糖基化、相对分子质量约为14×103的底物蛋白CTB为对照,当共表达CTB和糖基转移酶PglL时,通过Western印迹可检测到相对分子质量约为20×103的糖基化蛋白,经Ni柱及阳离子交换柱纯化,得到纯度较高的O139群霍乱O抗原多糖结合蛋白,其纯度约为84.2%,并计算得其糖-蛋白比为0.103∶1。结论:通过生物法合成了一种霍乱O139血清群的多糖结合疫苗,为后续进行动物评价打下了基础。
霍乱弧菌;多糖结合疫苗;O-糖基化;糖蛋白
霍乱是因感染霍乱弧菌而引起的烈性传染病,临床主要表现为急性腹泻,被世界卫生组织(WHO)定为必须国际检疫的传染病。在我国,霍乱和鼠疫是仅有的2种甲类传染病。历史上,霍乱有过7次世界大流行。根据表面O抗原的不同,霍乱弧菌被分为200多个血清群,WHO腹泻控制中心认定O1和O139血清群是引起霍乱的病原体。O139血清群霍乱是自1992年从印度半岛开始流行的一种新型霍乱,在抗原性方面与O1血清群无交叉[1]。近年来O139群霍乱发病数日益增多,2002年度O139群霍乱的发病例数占同年霍乱发病总例数的36.0%,我国于1993年5月首次在新疆阿克苏地区发现O139群霍乱病例[2]。
O139群霍乱弧菌产生的O抗原荚膜较薄,荚膜多糖(capsule polysaccharide,CPS)由较长的糖单位聚合而成,其结构与脂多糖(lipopolysaccharides,LPS)的O糖单位相同,但不连接于LPS的核心结构[3]。当一个O抗原多糖(O-antigen polysaccharide,OPS)单位连接于脂质A核心多糖结构,形成LPS,而未连接于LPS的O139侧链重复单位则构成荚膜多糖[4]。研究表明,O139血清群中与脂质核心连接的OPS在免疫应答中对于诱导血清抗体具有最重要的作用,而CPS仅具有很微弱的免疫原性[5]。
霍乱弧菌的主要毒力因子是霍乱毒素(cholera toxin,CT),它包括A和B亚单位。其中,霍乱毒素B亚单位(CTB)是无毒的同源五聚体,能与大多数哺乳动物细胞表面都有的神经节苷脂GM1特异性结合,刺激机体产生黏膜IgA。CTB可以诱导强烈的体液免疫,中和体内的霍乱毒素,而且最近的研究表明,CTB可以在体内引起抗炎症机制[6]。已经证实CTB是一种很好的黏膜佐剂,能够诱导机体产生黏膜免疫反应,具有加强抗原表位抗原性的特点。因此,CTB常被选作多肽疫苗的佐剂,特别是作为黏膜免疫的佐剂[7]。
脑膜炎奈瑟球菌糖基转移酶PglL可单独催化脑膜炎奈瑟球菌Ⅳ型菌毛蛋白PilE发生O糖基化,它有着宽松的底物特异性,并可以转移多种外源的聚糖,其糖基化过程与细菌LPS合成具有很大的相似性,均是在酶的催化下对糖的转移:LPS合成中,多糖在O抗原连接酶催化下与脂质A核心相连;而蛋白糖基化则是在糖基转移酶催化下将多糖转移至底物蛋白[8]。因此,我们可以通过改造其LPS合成路径,并转入蛋白糖基化系统,使OPS转移到适当的底物蛋白,从而制备多糖结合疫苗。相比于传统的化学合成方法,生物法能够一步合成,合成效率高,产品均一性强。
我们通过同源双交换方法敲除了霍乱弧菌O139血清群93-3株LPS合成途径中的O抗原连接酶waaL,使其产生游离的OPS,之后转入含有PglL和底物蛋白CTB编码序列的融合表达载体,诱导表达合成霍乱糖蛋白,并对其进行初步纯化分析,为下一步的动物评价打下了基础。
1 材料与方法
1.1 材料
霍乱弧菌O139血清群93-3株(CMCC编号,Smr)由中国医学细菌保藏管理中心提供;大肠杆菌DH5αλpir(含有λpir系统,用于克隆和富集重组自杀质粒)、SM10λpir(含有λpir系统及性菌毛,可作为接合转移的供体菌,Kmr),自杀质粒pWM91(含有sacB位点,Apr)由中国疾病预防控制中心惠赠;低拷贝质粒pAK(Kmr)、O-糖基转移酶PglL和底物蛋白CTB的融合表达载体pET28atac-pgIL-tac-CTB4573N(Kmr)、底物蛋白CTB表达载体pET28a-tac-CTB(Kmr)由本实验室构建;快速DNA产物纯化试剂盒、高纯度质粒小提试剂盒、纯化柱Ni-agarose Resin购自康为世纪公司;2× TransTaqHiFi PCR Super MixⅠ、ProteinRulerⅡ(12~120 kD)、Blue PlusⅡProtein Marker(14~120 kD)购自全式金生物公司;限制性内切酶SpeⅠ、XhoⅠ、BamH I、SalⅠ,10×缓冲液,除盐柱Zeba Spin Desalting Columns,蛋白定量试剂盒Micro BCA Protein Assay Kit购自Thermo Scientific公司;T4DNA连接酶、10×T4DNA连接酶缓冲液购自TaKaRa公司;氨苄西林、卡那霉素、链霉素购自Sigma公司。
1.2 霍乱93-3株waaL基因缺失株与回复株的构建与验证
以NCBI霍乱弧菌标准菌株El Tor N16961基因组waaL基因及上、下游序列作为模板设计引物,采用Primer 5.0软件完成(表1)。b和c引物包含10~20 bp互补序列,之后进行融合PCR连接waaL上、下游基因片段,纯化片段经SpeⅠ、XhoⅠ双酶切后连入经相同酶切的pWM91质粒,利用同源双交换方法构建突变株93-3ΔwaaL。之后利用引物waaLout-P1和waaLout-P2,以93-3基因组DNA为模板扩增waaL基因、自身启动子和上下游序列,通过BamHⅠ和SalⅠ酶切,连接构建回复质粒pAK-waaL,并电击转化93-3ΔwaaL感受态,从而构建回复株93-3waaLH。用waaL基因内部引物(waaLin-P1/waaLin-P2)、外部引物(waaLout-P1/waaLout-P2)、霍乱弧菌毒素协同调节菌毛基因引物(tcpA-P1/tcpA-P2)进行PCR验证。
1.3 霍乱O-连接糖基化修饰途径工程菌的构建与IPTG诱导表达及检测
将质粒pET28a-tac-pgIL-tac-CTB4573N、pET28atac-CTB分别电击转化93-3ΔwaaL感受态细胞,用卡那霉素抗性平板筛选阳性克隆,获得重组菌93-3ΔwaaL/pET28a-pgIL-CTB4573N和 93-3ΔwaaL/ pET28a-CTB。将上述重组菌株及缺失株按1∶100接种于LB液体培养基中,37℃摇床培养至D600nm达0.5左右,再加入终浓度为1 mmol/L的IPTG,30℃摇床培养12 h后收菌。参照《精编分子生物学实验指南》收集菌液制备SDS-PAGE样品,各取10 μL上样,经考马斯亮蓝染色和Western印迹检测。

表1 引物及序列
1.4 霍乱O-糖蛋白复合物的初步分离纯化
将30℃诱导12 h的93-3ΔwaaL/pET28a-tacpgIL-tac-CTB4573N离心收菌,用A1液[20 mmol/L Tris-HCl(pH7.5),0.5 moL/L NaCl,10 mmol/L咪唑]重悬菌体,超声破菌(超声4 s暂停5 s,累计超声2 h),离心收集上清,即为含霍乱弧菌O139血清群OPS修饰的CTB融合蛋白CTB4573N-OPS的粗提液。用Ni-agarose Resin初步纯化样品并除盐,用阳离子交换柱进一步纯化,考马斯亮蓝染色及Western印迹检测,用Image J软件对考马斯亮蓝染色图进行灰度分析,以确定样品纯度。
1.5 霍乱O-糖蛋白复合物的糖定量和蛋白定量
收集纯度较好的样品浓缩,稀释至1/20后用蒽酮-硫酸法测定样品中的糖含量,用蛋白定量试剂盒测定蛋白含量,并计算糖-蛋白比。
2 结果
2.1 霍乱93-3株O抗原连接酶缺失株的构建
用waaL基因内部引物、外部引物及霍乱弧菌特有的毒素协同调节菌毛基因引物进行PCR验证,结果如图1。用内部引物进行PCR验证时,仅野生株和回复株可以扩增得到483 bp片段;用外部引物验证时,野生株93-3的扩增产物为1271 bp,缺失株93-3ΔwaaL由于缺失了waaL基因,其扩增产物为591 bp,而93-3ΔwaaLH由于在缺失株的基础上导入包含waaL基因及上、下游调控序列的质粒,所以扩增产物含有1271和591 bp片段。用霍乱弧菌毒素协同调节菌毛基因引物验证时,野生株、缺失株和回复株的扩增产物均为675 bp。PCR结果表明waaL缺失株构建成功。
2.2 霍乱弧菌中建立O-糖基化系统
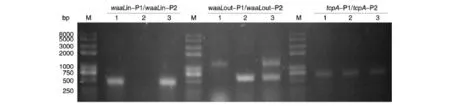
图1 93-3野生株、缺失株和回复株的PCR验证M:DNA marker;1:93-3;2:93-3ΔwaaL;3:93-3ΔwaaLH
经IPTG诱导糖基化途径表达后,对重组菌93-3ΔwaaL/pET28a-pgIL-CTB4573N、93-3ΔwaaL/ pET28a-CTB和缺失株93-3ΔwaaL中的糖蛋白进行检测,Western印迹结果如图2。93-3ΔwaaL由于不含糖基化系统,因此在Western印迹中无条带;而93-3ΔwaaL/pET28a-CTB只表达带有His标签的CTB,相对分子质量(Mr)约为14×103;93-3ΔwaaL/pET28a-pgIL-CTB4573N在表达CTB的同时表达糖基转移酶PglL,使多糖转移到底物蛋白,93-3的LPS仅含一个多糖重复单位,可看到Mr增大,且几乎所有底物蛋白均被糖基化。在Mr约20×103处出现2条带,可能是由于糖基化干扰影响信号肽的切割。此结果表明,在重组菌93-3ΔwaaL/pET28a-pgIL-CTB4573N中,可以由IPTG诱导糖基化途径表达并生成糖蛋白。
2.3 霍乱O-糖蛋白复合物的初步纯化及检测
镍柱纯化后的糖蛋白再经离子交换,考马斯亮蓝染色及灰度分析结果表明目标蛋白两峰的纯度约为84.2%,说明目标蛋白经Ni纯化柱和离子交换柱后分离效果较好,除去了大部分杂蛋白。对所得产物进行Anti-His Western印迹,蛋白纯度较高,均一性较好。结果见图3。
2.4 霍乱O-糖蛋白复合物的糖定量和蛋白定量

图2 CTB及糖基化修饰的SDS-PAGE与Anti-His Western印迹
对纯化浓缩的糖蛋白进行糖定量和蛋白定量,标准曲线见图4,曲线R2均大于0.99,可用于定量分析。根据标准曲线计算,CTB4573N-OPS样品中糖浓度约为150μg/mL,蛋白浓度约为1450 μg/mL。由于天然的CTB并没有O-糖基化位点,因此当融合1个糖基化位点后产生1个糖蛋白,故纯化产物中糖和蛋白的摩尔比为1∶1;而93-3株的OPS仅1个单位,因此产物中糖与蛋白的质量比为0.103∶1。
3 讨论
目前,国际上已获批准的霍乱疫苗中,只有Shanchol(包括霍乱O1群埃尔托型和O139群菌株灭活全细胞的口服二价疫苗)对O139群霍乱有保护性,临床试验表明,此疫苗对于O1和O139血清群的血清杀弧菌抗体滴度分别为91%和11%[9],证明O1血清群的免疫原性强于O139血清群。尽管婴幼儿是霍乱的高发群体,但在印度加尔各答的试验中发现Shanchol在所有年龄段的受试群体中保护作用为45%,在5岁以下儿童中的保护作用仅为17%[10]。有报道,目前获得许可的口服霍乱疫苗对儿童的免疫效果和持续时间都明显低于成年人[11]。因此,有必要研发一种保护时间长、效果好,且能在5岁以下婴幼儿中产生保护作用的霍乱O139血清群的疫苗。

图3 CTB4573N-OPS纯化结果的SDS-PAGE、灰度分布图及Anti-His Western印迹
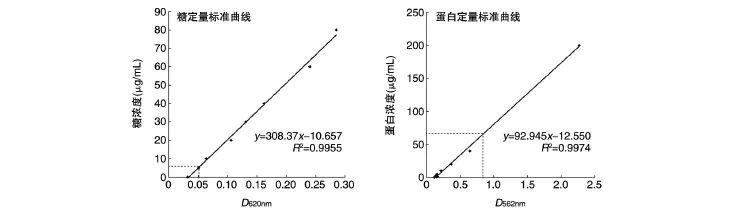
图4 糖定量和蛋白定量标准曲线
对于霍乱而言,LPS既是毒力因子,又是重要的保护性抗原,霍乱弧菌O1血清群的LPS在人体和实验动物中被证明可以诱导产生保护性免疫应答,因此将LPS作为保护性免疫原用于霍乱疫苗的思路被广泛认可。但LPS是Ⅰ类T细胞非依赖性抗原,在高水平时,纯化的LPS可以激活B细胞,产生多种抗体;低水平时,仅在霍乱全细胞或外膜囊泡存在的情况下,LPS才会诱导产生LPS特异性的IgM和IgG抗体[12-13]。O抗原多糖是LPS中最重要的免疫原性结构,它可以产生一种基于抑制菌体运动性的保护性机制,以阻止霍乱的成功克隆。霍乱弧菌有一个单极的鞭毛,鞭毛外部包被着包含LPS分子的外膜护鞘。在其他实验中,有学者证明只有抗O抗原的抗体,而非直接针对主要的鞭毛亚基FlaA和外膜蛋白的抗体,能有效抑制霍乱弧菌的运动性[13]。LPS在动物模型中产生的抗体有明显的保护作用,在志愿者试验中也获得证实,此抗体是主要的杀弧菌抗体[3]。因此我们将O抗原与底物蛋白CTB以生物法连接,其中底物蛋白CTB既是黏膜佐剂,又是抗原。因为在霍乱弧菌的所有血清群中,仅有O1和O139血清群会产生与传染性霍乱相关的霍乱毒素,所以CTB也能刺激机体产生重要的抗毒抗体。此CTB4573N-OPS糖蛋白作为疫苗可以提供更好的保护性并延长了保护时间,且能在5岁以下的婴幼儿中产生免疫保护。
综上,我们介绍了一种O139群霍乱多糖-蛋白结合疫苗的构建思路,并对糖蛋白进行了初步分析和纯化,获得了纯度较高的样品。但目前看来,仍有必要对其进一步改造和探索。O抗原糖链能够影响致病菌的抗原性并不同程度地刺激免疫系统,一般来说,O抗原糖链越长,其免疫原性越高[14]。可能正是由于霍乱弧菌O1血清群包含12~18个OPS单糖重复单位,而O139血清群的O抗原仅有1个糖单位,所以O139血清群的免疫原性更弱。本文所介绍的糖蛋白疫苗因为菌株本身原因,糖链过于短,糖-蛋白比过低。后续,可以通过导入外源的控制LPS合成中O抗原糖链延长的基因,尝试增加O抗原糖链的长度,并通过动物实验观察疫苗的效果差异,以提高霍乱弧菌O139血清群疫苗的保护效果。
[1]周妍妍.O139群霍乱弧菌基因工程减毒活疫苗株构建及初步评价[D].广州:南方医科大学,2009.
[2]任晓波,杨蓉,徐彬.霍乱O139菌群的流行趋势及防治措施[J].医学信息旬刊,2011,24(13):4334-4335.
[3]Chatterjee S N,Chaudhuri K.Lipopolysaccharides of Vibrio cholerae.I.Physical and chemical characterization[J].Biochim Biophys Acta,2003,1639:65-79.
[4]Nesper J,Schild S,Lauriano C M,et al.Role of Vibrio cholerae O139 surface polysaccharides in intestinal colonization[J].Infect Immun,2002,70:5990-5996.
[5]Attridge S R,Wallerstrom G,Li B L,et al.Differential immunogenicity of Vibrio cholerae O139 variants expressing different combinations of naturally occurring and atypical forms of the serogroup polysaccharide [J].Vaccine,2009,27:1055-1061.
[6]Baldauf K J,Royal J M,Hamorsky K T,et al.Cholera toxin B:one subunit with many pharmaceutical applications[J].Toxins(Basel),2015,7:974-996.
[7]张静飞,陈磊,董思国,等.口服重组B亚单位O1/O139霍乱疫苗的制备及检定[J].中国生物制品学杂志, 2016,29(1):1-6.
[8]潘超,朱力,王恒樑.病原细菌多糖疫苗和多糖结合疫苗研究进展[J].生物技术通讯,2013,24(5):705-709.
[9]Lopez A L,Gonzales M L,Aldaba J G,et al.Killed oral cholera vaccines:history,development and implementation challenges[J].Ther Adv Vaccines,2014,2: 123-136.
[10]Kabir S.Critical analysis of compositions and protective efficacies of oral killed cholera vaccines[J].Clin Vaccine Immunol,2014,21:1195-1205.
[11]Leung D T,Chowdhury F,Calderwood S B,et al.Immune responses to cholera in children[J].Expert Rev Anti Infect Ther,2012,10:435-444.
[12]Chernyak A,Kondo S,Wade T K,et al.Induction of protective immunity by synthetic Vibrio cholerae hexasaccharide derived from V.cholerae O1 Ogawa lipopolysaccharide bound to a protein carrier[J].J Infect Dis, 2002,185:950-962.
[13]Leitner D R,Feichter S,Schild-Prufert K,et al.Lipopolysaccharide modifications of a cholera vaccine candidate based on outer membrane vesicles reduce endotoxicity and reveal the major protective antigen[J].Infect Immun,2013,81:2379-2393.
[14]韩东雷,马中瑞,陈敏.Wzz酶对O抗原糖链聚合度的调控[J].微生物学报,2014,54(9):971-976.
Study of Vibrio cholerae O139 Serotype Polysaccharides Bio-Conjugated Vaccine
HUANG Jing1,DONG Yan2,PAN Chao1,HU Xian-Wen1, ZENG Ming2,WU Jun1,ZHU Li1,WANG Heng-Liang1*
1.Beijing Institute of Biotechnology,Beijing 100071;
2.Institute for Biological Product Control,National Institutes for Food and Drug Control,Beijing 100050;China
*Corresponding author,E-mail:wanghl@nic.bmi.ac.cn
Objective:Cholera is still a major global health problem,Vibrio choleraeO139 serotype emerged as a second aetiologic agent of cholera in 1992.It is necessary to find a safe and effective vaccine to control it.Methods:We constructedV.choleraeO139 group 93-3 strain containing a delection in O-antigen ligasewaaL, and free polysaccharides were produced in the periplasm.Then introduced the co-expression plasmid ofNeisseria meningitidisO-oligosaccharyltransferase PglL and cholerae toxin B subunit(CTB)to the genetically modified strain. After IPTG induction,the samples were prepared and the expression of glycoprotein was detected by anti His antibody.The target protein was further purified by Ni affinity column and cationic exchange column and quantify polysaccharide and protein content.Results:The substrate protein CTB,which was non glycosylation and relative molecular weight of about 14 kD,was used as control.When the co-expression of CTB and glycosyltransferasePglL,through the Western blot can detect the relative molecular weight of glycosylated protein is about 20 kD.Purified by Ni affinity column and cationic exchange column,we obtained O139 group of cholera O antigen polysaccharide binding protein with purity of 84.2%,and calculate the sugar protein ratio was 0.103∶1.Conclusion:We synthesized a polysaccharide conjugate vaccine by biological method,which laid the foundation for the subsequent animal evaluation.
Vibrio cholerae;polysaccharide conjugate vaccine;O-linked glycosylation;glycoprotein
Q78
A
1009-0002(2017)03-0281-05
10.3969/j.issn.1009-0002.2017.03.008
2017-01-03
国家自然科学基金(81373316);国家重点基础研究发展计划(2013CB910804)
黄竞(1991-),女,硕士研究生,(E-mail)1041526187@qq.com
王恒樑,(E-mail)wanghl@nic.bmi.ac.cn

