右美托咪定联合舒芬太尼在骨科手术后镇痛中的效果
孙慧芳, 沈伯雄, 罗海鸣
(上海第九人民医院北部 麻醉科, 上海, 201900)
右美托咪定联合舒芬太尼在骨科手术后镇痛中的效果
孙慧芳, 沈伯雄, 罗海鸣
(上海第九人民医院北部 麻醉科, 上海, 201900)
目的 评估右美托咪定联合舒芬太尼在骨科手术术后镇痛中的效果。方法 选择行骨科手术的患者86例,随机分为观察组和对照组。观察组采用右美托咪定联合舒芬太尼术后镇痛,对照组采用舒芬太尼术后镇痛。采用疼痛视觉模拟量表(VAS)和定量感觉测试(QST)评价2组患者不同时间点的疼痛程度,比较2组患者术后自控镇痛按压的次数、血流动力学参数、不良反应发生率和满意率。结果 对照组T1~T6时VAS评分显著高于观察组,机械性疼痛阈值显著低于观察组,HR和MAP显著高于观察组(P<0.05)。对照组自控镇痛按压次数、舒芬太尼用量以及不良反应发生率显著高于观察组(P<0.05)。观察组满意率显著高于对照组(P<0.05)。结论 右美托咪定用于骨科手术术后镇痛可减少舒芬太尼用量,降低不良反应发生率。
骨科手术; 舒芬太尼; 右美托咪定; 术后镇痛
研究[1]发现,应用阿片类受体激动剂可能会导致患者在术后发生阿片导致的痛觉过敏(OIH)。Fletcher and Martinez等[2]研究发现,采用大剂量的舒芬太尼可能会增加术后的急性疼 痛。研究[3]发现OIH发生可能与中枢和周围神经系统的可塑性变化有关。细胞分子机制可能涉及到舒芬太尼导致的急性和慢性的N-甲基-D-天冬氨酸(NMDA)受体上调[4]。临床研究[5]结果显示, NMDA受体拮抗剂, α2肾上腺素能受体激动剂和环氧合酶(COX)抑制剂能够抑制OIH。右美托咪定是高选择性的α2肾上腺素能受体激动剂,具有镇静、镇痛、抑制交感神经活性及无呼吸抑制等特性[6]。本研究评估右美托咪定联合舒芬太尼在骨科手术术后镇痛中的效果,现报告如下。
1 资料与方法
1.1 一般资料
选择2015年3月—2016年3月在本院骨科择期行骨科手术的患者86例。所有患者均为美国麻醉师协会分级Ⅰ~Ⅱ级,年龄18~60岁,男36例,女50例,肝、肾功能未见异常,无窦性心动过缓或房室传导阻滞,近期未服用抗抑郁药、镇静剂、镇痛药或β受体阻滞剂。随机分为观察组和对照组各43例。本研究经医院伦理委员会批准,所有患者均签署了知情同意书。观察组男20例,女23例,年龄45.8±3.6岁,体质量58.4±8.7 kg, 身高159.3±5.0 cm, 麻醉时间135.6±18.3 min, 手术时间117.1±17.0 min; 对照组男19例,女24例,年龄45.9±2.9岁,体质量59.8±7.8 kg, 身高158.4±4.6 cm, 麻醉时间138.3±20.6 min, 手术时间121.1±20.6 min。2组患者年龄、性别、体质量、身高、麻醉时间以及手术时间比较,差异均无统计学意义(P>0.05), 具有可比性。
1.2 方法
患者入室后常规咪达唑仑2~3 mg镇静,并进行常规的生命体征监测(BIS Vista; Medtronic, Minneapolis, MN, USA)。开通静脉通道,麻醉诱导采用静脉注射咪达唑仑0.04~0.06 mg/kg、依托咪酯0.2~0.3 mg/kg、舒芬太尼0.3~0.5 μg/kg和顺式阿曲库铵0.15~0.20 mg/kg, 气管插管后行机械通气,潮气量8~10 mL/kg, 吸呼比1∶2, 通气频率10~12次/min。麻醉维持采用间断追加舒芬太尼0.2 μg/(kg·h), 静脉输注丙泊酚4~12 mg/(kg·h), 间断静脉注射顺式阿曲库铵0.07 mg/kg, 吸入1.5%~2.0%七氟烷维持麻醉。手术结束前30 min停用舒芬太尼、顺式阿曲库铵以及七氟烷,手术结束前10 min停用丙泊酚。手术结束时连接静脉镇痛泵(Apollo Science Instrument Co. Ltd. Jiangsu, China), 患者自控静脉镇痛。对照组采用舒芬太尼(湖北宜昌人福药业,中国)150 μg+胃复安20 mg, 观察组采用舒芬太尼150 μg +右美托咪定200 μg+胃复安20 mg(江苏连云港恒瑞医药股份有限公司,中国),均用0.9%氯化钠注射液稀释至100 mL, 单次给药剂量2 mL, 输注速率2 mL/h, 锁定时间20 min。
1.3 观察指标
采用疼痛视觉模拟量表(VAS)和定量感觉测试(QST)记录2组患者术毕(T1)、术后30 min(T2)、1 h(T3)、6 h(T4)、12 h(T5)、24 h(T6)的评分,以及患者自控镇痛泵按压次数,并记录不良反应的发生情况。记录各时间点血氧饱和度、平均动脉压(MAP)、心率(HR)。在患者出院时,采用问卷调查的方法,记录患者对于麻醉的满意率。
1.4 统计学分析
采用IBM SPSS 17.0软件包进行统计分析。计量资料用均数±标准差表示,组间比较采用单因素方差分析,计数资料组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
术后T1~T6, 对照组VAS评分均显著高于观察组(P<0.05)。见图1。术后T1~T6,对照组机械性疼痛阈值显著低于观察组(P<0.05)。见图2。术后T1~T6, 对照组的HR和MAP显著高于观察组(P<0.05)。见表1。观察组发生低血压9例,心动过缓10例,术后1 h内寒战8例,术后24 h内恶心呕吐9例; 对照组发生低血压23例,心动过缓25例,术后1 h内寒战22例,术后24 h内恶心呕吐24例。观察组患者不良反应发生情况显著优于对照组(P<0.05)。对照组自控镇痛按压次数及舒芬太尼用量多于、高于观察组[(17.0±2.7)次∶(7.7±2.7)次,(87±15) μg∶(67±7) μg], 差异有统计学意义(P<0.05)。观察组中非常满意21例,满意20例,一般2例,满意率为95.3%; 对照组中非常满意21例,满意13例,一般9例,满意率为79.0%。观察组满意率显著高于对照组(P<0.05)。
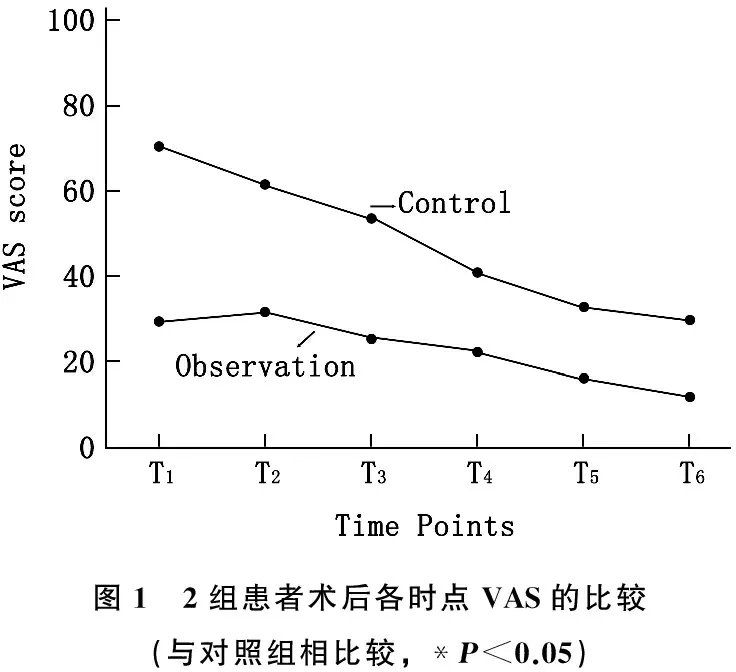
图1 2组患者术后各时点VAS的比较(与对照组相比较,*P<0.05)

图2 2组患者术后各时点机械性疼痛阈值的比较(与对照组相比较,*P<0.05)
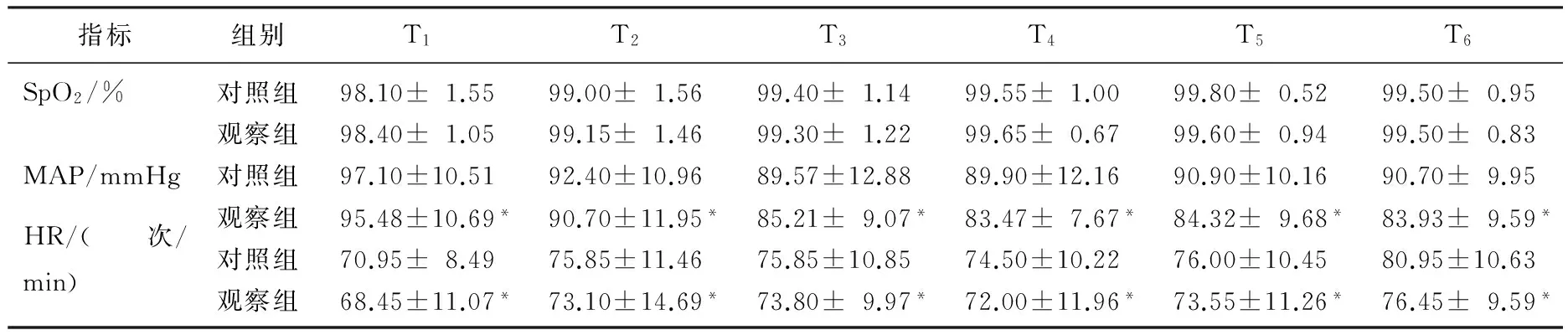
表1 2组患者术后的血流动力学参数的比较
与对照组比较, *P<0.05。
3 讨 论
右美托咪定是一种高选择性的α2肾上腺素能受体激动剂,作用于中枢和周围神经系统,具有催眠、镇静、抗焦虑、镇痛以及抗痛觉过敏的特点[7]。研究[8]表明,右美托咪定通过抑制NMDA受体的NR2B亚基的磷酸化而产生抗痛觉过敏的作用。右美托咪定还通过NMDA受体选择性抑制兴奋性突触后电位,并抑制由原始传入A和C纤维介导的突触传递以产生镇痛作用[9]。此外,右美托咪定可以通过增加脊髓中的乙酰胆碱水平和抑制具有放大疼痛信号并激活相邻神经细胞的脊髓神经胶质细胞的增殖来减少神经性疼痛[10-11]。Lee等[12]研究表明,右美托咪定减少了高剂量瑞芬太尼诱导的痛觉过敏,这与本研究的结果一致。作为一种高选择性的α2肾上腺素能受体激动剂,其药理作用主要是抑制去甲肾上腺素释放和神经元的兴奋,从而产生镇静及缓解焦虑的作用,也能够减轻疼痛引起的不愉快情感。本研究观察组患者术后各时点的VAS评分均低于对照组,机械性疼痛阈值均高于对照组,说明右美托咪定联合舒芬太尼的镇痛效果优于单独使用舒芬太尼,同时说明右美托咪定能够减少阿片类药物的用量。
2006年,德国神经病理性疼痛网络发明了QST方法,以研究健康受试者和神经性疼痛患者的疼痛阈值[13]。然而,以往的大多数研究使用VAS用于评价术后疼痛和药物的镇痛效果,其可能比QST方法更不敏感和客观。以往的痛觉过敏研究[14]使用传统的von Frey单丝(VFM)进行的QST测试。本研究中采用了EVF装置用于定量感官测试,其在探索机械性疼痛阈值方面比传统VFM更可靠。本研究发现,对照组中低血压和心动过缓的发生率高于观察组。因此,应当谨慎使用高剂量的舒芬太尼。确定舒芬太尼的最佳输注速率,以发挥最大化的麻醉镇痛效应,同时将不良的心血管副作用的发生率降至最低。研究[15]发现,右美托咪定还具有一定的止吐作用,这可能是通过α2肾上腺素能受体激动剂的直接止吐作用。本研究结果显示,对照组术后24 h内恶心呕吐的发生率明显高于观察组,这可能是由于右美托咪定的止吐作用。另外,术后1 h内寒战与高剂量的舒芬太尼有关。右美托咪定的抗颤动作用来自抑制外周血管收缩增加寒战阈值。临床研究发现,在诱导麻醉之前30 min采用帕瑞昔布可以有效地降低瑞芬太尼诱导的寒战的发生率和严重性。
综上所述,高剂量的术中舒芬太尼的使用与手术后痛觉过敏相关,可以通过右美托咪定联合给药有效地减轻或完全预防OIH。
[1] Wu C L, Raja S N. Treatment of acute postoperative pain[J]. Lancet, 2011, 377: 22152225.
[2] Fletcher D, Martinez V. Opioidinduced hyperalgesia in patients after surgery: A systematic review and a metaanalysis[J]. Br J Anaesth, 2014, 112: 9911004.
[3] Lee M, Silverman S M, Hansen H, et al. A comprehensive review of opioidinduced hyperalgesia[J]. Pain Physician, 2011, 14: 145161.
[4] Zhao M, Joo D T. Enhancement of spinal NmethylDaspartate receptor function by remifentanil action at deltaopioid receptors as a mechanism for acute opioidinduced hyperalgesia or tolerance[J]. Anesthesiology, 2008, 109: 308317.
[5] Zheng Y, Cui S, Liu Y, et al. Dexmedetomidine prevents remifentanilinduced postoperative hyperalgesia and decreases spinal tyrosine phosphorylation of Nmethyldaspartate receptor 2B subunit[J]. Brain Res Bull, 2012, 87: 427431.
[6] 杨伟, 邵建林. 右美托咪定用于腹腔镜胆囊切除术中的临床观察[J]. 临床麻醉学杂志, 201l, 27(1): 4748-4752.
[7] Blaudszun G, Lysakowski C, Elia N, et al. Effect of perioperative systemic α2 agonists on postoperative morphine consumption and pain intensity: Systematic review and meta?analysis of randomized controlled trials[J]. Anesthesiology, 2012, 116: 1312-1322.
[8] Kimura M, Saito S, Obata H. Dexmedetomidine decreases hyperalgesia in neuropathic pain by increasing acetylcholine in the spinal cord[J]. Neurosci Lett, 2012, 529: 7074.
[9] Liu L, Ji F, Liang J, et al. Inhibition by dexmedetomidine of the activation of spinal dorsal horn glias and the intracellular ERK signaling pathway induced by nerve injury[J]. Brain Res, 2012, 1427: 1-9.
[10] Lee C, Kim Y D, Kim J N. Antihyperalgesic effects of dexmedetomidine on high-dose remifentanil?induced hyperalgesia[J]. Korean J Anesthesiol, 2013, 64: 301-307.
[11] Lenz H, Raeder J, Draegni T, et al. Effects of COX inhibition on experimental pain and hyperalgesia during and after remifentanil infusion in humans[J]. Pain, 2011, 152: 12891297.
[12] Lee C, Lee H W, Kim J N. Effect of oral pregabalin on opioidinduced hyperalgesia in patients undergoing laparoendoscopic singlesite urologic surgery[J]. Korean J Anesthesiol, 2013, 64: 1924.
[13] Rolke R, Baron R, Maier C, et al. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): Standardized protocol and reference values[J]. Pain, 2006, 123: 231243.
[14] Tena B, Escobar B, Arguis M J, et al. Reproducibility of Electronic Von Frey and Von Frey monofilaments testing[J]. Clin J Pain, 2012, 28: 318323.
[15] Bajwa SJ, Gupta S, Kaur J, et al. Reduction in the incidence of shivering with perioperative dexmedetomidine: A randomized prospective study[J]. J Anaesthesiol Clin Pharmacol, 2012, 28: 8691.
Effect of dexmedetomidine combined with sufentanil on postoperative analgesia for patients with orthopedic surgery
SUN Huifang, SHEN Boxiong, LUO Haiming
(DepartmentofAnalgesia,NorthernBranchofShanghaiNinthPeople′sHospital,Shanghai, 201900)
Objective To evaluate the effect of dexmedetomidine combined with sufentanil on postoperative analgesia for patients with orthopedic surgery. Methods A total of 86 patients with orthopedic surgery were randomly divided into observation group and control group. The patients in the observation group were treated with dexmedetomidine combined with sufentanil for postoperative analgesia. The control group was treated with sufentanil for postoperative analgesia. The VAS and quantitative sensory testing (QST) were performed at different time points in both groups. The number of postoperative patient-controlled analgesia, hemodynamics parameters, the adverse reaction and satisfaction degree were compared between the two groups. Results The VAS scores at T1to T6in control group were significantly higher than the observation group, the mechanical pain threshold was significantly lower than the observation group, and the HR and MAP were significantly higher than the observation group (P<0.05). The number of patient-controlled analgesia, the dosage of sufentanil and the incidence rate of adverse reactions were significantly higher in the control group than the observation group (P<0.05). The satisfactory degree of the observation group was significantly higher than the control group (P<0.05). Conclusion Dexmedetomidine can reduce the dosage of sufentanil and the incidence rate of side effects in treatment of patients with orthopedic surgery.
orthopedic surgery; sufentanil; dexmedetomidine; postoperative analgesia
2016-11-19
上海市卫生系统优秀青年医学人才培养计划(PWRq2014-11)
R 614
A
1672-2353(2017)09-113-03
10.7619/jcmp.201709029

