成纤维生长因子2在胰腺癌中的表达及对胰腺癌细胞侵袭与转移的作用和机制
付西峰,董秀山,高 飞,赵海潮(山西医学科学院,山西大医院普通外科,太原 030032;通讯作者,E-mail:fxfyisheng@163.com)
成纤维生长因子2在胰腺癌中的表达及对胰腺癌细胞侵袭与转移的作用和机制
付西峰*,董秀山,高 飞,赵海潮
(山西医学科学院,山西大医院普通外科,太原 030032;*通讯作者,E-mail:fxfyisheng@163.com)
目的 探讨成纤维生长因子2(FGF2)在胰腺癌中的表达及对胰腺癌PANC-1细胞侵袭转移的作用和机制。 方法 收集62例患者的胰腺导管细胞癌(PDAC)组织和癌旁正常胰腺(NP)组织,免疫组化法检测癌组织和癌旁正常胰腺组织中FGF2的表达。将RPMI 1640培养的人胰腺癌细胞PANC-1分为4组:对照组、FGF2组、FGFR2+AZD4547组和FGFR2+LY294002组。Western blot及RT-PCR分别检测palladin和Akt的蛋白及mRNA表达。Transwell小室细胞侵袭活性实验和细胞划痕实验检测各组PANC-1细胞侵袭和迁移的能力。 结果 免疫组化显示,胰腺癌组织中FGF2表达率81%(50/62)高于癌旁正常组织的10%(2/20,P<0.05),且胰腺癌中FGF2表达与肿瘤的分化程度、临床TNM分期、淋巴结转移和远处转移有关(P<0.05),与患者性别、年龄和肿瘤部位无关(P>0.05)。Western blot测定显示:FGF2组palladin和p-Akt的蛋白表达高于其他组(P<0.05)。RT-PCR结果显示:FGF2组palladin和p-Akt的mRNA表达高于其他组(P<0.05)。Transwell小室侵袭活性实验结果表明:FGF2组侵袭细胞数高于其他组(P<0.05),FGFR2+AZD4547组和FGFR2+LY294002组侵袭细胞数低于对照组和FGF2组(P<0.05)。细胞划痕实验结果表明:FGF2组细胞迁移率高于其他组(P<0.05),FGFR2+AZD4547组和FGFR2+LY294002组细胞迁移率低于对照组和FGF2组(P<0.05)。 结论 FGF2在胰腺癌组织中高表达,与胰腺癌的侵袭和转移相关,其机制可能是FGF2与其受体FGFR2结合后活化PI3K/Akt信号通路,激活并提高palladin的表达,促进细胞的运动,进而促进肿瘤细胞的侵袭与迁移活动。
成纤维生长因子2; 胰腺癌; 侵袭; 转移
胰腺癌是具有高度侵袭性的恶性肿瘤,由于其早期浸润、快速转移的特征,患者往往预后不良,临床治愈率低,总体生存率不到6%[1],探讨胰腺癌的发生发展过程,了解其侵袭转移的机制具有重要意义。成纤维细胞生长因子(fibroblast growth factor 2,FGF2)在恶性肿瘤发生发展中的作用已受到广泛关注。FGF2与其受体(fibroblast growth factor receptor 2,FGFR2)结合后可激活肿瘤细胞内相关信号通路,促进细胞的增殖、迁移和侵袭等过程[2],而FGF2在胰腺癌中的表达及其作用的下游底物尚不清楚。我们前期研究发现,细胞支架蛋白palladin高度表达于胰腺癌组织中,且与胰腺癌组织的分化及侵袭转移等有关[3]。肿瘤细胞内的重要信号通路磷脂酰肌醇3激酶/丝氨酸-苏氨酸激酶(phosphatidylinositol 3 kinase/serine-threonine kinases,PI3K/Akt)可激活palladin,维持其稳定性并促进其表达[4]。作为促细胞生长因子的FGF2,FGF2能否通过PI3K/Akt信号通路激活并诱导palladin表达进而促进胰腺癌细胞的侵袭和转移,有待于深入研究。本研究拟观察FGF2在胰腺癌组织中的表达情况,并观察给予FGF2对体外培养的PANC-1细胞侵袭、迁移以及palladin表达的影响,探讨FGF2在促进胰腺癌发生发展中的作用机制,为临床上胰腺癌的治疗提供新的靶点。
1 资料与方法
1.1 临床标本
收集2008-10~2015-06在山西医科大学第一医院普通外科和山西大医院普通外科进行胰腺癌手术切除并经病理诊断为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的标本62例,包括相应的20例距肿瘤边缘2 cm以上的正常胰腺(normal pancreas,NP)组织标本。62例PDAC标本中,男性38例,女性24例,年龄(53±10)岁,其中胰头癌39例,胰体/尾癌23例,患者术前未行任何抗肿瘤治疗。按照国际抗癌联合会(UICC)分类标准分为:低分化24例,中分化20例,高分化18例;有淋巴结转移34例,无淋巴结转移28例。按照TNM分期分为:Ⅰ-Ⅱ期25例,Ⅲ-Ⅳ期37例。所有上述标本经中性甲醛固定,石蜡包埋。本研究已经过医院伦理委员会的审核批准,并获得患者及其家属的知情同意。
1.2 细胞株及主要试剂
人胰腺癌PANC-1细胞,购自中科院上海细胞生物医学研究所;重组人FGF2购自英国Peprotech公司;兔抗人FGF2多克隆抗体、兔抗人p-Akt(ser-473)单克隆抗体和兔抗人palladin多克隆抗体购自武汉博士德生物工程有限公司;山羊抗兔IgG、免疫组化SP试剂盒、BCA蛋白浓度测定试剂盒、DAB显色试剂盒购自北京中杉金桥生物技术有限公司;Transwell小室(24孔,0.8 μm)购自美国Corning公司;FGFR2抑制剂(AZD4547)、PI3K/Akt特异性抑制剂(LY294002)购自美国Sigma公司,总RNA提取试剂盒购自上海生工生物科技有限公司。
1.3 免疫组化检测FGF2表达及结果判定
上述标本经甲醛固定、石蜡包埋、4 μm连续切片,分别行HE染色和免疫组化染色,参照试剂盒说明书进行,PBS液代替一抗作为阴性对照。染色结果由2位病理科医师采用双盲法判定,以细胞胞质中出现棕黄色颗粒为FGF2阳性表达。参照课题组前期实验方法[3],每个光学高倍显微镜下随机选取5个视野,每个视野内计数100个细胞,根据染色面积和染色强度进行评分:①染色面积:0分,0-10%;1分,11%-25%;2分,26%-50%;3分,大于50%。②染色强度:0分,阴性;1分,偏弱;2分,偏中;3分,偏强。染色面积和染色强度的评分相加即FGF2染色的分级:≤3分为FGF2低表达;>3分为FGF2高表达。
1.4 细胞培养及分组处理
将胰腺癌细胞PANC-1接种于RPMI 1640(每毫升含100 U青霉素和100 U链霉素)培养液中,37 ℃、5% CO2的培养箱中培养,隔1 d换液1次。细胞长到培养瓶底80%,用0.25%胰蛋白酶和0.02%乙二胺四乙酸消化并传代。取对数生长期细胞进行实验。细胞培养24 h,随后即分为4组:对照组(C组,细胞继续在培养液中生长)、FGF2组(于培养液中加入FGF2 75 ng/ml)、AZD4547组(FGFR2+AZD4547组,在加入FGF2 75 ng/ml的基础上加入3.0 nmol/L的AZD4547)、LY294002组(FGFR2+LY294002组,在加入FGF2 75 ng/ml的基础上加入10 μmol/L的LY294002)。四组分别进行Western blot测定、RT-PCR检测和Transwell小室细胞侵袭活性实验和细胞划痕实验。
1.5 Western blot测定p-Akt和palladin蛋白表达
提取PANC-1细胞总蛋白,BCA定量蛋白质,各样本蛋白分别取50 μg进行SDS-PAGE电泳分离蛋白,采用电泳转移法将蛋白转移至硝酸纤维膜。封闭2 h分别加入一抗兔抗人p-Akt(ser-473)单克隆抗体和兔抗人palladin多克隆抗体孵育过夜,次日洗膜后加入辣根过氧化物酶标记的山羊抗兔IgG二抗孵育。漂洗后进行化学增强发光反应,洗片后扫描电泳条带。用Image J软件对蛋白条带的灰度值进行分析,以目的条带与内参β-actin灰度值的比值代表该蛋白的表达水平。
1.6 RT-PCR检测Akt mRNA和palladin mRNA的表达
按照总RNA提取试剂盒说明书操作,用Trizol试剂盒提取mRNA,将RNA逆转录合成cDNA后进行palladin和Akt的基因扩增。以β-actin作为内参照。palladin上游引物5′-GCATCAGAG CTGACCTCAAC-3′,下游引物5′-GGTTGATCACCGAGGCTA AT-3′,片段长度332 bp;Akt上游引物5′-GCGACAGTGGCTATTGTGA-3′,下游引物5′-AGCTGCTCAAAGATGC CATT-3′,片段长度232 bp;β-actin上游引物:5′-GTCAGTGCATCACTACT GGCAAT-3′,下游引物:5′-CGATCTGGTAG GGCCTTG-3′,扩增长度312 bp。PCR反应体系50 μl,反应条件为:95 ℃预变性10 min,活化Tag酶;94 ℃变性15 s,55 ℃退火及延伸60 s,45个循环结束。采用2-ΔΔct计算palladin mRNA和Akt mRNA的相对表达水平。
1.7 肿瘤细胞侵袭和迁移实验
将PANC-1细胞接种于24孔板,调整细胞浓度为2×105个/ml,每组设6个复孔。采用Transwell小室检测PANC-1细胞的侵袭能力,将50 μl的Matrigel溶液铺于上下室之间的聚碳酸酯微孔膜上,再分别加入100 μl和600 μl的RPMI 1640培养基。各组PANC-1细胞经洗涤、消化后按照104/孔接种于小室上层,24 h观察膜及孔下的细胞数,甲醛固定,PBS漂洗,0.5%结晶紫染液室温作用10 min。显微镜下拍照计数穿过滤膜的细胞数,每孔随机选取5个视野,取其平均值。通过细胞划痕实验测定PANC-1细胞的迁移能力。细胞接种于6孔板,调整细胞浓度为1×106个/ml,细胞贴壁生长90%时进行实验。用微量移液器的枪头在培养基中划一横隔。PBS后洗去划下的细胞,加入无血清培养基。0 h和24 h取样,倒置显微镜下拍照。每个样品取5个视野测量距离。细胞迁移率=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.8 统计学处理
2 结果
2.1 FGF2在PDAC及NC组织中的表达
免疫组化结果显示,在癌旁正常胰腺组织中FGF2有微量表达,染色较浅(见图1A、C)。在胰腺癌组织中FGF2高表达,在胰腺癌导管细胞和间质细胞中均有表达,主要定位于细胞质,表现为深棕色颗粒(见图1B、D)。依据评判标准,FGF2在20例NP组织中高表达2例,低表达18例,FGF2蛋白高表达率为10%;FGF2在62例PDAC组织中高表达50例,低表达12例,FGF2蛋白高表达率为81%。PDAC组织中FGF2蛋白高表达率显著高于NP组织(χ2=32.529,P<0.000 1)。
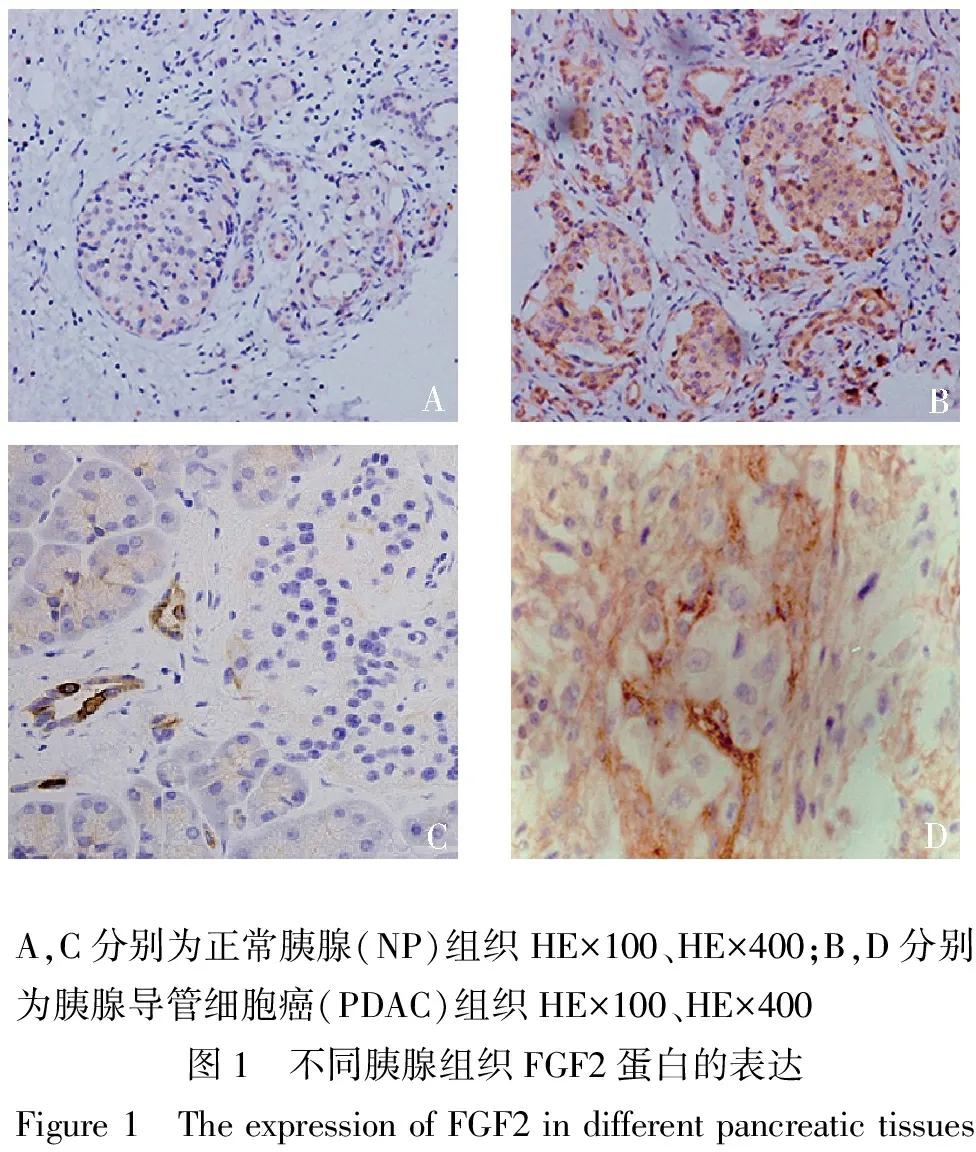
A,C分别为正常胰腺(NP)组织HE×100、HE×400;B,D分别为胰腺导管细胞癌(PDAC)组织HE×100、HE×400图1 不同胰腺组织FGF2蛋白的表达Figure1 TheexpressionofFGF2indifferentpancreatictissues
2.2 PDAC组织中FGF2表达与临床病理因素的关系
将FGF2免疫组化染色结果与患者的性别、年龄、肿瘤部位、分化程度、TNM分期、有无淋巴结和远处转移进行χ2检验,结果见表1。FGF2表达与患者的性别、年龄和肿瘤部位无关(P>0.05),与肿瘤的分化程度、临床TNM分期、淋巴结转移和远处转移有关(P<0.05)。
表1 胰腺癌组织中FGF2蛋白表达水平与临床病理因素之间的关系 例(%)
Table 1 Relationship between the expression of FGF2 in pancreatic adenocarcinoma tissues and clinical pathological factors cases(%)
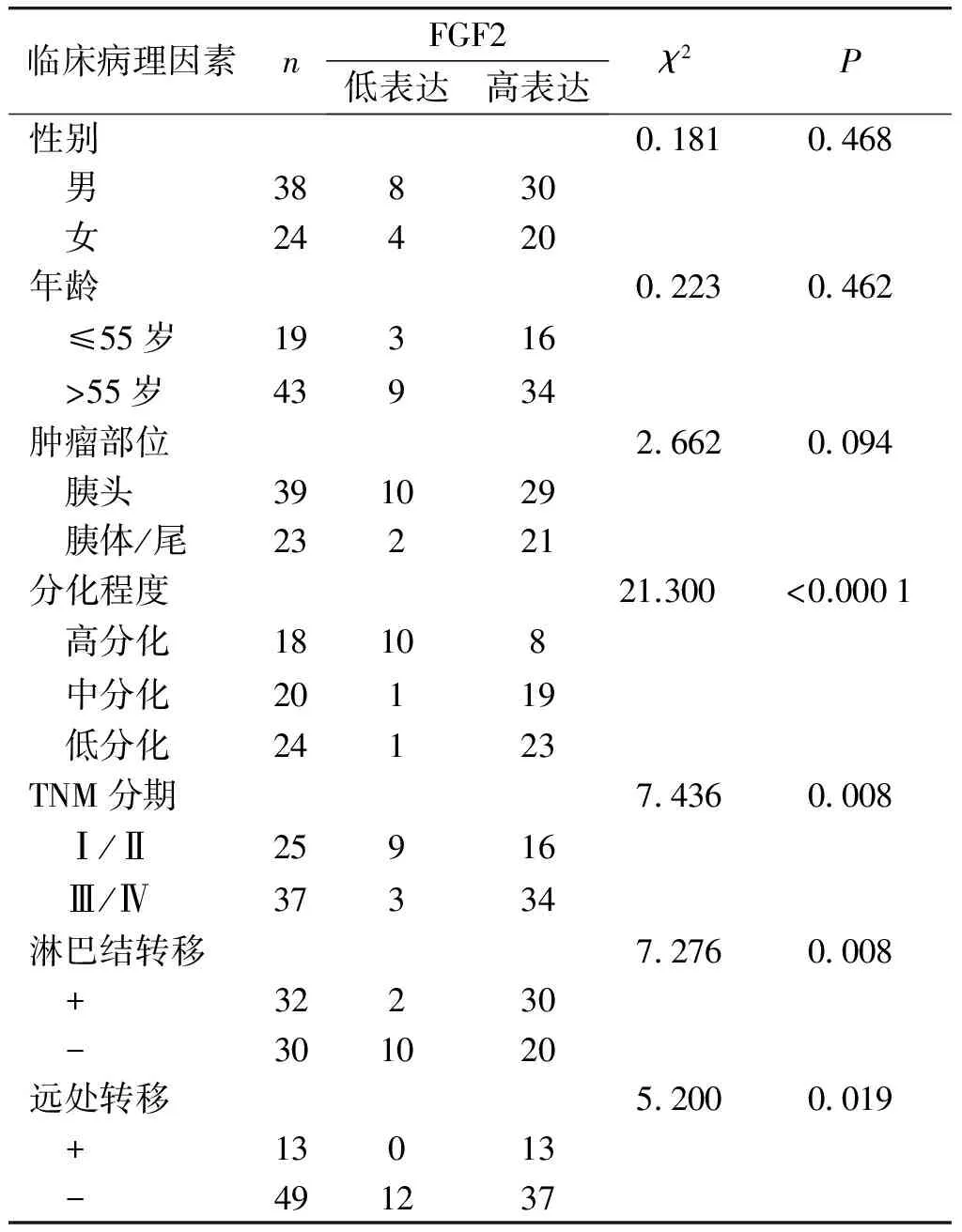
临床病理因素nFGF2低表达高表达χ2P性别0 1810 468 男38830 女24420年龄0 2230 462 ≤55岁19316 >55岁43934肿瘤部位2 6620 094 胰头391029 胰体/尾23221分化程度21.300<0.0001 高分化18108 中分化20119 低分化24123TNM分期7 4360 008 Ⅰ/Ⅱ25916 Ⅲ/Ⅳ37334淋巴结转移7 2760 008 +32230 -301020远处转移5 2000 019 +13013 -491237
2.3 Western blot及RT-PCR结果分析
Western blot测定结果显示,对照组、AZD4547组和LY294002组,palladin蛋白和p-Akt蛋白仅有微量表达,而FGF2组palladin蛋白和p-Akt蛋白表达明显高于其他组,RT-PCR也得到了同样的变化趋势。对照组、FGF2组、AZD4547组、LY294002组的palladin蛋白表达水平分别为0.19±0.05,0.97±0.04,0.16±0.04,0.16±0.05(F=741.878,P<0.000 1);p-Akt蛋白表达水平分别为0.25±0.06,1.22±0.07,0.20±0.03,0.20±0.05(F=862.371,P<0.000 1);对照组、FGF2组、AZD4547组、LY294002组的palladin mRNA表达水平分别为0.51±0.08,1.19±0.10,0.54±0.08,0.52±0.07(F=161.040,P<0.000 1),Akt mRNA表达水平分别为0.38±0.08,1.36±0.07,0.32±0.04,0.34±0.06(F=587.684,P<0.000 1),四组差异有统计学意义(见图2及表2)。
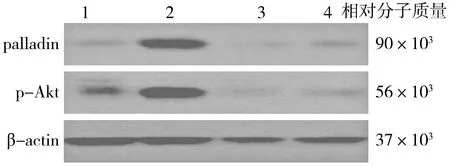
图2 Western blot检测各组细胞中p-Akt及palladin蛋白的表达Figure 2 The expression of p-Akt and palladin in different groups by Western blot
2.4 肿瘤细胞侵袭和迁移实验结果
Transwell小室侵袭活性实验和细胞划痕实验结果表明,PANC-1细胞使用FGF2处理后,侵袭细胞数和细胞迁移率增加,而分别给予FGFR2抑制剂AZD4547和PI3K/Akt抑制剂LY294002后,细胞迁移数量和细胞迁移率受到明显的抑制。FGF2组侵袭细胞数和细胞迁移率明显高于其他三组(P<0.05),而AZD4547组和LY294002组侵袭细胞数和细胞迁移率较对照组和FGF2组降低(P<0.05,见图3、4和表2)。
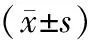

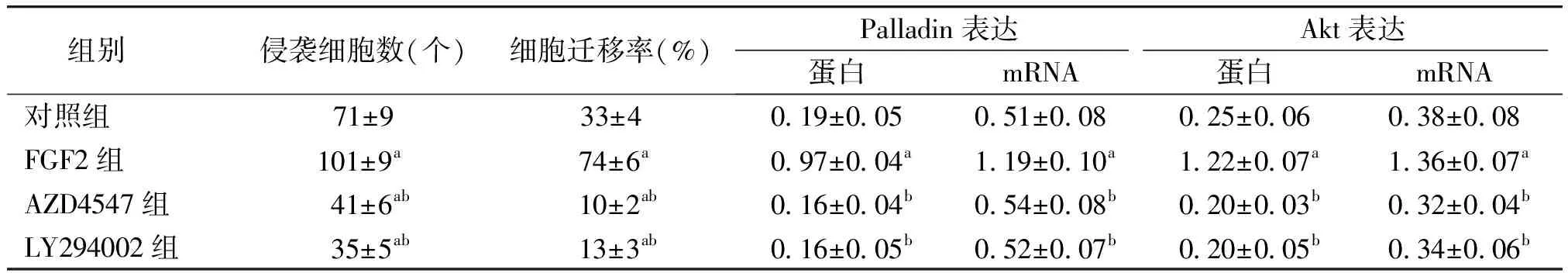
组别侵袭细胞数(个)细胞迁移率(%)Palladin表达Akt表达蛋白mRNA蛋白mRNA对照组71±933±40 19±0 050 51±0 080 25±0 060 38±0 08FGF2组101±9a74±6a0 97±0 04a1 19±0 10a1 22±0 07a1 36±0 07aAZD4547组41±6ab10±2ab0 16±0 04b0 54±0 08b0 20±0 03b0 32±0 04bLY294002组35±5ab13±3ab0 16±0 05b0 52±0 07b0 20±0 05b0 34±0 06b
与对照组比较,aP<0.05;与FGF2组比较,bP<0.05
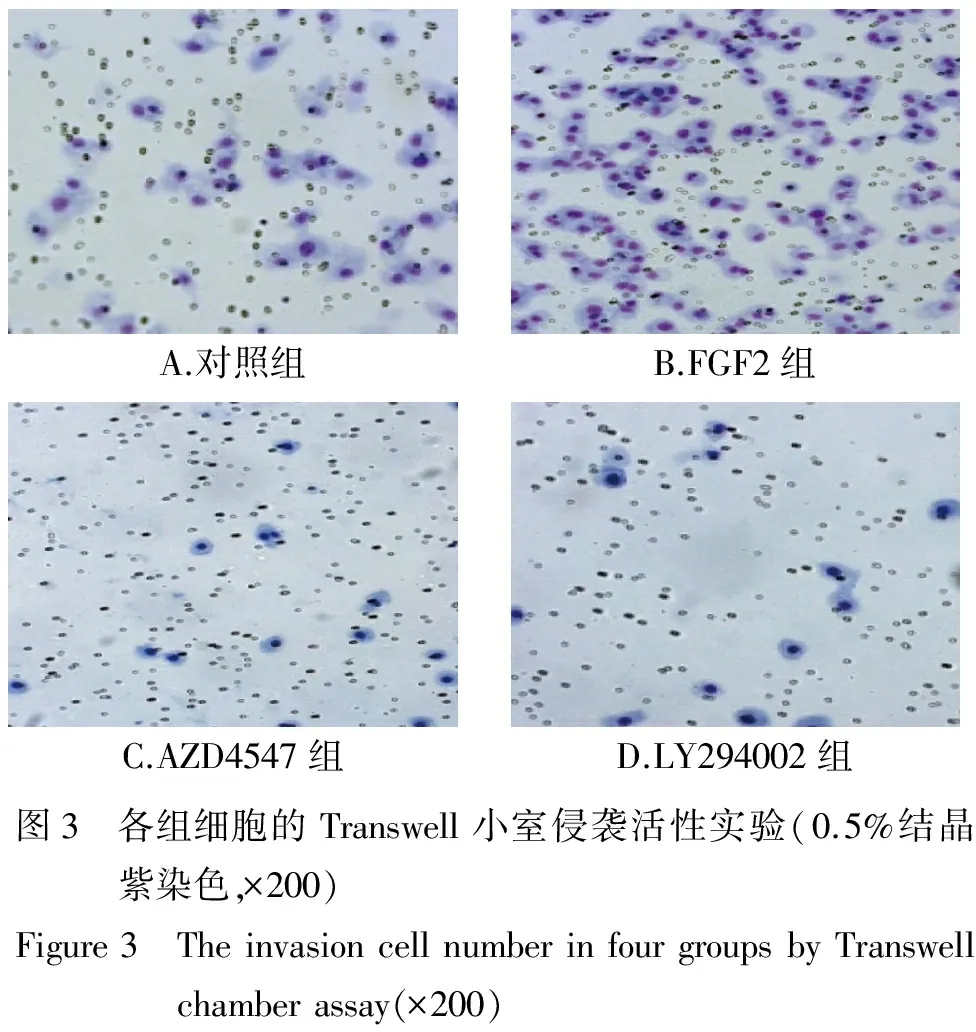
A.对照组B.FGF2组C.AZD4547组D.LY294002组图3 各组细胞的Transwell小室侵袭活性实验(0.5%结晶紫染色,×200)Figure3 TheinvasioncellnumberinfourgroupsbyTranswellchamberassay(×200)
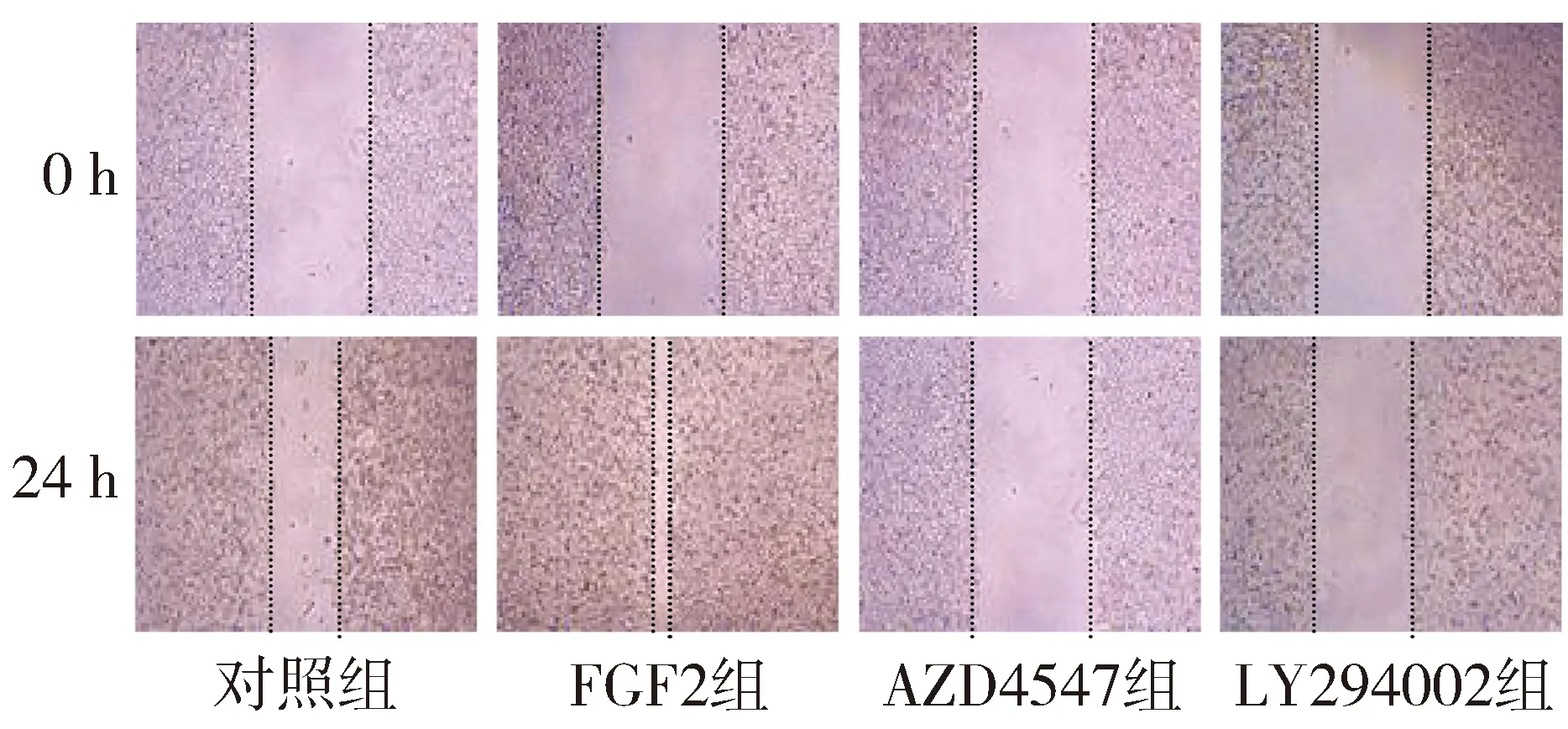
图4 各组PANC-1细胞的细胞划痕图 (×200)Figure 4 The migration rate of PANC-1 cells in different groupby wound healing assay (×200)
3 讨论
早期侵袭和迅速转移是胰腺癌最重要的生物学特性之一,如何在胰腺癌的侵袭和转移机制中找到突破口,尚没有明确的答案。近年来,促细胞生长因子和肿瘤发生的关系成为研究的热点,促细胞生长因子与其特异性受体相结合后,激活细胞内一系列信号通路,在调节细胞增殖、凋亡和血管生成等过程中发挥重要作用[5]。作为促生长因子之一的FGF2,在乳腺癌、胃癌、甲状腺癌等组织中已被发现有较高水平的表达量,且异常的FGF2/FGF2R信号通路可能促进了肿瘤的发生发展[6,7],而对于FGF2在胰腺癌组织中的表达及在胰腺癌发生发展中的作用未见到相关报道。本研究应用免疫组化染色法检测了FGF2在胰腺癌组织中的表达,结果表明,FGF2高表达于PDA对照组织中,而在癌旁正常组织中仅有微量表达,且FGF2表达与肿瘤组织的分化程度、临床分期、淋巴转移和远处转移相关,由此推测FGF2可能参与了胰腺癌的发病过程。FGF2又是通过具体什么机制作用于胰腺癌细胞并对其发挥作用呢?
研究发现,多种肿瘤细胞中存在FGF/FGFR家族介导的信号通路的异常激活,而这些信号通路又可以激活下游蛋白,进一步促进肿瘤细胞的侵袭和转移[8,9]。PI3K/Akt是细胞内一条经典的抗细胞凋亡并促进其存活的信号通路,该信号转导通路若发生异常,可引起细胞异常增殖从而发生肿瘤,PI3K/Akt已被证实参与了大多数肿瘤的发生发展[10,11]。而FGF2与具有酪氨酸激酶活性的FGFR2受体结合后,可引起FGFR2自身磷酸化,然后通过调节亚基与PI3K结合使PI3K活化,进一步引起Akt的磷酸化,而磷酸化后的p-Akt具有庞大的下游信号网络[12]。本研究继续通过在细胞水平上检测了FGF2对胰腺癌PANC-1细胞的作用,结果表明,FGF2单独作用于PANC-1时,可明显促进细胞的迁移和侵袭,分别给予FGF2的受体(FGFR2)抑制剂AZD4547及PI3K/Akt信号通路的特异性抑制剂LY294002后,细胞的侵袭和迁移活动较对照组和FGF2组有了明显的抑制。由此提示,FGF2可能通过PI3K/Akt信号通路而促进PANC-1细胞的侵袭和转移,参与了胰腺癌的发生发展过程。
蛋白palladin存在于多种组织细胞中,参与细胞的组装与重构,在调控肿瘤细胞的运动和侵袭迁移中起到关键作用。在前期研究中我们发现palladin在胰腺癌组织中高表达,与肿瘤细胞的侵袭和迁移活动相关[3],而调控palladin表达的上游分子信号机制未明确。研究表明,PI3K/Akt可通过加强肌动蛋白细丝重构而促进细胞的运动,若给予PI3K/Akt抑制剂降低Akt的磷酸化水平,细胞的运动能力下降[13]。而细胞运动能力的增强是肿瘤侵袭与转移的前提,palladin作为一种肌动蛋白相关蛋白,PI3K/Akt可激活palladin并促进其表达,进而增加细胞的运动能力,促进癌细胞的侵袭与迁移[4]。本研究结果表明,Akt和palladin的表达在单独给予FGF2时较对照组有明显升高,但在分别给予FGFR2抑制剂及PI3K/Akt信号通路抑制剂后,Akt和palladin的表达与对照组相比没有明显变化,但却比FGF2组明显降低。由此推测,FGF2可能通过PI3K/Akt信号途径引起Akt磷酸化加强,进一步激活palladin并提高其表达,进而促进肿瘤细胞的运动能力,引起其侵袭和迁移活动增强。
综上所述,FGF2在胰腺癌组织中高表达,且与肿瘤组织的分化、临床分期、淋巴转移和远处转移密切相关。而FGF2促进胰腺癌发生的机制,可能是FGF2通过与其受体FGFR2结合后活化PI3K/Akt信号通路,作用于palladin蛋白,促进细胞的运动,进而促进的肿瘤细胞的侵袭与迁移活动。FGF2有望成为临床上胰腺癌治疗的新靶点。
[1] Cid-Arregui A,Juarez V. Perspectives in the treatment of pancreatic adenocarcinoma[J]. World J Gastroenterol,2015,21(31):9297-9316.
[2] La Venuta G,Zeitler M,Steringer JP,etal. The startling properties of fibroblast growth factor 2:how to exit mammalian cells without a signal peptide at hand[J]. J Biol Chem,2015,290(45):27015-27020.
[3] 付西峰,田彦璋,董秀山,等. 细胞支架蛋白palladin在胰腺癌中的表达及其临床病理意义[J]. 肿瘤研究与临床,2015,27(8):522-525.
[4] Chin YR,Toker A. Akt2 regulates expression of the actin-bundling protein palladin[J]. FEBS Lett,2010,584(23):4769-4774.
[5] Nandy D,Mukhopadhyay D. Growth factor mediated signaling in pancreatic pathogenesis[J]. Cancers (Basel),2011,3(1):841-871.
[6] 李倩,李莉,郭淑芹,等. 成纤维细胞生长因子2、成纤维细胞生长因子受体4蛋白在人甲状腺乳头状癌中的表达及意义[J]. 解剖学报,2014,45(5):675-681.
[7] Li W,Du X,Chen Q,etal. Peptidomimetic suppresses proliferation and invasion of gastric cancer cells by fibroblast growth factor 2 signaling cascade blockage[J]. Anticancer Drugs,2016,27(3):164-172.
[8] Hong L,Han Y,Liu J,etal. Fibroblast growth factor receptor 2:a therapeutic target in gastric cancer[J]. Expert Rev Gastroenterol Hepatol,2013,7(8):759-765.
[9] Corn PG,Wang F,McKeehan WL,etal. Targeting fibroblast growth factor pathways in prostate cancer[J]. Clin Cancer Res,2013,19(21):5856-5866.
[10] Olasz J,Doleschall Z,Dunai Z,etal. PI3K/AKT pathway activation and therapeutic consequences in breast cancer[J]. Magy Onkol,2015,59(4):346-351.
[11] Lau MT,So WK,Leung PC. Fibroblast growth factor 2 induces E-cadherin down-regulation via PI3K/Akt/mTOR and MAPK/ERK signaling in ovarian cancer cells[J]. PLoS One,2013,8(3):e59083.
[12] Zyuz′kov GN,Danilets MG,Ligacheva AA,etal. PI3K,MAPK EPK1/2 and p38 are involved in the realization of growth potential of mesenchymal progenitor cells under the influence of basic fibroblast growth factor[J]. Bull Exp Biol Med,2014,157(4):436-439.
[13] Qian Y,Corum L,Meng Q,etal. PI3K induced actin filament remodeling through Akt and p70S6K1:implication of essential role in cell migration[J]. Am J Physiol Cell Physiol,2004,286(1):C153-163.
Expression of fibroblast growth factor 2 in pancreatic ductal adenocarcinoma tissues and its effects on invasion and metastasis of PANC-1
FU Xifeng*,DONG Xiushan,GAO Fei,ZHAO Haichao
(DepartmentofGeneralSurgery,ShanxiAcademyofMedicalSciences,ShanxiDayiHospital,Taiyuan030032,China;*Correspondingauthor,E-mail:fxfyisheng@163.com)
ObjectiveTo investigate the expression of fibroblast growth factor 2(FGF2) in pancreatic ductal adenocarcinoma(PDAC) tissues and its role in the invasion and metastasis of PANC-1.MethodsImmunohistochemistry assay was performed to detect the expression of FGF2 in 62 cases of PDAC tissues and corresponding adjacent normal pancreas(NP) tissues. The human pancreatic cancer PANC-1 cells were cultured in RPMI 1640 culture medium.The cells were randomly divided into 4 groups:control group,FGF2 group,FGF2+AZD4547 group and FGF2+LY294002 group. Western blot analysis and RT-PCR were performed respectively to detect the expression of palladin and Akt in PANC-1 cells. Transwell chamber assay and wound healing assay were applied to determine the invasive activity and the migration of PANC-1 cells respectively.ResultsImmunohistochemical staining showed that FGF2 was highly expressed in PDAC tissues. The rate of FGF2 expression was 81%(50/62) in PDAC tissues,significantly higher than that of NP tissues (10.0%,2/20) (P<0.05). And FGF2 expression was correlated with the degree of tumor differentiation,clinical TNM classification,lymph node metastasis and distant metastasis in pancreatic tissues(P<0.05),but not related with patient’s sex,age and tumor location(P>0.05). Western blot analysis revealed that the relative expression of FGF2 and p-Akt in FGF2 group was higher than that in the other groups(P<0.05). RT-PCR results showed that the relative expression of FGF2 mRNA and Akt mRNA in FGF2 group was higher than that in the other groups(P<0.05). Transwell chamber assay showed that the invasion cells numbers in FGF2 group were higher than that in other groups(P<0.05). The invasion cells numbers in AZD4547 group and LY294002 group were lower than that in control group and FGF2 group(P<0.05). The wound healing assay showed that the migration rate in FGF2 group was higher than that in the other groups(P<0.05).The migration rates in AZD4547 group and LY294002 group were lower than that in control group and FGF2 group(P<0.05).ConclusionFGF2 is highly expressed in PDAC tissues,and is related to invasion and metastasis of PDAC. FGF2 could enhance the invasion and migration of pancreatic tumor cells by binding to its receptor FGFR2 for activating PI3K/Akt signaling pathway and activating and highly expressing palladin.
fibroblast growth factor 2; pancreatic ductal adenocarcinoma; invasion; metastasis
山西省自然科学基金资助项目(2015011131)
付西峰,男,1974-07生,硕士,副主任医师,E-mail:fxfyisheng@163.com
2017-02-15
R735.9
A
1007-6611(2017)05-0426-06
10.13753/j.issn.1007-6611.2017.05.005

