盐酸千金藤碱对HepG2.2.15细胞HBX/NF-κB通路的影响
张晶敏,魏青青,马 琳,吕晓瑞,江金花,王庆端(河南省医药科学研究院,河南省肝病药理重点实验室,郑州 45005;郑州大学第一附属医院药学部;通讯作者,E-mail:wangqd@zzu.edu.cn)
盐酸千金藤碱对HepG2.2.15细胞HBX/NF-κB通路的影响
张晶敏1,2,魏青青1,马 琳1,吕晓瑞1,江金花1,王庆端1*
(1河南省医药科学研究院,河南省肝病药理重点实验室,郑州 450052;2郑州大学第一附属医院药学部;*通讯作者,E-mail:wangqd@zzu.edu.cn)
目的 探讨盐酸千金藤碱(cepharanthine hydrochloride,CH)对HepG2.2.15细胞HBX/NF-κB信号通路的影响。 方法 选用不同浓度的CH(2.5,5,10 μmol/L)干预稳定表达野生型乙型肝炎病毒(hepatitis B virus,HBV)的HepG2.2.15细胞后,采用RT-PCR和ELISA法分别检测细胞内X基因 mRNA和X蛋白表达变化;采用Annexin Ⅴ-FITC/PI法检测细胞的凋亡率,Western blot法检测细胞内NF-κB信号通路成员P65和IκBα蛋白表达。 结果 与未经CH处理的HepG2.2.15细胞(对照组)相比,CH各剂量组明显抑制细胞内X基因mRNA和X蛋白的表达(P<0.05)。CH干预细胞48 h能够浓度依赖性地诱导HepG2.2.15细胞凋亡,2.5,5,10 μmol/L CH处理细胞后,HepG2.2.15细胞平均凋亡率分别为(11.9±1.21)%,(19.8±2.32)%,(29.3±1.27)%。CH处理组细胞内IκBα蛋白的表达水平明显高于对照组,且P65蛋白的表达水平明显下调(P均<0.05)。 结论 CH能够抑制HBX/NF-κB信号通路的活性,并具有促进HepG2.2.15细胞凋亡的作用。
盐酸千金藤碱; 乙型肝炎病毒; HBV X蛋白; 核转录因子-κB; HepG2.2.15细胞
乙型肝炎病毒(hepatitis B virus,HBV)感染引起的慢性乙型肝炎严重威胁人类健康,全球有超过2.4亿HBV s 抗原(HBsAg)阳性者[1]。HBV慢性感染与肝衰竭、肝硬化和原发性肝细胞癌的发生和发展密切相关[2,3]。目前,治疗乙肝的抗病毒药物主要包括干扰素和核苷(酸)类似物(nucleos(t)ide analogues,NAs)两大类。干扰素具有骨髓抑制和肝功能损害等不良反应,且不适用于免疫功能不全的患者,HBV e 抗原(HBeAg)血清转换率仅有30%-40%,HBsAg清除率低于10%,临床应用受到很大限制[4]。NAs作用机制基本明确,但不能完全清除体内的病毒,只能最大限度地抑制病毒的复制,需长期用药。耐药HBV尤其是多药耐药HBV突变体的出现削弱了多种NAs的临床效果,成为临床治疗乙肝的一大挑战[5]。因此,研究和发现新型有效的抗HBV药物至关重要[6]。中草药治疗乙肝是我国特有的有效治疗手段,从天然药物中寻找作用机制不同于核苷(酸)类似物的抗HBV有效成分是研究新型抗HBV药物的有效途径。
盐酸千金藤碱(cepharanthine hydrochloride,CH)是从千金藤属植物块根中提取、分离、成盐而得的一种双苄基异喹啉类生物碱。国内外研究证实其具有免疫调节、镇痛、抗肿瘤、逆转肿瘤多药耐药、抗人类免疫缺陷病毒、抗急性呼吸道综合征冠状病毒等多种生物学活性[7-12]。CH对多种炎症及有炎症反应进程的相关疾病如脓毒症、乳腺炎、急性肺损伤、肾缺血再灌注损伤以及糖尿病肾病等的作用机制主要为抑制炎症细胞活性和炎症因子的释放,均涉及核因子-κB(nuclear factor-κB,NF-κB)通路[13-17]。NF-κB受HBV X蛋白(HBx)的反式激活,被活化后,一方面作用于病毒基因调控区促进病毒自身复制,另一方面作用于其下游基因或原癌基因κB位点,使原癌基因过表达。HBx蛋白对启动和维持感染后病毒复制必不可少[18]。
研究发现CH能有效抑制野生型和拉米夫定耐药性HBV的表达和复制[19,20]。本研究利用HepG2.2.15细胞,观察CH对HBX/NF-κB通路的影响,为揭示其抗HBV的作用机制和临床应用提供理论及实验依据。
1 材料与方法
1.1 细胞和细胞培养
HepG2.2.15细胞株由暨南大学王一飞教授惠赠,河南省肝病药理重点实验室(以下简称本实验室)液氮保存。培养液为含10%的胎牛血清的RPMI1640完全培养基,用时加G418(Geneticin,遗传霉素)至终浓度为200 mg/L。培养条件为37 ℃,饱和湿度及5% CO2的恒温细胞培养箱,每3-4 d传代1次。
1.2 主要试剂
CH粉末由本实验室研制,纯度>98.5%;Annexin Ⅴ/PI凋亡试剂盒(联科生物技术有限公司);超纯RNA提取试剂盒(北京康为世纪);HBXAg抗原诊断试剂盒(美国R&D公司);细胞核和胞质蛋白提取试剂盒(上海生工公司);预染蛋白Marker,(美国Genview公司);β-actin多克隆抗体(北京中杉金桥公司);超敏ECL化学发光试剂盒(碧云天生物技术研究所);NF-ΚB p65多克隆抗体、IκBα多克隆抗体、HRP标记IgG、BCA蛋白测定试剂盒均为北京博奥森公司产品;引物、RT-PCR试剂盒由大连宝生物合成和提供。
1.3 RT-PCR和ELISA法检测细胞内X基因mRNA和X蛋白的表达
收集对数生长期的HepG2.2.15细胞,以2×104个/ml接种于6孔板中,培养24 h,弃去上清。实验组加入含CH的培养液(终浓度分别为2.5,5,10 μmol/L)。空白对照组加入等体积培养液。每组细胞设6个复孔,每3 d更换1次培养液,共培养9 d。弃上清,0.25%胰酶消化并收集细胞,按试剂盒说明分别提取细胞内RNA和蛋白质,测定各组样品纯度及浓度。取1 μg 总RNA作为模板,按RT-PCR试剂盒说明操作,引物如下:HBV X基因正向:5′-TCTCAGCAATGTCAACGAC -3′;反向:5′-TTTATGCCTACAGCCTCCT-3′;扩增产物92 bp。β-actin基因正向:5′-CTCCATCCTGGCCTCGCTGT-3′;反向:5′-GCTGTCACCTTCACCGTTCC-3′;扩增产物268 bp;PCR产物经3% 琼脂糖电泳,凝胶成像系统进行图像采集。用Quantity One 4.2进行光密度测定,以目的基因(X)与内参(β-actin)光密度值的比值表示目的基因mRNA的相对表达水平。蛋白样品按照ELISA试剂盒说明进行,酶联免疫检测仪测定OD450值,并根据下公式计算抑制率:
抑制率=(1-实验孔OD值/对照孔OD值)×100%。
1.4 FCM(AnnexinⅤ/PI双染法)检测细胞凋亡率
收集对数生长期HepG2.2.15细胞,以1.5×105个/孔接种于6孔板中。实验分组同1.3部分,加药培养48 h消化并收集细胞,按Annexin Ⅴ/PI凋亡试剂盒说明书操作,加入5 μl Annexin Ⅴ-FITC和10 μl PI,混匀,室温避光孵育5 min后,立即用流式细胞仪检测,用Cell Quest 软件分析细胞凋亡和死亡情况。
1.5 Western blot法检测细胞内IκBα和P65蛋白的表达
收集对数生长期的HepG2.2.15细胞,以1.5×105个/孔接种于6孔板中。实验分组同1.3部分,加药培养48 h消化并收集细胞,按试剂盒操作提取细胞总蛋白,BCA法测定样品的浓度。取30 μg蛋白进行SDS-PAGE电泳,将蛋白转移至PVDF膜上,用5%脱脂奶粉封闭1 h,分别加入抗p65、抗IκBα多克隆抗体(均稀释300倍),4 ℃过夜后洗膜。加入辣根过氧化物酶标记IgG(稀释5 000倍)室温孵育后脱色,ECL显影成像。每组实验重复3次,采用 Quantity one软件对各组蛋白条带光密度进行测定,以目的蛋白与内参β-actin条带光密度的比值作为目的蛋白的相对表达量。
1.6 统计学分析
2 结果
2.1 CH对细胞内X基因mRNA和X蛋白表达的影响
采用RT-PCR检测了HepG2.2.15细胞中X 基因 mRNA的表达,经凝胶成像系统对结果进行分析。由图1可看出,与对照组相比,CH处理组HepG2.2.15细胞内HBV X mRNA的表达均明显下降(P<0.05)。X基因mRNA表达随 CH浓度增加而降低,表明CH在转录水平干扰HBV X 基因mRNA的合成。

1.对照组;2.CH 10 μmol/L;3.CH 5 μmol/L;4.CH 2.5 μmol/LA.X基因及内参电泳结果
经ELISA检测细胞内X蛋白的表达,可以看出:与对照组相比,CH 各浓度处理组,细胞内X蛋白表达量显著减少(P<0.05,见表1)。结果表明CH在一定程度上抑制HepG2.2.15 细胞X蛋白的表达。
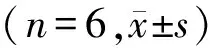

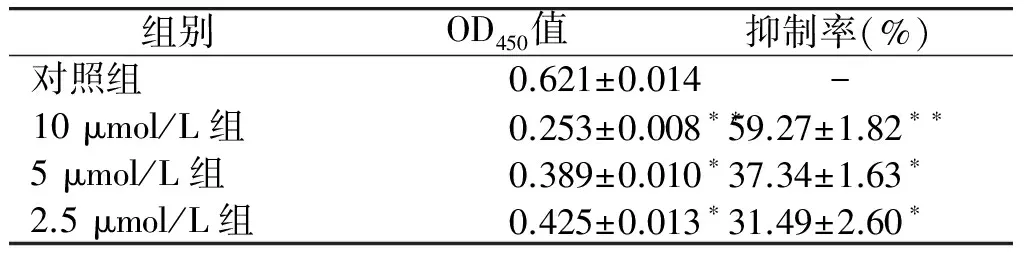
组别OD450值抑制率(%)对照组0.621±0.014-10μmol/L组0.253±0.008∗∗59.27±1.82∗∗5μmol/L组0.389±0.010∗37.34±1.63∗2.5μmol/L组0.425±0.013∗31.49±2.60∗
与对照组相比,*P<0.05,**P<0.01
2.2 CH对HepG2.2.15细胞凋亡的影响
在流式细胞术双参数散点图上,左下象限显示活细胞(Annexin Ⅴ-/PI-);右下象限显示凋亡细胞(FITC+/PI-);右上象限为凋亡后期的继发性坏死细胞(FITC+/PI+)。细胞凋亡率=(凋亡细胞+继发性坏死细胞)/全部细胞×100%。 AnnexinⅤ-/PI双染法结果显示,对照组HepG2.2.15细胞无明显凋亡,经不同浓度CH处理48 h后,细胞凋亡率明显增加。2.5,5,10 μmol/L 的CH处理细胞后,HepG2.2.15细胞凋亡率分别为(11.9±1.21)%、(19.8±2.32)%、(29.3±1.27)%(见表2、图2)。
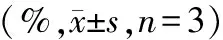
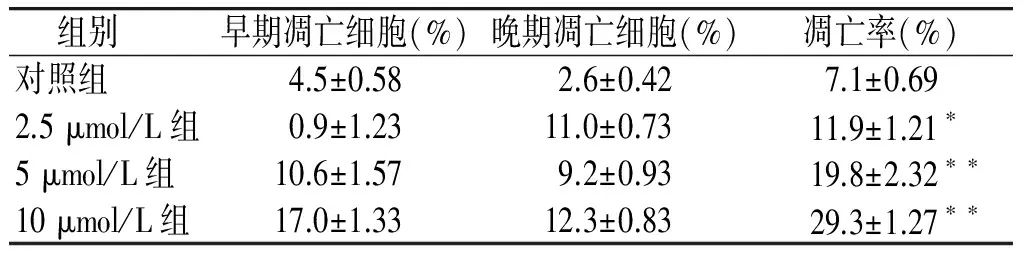
组别早期凋亡细胞(%)晚期凋亡细胞(%)凋亡率(%)对照组4.5±0.582.6±0.427.1±0.692.5μmol/L组0.9±1.2311.0±0.7311.9±1.21∗5μmol/L组10.6±1.579.2±0.9319.8±2.32∗∗10μmol/L组17.0±1.3312.3±0.8329.3±1.27∗∗
与对照组相比,*P<0.05,**P<0.01
2.3 CH对细胞内IκBα和P65蛋白表达的影响
采用Western blot检测CH对HepG2.2.15细胞内IκBα和P65蛋白表达的影响,结合Western blot检测结果和蛋白表达灰度值分析可以看出,与对照组相比, 10,5,2.5 μmol/L CH组细胞胞质IκBα蛋白表达均明显增加(P<0.05),而胞核 P65蛋白表达均明显减少(P<0.05,见图3),且均呈剂量依赖性。
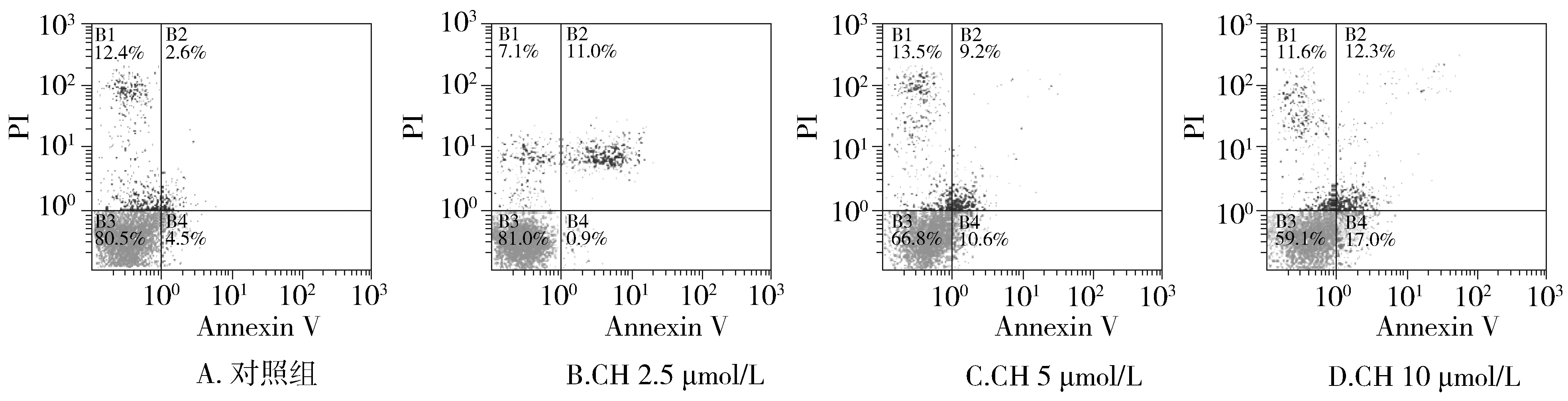
图2 CH对HepG2.2.15细胞凋亡的影响Figure 2 Effects of CH on HepG2.2.15 cell apoptosis
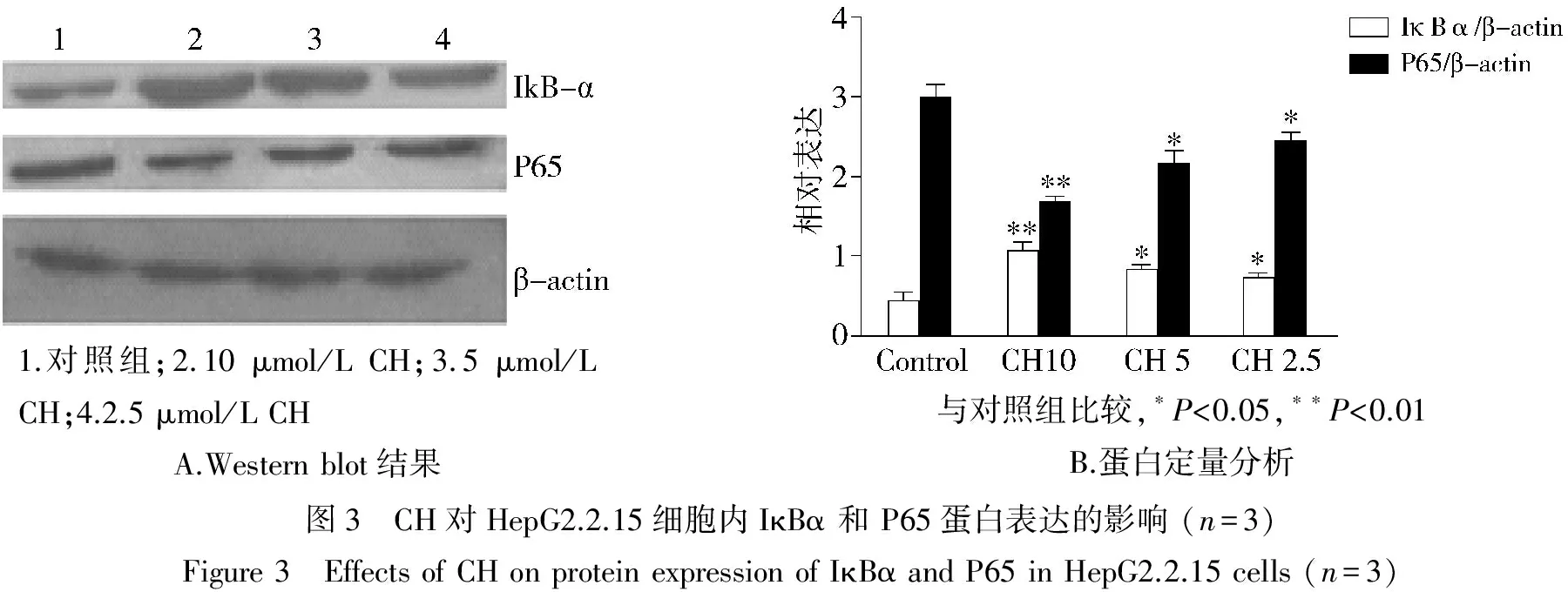
1.对照组;2.10μmol/LCH;3.5μmol/LCH;4.2.5μmol/LCHA.Westernblot结果与对照组比较,∗P<0.05,∗∗P<0.01B.蛋白定量分析图3 CH对HepG2.2.15细胞内IκBα和P65蛋白表达的影响(n=3)Figure3 EffectsofCHonproteinexpressionofIκBαandP65inHepG2.2.15cells(n=3)
3 讨论
HBV是目前已知可感染人类并具有独立复制能力的双链DNA病毒中最小的病毒,其基因组仅含3 200 bp,属于嗜肝DNA病毒科,具有S、C、P和X四个开放阅读框。HBV X基因是HBV基因组中最小的一个,在不同亚型的HBV中其序列大小有所不同。X基因位于位于C基因的上游,与P基因、pre-C基因相互重叠。HBx是由X基因编码的一种多功能蛋白,具有多种生物活性,参与转录调节、细胞周期调控、DNA修复、信号转导和细胞凋亡等,在维持HBV复制、肝细胞肝癌的发生发展和机体的免疫调节中起到重要的作用[21-23]。在乙肝相关性肝细胞癌中,X蛋白与共价闭合环状DNA(cccDNA)相互作用,相互影响,cccDNA可能通过增加HBx的表达进而致癌,HBx通过调控cccDNA的转录,使得HBV的复制处于活跃状态[24]。作为病毒与机体感染、致癌之间的交叉点,HBx的作用越来越受到重视。ALnylam制药公司以HBx开放阅读框的一个位点为靶点设计的siRNA偶联物ALN-HBV,可介导特异性、强力和持久的HBV转录沉默和HBsAg表达沉默[25]。另外由GlobeImmune和Gilead公司合作开发的治疗性疫苗GS-4774,包含来自HBx的60个氨基酸以及整个L型HBsAg和HBcAg。该药物主要通过联合其他抗HBV治疗,激发针对含HBV抗原细胞的T细胞免疫反应,提高CHB患者治疗的应答率[26]。
目前许多中药制剂已被用作对乙肝的治疗或辅助治疗。本实验室前期研究发现CH体外明显抑制野生型和拉米夫定耐药性HBV上清中抗原的分泌和DNA的复制[19,20]。CH良好的抗HBV生物学活性为其进一步开发为新型抗HBV药物奠定了良好的基础。本实验以稳定表达野生型HBV的HepG2.2.15细胞为模型,通过检测发现CH能够浓度依赖性地抑制X基因mRNA和蛋白的表达,提示CH对病毒编码的X蛋白转录和翻译环节均有抑制作用。X蛋白参与的细胞凋亡直接或间接地影响HBV的复制和病毒颗粒的包装。FCM实验显示CH能诱导HepG2.2.15细胞凋亡,随着药物浓度的增加,凋亡比率逐渐上升,呈明显的剂量依赖关系。
细胞凋亡和细胞增殖等生理过程一样,对维持机体内稳态十分重要。凋亡的缺陷会从多方面导致疾病的发生和发展。许多病毒基因组的编码产物可通过调节宿主细胞凋亡,延长被感染宿主细胞生命,从而有利于病毒的复制、扩散、持续感染和对免疫应答的逃避[27,28]。NF-κB通路被认为是HBx蛋白抑制凋亡的潜在机制,同时也被称为人类免疫反应的中枢调节剂,在机体免疫应答、炎性反应、细胞增殖和凋亡等方面发挥着重要作用,是真核细胞基因转录中关键的调控因子[29,30]。NF-κB被激活后引起的细胞凋亡的抑制可能与病毒复制及病毒颗粒的包装释放有关。
本实验采用Western blot检测经药物处理后的HepG2.2.15细胞中NF-κB的抑制因子IκBα和其二聚体P65蛋白的表达情况,发现CH能上调HepG2.2.15细胞中IκBα的表达,减少P65蛋白入核,从而降低了NF-κB活性,提示CH诱导的细胞凋亡作用可能与其抑制HBX/NF-κB信号通路相关。但HBV感染是一个多步骤、多环节的慢性过程,从HBX/NF-κB信号通路角度探讨CH抗HBV复制和促细胞凋亡的作用,只是研究抗HBV药物机制中的一个点。CH对病毒编码的X蛋白转录和翻译环节的抑制作用以及对宿主细胞NF-κB信号通路下游相关凋亡因子的影响仍有待于进一步研究。
本实验室前期研究发现CH抗HBV的作用可能与其抑制宿主热应激同源蛋白70(heat stress cognate 70,Hsc70)的表达有关[20]。研究揭示NF-κB p65蛋白作为一种高度灵活的蛋白,不会固定某一状态,但是在NF-κB活化后具有承受动态变化的能力,而在这个过程中HSP70/HSC70家族发挥着重要作用,它能够控制蛋白重排的保真度,因此对HSP70/HSC70的药理学抑制能够影响p65触发基因的表达[31]。另外研究发现HSC70通过阻断IκBα的磷酸化减弱脂多糖(LPS)诱导的NF-κB亚基P65的核易位,以及抑制LPS所致的MAPKs的激活,发挥其抗炎作用,使机体能够抵御LPS导致的心肌和肝功能异常等问题[32]。那么在CH抗HBV作用中HSC70与HBX/NF-κB通路的关系,以及具体的信号转导机制及途径还需要进一步的实验研究。
综上所述,CH通过抑制HBX/NF-κB信号通路的活化,促进了细胞的凋亡,继而对病毒的复制及病毒颗粒包装释放起到了阻断作用,可能是其体外抗HBV的重要作用机制。该作用机制的揭示为CH临床应用提供理论及实验依据,同时为发现抗HBV药物作用靶点和开发高效低毒的新型药物提供了一定的基础。
[1] Schweitzer A,Horn J,Mikolajczyk RT,etal.Estimations of worldwideprevalence of chronic hepatitis B virus infection:a systematic review of datapublished between 1965 and 2013[J].Lancet,2015,386(1003):1546-1555.
[2] Kao JH.Hepatitis B vaccination and prevention of hepatocellular carcinoma[J].Best Pract Res Clin Gastroenterol,2015,29(6):907-917.
[3] Park IH,Kwon YC,Ryu WS,etal.Inhibition of hepatitis B virus replication by ligand-mediated activation of RNase L[J].Antivir Res,2014,104:118-127.
[4] Kao JH.HBeAg-positive chronic hepatitis B:why do I treat my patients with pegylated interferon?[J].Liver Int,2014,34(1):112-119.
[5] Liu Y,Wang C,Zhong Y,etal.Genotypic resistance profile of hepatitis B virus (HBV) in a large cohort of nucleos(t)ide analogue-experienced Chinese patients with chronic HBV infection[J].J Viral Hepat,2011,18(4):29-39.
[6] Lin CL,Yang HC,Kao JH.Hepatitis B virus:new therapeutic perspectives[J].Liver Int,2016,36(Suppl 1):85-92.
[7] Liu G,Wu D,Liang X,etal.Mechanisms and in vitro effects of cepharanthine hydrochloride:Classification analysis of the drug-induced differentially-expressed genes of human nasopharyngeal carcinoma cells[J].Oncol Rep,2015,34(4):2002-2010
[8] Hua P,Sun M,Zhang G,etal.Cepharanthine induces apoptosis through reactive oxygen species and mitochondrial dysfunction in human non-small-cell lung cancer cells[J].Biochem Biophys Res Commun,2015,460(2):136-142.
[9] Li H,Yan Z,Ning W,etal.Using Rhodamine 123 accumulationin CD8+ cells as a surrogate indicator to study the P-glycoproteinmodulating effect of cepharanthine hydrochlorideinvivo[J].J Biomed Biotechnol,2011,2011:281651.
[10] Rogosnitzky M,Danks R.Therapeutic potential of the biscoclaurine alkaloid,cepharanthine,for a range of clinical conditions[J].Pharmacol Rep,2011,63(2):337-347.
[11] Baba M,Okamoto M,Kashiwaba N,etal.Anti-HIV-1 activity and structure-activity relationship of cepharanoline derivatives in chronically infected cells[J].Antivir Chem Chemother,2001,12(5):307-312.
[12] Zhang CH,Wang YF,Liu XJ,etal.Antiviral activity of cepharanthine against severe acute respiratory syndrome coronavirus in vitro[J].Chin Med J (Engl),2005,118(6):493-496.
[13] Kudo K,Hagiwara S,Hasegawa A,etal.Cepharanthine exerts anti-inflammatory effects via NF-κB inhibition in a LPS-induced rat model of systemic inflammation[J].J Surg Res,2011,171(1):199-204.
[14] Huang H,Hu G,Wang C,etal.Cepharanthine,an alkaloid from Stephania cepharantha Hayata,inhibits the inflammatory response in the RAW264.7 cell and mouse models[J].Inflammation,2014,37(1):235-246.
[15] Ershun Z,Yunhe F,Zhengkai W,etal.Cepharanthine attenuates lipopolysaccaride-induced micemastitisby suppressing the NF-κB signaling pathway[J].Inflammation,2014,37(2):331-337.
[16] Kao MC,Yang CH,Chou WC,etal.Cepharanthinemitigates lung injury in lower limb ischemia-reperfusion[J].J Surg Res,2015,199(2):647-656.
[17] Samra YA,Said HS,Elsherbiny NM,etal.Cepharanthineand Piperine ameliorate diabetic nephropathy in rats:role of NF-κB and NLRP3 inflammasome[J].Life Sci,2016,157:187-199.
[18] Lucifora J,Arzberger S,Durantel D,etal.Hepatitis B virus X protein is essentialto initiate and maintain virus replication after infection[J].J Hepatol,2011,55(5):996-1003.
[19] 王晓,郑立运,赵志鸿,等.盐酸千金藤碱抗乙型肝炎病毒的体外实验研究[J].时珍国医国药,2010,21(12):3109-3111.
[20] Zhou YB,Wang YF,Zhang Y,etal.Invitroactivity of cepharanthine hydrochloride against clinical wild-type and lamivudine-resistant hepatitis B virus isolates[J].Eur J Pharmacol,2012,683(1-3):10-15.
[21] Slagle BL,Bouchard MJ.Hepatitis B virus X and regulation of viral gene expression[J].Cold Spring Harb Perspect Med,2016,6(3):a021402.
[22] Zhang XD,Wang Y,Ye LH.Hepatitis B virus X protein accelera-tes the development of hepatoma[J].Cancer Biol Med,2014,11(3):182-190.
[23] Belloni L,Pollicino T,De Nicola F,etal.Nuclear HBx binds the HBV minichromosome and modifies the epigenetic regulation of cccDNA function[J].Proc Natl Acad Sci USA,2009,106(47):19975-19979.
[24] 潘爱萍,黄古叶,陈晶,等.乙型肝炎病毒cccDNA与HBx蛋白在肝细胞性肝癌中表达的关系及意义[J].世界华人消化杂志,2009,17(7):712-715.
[25] Lin D,Nguyen NH,Hoang J,etal.Incidence of hepatocellular carcinoma(HCC) in a US cohort ofchronic hepatitis B (CHB)patients by age,gender,cirrhosis and antiviraltreatment status[J].Hepatology,2014,60:315A
[26] Gaggar A,Coeshott C,Apelian D,etal.Safety,tolerability andimmunogenicity of GS-4774,a hepatitis Bvirus-specific therapeutic vaccine,in healthysubjects:a randomized study[J].Vaccine,2014,32(39):4925-4931.
[27] Wei L,Zhu S,Ruan G,etal.Infectious bursal disease virus-induced activation of JNK signaling pathway is required for virus replication and correlates with virus-induced apoptosis[J].Virology,2011,420(2):156-163.
[28] Lamontagne J,Pinkerton M,Block TM,etal.Hepatitis B and hepatitis C virus replication upregulates serine protease inhibitor Kazal,resulting in cellular resistance to serine protease-dependent apoptosis[J].J Virol,2010,84(2):907-917.
[29] Sethi G,Sung B,Aggarwal BB.Nuclear factor-kappaB activation:from bench to bedside[J].Exp Biol Med (Maywood),2008,233(1):21-31.
[30] Sethi G,Ahn KS,Sung B,etal.Pinitol targets nuclear factor-kappaB activation pathway leading to inhibition of gene products associated with proliferation,apoptosis,invasion,and angiogenesis[J].Mol Cancer Ther,2008,7(6):1604-1614.
[31] Milanovic M,Kracht M,Schmitz ML.The cytokine-induced conformational switch of nuclear factor κB p65 is mediated by p65 phosphorylation[J].Biochem J,2014,457(3):401-413.
[32] Hsu JH,Yang RC,Lin SJ,etal.Exogenous heat shock cognate protein 70 pretreatment attenuates cardiac and hepatic dysfunction with associated anti-inflammatory responses in experimental septic shock[J].Shock,2014,42(6):540-547.
Effect of cepharanthine hydrochloride on HBX/NF-κB signal pathway of HepG2.2.15 cells
ZHANG Jingmin1,2,WEI Qingqing1,MA Lin1,LÜ Xiaorui1,JIANG Jinhua1,WANG Qingduan1*
(1HenanAcademyofMedicalandPharmaceuticalSciences,HenanKeyLaboratoryforPharmacologyofLiverDiseases,Zhengzhou450052,China;2DepartmentofPharmacy,FirstAffiliatedHospitalofZhengzhouUniversity;*Correspondingauthor,E-mail:wangqd@zzu.edu.cn)
ObjectiveTo investigate the effect of cepharanthine hydrochloride(CH) on HBX/NF-κB signal pathway of HepG2.2.15 cells stably expressing wide-type HBV.MethodsHepG2.2.15 cells were treated with different concentration of CH(2.5,5,10 μmol/L).Then the expression levels of X gene and X protein of HBV were detected by reverse thanscriptase polymerase chain reaction(RT-PCR) and enzyme-linked immunosorbent assay(ELISA),respectively.Flow cytometry method was used to detect the cell apoptosis rates.The expression levels of IκBα and P65 protein in HepG2.2.15 cells were detected by Western blot.ResultsCompared with HepG2.2.15 cells without CH treament(control group),the expression of X gene mRNA and X protein in HepG2.2.15 cells after treatment with CH(2.5,5,10 μmol/L) were significantly inhibited(P<0.05).The apoptosis retes of HepG2.2.15 cells were (11.9±1.21)%,(19.8±2.32)%,(29.3±1.27)% after treatment with 2.5,5,10 μmol/L CH for 48 h,respectively.CH increased apoptosis rates of HepG2.2.15 cells in a concentration-dependent manner.CH effectively up-regulated the protein expression of IκBα and down-regulated the expression of P65 protein(bothP<0.05).ConclusionCH can inhibit the activity of HBx/NF-κB signal pathway and increase cell apoptosis of HepG2.2.15 cells.
cepharanthine hydrochloride; hepatitis B virus; HBx; NF-κB; HepG2.2.15 cells
张晶敏,女,1986-09生,博士,主管药师, E-mail:jing2677594@163.com
2016-07-28
R512.6
A
1007-6611(2017)05-0409-06
10.13753/j.issn.1007-6611.2017.05.002

