高糖诱导H9C2大鼠心肌细胞线粒体功能障碍及其机制
左 军,吴 霞,汤之铭(陕西省第四人民医院内科,西安 7004;陕西省西北妇女儿童医院内科;西安市灞桥区人民医院内科;通讯作者,E-mail:070907@qq.com)
高糖诱导H9C2大鼠心肌细胞线粒体功能障碍及其机制
左 军1,吴 霞2*,汤之铭3
(1陕西省第四人民医院内科,西安 710043;2陕西省西北妇女儿童医院内科;3西安市灞桥区人民医院内科;*通讯作者,E-mail:1070907222@qq.com)
目的 观察高糖对H9C2大鼠心肌细胞线粒体功能的影响,以探讨高糖所致心肌病发生发展的分子机制。 方法 将H9C2大鼠心肌细胞分为低浓度组(含5 mmol/L葡萄糖),中浓度组(含15 mmol/L葡萄糖)和高浓度组(含30 mmol/L葡萄糖),实验干预12 h。CCK-8检测心肌细胞活力。JC-1检测心肌细胞线粒体膜电位。线粒体ROS荧光探针检测线粒体ROS水平。Western blot 检测心肌细胞Bcl-2、Bax、胞质内细胞色素C(Cyt C)及cleaved caspase-3表达水平。 结果 与低浓度组相比,中浓度组心肌细胞活力降低14.5%(P<0.05),高浓度组心肌细胞活力降低26.3%(P<0.01)。低浓度组心肌细胞维持较高线粒体膜电位水平,中浓度组及高浓度组心肌细胞线粒体膜电位明显降低。与低浓度组相比,中浓度组心肌细胞线粒体内ROS水平明显降低(P<0.05),高浓度组心肌细胞线粒体内ROS水平显著降低(P<0.01)。与低浓度组相比,中浓度组心肌细胞Bax/Bcl-2、胞质内Cyt C及cleaved caspase-3表达明显升高(P<0.05),高浓度组心肌细胞Bax/Bcl-2、胞质内细胞色素 C及cleaved caspase-3表达显著升高(P<0.01)。 结论 高糖导致心肌细胞线粒体功能障碍,促进了心肌细胞活力降低,可能是高糖所致心肌病分子机制之一。
高糖血症; H9C2; 心肌病; 线粒体功能障碍
高糖血症是独立于高脂血症、高同型半胱氨酸血症及高血压之外,直接影响心脏结构及功能的重要危险因素[1]。临床及基础研究均已证实,高糖能够直接引起心肌细胞功能障碍,导致心脏舒张期延长以及收缩力下降[2,3]。然而,高糖诱导心肌细胞损伤及功能障碍的分子机制尚不明确。线粒体是维持细胞存活的重要细胞器,各种原因导致的线粒体功能障碍是调节细胞凋亡的重要分子通路[4]。此外,线粒体是ROS产生的重要场所,线粒体功能障碍可导致细胞内ROS水平升高,加重氧化应激反应,损伤细胞结构及功能[5]。高糖是否诱导心肌细胞线粒体功能障碍,目前尚不明确。因此,本研究通过体外给予H9C2大鼠心肌细胞高糖刺激,观察其对心肌细胞线粒体功能的影响,以探讨糖尿病心肌病发生发展的分子机制。
1 材料和方法
1.1 细胞株与主要试剂
H9C2细胞系由中国科学院细胞库提供。DMEM培养基购自Gibco公司,胎牛血清购自杭州四季青生物有限公司,CCK-8细胞活力检测试剂盒购自南京建成生物有限公司,JC-1试剂盒及线粒体内ROS荧光探针购自碧云天生物有限公司,兔抗大鼠Bcl-2、Bax、细胞色素C、cleaved caspase-3及 actin抗体购自Abcam公司,辣根过氧化物酶标记羊抗兔IgG购自武汉博士德生物有限公司。
1.2 H9C2细胞培养及分组
H9C2心肌细胞接种于100 mm培养皿中,加入6 ml含10% FBS低糖DMEM培养基,于37℃,5% CO2培养箱中培养。细胞生长铺满皿底80%时,0.25%胰酶消化传代,接种于6孔板或96孔板,取对数生长期细胞进行实验。实验分为低浓度组(含5 mmol/L葡萄糖),中浓度组(含15 mmol/L葡萄糖)和高浓度组(含30 mmol/L葡萄糖),实验干预12 h。每组设4个复孔。实验重复3次。
1.3 H9C2心肌细胞活力检测
将细胞接种于96孔培养板,实验结束后,弃培养基,PBS洗3次,每孔加入100 μl不含血清的DMEM培养基,每孔再加入10 μl CCK8试剂,混匀后避光置于37 ℃,5% CO2培养箱中孵育45 min,Bio-Rad酶标仪470 nm处检测吸收光值。
1.4 H9C2心肌细胞线粒体膜电位检测
将细胞接种于10 mm培养皿中,实验结束后,弃培养基,冰1×JC-1缓冲液冲洗细胞3次,按说明配制JC-1工作液,每皿加入1 ml JC-1工作液,再加入1 ml DMEM培养基,避光于37 ℃,5% CO2培养箱中孵育25 min,使用预冷的1×JC-1缓冲液冲洗细胞3次。荧光显微镜下于红光及绿光通道处分别观察同一视野细胞红光及绿光荧光强度。红光强度与绿光强度的比为细胞线粒体膜电位的变化。
1.5 H9C2心肌细胞线粒体内ROS检测
将细胞接种于6孔板,实验结束后,弃培养基,使用Hank’s液冲液一遍,按1 ∶1 000将ROS探针加入至Hank’s中,混匀后加入6孔板中,每孔1 ml,避光于37 ℃,5% CO2培养箱中孵育15 min,荧光显微镜下于红光通道处观察荧光强度。
1.6 H9C2心肌细胞相关蛋白Western blot检测
取高糖干预后细胞,冰PBS冲洗3次,收集细胞,强裂解液(RIPA ∶PMSF=100 ∶1)冰上裂解细胞40 min,4 ℃ 12 000 r/min离心15 min,取上清,BCA蛋白定量后加入5×lodding buffer,100 ℃煮5 min。配制12%的SDS-PAGE分离胶,每泳道蛋白上样量为30 μg,电泳分离蛋白,将PAGE胶中蛋白转移至硝酸纤维素膜上,5%脱脂牛奶室温封闭60 min,放入稀释(1 ∶1 000)后的一抗中,4 ℃孵育过夜。TBST冲洗后将膜放入碱性磷酸酶标记的二抗中,室温孵育120 min,TBST冲洗后ECL显影,Image lab软件分析各条带吸光值,分析各组蛋白的相对表达水平。
1.7 统计学分析
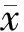
2 结果
2.1 高糖对H9C2心肌细胞活力的影响
CCK-8检测心肌细胞活力结果显示,低浓度组心肌细胞为98.7%,中浓度组心肌细胞活力约为84.2%,较低浓度组降低14.5%(P<0.05)。高浓度组心肌细胞活力约为72.4%,较低浓度组降低26.3%(P<0.01,见图1)。
与低浓度组比较,*P<0.05,**P<0.01图1 各组H9C2心肌细胞活力Figure 1 The cardiomyocytes viability in different groups
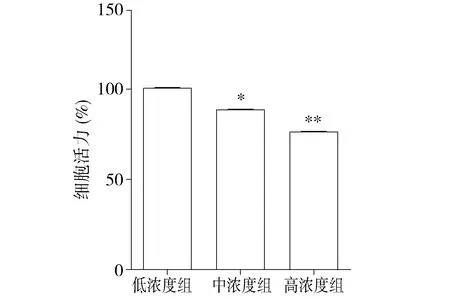
2.2 高糖对H9C2心肌细胞线粒体膜电位的影响
JC-1检测心肌细胞线粒体膜电位,红色荧光越强,表明细胞线粒体膜电位水平越高;绿色荧光增强,表明细胞线粒体膜电位水平越低。结果显示,低浓度组心肌细胞红色荧光较强,绿色荧光较弱。中浓度组心肌细胞红色荧光明显降低,绿色荧光明显增强。高浓度组含心肌细胞红色荧光显著降低,绿色荧光显著增强(见图2)。
红色荧光检测JC-1 聚合物,为较高线粒体膜电位水平;绿色荧光检测JC-1单体,为较低线粒体膜电位水平;融合体为红色与绿色荧光共定位图2 各组H9C2心肌细胞线粒体膜电位改变 (×40)Figure 2 The change of mitochondrial membrane potential of H9C2 cardiomyocytes in different groups (×40)
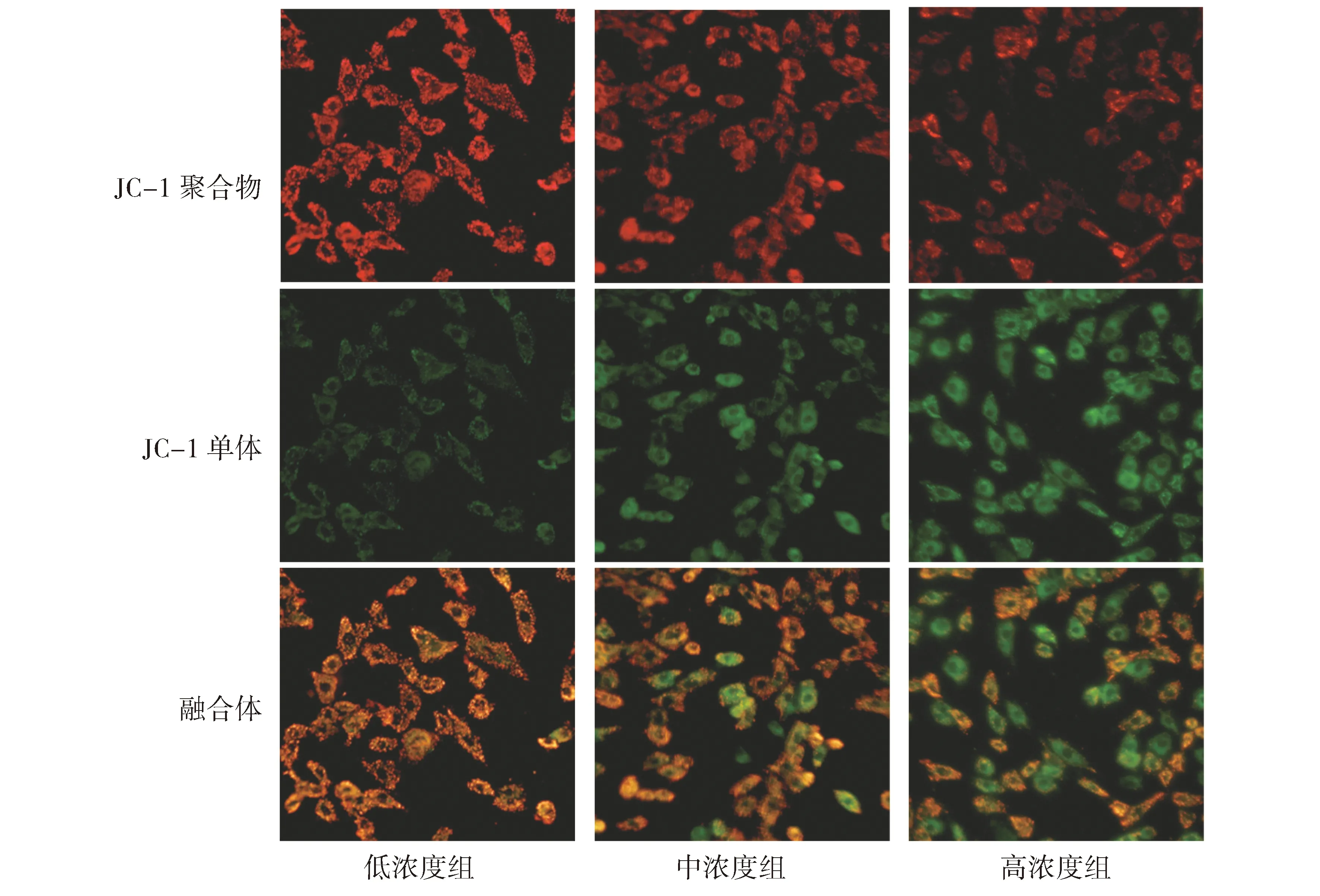
2.3 高糖对H9C2心肌细胞线粒体内ROS水平的影响
线粒体ROS荧光探针检测线粒体ROS水平,红色荧光强弱可显示线粒体ROS水平。结果显示,低浓度组红色荧光强度较弱;与低浓度组相比,中浓度组红色荧光明显增强(P<0.05);与低浓度组相比,高浓度组红色荧光显著增强(P<0.01,见图3)。
图3 各组H9C2心肌细胞线粒体内ROS水平变化(×40)Figure 3 The mitochondrial ROS level of H9C2 cardiomyocytes in different groups (×40)
2.4 高糖对H9C2心肌细胞线粒体凋亡途径相关蛋白表达的影响
Western blot 检测心肌细胞线粒体凋亡途径相关蛋白表达水平。结果显示,与低浓度组相比,中浓度组Bcl-2蛋白水平明显降低,Bax蛋白水平明显升高,Bax/Bcl-2水平明显升高(P<0.05);与低浓度组相比,高浓度组Bcl-2蛋白水平显著降低,Bax蛋白水平显著升高,Bax/Bcl-2水平显著升高(P<0.01)。与低浓度组相比,中浓度组胞质内细胞色素 C水平明显升高(P<0.05),cleaved caspas-3表达明显升高(P<0.05);与低浓度组相比,高浓度组组胞质内细胞色素 C水平显著升高(P<0.01),cleaved caspas-3表达显著升高(P<0.01,见图4)。
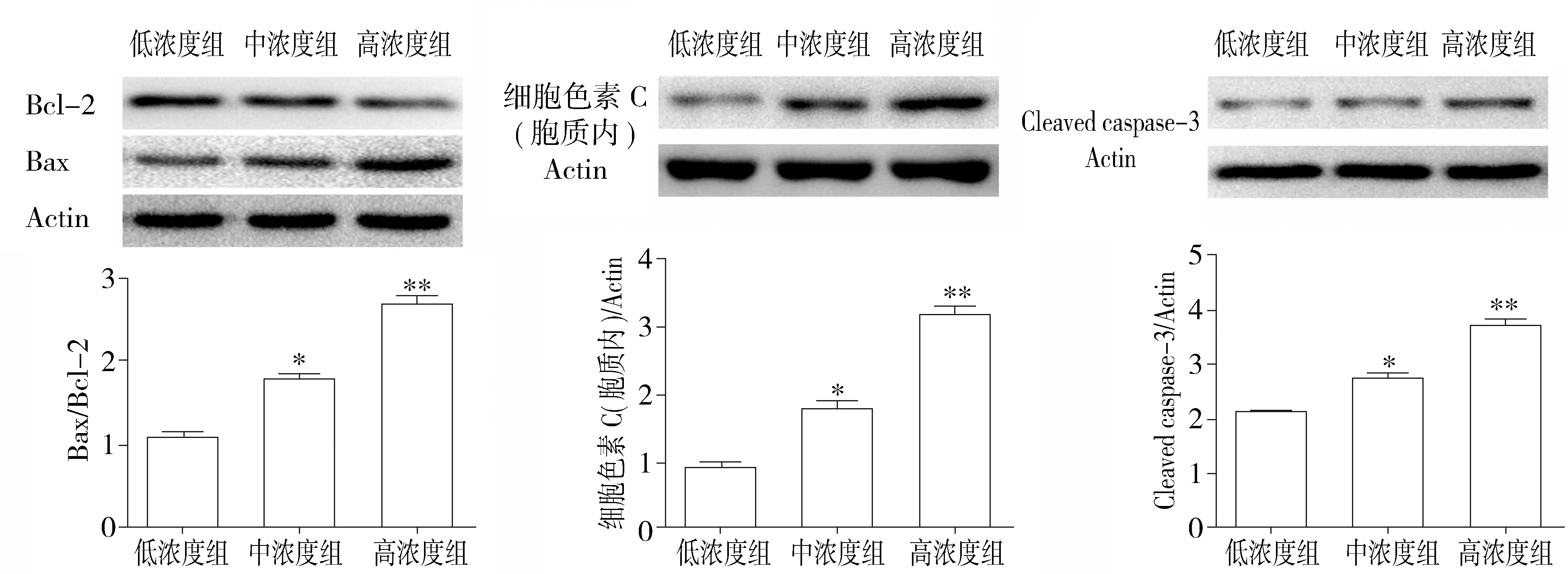
与低浓度组比较,*P<0.05,**P<0.01图4 各组H9C2心肌细胞Bcl-2、Bax、细胞色素C和cleaved caspase-3表达水平的变化Figure 4 The expression of Bcl-2,Bax,Cyt C,and cleaved caspase-3 in H9C2 cardiomyocytes in different groups
3 讨论
目前,随着生活水平的提高,糖尿病的发病率逐年增高,继发于糖尿病的心血管并发症—糖尿病心肌病已成为糖尿病患者死亡的主要原因之一。Framingham研究表明糖尿病患者心衰的发生率明显升高,其中男性患者增加2-3倍,女性患者较正常人增加5.1倍[6]。糖尿病心肌病的发病机制复杂,目前尚不明确。以往研究表明,高糖可诱导细胞内ROS水平升高,引起细胞内氧化应激反应,加重高糖对细胞损伤[7]。细胞内ROS主要来源于线粒体,且ROS是多种细胞内信号通路激活的启动因素,比如内质网应激、炎症因子激活及自噬等[8,9]。我们的研究表明,随葡萄糖干预浓度升高,线粒体内ROS水平明显升高,细胞活力明显下降,提示ROS水平的升高可能与细胞活力下降有关,该结果可能有助于揭示高糖诱导心肌细胞损伤的原因。
线粒体是心肌细胞维持存活的重要细胞器。线粒体功能的失衡可直接导致细胞凋亡事件的发生。以往研究表明,细胞内ROS水平升高是造成线粒体功能下降的主要原因,可导致线粒体膜通透性改变,细胞色素C由线粒体释放至胞质,激活凋亡执行蛋白caspase-3,启动caspase依赖的级联凋亡反应[10,11]。本研究表明,随葡萄糖干预浓度的升高,线粒体内ROS水平升高,线粒体膜电位水平下降。线粒体维持较高的膜电位对细胞存活起至关重要的作用,高糖可导致心肌细胞线粒体膜电位水平明显降低,是细胞早期凋亡发生的标志性事件。其次,高糖干预导致心肌细胞Bcl-2表达明显降低,Bax表达明显升高,胞质内细胞色素C水平明显升高。Bcl-2主要定位于线粒体外膜,调控线粒体通透性的改变,Bcl-2表达的降低可导致线粒体膜通透性升高,这是细胞色素C释放至胞质的主要原因。以往研究报道,细胞色素C由线粒体释放至胞质可激活caspase-3,caspase-3的激活直接启动了细胞凋亡程序[12]。本研究显示,随胞质细胞色素C水平升高,cleaved caspase-3表达水平明显升高,提示高糖所致心肌细胞caspase-3的激活可能直接导致了细胞死亡事件的发生。
综上所述,高糖诱导H9C2心肌细胞线粒体内ROS水平升高,造成线粒体功能受损,细胞色素C释放至胞质,最终激活casapase依赖的级联凋亡途径。高糖诱导的线粒体功能失衡可能促进了心肌细胞凋亡事件的发生,这可能是高糖诱导心肌细胞受损的分子机制之一。本研究可能为糖尿病心肌病的发生发展提供理论依据。
[1] Armstrong AC,Ambale-Venkatesh B,Turkbey E,etal.Association of cardiovascular risk factors and myocardial fibrosis with early cardiac dysfunction in type 1 diabetes: the diabetes control and complications trial/epidemiology of diabetes interventions and complications study[J].Diabetes Care,2016,40(2):1889.
[2] Loncarevic B,Trifunovic D,Soldatovic I,etal.Silent diabetic cardiomyopathy in everyday practice: a clinical and echocardiographic study[J].BMC Cardiovasc Disord,2016,16(1):242.
[3] Gonzalo-Calvo D,Kenneweg F,Bang C,etal.Circulating long-non coding RNAs as biomarkers of left ventricular diastolic function and remodelling in patients with well-controlled type 2 diabetes[J].Sci Rep,2016,6:37354.
[4] Asghari MH,Abdollahi M,de Oliveira MR,etal.A review of the protective role of melatonin during phosphine-induced cardiotoxicity: focus on mitochondrial dysfunction,oxidative stress and apoptosis[J].J Pharm Pharmacol,2016,8(10):314-319.
[5] Faria A,Persaud SJ.Cardiac oxidative stress in diabetes: Mechanisms and therapeutic potential[J].Pharmacol Ther,2016,16(5): 163-167.
[6] Mizamtsidi M,Paschou SA,Grapsa J,etal.Diabetic cardiomyopathy: a clinical entity or a cluster of molecular heart changes?[J].Eur J Clin Invest,2016,46(8):947-953.
[7] Koncsos G,Varga ZV,Baranyai T,etal.Diastolic dysfunction in prediabetic male rats: role of mitochondrial oxidative stress[J].Am J Physiol Heart Circ Physiol,2016,311(4):H927-H943.
[8] Victor VM,Rocha M,Herance R,etal.Oxidative stress and mitochondrial dysfunction in type 2 diabetes[J].Curr Pharm Des,2011,17(36):3947-3958.
[9] Han S,Wu H,Li W,etal.Protective effects of genistein in homocysteine-induced endothelial cell inflammatory injury[J].Mol Cell Biochem,2015,403(8):43-49.
[10] Martín-Fernndez B,Gredilla R.Mitochondria and oxidative stress in heart aging[J].Age (Dordr),2016,38(4):225-238.
[11] Suhm T,Ott M.Mitochondrial translation and cellular stress response[J].Cell Tissue Res,2016,18(6):200-206.
[12] Zhu LZ,Hou YJ,Zhao M,etal.Caudatin induces caspase-dependent apoptosis in human glioma cells with involvement of mitochondrial dysfunction and reactive oxygen species generation[J].Cell Biol Toxicol,2016,32(4):333-345.
High glucose induces mitochondrial dysfunction in H9C2 rat cardiomyocytes
ZUO Jun1,WU Xia2*,TANG Zhiming3
(1DepartmentofInternalMedicine,FourthPeople’sHospitalofShaanxiProvince,Xi’an710043,China;2DepartmentofInternalMedicine,NorthwestWomenandChildrenHospitalofShaanxiProvince;3DepartmentofInternalMedicine,People’sHospitalofBaqiaoDistrictofXi’anCity;*Correspondingauthor,E-mail:1070907222@qq.com)
ObjectiveTo explore the effect of high glucose on mitochondrial dysfunction in H9C2 rat cardiomyocytes and the molecular mechanism of high glucose-related cardiomyopathy.MethodsH9C2 rat cardiomyocytes were divided into low concentration group(5 mmol/L glucose),moderate concentration group(15mmol/L glucose) and high concentration group(30 mmol/L glucose).After treatment with glucose for 12 h,the cell viability was measured by CCK-8,the level of mitochondrial ROS was detected by mitochondrial ROS fluorescence probe,the mitochondrial membrane potential was examined by JC-1,and the related proteins levels in H9C2 rat cardiomyocytes were analyzed by Western blot.ResultsCompared with low concentration group,the cellular viability decreased by 14.5 percentage in moderate concentration group(P<0.05) and 26.3 percentage in high concentration group(P<0.01).Compared with low concentration group,the level of mitochondrial ROS was increased in moderate concentration group(P<0.05) and high concentration group(P<0.01).Mitochondrial membrane potential of H9C2 rat cardiomyocytes maintained a high level in low concentration group,while mitochondrial membrane potential significantly decreased in moderate concentration group and high concentration group.Compared with control group,the expression of Bax/Bcl-2,cytoplasmic Cyt C and cleaved caspase-3 were significantly increased in moderate concentration group(P<0.05) and high concentration group(P<0.01).ConclusionHigh glucose-induced mitochondrial dysfunction may contribute to the decrease of cellular viability,suggesting that the mitochondrial dysfunction induced by high glucose might be responsible for the development of high glucose-related cardiomyopathy.
high glucose; H9C2; cardiomyocytes; mitochondria dysfunction
陕西省科学技术攻关课题资助项目(2010K 18-H1-6)
左军,男,1976-生,硕士,主治医师,E-mail:244059348@qq.com
2016-12-29
R589.1
A
1007-6611(2017)05-0405-05
10.13753/j.issn.1007-6611.2017.05.001

