黄瓜Ca2+家族序列特征及其表达特性分析
盛 慧,杜伟玲
(哈尔滨市农业科学院生物中心,黑龙江 哈尔滨 150029)
黄瓜Ca2+家族序列特征及其表达特性分析
盛 慧,杜伟玲
(哈尔滨市农业科学院生物中心,黑龙江 哈尔滨 150029)
通过黄瓜基因组数据库,采用生物信息学方法获得15个黄瓜Ca2+家族序列,并对其染色体位置、基因组位置、氨基酸长度、转录起始位点和Pfam匹配结构域数进行预测;利用RT-PCR方法对所有搜索到的Ca2+家族基因进行组织特异性分析;对黄瓜植株进行低温处理,分析黄瓜Ca2+基因家族的表达情况。结果显示:15个基因中除Csa021245未定位以外,其余均匀分布在1~6号染色体上,一致性为47.67%;Csa001688、Csa009857和Csa009360 等3个基因的5′区出现CpG岛结构;组织表达特异性分析结果显示,Csa001688、Csa006826、Csa010172和Csa016434在叶中表达量最高,Csa003758、Csa010172 和Csa018949在根中表达量最高;进化树分析结果显示,只有Csa010172和Csa009360与拟南芥AtACA2亲缘关系最近,这些基因可能在Ca2+家族信号传导过程中起着主要作用;实时定量表达分析表明,Ca2+基因家族参与黄瓜对低温胁迫的应答。
黄瓜;Ca2+家族;组织特异性;信号传导
植物感受外界逆境反应的传导途径和传导方式一直备受关注。Ca2+作为胞内的第二信使,参与许多细胞的调控和基因转录[1-3],在植物对各种逆境信号的转导[4-7]中起着重要作用。董先平等[8]认为,在生物进化过程中,真核细胞形成了一套包括离子通道、离子泵和离子交换体等复杂的Ca2+转运系统,用来维持胞质中的Ca2+平衡。细胞内的Ca2+信号传导主要是通过钙结合蛋白将信息传递给下游基因。孙存华等[9]研究表明,逆境胁迫如干旱、低温、热激等都可诱发植物细胞产生Ca2+信号及相应的生理生化反应。Roberto等[10]认为在寄主植物中,细胞内钙离子变化是一个组成部分的信号机制。Christoph[11]也证实在植物体内,细胞与细胞间的信号传递最快、最有效的途径是电信号,这与瞬间改变的Ca2+浓度是紧密相连的。植物对细胞内Ca2+浓度的调节依赖于定位在不同细胞器和质膜上的Ca2+通道、Ca2+泵和Ca2+/H+反转运子的活性[12-13]。Lourido等[14]研究表明,在细胞中与钙离子结合的信号元件主要包括响应元件和传感元件两类蛋白。响应元件与钙离子结合后能直接产生信号效果,因此既是钙信号的感应器又是钙信号的效应器,主要是一些钙依赖蛋白激酶类蛋白[15-16]。它们既含有类似于钙调蛋白的与钙离子结合的结构域,也含有蛋白激酶的结构域。传感元件与钙离子结合后还必须与目标蛋白相互作用才能产生信号效果,目前已经鉴定出包括钙调素、钙调磷酸酶B类似蛋白等多类钙结合蛋白家族[17]。总之,Ca2+在植物生长发育、器官分化以及生理代谢方面都起到至关重要的作用。目前在拟南芥中已发现14个Ca2+泵基因,但大部分功能还不清楚。
目前,黄瓜基因组测序已经完成,但后续的功能验证及基因之间的相互作用关系尚不完善。为了鉴定黄瓜基因组中Ca2+家族成员,本研究根据拟南芥Ca2+泵基因ACA2的完整序列搜索黄瓜基因组数据库,以期得到黄瓜基因组中与Ca2+有关的所有基因;对获得的所有Ca2+家族基因进行生物信息学分析和组织表达特异性分析,并分析低温处理下黄瓜Ca2+基因家族的表达情况,为后续信号传导机制的研究奠定基础。
1 材料与方法
1.1 试验材料
密刺型黄瓜品种M801-3,由哈尔滨市农业科学院黄瓜育种试验室提供。黄瓜总RNA 的提取使用TaKaRa公司的RNAiso Plus and RNAisomate for Plant Tissue 试剂盒,mRNA 的分离、纯化使用A.P mRNA Purification Kit。SYBR PrimeScript RT-PCR试剂盒、PCR相关试剂均购自宝生物工程(大连)有限公司。LineGene 9620型实时荧光PCR仪购自杭州博日科技有限公司。
1.2 试验方法
1.2.1 RNA提取及mRNA分离 选取经低温处理[18]的黄瓜根、茎和叶组织样,液氮处理后置于-70℃中保存备用。总RNA 的提取、mRNA的分离、纯化按照试剂盒说明书操作,mRNA纯化后检测样品的浓度及纯度。
1.2.2 黄瓜Ca2+基因家族搜索及其生物信息学分析 依据拟南芥Ca2+家族蛋白质序列,反复检索黄瓜基因组数据库(http://www.icugi.org/ cgi-bin/ICuGI/tool/blast.cgi),经过BLASTX筛选共得到15个黄瓜Ca2+家族序列。利用黄瓜基因组数据库确定基因在染色体上的位置,并利用DNAman 6.0 软件对上述基因的氨基酸序列进行比对。
1.2.3 组织表达特异性分析 利用Primer Premier 5.0 设计特异引物,分析上述基因在黄瓜根、茎和叶中的表达情况。PCR反应体系为:10 × PCR Buffer 2.0 μL,dNTP 1.0 μL,上下游引物 各 1.0 μL,Taq 酶0.2 μL,2.5 mmol/L MgCl22.0 μL,模板 1.0 μL,无菌去离子水补足到15 μL。PCR反应条件依据退火温度而定,循环次数均为31个,具体引物序列详见表1。
1.2.4 低温处理下Ca2+基因家族的表达分析 将具有2~3片真叶的黄瓜植株,在4℃下处理0、2、4、12、24 h。叶片-80℃保存,用于总RNA提取。选取Csa001688进行实时定量PCR分析。利用LineGene 9620型实时荧光PCR仪,采用两步法,在60℃进行荧光信号采集,反应结束后绘制曲线图。
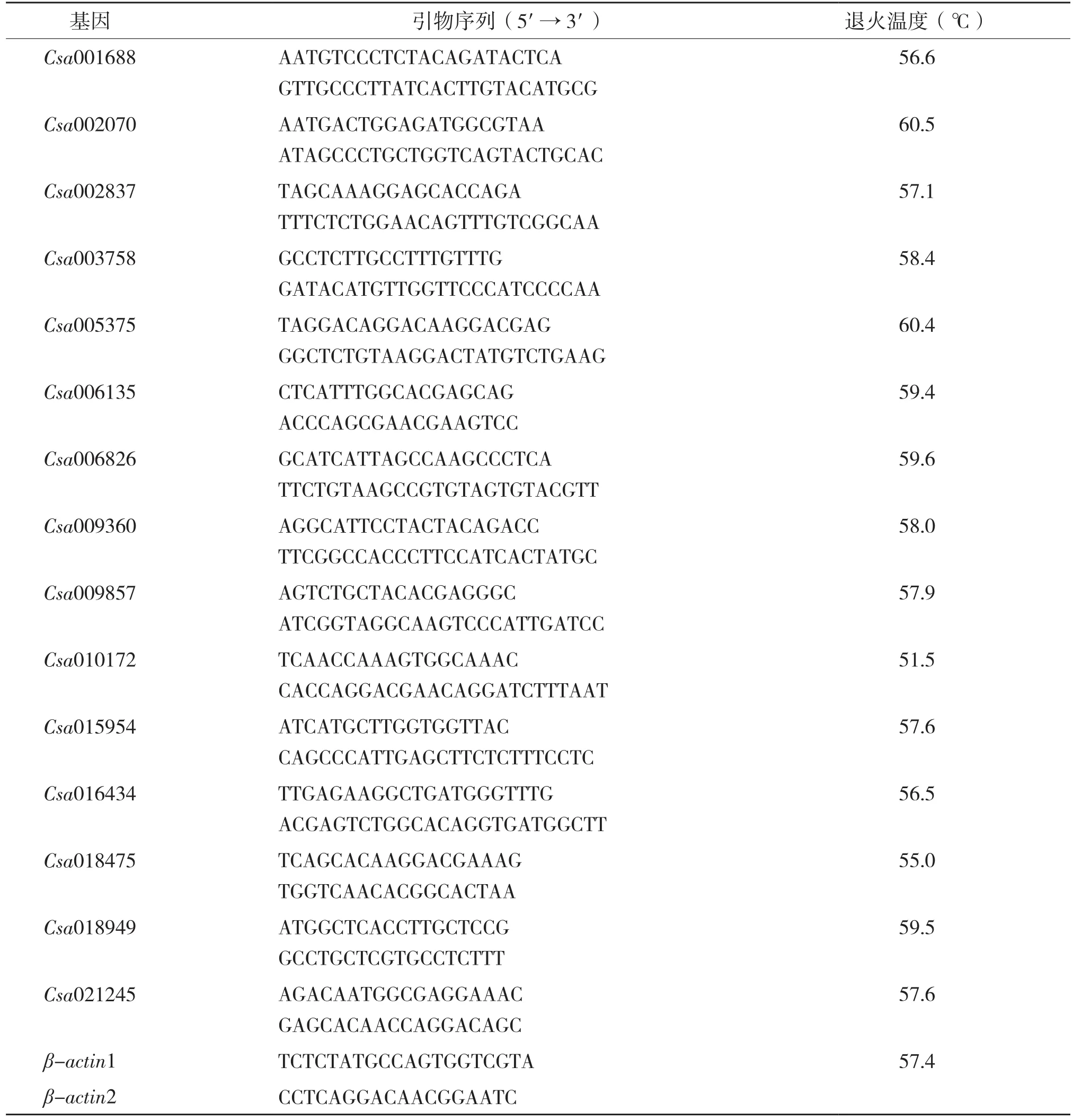
表1 引物序列及退火温度
2 结果与分析
2.1 黄瓜Ca2+基因家族序列生物信息学分析
利用网站上发布的拟南芥Ca2+基因家族蛋白质序列(NM_119927.3)反复搜索黄瓜基因组数据库,共得到15个相关基因。其中,有5个序列分布于第1条染色体上,3个序列分布于第2条染色体上,2个序列分布于第4条染色体上,1个序列尚未定位,其余序列分布见表2,一致性为47.67%,Csa001688、Csa009857和Csa009360等3个基因的5′区出现CpG岛结构。
2.2 候选基因序列比对
利用DNAMAN6.0对拟南芥和黄瓜中的Ca2+基因家族氨基酸序列进行同源性比对,结果(图1,封二)表明,Csa002070、Csa002837、Csa003758、Csa005375、Csa015954、Csa016434、Csa018475和Csa018949同源性较高;Csa010172与拟南芥同源性最高;Csa009360与其他氨基酸序列差异最大,不具有全部保守序列结构域;Csa009857所编码的氨基酸只具备Ca2+基因家族部分功能。
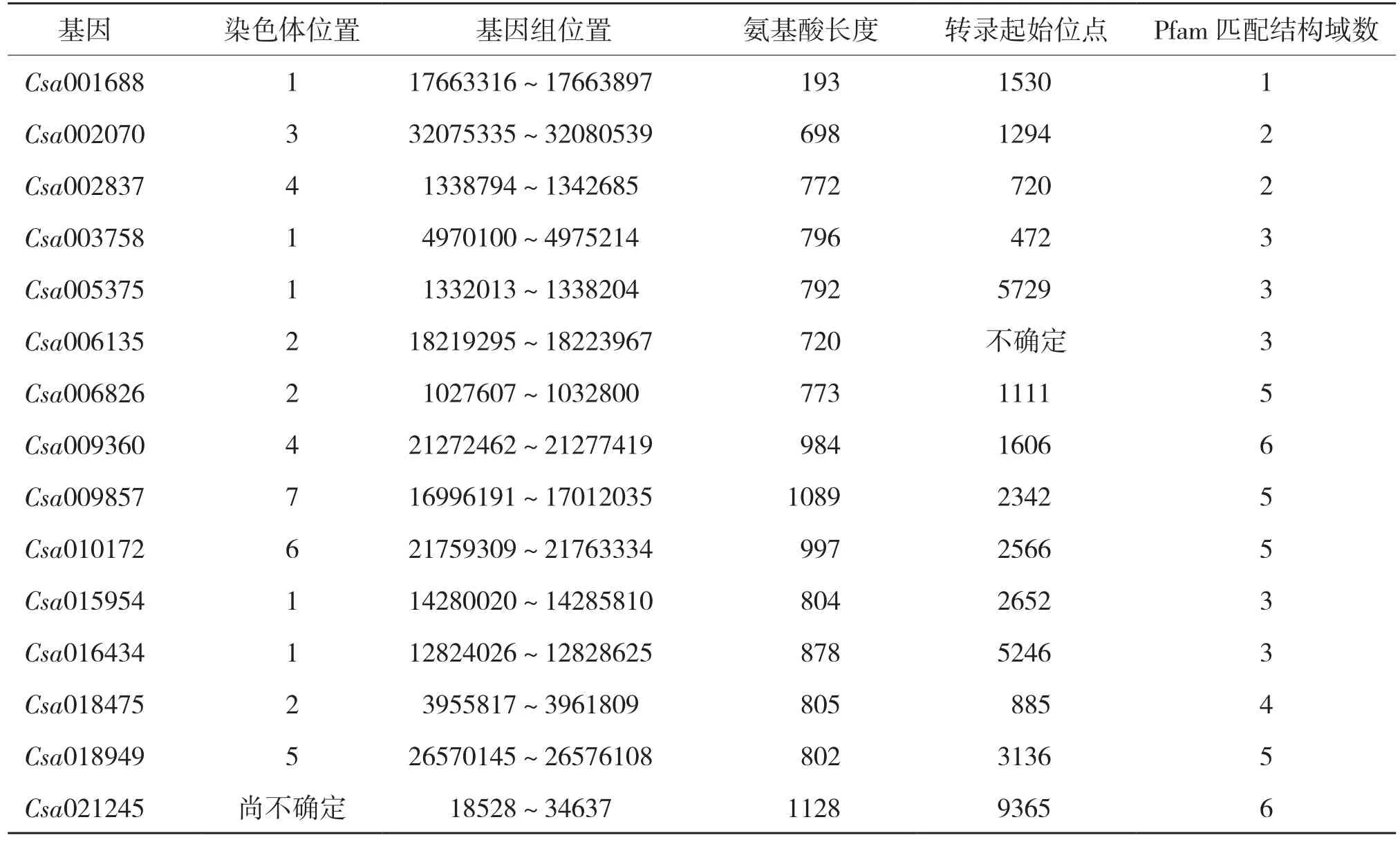
表2 黄瓜Ca2+基因家族生物信息学分析结果
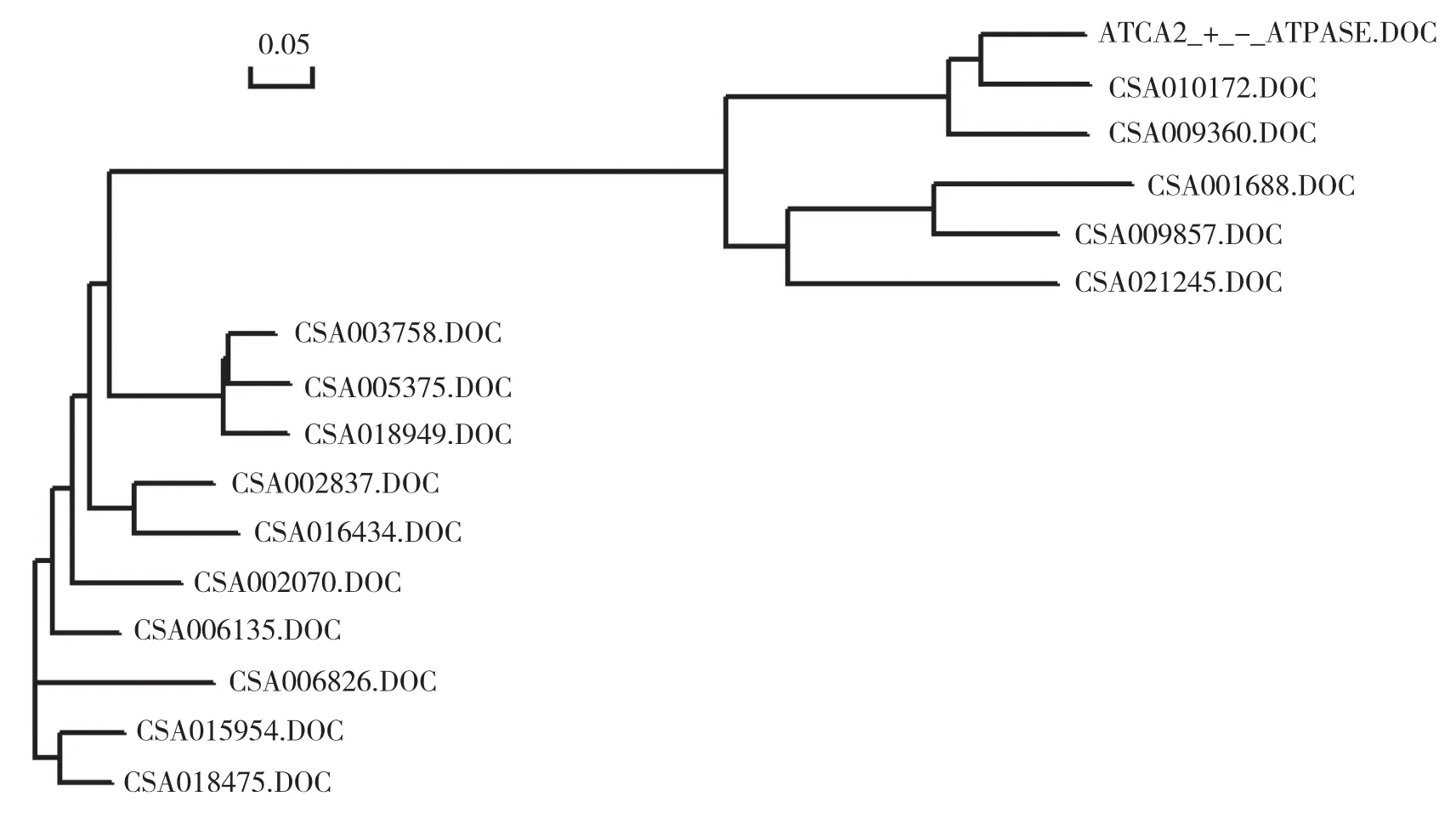
图2 黄瓜Ca2+家族成员与拟南芥蛋白的进化树
2.3 黄瓜Ca2+基因家族进化树分析
用DNAMAN6.0 软件将黄瓜15个Ca2+家族蛋白序列与拟南芥AtACA2构建系统进化树进行聚类分析。从图2可以看出,黄瓜Ca2+基因家族蛋白主要分为两类,其中Csa010172和Csa009360与拟南芥AtACA2亲缘关系最近,Csa001688、Csa009857和Csa021245与拟南芥AtACA2关系稍远,其他Ca2+基因家族蛋白成员聚集在一起。
2.4 黄瓜Ca2+基因家族组织表达特异性分析
对15个黄瓜Ca2+基因家族进行组织表达特异性分析。从图3(封二)可以看出,Csa003758、Csa006135、Csa010172、Csa018475和Csa018949等5个基因在根、茎和叶中均有表达,其中Csa003758在叶中的表达量远远高于茎和根,Csa006135在根中的表达量较低;Csa009360和Csa009857在所有组织中均无表达;Csa001688、Csa002070、Csa005375和Csa016434只在叶片中有表达;Csa002837和Csa021245在叶和茎中有表达,且表达量相近;Csa015954在叶和根中均有表达,在根中的表达量较弱,茎中未见。
2.5 低温处理下黄瓜Ca2+基因家族表达分析
试验选取Csa001688进行实时定量PCR分析,结果(图4)显示,Csa001688基因在4℃处理12 h的表达量达到最高峰,处理24 h时表达量出现急剧下降,表明Csa001688基因参与低温胁迫的应答。

图4 低温胁迫下Csa001688基因的实时定量表达分析
3 结论与讨论
Ca2+作为细胞信使的基础是胞浆Ca2+与胞内钙库之间存在浓度梯度,当某种刺激使胞内Ca2+浓度大幅度增加时,就会产生信号传导[19-21]。在植物细胞中,Ca2+与其他离子有着本质区别,Ca2+不可移动,它不能从老的叶片撤离而补充到新生的年轻细胞中,因此Ca2+必须不断补充到年轻细胞的胞内Ca2+贮存库,特别是茎尖和根尖分生区和伸长区细胞。Ca2+泵(Ca2+- ATPase) 属于P-型ATPase家族,直接利用ATP驱动离子转运[22-24]。目前在拟南芥中已发现14种Ca2+泵,大部分功能还不清楚。
本研究利用测序已完成的黄瓜基因组数据库,以拟南芥Ca2+泵基因ACA2的完整序列为模板,共得到15个黄瓜Ca2+基因家族成员。经过生物信息学分析可知,成员内部之间存在高度保守序列,且序列一致性为47.67%。15个基因中除Csa021245未定位以外,其余均匀分布在1~6号染色体上;进化树分析结果显示,只有Csa010172和Csa009360与拟南芥AtACA2亲缘关系最近;Csa009360和Csa009857在根、茎和叶中均未检测到表达,可能与低温诱导的时间有关或只在花和果实等部位特异表达。15个基因中,除Csa009360和Csa009857外,其余13个基因均在叶中有表达,推测叶片对于外界刺激最为敏感,茎部次之,根部最差。但是这13个基因如何参与逆境调控还有待进一步探讨。试验选取Csa001688进行实时定量PCR分析,结果显示,Csa001688基因在低温4℃处理12 h时达到表达最高峰,表明Csa001688基因参与低温胁迫的应答。
[1]赵昕,裴真明,何奕昆. 胞外Ca2+信号—— 动植物中的第一信使[J]. 遗传,2007,29(3):269-275.
[2]Kubota Y,Waxham M N.Lobe Specific Ca2+-Calmodulin Nano-Domain in Neuronal Spines:A Single Molecule Level Analysis[J]. PLoS Comput Biol,2010,6(11):e1000987.
[3]Foskett J K,White C,Cheung K H,et al. Inositol Trisphosphate Receptor Ca2+Release Channels[J]. Physiol Rev,2007,87(2):593-658.
[4]Anireddy S N R,Gul S A,Helena C,et al. Coping with Stresses:Roles of Calcium- and Calcium/Calmodulin-Regulated Gene Expression[J]. Plant Cell,2011,23(6):2010-2032.
[5]郭静,蒲咏梅,张东才. 钙离子信号与细胞凋亡[J]. 生物物理学报,2005,21(1):1-18.
[6]Nomura H,Komori T,Kobori M,et al. Evidencefor chloroplast control of external Ca2+-induced cytosolic Ca2+transients and stomatal closure[J]. Plant J,2008,53(6):988-998.
[7]Lemtiri-Chlieh F,MacRobbie E A,Webb A A,et al. Inositol hexakisphosphate mobilizes an endomembrane store of calcium in guard cells[J]. Proc Natl Acad Sci USA,2003,100(17):10091-10095.
[8]董先平,智刚,徐天乐. 钙调素参与离子通道和受体功能的调控[J]. 自然科学进展,2002,12(3):232-239.
[9]孙存华,李扬,贺鸿雁,等. 藜对干旱胁迫的生理生化反应[J]. 生态学报,2005,25(10):2556-2561.
[10]Roberto M,Sara A,Andrea S,et al. Evidence for calcium-mediated perception of plant symbiotic signals in aequorin-expressing Mesorhizobium loti[J]. BMC Microbiol,2009,9:206.
[11]Christoph P. Signal percolation through plants and the shape of the calcium signature[J]. Plant Signal Behav,2010,5(4):379-385.
[12]朱炜,魏建民,乌日罕. 拟南芥Ca2+泵基因ACA2的RNAi载体的构建及转基因植株的筛选[J].内蒙古农业大学学报(自然科学版),2008,29(4):142-145.
[13]Gabriele B M,Tatiana N B,Manfred H W,et al.Ca2+Regulates Reactive Oxygen Species Production and pH during Mechanosensing in Arabidopsis Roots[J]. Plant Cell,2009,21(8):2341-2356.
[14]Lourido S,Shuman J,Zhang C,et al. Calciumdependent protein kinase 1 is an essential regulator of exocytosis in Toxoplasma[J]. Nature,2010,465(7296):359-362.
[15]Lidia C S,Jorge G A,Paola B,et al. A rice calcium-dependent protein kinase is expressed in cortical root cells during the presymbiotic phase of the arbuscular mycorrhizal symbiosis[J]. BMC Plant Biology,2011,11:90.
[16]Zou J J,Wei F J,Wang C,et al. Arabidopsis Calcium-Dependent Protein Kinase CPK10 Functions in Abscisic Acid- and Ca2+-Mediated Stomatal Regulation in Response to Drought Stress[J]. Plant Physiol,2010,154(3):1232-1243.
[17]Manceva S,Lin T M,Pham H,et al. Calcium Regulation of Calmodulin Binding to and Dissociation from the Myo1c Regulatory Domain[J]. Biochemistry,2007,46(42):11718-11726.
[18]周艳红,喻景权,钱琼秋,黄黎锋.低温弱光对黄瓜幼苗生长及抗氧化酶活性的影响[J].应用生态学报,2003,14(6):921-924.
[19]张国增,白玲,宋纯鹏. 低温胁迫下拟南芥CBF1超表达突变体胞质中Ca2+浓度的变化[J]. 植物学报,2009,44(3):283-289.
[20]Conn S J,Gilliham M,Athman A,et al. Cell-Specific Vacuolar Calcium Storage Mediated by CAX1 Regulates Apoplastic Calcium Concentration,Gas Exchange,and Plant Productivity in Arabidopsis[J]. Plant Cell,2011,23(1):240-257.
[21]Vadassery J,Oelmüller R.Calcium signaling in pathogenic and beneficial plant microbe interactions[J]. Plant Signal Behav,2009,4(11):1024-1027.
[22]杨凤娟,魏珉,苏秀荣,等. 不同浓度NO3-胁迫下黄瓜幼苗根系分生区细胞内Ca2+分布变化的差异[J]. 园艺学报,2009,36(9):49-56.
[23]刘贯山,陈珈. 钙依赖蛋白激酶(CDPKs)在植物钙信号转导中的作用[J]. 植物学通报,2003,20(2):160-167.
[24]毛国红,宋林霞,孙大业. 植物钙调素结合蛋白研究进展[J]. 植物生理与分子生物学学报,2004,30(5):481-488.
(责任编辑 崔建勋)
Analysis on sequence characteristics and expression of Ca2+family of cucumber
SHENG Hui,DU Wei-ling
(Biological Center,Harbin Academy of Agricultural Sciences,Harbin 150029,China)
Fifteen sequences of Ca2+family in cucumber were indentified from Cucumber Genome Database using bioinformatics methods,and the chromosomal location,genomic position,amino acid length,transcription initiation site and Pfam matching domain were predicted. At the same time,sequence similarity and phylogenetic tree were analyzed. Cucumber plants were exposed to low temperature,and the expression of Ca2+gene family was analyzed. The results showed that 5 sequences distributed on the first chromosome,3 sequences distributed on the second chromosome,2 sequences distributed on the fourth chromosome,1 sequence was not located,the remaining sequences evenly distributed on other chromosomes. With RT-PCR technique,the expressions of Csa001688,Csa006826,Csa010172 and Csa016434 in leaves were higher, the expressions of Csa003758,Csa010172 and Csa018949 in roots were higher. Phylogenetic tree analysis showed that,only Csa010172 and Csa009360 were close with Arabidopsis AtACA2,these genes may play important roles in Ca2+family signal transduction. Real - time quantitative expression analysis showed that Ca2+gene family was involved response to low temperature stress in cucumber.
cucumber; Ca2+family; tissue specificity; signal transduction
S642.2;Q786
A
1004-874X(2017)03-0061-06
2016-12-25
哈尔滨市科技攻关计划项目(2006HE6BE052)
盛慧(1976-),女,博士,高级农艺师,E-mail:shenghui415128@163.com
盛慧,杜伟玲.黄瓜Ca2+家族序列特征及其表达特性分析[J].广东农业科学,2017,44(3):61-66.

