TERT基因转染BMSC血管性痴呆大鼠记忆功能及海马CA1区突触可塑性的影响*
段金旗,马丽琼,刘远林,任 炜,陈媛媛,李春岩
(1.张家口学院医学院,河北张家口 075000;2.解放军251医院重症医学科,河北张家口 075000;3.河北医科大学第二医院神经内科,石家庄 050000)
·论 著·
TERT基因转染BMSC血管性痴呆大鼠记忆功能及海马CA1区突触可塑性的影响*
段金旗1,马丽琼2,刘远林1,任 炜1,陈媛媛1,李春岩3
(1.张家口学院医学院,河北张家口 075000;2.解放军251医院重症医学科,河北张家口 075000;3.河北医科大学第二医院神经内科,石家庄 050000)
目的 探讨端粒酶逆转录酶(TERT)基因转染骨髓基质干细胞(BMSC)对血管性痴呆大鼠记忆功能及海马CA1区突触可塑性的影响。方法 60只大鼠随机分为阴性对照组(A组)、模型组(B组)、常规BMSC组(C组)和转染BMSC组(D组);采用Morris迷宫测试、RT-PCR和蛋白免疫印迹法检测各组大鼠相关指标。结果 C组、D组逃避潜伏期显著长于B组;D组逃避潜伏期显著长于B组。与A组比较,B组、C组、D组脑源性神经营养因子(BDNF) mRNA、TERT mRNA、突触前区突触素(SYP)mRNA及蛋白表达均显著降低,A组大鼠突触间隙排列清晰,SYN阳性细胞数较多;D组突触间隙更为清晰,SYN阳性细胞数量和突出间隙排列结构都接近于A组。结论 TERT转染BMSC对血管性痴呆大鼠的治疗作用明显,其作用机制与促进BDNF、TrkB表达、改善突触的可塑性有关。
端粒酶逆转录酶;骨髓基质干细胞;痴呆,血管性;记忆功能;突触;可塑性
血管性痴呆(vascular dementia,VD)是脑血管病所诱发的智力损害,目前VD已经成为老年期痴呆的主要病因之一[1-2]。骨髓基质干细胞(bone marrow stem cell,BMSC)具有促进神经元细胞分化能力,是一种理想的种子细胞[3]。有报道称对脑缺血大鼠移植BMSC能够促进脑组织重塑和血管再生[4];然而在移植BMSC过程中常发生BMSC衰老、凋亡以及增殖不稳定情况,表现为突触前区突触素(synaptophysin,SYP)数量、密度显著降低,这可能与端粒酶活性降低有关[5]。鉴于此,本研究将端粒酶逆转录酶(telomerase reverse transcriptase,TERT)转染的BMSC移植至VD大鼠中,观察大鼠的行为学及海马CA1区SYP、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)其受体酪氨酸激酶受体B(tyrosine kinase B,TrkB)变化水平,旨在为VD的治疗提供依据,现将研究成果报道如下。
1 材料与方法
1.1 动物来源 本研究设计动物实验及操作均经张家口学院伦理委员会审核批准。60只健康SD级成年雄性大鼠购自河北北方学院动物实验中心,体质量240~310 g,平均(278.5±13.7)g。所有大鼠均常规自由进食进水,喂养室温20~22 ℃,空气湿度50%,光照12 h后黑暗12 h昼夜交替,待饲养1周后进行实验。
1.2 主要仪器与试剂 Lipofectamine 2000购自美国ATCC公司;DMEM培养基购自美国HyClone公司;TERT、BMSC均购自上海桑尼生物科技有限公司;BDNF、TrkB、SYP抗体均购自美国Sigma公司。PCR仪购自美国ABI公司;H-7650透射电镜购自日本日立公司;Nucleofector Ⅱ细胞核转染仪瑞士Lonza公司。
1.3 方法
1.3.1 VD大鼠模型的制备 60只大鼠按照随机数字表分为阴性对照组(A组)、模型组(B组)、常规BMSC组(C组)和转染BMSC组(D组),每组各15只;其中阴性对照组不给于任何干预措施,VD大鼠模型制备方法:采用结扎双侧颈总动脉(2-VO)法[6]:术前大鼠禁水4 h、禁食12 h,腹腔注射10%水合氯醛(注射剂量:0.5 mL/100 g);待大鼠麻醉后置于操作台上,取出颈部毛,常规消毒将于颈部正中做一约2~3 cm切口,皮下组织钝性分离后将气管充分暴露,用眼科镊将气管两侧颈总动脉逐层分离并显露,再采用3-0缝合线将双侧颈总动脉结扎,确认结扎成功后缝合伤口,并涂抹万古霉素消毒。大鼠苏醒后常规进食进水,检测大鼠生命体征并观察行为变化。术后第2天将存活的大鼠进行Morris迷宫测试,大鼠平均逃避潜伏期大于2倍对照组大鼠平均逃避潜伏期判定为VD大鼠造模成功标准。
1.3.2 TERT转染BMSC 将BMSC接种于6孔板中,分为3组:对照组、逆转录病毒载体(plxsn)组,plxsn-TERT组,待细胞汇合率达到90%时,分别于每孔加入3 μg载体、Lipofectamine 2000 10 mL、LDMEM培养基3 mL,转染6 h后更换培养基,转染24 h后进行传代(1∶10),转染48 h后加入G418(200 μg/mL)筛选。
1.3.3 BMSC细胞移植 A组和B组不注射任何药物,常规喂养;常规BMSC组尾静脉注射1 mL BMSC(浓度:4×106个/mL),转染BMSC组组尾静脉注射1 mL TERT-BMSC(浓度:4×106个/mL);注射后常规喂养6周。
1.4 观察指标 (1)移植2个月后对4组大鼠采用Morris迷宫测试[7-9]:①定位航行测试,将大鼠分别从4个象限放入水中,记录大鼠的逃避潜伏期;②空间探索测试:撤去平台,记录120 s内大鼠在第一象限停留的时间。(2)将大鼠处死,快速切取大鼠海马CA1区组织,采用Trizol法提取脑组织RNA并逆转录成cDNA,以β-actin为内参,采用RT-PCR法检测组织中BDNF mRNA、TrkB mRNA、SYP mRNA表达水平。RT-PCR总反应体系20 μL,其中cDNA 3 μL,上下游引物0.5 μL。设置PCR反应条件:94 ℃预变性30 s,95 ℃变性1 min,55 ℃退火30 s,总计30个循环;各引物序列及长度见表1。(3)采用蛋白免疫印迹检测大鼠海马CA1区BDNF、TrkB、SYP蛋白表达:取各组大鼠海马CA1区脑组织200 g,加入1 mL蛋白酶抑制剂,提取总蛋白。采用聚丙烯酰胺凝胶电泳分离各蛋白,再将分离出的蛋白转移至PVDF膜上25 mA恒流过夜。分别加入BDNF、TrkB、SYP一抗室温孵育2 h,再加入辣根过氧化物标记的二抗室温孵育1.5 h,最后加入辣根过氧化物标记的actin抗体,经化学发光法检测,图片扫描保存,计算目的蛋白相对含量,其中目的蛋白相对含量=目的蛋白灰度值/内参actin蛋白灰度值。(4)切取海马CA1区脑组织,常规固定、切片、染色后,用透射电镜观察海马CA1区神经元突触的超微结构。

2 结 果
2.1 各组大鼠一般情况比较 A组大鼠均正常喂养,全部存活;B组有3只大鼠在行颈总动脉结扎时死亡,其余12只存活;C组有2只在颈总动脉结扎时死亡,2只因腹腔感染死亡,其余11只存活;D组1只在颈总动脉结扎时死亡,1只在注射TERT-BMSC后第2天不明原因死亡,其余13只存活;各组存活大鼠生长发育情况良好。

表1 RT-PCR各引物序列及长度
2.2 TERT mRNA表达及端粒酶活性与对照组和plxsn组比较 plxsn-TERT组TERT mRNA表达水平显著升高,端粒酶活性也显著上升,见图1~2。
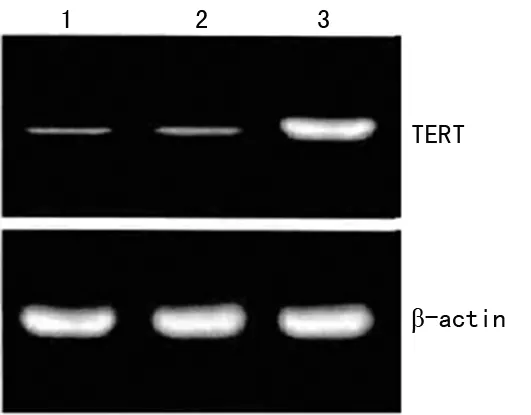
1:对照组;2:plxsn组;3:plxsn-TERT组。
图1 各组TERT mRNA表达水平
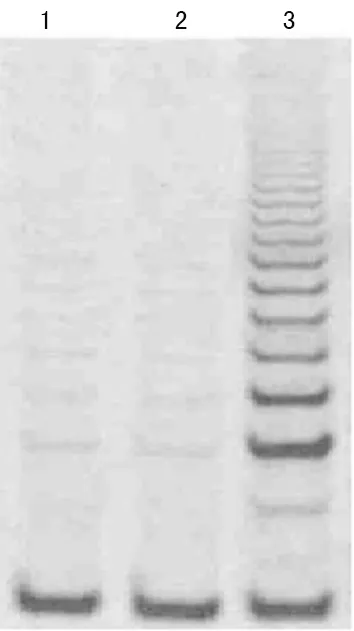
1:对照组;2:plxsn组;3:plxsn-TERT组。
图2 各组端粒酶活性
2.3 各组大鼠Morris迷宫测试结果比较 B组、C组、D组逃避潜伏期显著长于A组,第一象限停留时间显著少于A组(P<0.05);C组、D组逃避潜伏期显著长于B组,第一象限停留时间显著少于B组(P<0.05);D组逃避潜伏期显著长于C组,第一象限停留时间显著少于C组(P<0.05),见表2。
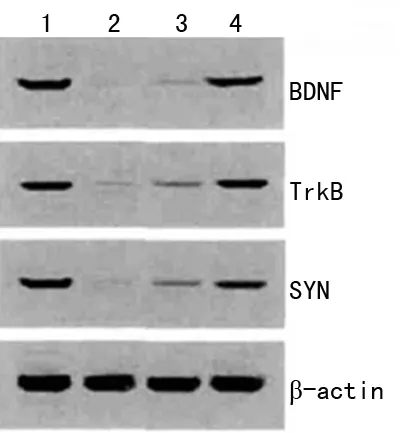
2.4 各组大鼠海马CA1区BDNF mRNA、TrkB mRNA、SYP mRNA表达水平 与A组比较,B组、C组、D组BDNF mRNA、TrkB mRNA、SYP mRNA均显著降低(P<0.05),其中D组BDNF mRNA、TrkB mRNA、SYP mRNA显著高于B组、C组(P<0.05),C组BDNF mRNA、TrkB mRNA、SYP mRNA又显著高于正常值(P<0.05),见图3、表3。
表2 各组大鼠Morris迷宫测试结果比较
a:P<0.05,与A组比较;b:P<0.05,与B组比较;c:P<0.05,与C组比较。

表3 各组大鼠海马CA1区BDNF mRNA、TrkB mRNA、SYP mRNA表达水平
a:P<0.05,与A组比较;b:P<0.05,与B组比较;c:P<0.05,与C组比较。
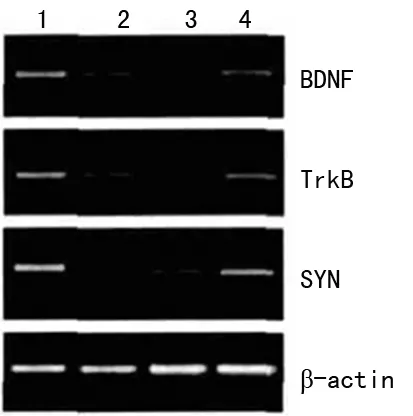
1:A组;2:B组;3:C组;4:D组。
图3 各组大鼠海马CA1区BDNF mRNA、TrkB mRNA、SYP mRNA表达水平

表4 各组大鼠海马CA1区BDNF、TrkB、SYP蛋白表达水平
a:P<0.05,与A组比较;b:P<0.05,与B组比较;c:P<0.05,与C组比较。
2.5 各组大鼠海马CA1区BDNF、TrkB、SYP蛋白表达水平与阴性对照组比较 B组、C组、D组BDNF、TrkB、SYP蛋白表达水平均显著降低(P<0.05),其中D组BDNF、TrkB、SYP蛋白表达水平显著高于B组、C组(P<0.05),C组BDNF、TrkB、SYP蛋白表达水平又显著高于B组(P<0.05),见图4、表4。
2.6 各组大鼠海马CA1区突触素观察结果比较 A组大鼠突触间隙排列清晰,SYN阳性细胞数较多;B组突触间隙排列紊乱,SYN阳性细胞数量明显减少;C组突触间隙较模型组更加有序,且阳性细胞数量有所增加;D组突触间隙更为清晰,SYN阳性细胞数量和突出间隙排列结构都接近于A组;见图5。
1:A组;2:B组;3:C组;4:D组。
图4 各组大鼠海马CA1区BDNF、TrkB、SYP蛋白表达水平
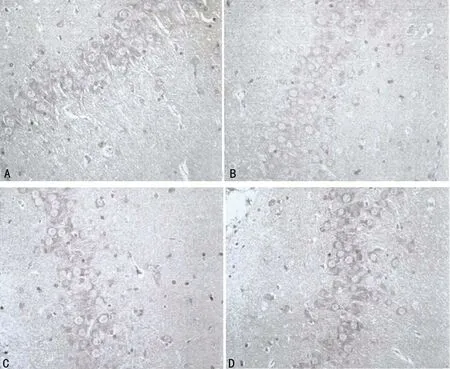
A:A组;B:B组;C:C组;D:D组。
图5 光镜下突触素观察结果(×400)
3 讨 论
目前已证实骨髓内含量大量干细胞,其中BMSC能够定向分化为成骨细胞、脂肪细胞、神经元细胞等中胚层来源细胞[10]。BMSC取材简单、培养方便、具有弱免疫原性等特点,被认为是理想的干细胞。Park等[11]对缺血性脑损伤大鼠移植BMSC,结果显示大鼠损伤脑组织血管重新生成,部分脑组织也得以重塑。但是BMSC存在分化能力容易丧失、过度老化、增值不稳定等情况。Veronesi等[12]学者对BMSC的生物学现象进行研究,最终提出BMSC多种生物学功能均与端粒酶活性有关,特别是其神经保护功能的效果与端粒酶活性呈明显正相关。端粒酶是核糖核蛋白酶的一种,在调节染色体的复制中发挥重要作用[13-14]。本研究亦证实经过端粒酶逆转录酶转染能够使BMSC获得更高的端粒酶活性,这对于提高BMSC的增殖速度、预防BMSC过度衰老凋亡具有重要作用。Jiang等[15]也证实将慢病毒携带的VEGF转染至BMSC,BMSC的新生血管的形成和自身的增殖能够显著增强。
本研究对VD大鼠注射TERT转染的BMSC,结果显示转染BMSC组逃避潜伏期显著长于常规BMSC组,第一象限停留时间显著少于常规BMSC组,说明相比较于普通BMSC替代治疗,TERT转染的BMSC治疗VD后大鼠学习、记忆能够改善更为明显。Baranova等[16]证实BMSC能够抑制兴奋性氨基酸所产生的细胞毒作用,使突触传递功能重新恢复,从而改善因神经元损伤所引起的学习、记忆功能损害。Kishi等[17]证实BNDF是保护神经细胞的主要营养因子,敲除BNDF基因后大鼠发生VD的风险显著升高。BNDF发挥相应的作用有赖于与其特异性受体TrkB结合;Yasutake等[18]报道BNDF首先在组织中合成,然后顺轴突运输至突触间隙,并与间隙中受体TrkB结合,从而参与神经元细胞的增殖、分化,并对损伤的神经元有恢复作用。本研究亦证实转染BMSC组BDNF、TrkB表达水平显著高于常规BMSC组,提示转染BMSC对神经元的修复作用与增强BDNF、TrkB表达有关。
Schroeter等[19]称通过观察突触结构的变化能够反映出突触结构的可塑性。SYN是神经元突触前的特异性生物学标志物,能够促进多种神经递质的释放,还能调节突触传递效能;而突触素是反映突触数量、密度和分布的指标之一[20]。本研究显示转染BMSC组SYN表达水平显著高于常规BMSC组,电镜下观察转染BMSC组突触间隙更为清晰,SYN阳性细胞数量和突出间隙排列结构都接近于阴性对照组,说明移植转染BMSC能够透过血脑屏障,从而促进神经细胞的生长,并诱导和产生新生轴突和树突,证实转染BMSC能显著改善VD动大鼠海马CA1区突触可塑性,这亦是治疗VD的生物学基础。
综上所述,相比于普通BMSC替代治疗,TERT转染BMSC对血管性痴呆大鼠的治疗作用明显,其作用机制与促进BDNF、TrkB表达、改善突触的可塑性有关。然而神经元损伤修复的作用机制是个复杂过程,包括各种酶、钙离子通道以及NMDAR1的磷酸化过程等,因此对其具体作用机制尚待进一步研究。
[1]Meguro K,Tanaka N,Nakatsuka M,et al.Vascular lesions in mixed dementia,vascular dementia,and Alzheimer′s disease with cerebrovascular disease:the Kurihara Project[J].J Neurol Sci,2012,322(1/2):157-160.
[2]Meguro K,Akanuma K,Meguro M,et al.Prognosis of vascular mild cognitive impairment includes vascular dementia onset and death by cardiovascular disease:reanalysis from the Osaki-Tajiri project[J].J Stroke Cerebrovasc Dis,2012,21(7):607-611.
[3]Kawakatsu M,Urata Y,Goto S,et al.Placental extract protects bone marrow-derived stem/progenitor cells against radiation injury through anti-inflammatory activity[J].J Radiat Res,2013,54(2):268-276.
[4]Zhong Y,Xu J,Deng M,et al.Generation of a human bone marrow-derived mesenchymal stem cell line expressing and secreting high levels of bioactive α-melanocyte-stimulating hormone[J].J Biochem,2013,153(4):371-379.
[5]Ding J,Cheng Y,Gao S,et al.Effects of nerve growth factor and Noggin-modified bone marrow stromal cells on stroke in rats[J].J Neurosci Res,2011,89(2):222-230.
[6]Etgen T,Hochreiter M,Kiechle V.Subclavian-axillary graft plus graft-carotid interposition in symptomatic radiation-induced occlusion of bilateral subclavian and common carotid arteries[J].Vasa,2013,42(3):223-226.
[7]Gordan ML,Jungwirth B,Ohl F,et al.Evaluation of neurobehavioral deficits following different severities of cerebral ischemia in rats:a comparison between the modified hole board test and the Morris water maze test[J].Behav Brain Res,2012,235(1):7-20.
[8]Alam JJ.Selective Brain-targeted antagonism of p38 MAPKα reduces hippocampal IL-1β levels and improves morris water maze performance in aged rats[J].J Alzheimer′s Dis,2015,48(1):219-227.
[9]Fridgeirsdottir GA,Hillered L,Clausen F.Escalated handling of young C57BL/6 mice results in altered Morris water maze performance[J].Ups J Med Sci,2014,119(1):1-9.
[10]Togami W,Sei A,Okada T,et al.Effects of water-holding capability of the PVF sponge on the adhesion and differentiation of rat bone marrow stem cell culture[J].J Biomed Mater Res A,2014,102(1):247-253.
[11]Park SY,Yoon H,Lee N,et al.Analysis of cerebral blood flow with single photon emission computed tomography in mild subcortical ischemic vascular dementia[J].Nucl Med Mol Imaging (2010),2014,48(4):272-277.
[12]Veronesi E,Murgia A,Caselli A,et al.Transportation conditions for prompt use of ex vivo expanded and freshly harvested clinical-grade bone marrow mesenchymal stromal/stem cells for bone regeneration[J].Tissue Eng Part C Methods,2014,20(3):239-251.
[13]Raichlin S,Sharon E,Freeman R,et al.Electron-transfer quenching of nucleic acid-functionalized CdSe/ZnS quantum dots by doxorubicin:a versatile system for the optical detection of DNA,aptamer-substrate complexes and telomerase activity[J].Biosens Bioelectron,2011,26(12):4681-4689.
[14]Holmstrom ED,Nesbitt DJ.Single-molecule fluorescence resonance energy transfer studies of the human telomerase RNA pseudoknot:temperature-/urea-dependent folding kinetics and thermodynamics[J].J Phys Chem B,2014,118(14):3853-3863.
[15]Jiang Y,Chen L,Tang Y,et al.HO-1 gene overexpression enhances the beneficial effects of superparamagnetic Iron oxide labeled bone marrow stromal cells transplantation in swine hearts underwent ischemia/reperfusion:an MRI study[J].Basic Res Cardiol,2010,105(3):431-442.
[16]Baranova O,Miranda LF,Pichiule P,et al.Neuron-specific inactivation of the hypoxia inducible factor 1 alpha increases brain injury in a mouse model of transient focal cerebral ischemia[J].J Neurosci,2007,27(23):6320-6332.
[17]Kishi T,Hirooka Y,Sunagawa K.Telmisartan protects against cognitive decline via up-regulation of brain-derived neurotrophic factor/tropomyosin-related kinase B in hippocampus of hypertensive rats[J].J Cardiol,2012,60(6):489-494.
[18]Yasutake C,Kuroda K,Yanagawa T,et al.Serum BDNF,TNF-alpha and IL-1beta levels in dementia patients:comparison between Alzheimer′s disease and vascular dementia[J].Eur Arch Psychiatry Clin Neurosci,2006,256(7):402-406.
[19] Schroeter A,Wen S,Mölders A,et al.Depletion of the AMPAR reserve pool impairs synaptic plasticity in a model of hepatic encephalopathy[J].Mol Cell Neurosci,2015,68:331-339.
[20]Elliott T.The mean time to Express synaptic plasticity in integrate-and-express,stochastic models of synaptic plasticity induction[J].Neural Comput,2011,23(1):124-159.
Effect of TERT gene transfected BMSC on memory function and hippocampal CA1 region synaptic plasticity in vascular dementia rat*
DuanJinqi1,MaLiqiong2,LiuYuanlin1,RenWei1,ChenYuanyuan1,LiChunyan3
(1.MedicalCollegeofZhangjiakouUniversity,Zhangjiakou,Hebei075000,China;2.DepartmentofIntensiveCareMedicine,251HospitalofPLA,Zhangjiakou,Hebei075000,China;3.DepartmentofNeurology,SecondHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050000,China)
Objective To explore the effect of telomerase reverse transcriptase(TERT) gene transfected bone marrow stem cell(BMSC)on the memory function and hippocampal CA1 region synaptic plasticity in vascular dementia rat.Methods A total of 60 rats were randomly divided into the negative control group(group A),model group(group B),conventional BMSC group(group C) and transfected BMSC group(group D).The related indicators in each group were detected by using the Morris maze test,RT-PCR and Western blot respectively.Results The escape latency period in the group C and group D was significantly longer than that in the group B,which in the group D was significantly longer than that in the group C.Compared with the group A,the expressions of brain-derived neurotrophic factor(BDNF)mRNA,TERT mRNA,SYP mRNA and protein in the group B,group C and group D were significantly decreased.The synaptic cleft arrange in group A was clear with more SYN positive cells.The synaptic cleft in the group D was clearer,and the number of SYN positive cells was close to that in group A.Conclusion TERT transfected BMSC has obvious therapeutic effect on vascular dementia rats and its mechanism may be related to the promotion of BDNF,TrkB expression and the improvement of synaptic plasticity.
telomerase reverse transcriptase;bone marrow stromal stem cells;dementia,vascular;memory function;synaptic;plasticity
10.3969/j.issn.1671-8348.2017.10.002
国家自然科学基金资助项目(81171210)。 作者简介: 段金旗(1975-),副教授,本科,主要从事急救医学教学工作。
R743.9
A
1671-8348(2017)10-1300-04
2016-10-26
2017-01-21)

