髓源抑制细胞对慢性丙型肝炎患者干扰素联合利巴韦林抗病毒治疗临床预后的影响
孟雪飞,李红兵
渭南市中心医院感染科,陕西 渭南 714000
髓源抑制细胞对慢性丙型肝炎患者干扰素联合利巴韦林抗病毒治疗临床预后的影响
孟雪飞,李红兵
渭南市中心医院感染科,陕西 渭南 714000
目的研究髓源抑制细胞(myeloid-derived suppressor cells, MDSCs)对慢性丙型肝炎(chronic hepatitis C,CHC)患者使用干扰素联合利巴韦林抗病毒治疗的临床预后影响。方法选取渭南市中心医院2012年1月-2014年1月收治的CHC患者100例,均给予干扰素联合利巴韦林抗病毒治疗,同时选取100名健康体检者作为对照组,根据MDSCs表型,将其分为粒系髓源抑制细胞(G-MDSCs)和单核系髓源抑制细胞(M-MDSCs)。分析CHC患者和对照组MDSCs、CD4+T和CD8+T水平,分析CHC患者经治疗后病毒HCV-RNA、MDSCs、CD4+T、CD8+T水平,治疗后的CHC患者分为获得持久病毒学应答(SVR)和未获得持久病毒学应答(non-SVR),分析non-SVR患者中剔除MDSCs组和未剔除MDSCs组的CD4+T和CD8+T水平。结果治疗前,CHC患者CD4+T、CD8+T水平均显著低于对照组(P<0.05)。CHC患者HCV-RNA、G-MDSCs水平均高于对照组(P<0.05);两组M-MDSCs水平相比,差异无统计学意义(P>0.05)。治疗前CHC组、治疗后SVR组和non-SVR组HCV-RNA、G-MDSCs、CD4+T、CD8+T水平比较,差异有统计学意义(P<0.05),M-MDSCs水平差异无统计学意义(P>0.05)。MDSCs剔除组和MDSCs未剔除组CD4+T和CD8+T水平差异有统计学意义(P<0.05)。结论干扰素联合利巴韦林抗病毒治疗可以降低患者HCV-RNA水平,而HCV-RNA对G-MDSCs有促进作用,G-MDSCs对CD4+T、CD8+T有抑制作用,对CHC患者使用干扰素联合利巴韦林抗病毒治疗起到不良的临床预后影响。
髓源抑制细胞;慢性丙型肝炎;干扰素;利巴韦林
丙型病毒性肝炎是一种呈世界性流行的传染性疾病[1]。流行病学调查发现70%以上的丙肝患者发展为慢性丙型肝炎(chronic hepatitis C,CHC),因CHC有明显的致肝硬化甚至致肝癌倾向,因此若CHC治疗不及时,患者多预后不良[2]。采用传统的干扰素联合利巴韦林等抗病毒药物作为治疗CHC的一线方案,近50%的患者不能获得持久病毒学应答(sustained virological response,SVR)[3]。髓源抑制细胞(myeloid-derived suppressor cells,MDSCs)是近年发现的起源于骨髓的免疫抑制细胞,研究[4]证实MDSCs与多种免疫性疾病、感染性疾病及肿瘤性疾病的不良预后密切相关,其是否对干扰素联合利巴韦林抗病毒治疗的CHC患者临床预后产生影响研究较少。本研究分析了CHC患者与正常人群之间的MDSCs、CD4+T和CD8+T水平及CHC患者治疗后病毒HCV-RNA、MDSCs、CD4+T、CD8+T水平变化及MDSCs对CHC患者预后的影响,现报道如下。
1 资料与方法
1.1 一般资料收集渭南市中心医院2012年1月-2014年1月确诊为CHC患者100例,男58例,女42例,年龄(47.95±8.16)岁(30~65岁),体质量指数(BMI)(23.89±4.21)kg/m2,谷丙转氨酶(ALT)(70.12±8.02)U/L,谷草转氨酶(AST)(60.15±7.34)U/L,其中代偿期肝硬化Child-Pugh A级患者39例。同时纳入健康体检者100名作为对照组,男63名,女37名,年龄(48.61±8.71)岁(30~65岁),BMI(23.75±4.11)kg/m2,ALT(17.96±4.35)U/L,AST(16.24±3.76)U/L。两组性别、年龄和BMI相比,差异无统计学意义(P>0.05),具有可比性。本次纳入的患者均签署知情同意书,本次研究已报我院伦理委员会通过。
1.2 诊断标准参照《丙型肝炎防治指南》[5]:(1)HCV抗体检测呈阳性且检测出HCV-RNA;(2)影像学检查肝纤维化;(3)ALT或AST持续升高。
1.3 纳入及排除标准纳入标准[6]:(1)符合以上CHC的诊断标准;(2)患者为初期感染HCV-RNA和代偿期肝硬化Child-Pugh分级为A级的患者;(3)年龄30~65岁;(4)配合治疗;(5)均为初次接受该治疗方案。排除标准:(1)合并有其他任何类型的肝炎、结核及HIV的患者;(2)孕妇、妊娠期和哺乳期的患者;(3)有精神疾病者;(4)对该药物存在严重并发症患者;(5)身体患有任何类型肿瘤的患者。
1.4 仪器及药品干扰素(凯因益生重组人干扰素α2b注射液,北京凯因生物技术有限公司,国药准字S20030030,批号11100002);利巴韦林(山东圣鲁制药有限公司,国药准字H20003099,批号11090003)。HCV RNA定量采用荧光定量聚合酶链式反应法(聚合酶链式反应仪购自赛飞(中国)有限公司,型号Biosafer 9701)。
1.5 研究方法第一阶段:将CHC患者和健康志愿者的G-MDSCs、M-MDSCs、CD4+T和CD8+T水平进行对比分析了解以上指标在两组之间的差异。第二阶段:对CHC患者进行抗病毒治疗,药物使用干扰素联合利巴韦林。干扰素用量及用法:肌肉注射,3 000 000 IU/次,1次/d,连用4周后改为3次/周,共连用48周。治疗结束后根据病毒学应答情况,将患者分为持久病毒学应答(SVR)组和未获得持久病毒学应答(non-SVR)组,对比分析治疗前和治疗后SVR组及non-SVR组G-MDSCs、M-MDSCs、CD4+T和CD8+T水平,了解以上指标在三组之间的差异。第三阶段:提取non-SVR组患者的外周血单核细胞,使用流式细胞仪将部分患者单核细胞剔除MDSCs,另一部分为未剔除MDSCs,使用CD3/CD28抗体对CD4+T和CD8+T进行刺激增殖,观察MDSCs对CD4+T和CD8+T增殖的影响。
1.6 指标观察观察各组G-MDSCs、M-MDSCs、CD4+T和CD8+T水平和治疗前后CHC患者HCV-RNA水平。
1.6.1 G-MDSCs、M-MDSCs的检测:取外周静脉血进行离心,首先以1 500 r/min离心5 min,提取真空采血管下层的血细胞,加入适量磷酸缓冲盐溶液(PBS)进行稀释,置于离心管中,再加入适量淋巴细胞分离液,以2 500 r/min进行离心操作30 min,提取单核细胞分离层,再经RPMI 1640培养基洗涤2次,1 500 r/min离心10 min。使用贝克曼库尔特CytoFLEX流式细胞仪(型号CytoFLEX)进行G-MDSCs和M-MDSCs比例的测定。
1.6.2 CD4+T和CD8+T水平检测:取外周静脉血进行离心提取单核细胞,离心弃上清,分别加入anti-CD4+T和anti-CD8+T抗体,使用贝克曼库尔特CytoFLEX流式细胞仪分离检测其比例。

2 结果
2.1 治疗前CHC患者和对照组体内CD4+T、CD8+T水平分析治疗前,CHC组CD4+T、CD8+T水平均显著低于对照组,差异有统计学意义(P<0.05,见表1)。
2.2 治疗前CHC组和对照组HCV-RNA、G-MDSCs、M-MDSCs水平治疗前,CHC患者体内有HCV-RNA,对照组均无HCV-RNA;CHC患者体内G-MDSCs水平显著高于对照组,差异有统计学意义(P<0.05);CHC患者M-MDSCs水平与对照组相当,差异无统计学意义(P>0.05,见表2)。
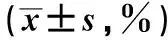
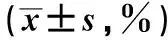
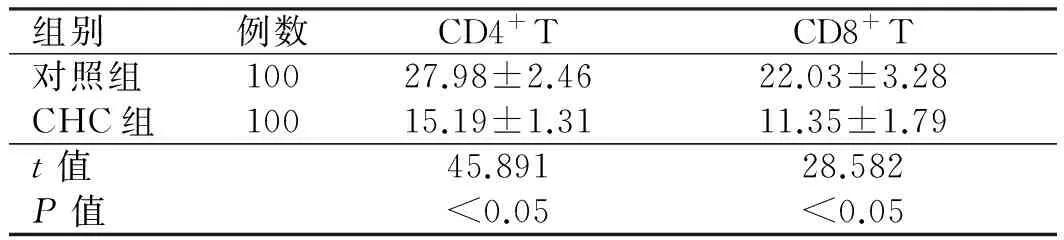
组别例数CD4+TCD8+T对照组10027.98±2.4622.03±3.28CHC组10015.19±1.3111.35±1.79t值45.89128.582P值<0.05<0.05
2.3 CHC患者治疗前后SVR组、non-SVR组HCV-RNA、G-MDSCs、M-MDSCs水平治疗后CHC患者体内HCV-RNA水平均下降,且SVR组
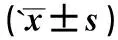

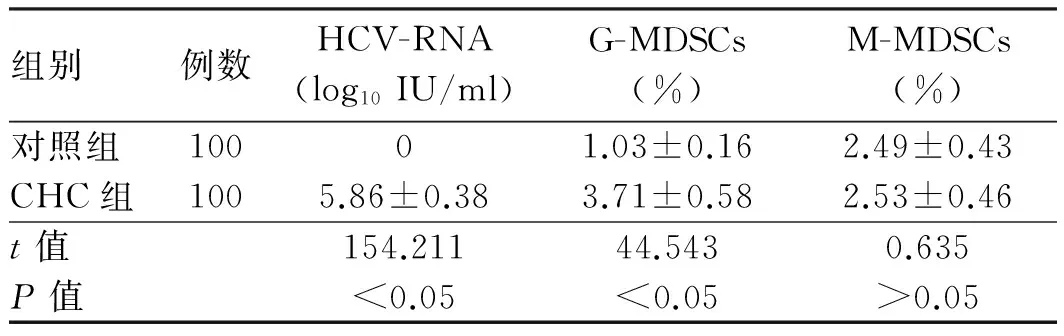
组别例数HCV-RNA(log10IU/ml)G-MDSCs(%)M-MDSCs(%)对照组10001.03±0.162.49±0.43CHC组1005.86±0.383.71±0.582.53±0.46t值154.21144.5430.635P值<0.05<0.05>0.05



组别例数HCV-RNA(log10IU/ml)G-MDSCs(%)M-MDSCs(%)治疗前CHC组1005.86±0.383.71±0.582.53±0.46治疗后non-SVR组285.01±0.313.16±0.472.51±0.45治疗后SVR组724.51±0.252.50±0.312.50±0.42F值305.928111.7780.079P值<0.05<0.05>0.05
2.4 治疗前CHC患者和治疗后SVR组、non-SVR组CD4+T、CD8+T水平分析治疗后CHC患者体内CD4+T、CD8+T水平显著升高,且SVR组>non-SVR组>治疗前CHC组,差异有统计学意义(P<0.05,见表4)。
2.5 non-SVR患者中剔除MDSCs组和未剔除MDSCs组的CD4+T、CD8+T水平分析将28例non-SVR患者抽取外周血,将其中14例患者的外周血剔除MDSCs,并设为MDSCs剔除组,另14例患者设为MDSCs未剔除组,经抗体刺激增殖后显示剔除MDSCs组的CD4+T、CD8+T水平显著高于未剔除MDSCs组,差异有统计学意义(P<0.05,见表5)。
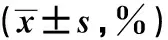
组别例数CD4+TCD8+T治疗前CHC组10015.19±1.3111.35±1.79治疗后non-SVR组2817.96±1.3813.58±1.83治疗后SVR组7219.87±1.4316.01±1.92F值194.488105.569P值<0.05<0.05
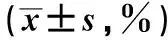
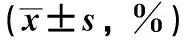
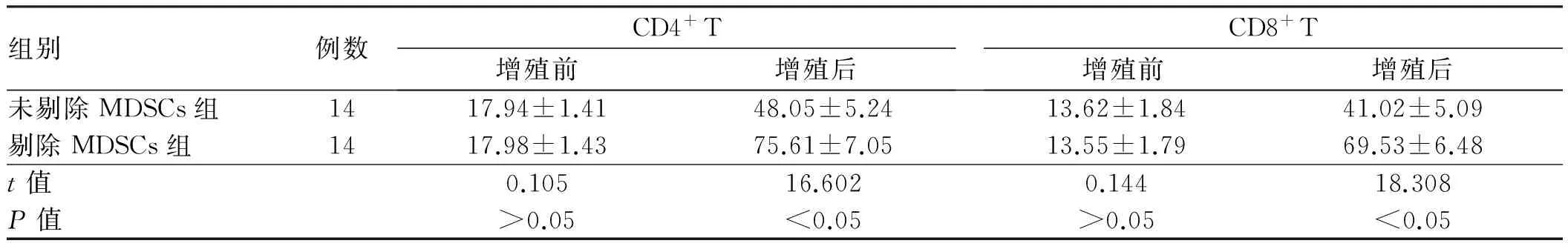
组别例数CD4+T增殖前增殖后CD8+T增殖前增殖后未剔除MDSCs组1417.94±1.4148.05±5.2413.62±1.8441.02±5.09剔除MDSCs组1417.98±1.4375.61±7.0513.55±1.7969.53±6.48t值0.10516.6020.14418.308P值>0.05<0.05>0.05<0.05
3 讨论
MDSCs主要由成熟及非成熟的髓样细胞组成,如未成熟状态的粒细胞、巨噬细胞等,具有显著的免疫抑制作用,尤其能显著抑制T细胞功能[7]。研究[8]发现丙肝病毒作为刺激源可持续诱导机体MDSCs生成,表现为外周血MDSCs含量升高,但关于其具体诱导机制尚不明确。Ning等[9]通过实验研究发现丙肝病毒的核心蛋白成分可能在MDSCs的生成中起重要作用,核心蛋白通过抑制髓系细胞的活化来达到抑制T细胞免疫能力的目的。另有研究[10]指出MDSCs为被病毒感染的细胞提供免疫耐受的条件,使其免于被免疫细胞灭杀,最终促成病毒感染性疾病的慢性化。CD4+T和CD8+T细胞机体主要发挥细胞免疫功能,但在CHC患者中CD4+T和CD8+T细胞并未对感染的肝细胞进行攻击,推测可能与感染的肝细胞在MDSCs作用下出现的免疫逃避有关[11]。
本研究发现CHC患者CD4+T、CD8+T水平均显著低于健康人群,差异有统计学意义,说明慢性丙肝病毒感染患者未出现强烈的细胞免疫,提示CHC患者存在免疫耐受情况,这与国外的相关研究结果相符[12]。MDSCs按细胞类型可分为G-MDSCs及M-MDSCs[13]。本研究发现CHC患者组体内G-MDSCs水平显著高于对照组,但M-MDSCs水平与对照组相当,说明G-MDSCs与丙肝慢性化密切相关而M-MDSCs水平与丙肝并无明显关系。本观察组患者采用干扰素联合利巴韦林治疗后共有72例患者获得SVR,有28例未获得SVR,患者SVR比例为72%,该结果与国内的相关报道[14]一致。治疗后CHC患者体内G-MDSCs水平均下降,且SVR组 综上所述,HCV-RNA对CHC患者G-MDSCs有促进作用,G-MDSCs对患者体内CD4+T、CD8+T水平有抑制作用,对CHC患者使用干扰素联合利巴韦林抗病毒治疗起到不良的临床预后影响。 [1]黄艳秋, 史昌河. 丙型病毒性肝炎基因分型及临床意义[J]. 青岛大学医学院学报, 2012, 48(5): 468-470. Huang YQ, Shi CH. Genotyping of hepatitis C virus and its clinical significance [J]. Acta Academiae Medicinae Qingdao Universitatis, 2012, 48(5): 468-470. [2]Ward JW. The epidemiology of chronic hepatitis C and one-time hepatitis C virus testing of persons born during 1945 to 1965 in the United States [J]. Clin Liver Dis, 2013, 17(1): 1-11. [3]徐庆年, 杨宗国, 陆云飞, 等. 聚乙二醇干扰素联合利巴韦林治疗经治慢性丙型肝炎患者的回顾性分析[J]. 世界华人消化杂志, 2013, 11(19): 1797-1802. Xu QN, Yang ZG, Lu YF, et al. Retrospective analysis of peg interferon combined with Ribavirin in the treatment of chronic hepatitis C [J]. World Chinese Journal of Digestology, 2013, 11(19): 1797-1802. [4]Jiang H, Gebhardt C, Umansky L, et al. Elevated chronic inflammatory factors and myeloid-derived suppressor cells indicate poor prognosis in advanced melanoma patients [J]. Int J Cancer, 2015, 136(10): 2352-2360. [5]中华医学会肝病学分会. 丙型肝炎防治指南[J]. 中华医学杂志, 2004, 7(3): 1-12. Chinese Society of Hepatology. Guidelines for the prevention and treatment of hepatitis C [J]. Chinese Journal of Medicine, 2004, 7(3): 1-12. [6]郭朋乐, 李凌华, 唐小平. 髓系抑制性细胞与病毒感染性疾病[J]. 中国病毒病杂志, 2012, 2(3): 228-232. Guo PL, Li LH, Tang XP. Myeloid suppressor cells and viral infectious diseases [J]. Chinese Journal of Viral Diseases, 2012, 2(3): 228-232. [7]Chandra D, Gravekamp C. Myeloid-derived suppressor cells: cellular missiles to target tumors [J]. Oncoimmunology, 2013, 2(11): e26967. [8]金磊, 张学秀, 曾庆磊, 等. 髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)是未成熟的髓系细胞亚群[J]. 世界华人消化杂志, 2014, 14(11): 52-53. Jin L, Zhang XX, Zeng QL, et al. Myeloid-derived suppressor cells were immature myeloid lineage [J]. World Chinese Journal of Digestology, 2014, 14(11): 52-53. [9]Ning G, She L, Lu L, et al. Analysis of monocytic and granulocytic myeloid-derived suppressor cells subsets in patients with hepatitis C virus infection and their clinical significance [J]. Biomed Res Int, 2015, 2015: 385378. [10]Su H, Cong X, Liu YL. Transplantation of granulocytic myeloid-derived suppressor cells (G-MDSCs) could reduce colitis in experimental murine models [J]. J Dig Dis, 2013, 14(5): 251-258. [11]陈志刚, 左维泽, 周迪, 等. 慢性丙型肝炎患者外周血T淋巴细胞亚群与病毒载量的相关性分析[J]. 临床和实验医学杂志, 2013, 12(6): 457-458. Chen ZG, Zuo WZ, Zhou D, et al. Correlation analysis of peripheral blood T lymphocyte subsets and viral load of patients with chronic hepatitis C [J]. Journal of Clinical and Experimental Medicine, 2013, 12(6): 457-458. [12]Gani RA, Yunihastuti E, Krisnuhoni E, et al. Periportal CD4+cell infiltration increases in HIV/hepatitis C virus-coinfected patients commencing ART, whereas CD8+cells clear from the liver [J]. J Infect Dis, 2014, 210(3): 405-409. [13]Kittang AO, Kordasti S, Sand KE, et al. Expansion of myeloid derived suppressor cells correlates with number of T regulatory cells and disease progression in myelodysplastic syndrome [J]. Oncoimmunology, 2015, 5(2): e1062208. [14]徐菁, 欧亚非. 干扰素α-2b与聚乙二醇干扰素α-2a治疗低病毒载量慢性丙型肝炎快速及早期病毒学应答临床观察[J]. 热带病与寄生虫学, 2014, 12(4): 209-211. Xu J, Ou YF. Interferon α-2b and pegylated interferon α-2a in therapy of chronic hepatitis C patients with low viral load: clinical observation on the rapid and early virological [J]. Journal of Tropical Diseases and Parasitology, 2014, 12(4): 209-211. (责任编辑:王全楚) Effect of myeloid-derived suppressor cells on the clinical prognosis of interferon and Ribavirin in treatment of chronic hepatitis C patients MENG Xuefei, LI Hongbing Department of Infectious Disease, Weinan Central Hospital, Weinan 714000, China Objective To investigate the effect of myeloid-derived suppressor cells (MDSCs) on the clinical prognosis of interferon and Ribavirin in treatment of chronic hepatitis C (CHC).Methods One hundred patients with CHC in Weinan Central Hospital from Jan. 2012 to Jan. 2014 were treated with interferon and Ribavirin for antiviral therapy, and 100 healthy persons were selected as control group. According to the phenotype of MDSCs, which can be divided into granulocyte MDSCs (G-MDSCs) and monocytic MDSCs (M-MDSCs). The MDSCs, CD4+T and CD8+T levels in patients with CHC and control group were compared, and the levels of HCV-RNA, MDSCs, CD4+T, and the levels of CHC after treatment were compared. After treatment, CHC patients were divided into achieving sustained virologic response (SVR) and non-getting SVR (non-SVR), the levels of CD4+T and CD8+T in patients with non-SVR were compared between MDSCs rejection group and MDSCs non-rejection group.Results Before treatment, the CD4+T and CD8+T in the patients with CHC were significantly lower than those in the control group (P<0.05). The levels of HCV-RNA and G-MDSCs in patients with CHC were higher than those in control group (P<0.05). There was no significant difference in M-MDSCs level between two groups (P>0.05). There was statistical significance in HCV-RNA, G-MDSCs, CD4+T, CD8+T among CHC group before treatment and SVR group and non-SVR group after treatment (P<0.05); but there was no statistically significant difference in the level of M-MDSCs (P>0.05). There was significant difference in CD4+T, CD8+T between the MDSCs rejection group and the MDSCs non-rejection group (P<0.05).Conclusion Interferon and Ribavirin antiviral therapy can reduce the level of HCV-RNA in patients with CHC, and promote the role of G-MSCs, G-MDSCs can inhibit CD4+T and CD8+T levels, and it plays adverse clinical prognosis for CHC patients with interferon and Ribavirin antiviral therapy. Myeloid-derived suppressor cells; Chronic hepatitis C; Interferon; Ribavirin 孟雪飞,主治医师,E-mail:mengxuefeimxf@163.com 10.3969/j.issn.1006-5709.2017.03.017 R512.6+3 A 文章编号:1006-5709(2017)03-0307-04 2016-08-06

