透明质酸在不同胃疾病中的表达及幽门螺杆菌感染对其表达的影响
金 星,孙明军,宫月华
中国医科大学附属第一医院 1. 消化内科;2. 肿瘤研究所暨普通外科研究所肿瘤病因与筛查研究室 辽宁省高效肿瘤病因与预防重点实验室,辽宁 沈阳 110001
透明质酸在不同胃疾病中的表达及幽门螺杆菌感染对其表达的影响
金 星1,孙明军1,宫月华2
中国医科大学附属第一医院 1. 消化内科;2. 肿瘤研究所暨普通外科研究所肿瘤病因与筛查研究室 辽宁省高效肿瘤病因与预防重点实验室,辽宁 沈阳 110001
目的探讨透明质酸(hyaluronic acid,HA)与胃癌和癌前疾病的相关性及幽门螺杆菌(Helicobacter pylori,H.pylori)感染对HA表达的影响。方法共选择179例31~82岁不同胃疾病患者(包括H.pylori感染阴性85例和H.pylori感染阳性94例),应用酶联免疫吸附测定法(ELISA)检测患者血清HA表达水平。结果健康人中血清HA表达水平为(12.66±8.98)ng/ml,年龄<60岁组与年龄≥60岁组、男性组与女性组HA表达水平差异无统计学意义(P>0.05)。从SG组到AG组,再到GC组血清HA表达水平逐渐升高,GC组显著高于SG组(P=0.025)。H.pylori感染阴性组中NOR组、AG组、GC组三组血清HA平均浓度差异无统计学意义(P=0.618);在H.pylori感染阳性组中随疾病进展,血清HA平均浓度GC组显著高于SG组和AG组(P=0.021、P=0.035)。结论健康人中血清HA表达水平与年龄、性别无明显相关性。血清HA表达水平随胃疾病进展呈逐渐升高趋势,表明HA可以反映胃疾病的严重程度,HA与胃疾病的发生、发展密切相关,具有作为胃癌筛查标记物的潜能。在H.pylori感染状态下,随着胃疾病进展,血清HA水平显著升高,提示H.pylori感染可以影响血清HA表达水平。
透明质酸;胃癌;萎缩性胃炎;浅表性胃炎;幽门螺杆菌
胃癌(gastric cancer,GC)是消化系统最常见的恶性肿瘤之一,其全球发病率在恶性肿瘤发病率中居第4位,在癌症致死率中占第2位。中国每年新发GC患者约40万人,占世界GC发病人数的42%,但因GC早期多无典型症状,其早期癌变检出率仅10%左右。目前认为GC是从胃正常黏膜-浅表性胃炎(superficial gastritis,SG)-萎缩性胃炎(atrophic gastritis,AG)-GC逐步发展形成的,但其分子机制尚不明确。与GC密切相关癌基因的激活、抑癌基因的失活[1-2]、DNA复制过程的不稳定性[3]、信号通路的改变[4]等都是导致GC发生的原因之一。除此之外,癌和癌旁间质细胞相互作用形成的肿瘤微环境也会影响肿瘤进展中癌细胞的增殖、侵袭和转移等行为,是肿瘤发生、发展中不可忽视的重要因素之一。
肿瘤微环境主要由细胞和生物活性物质组成,后者又包括生长因子和细胞外基质[5]。透明质酸(hyaluronic acid,HA)是细胞外基质的主要组成成分,是2 000~25 000个由D-葡糖醛酸和β-N-乙酰氨基葡糖组成的双糖单位连续反复构成的糖胺聚糖,广泛存在于体内。主要通过与HA连接蛋白[6-8](包括细胞表面受体和某些功能蛋白)相连结到细胞表面而发挥作用。
本研究旨在探讨HA在GC及其癌前疾病中的表达差异及H.pylori感染对HA表达的影响,进一步探讨HA在胃疾病进展中的作用。
1 资料与方法
1.1 一般资料选取2002年-2011年中国医科大学附属第一医院肿瘤病因与筛查研究室标本库中存档的不同胃疾病患者血清,共纳入179例,年龄(57.96±9.25)岁(31~82岁),男109例,女70例,H.pylori感染阴性者85例,H.pylori感染阳性者94例。按疾病严重程度分为GC组69例,AG组60例,SG组26例,轻度SG定义为正常人群(normal,NOR)组24例,疾病诊断通过内镜检查和病理活检确定,GC的诊断符合WHO胃癌诊断标准和Lauren分型。H.pylori感染的判断通过检测血清H.pylori-IgG抗体滴度来确定(Helicobacter pylori ELISA试剂盒,BIOHIT,芬兰),≥34 EIU即诊断为H.pylori感染阳性。本研究经过中国医科大学附属第一医院伦理委员会批准。
1.2 实验方法采用ELISA法检测血清HA含量。具体测定步骤如下:(1)将0.25 mg/ml HA结合蛋白 (hyaluronan binding protein,HABP,COSMOBIO,日本)
用50 mmol/L,pH 9.6碳酸盐溶液(carbonate solution,CB)稀释至1 μg/ml,分别加入96孔板中,每孔50 μl,4 ℃冰箱过夜。(2)用350 μl洗液(浓缩磷酸盐缓冲液1∶100稀释)洗3次,拍干。(3)每孔加入200 μl 0.1% BSA,于37 ℃封闭2 h。(4)弃掉封闭液,直接拍干。(5)96孔板中分别加入0、10、25、40、50、75、100 ng/ml HA(SIGMA,美国)标准品或稀释待检测血清样品,每孔100 μl,置于25 ℃温箱中1 h。(6)用350 μl洗液洗3次,拍干。(7)将0.25 mg/ml生物素-透明质酸结合蛋白(biotin-hyaluronan binding protein,b-HABP,COSMOBIO,日本)用PBS稀释至0.5 μg/ml,50 μl每孔,25 ℃,孵育1 h。(8)用350 μl洗液洗3次,拍干。(9)将链酶亲合素-辣根过氧化物酶(streptavidin-horseradish peroxidase,streptavidin-HRP,SOLARBIO,北京)用PBS按1∶1 000稀释,50 μl每孔,25 ℃,孵育30 min。(10)用350 μl洗液洗3次,拍干。(11)每孔加入50 μl底物液,25 ℃避光孵育20 min显色。(12)每孔加入50 μl终止液。(13)450 nm波长下测定OD值。(14)利用HA标准品的浓度及其OD值拟合标准曲线,根据标准曲线求得各孔OD值对应的浓度。
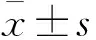
2 结果
2.1 基本特征179例患者中,年龄<60岁者101例,占56.42%,年龄≥60岁者78例,占43.58%,男109例(60.89%),女70例(39.11%),按疾病严重程度分为NOR组(n=24)、SG组(n=26)、AG组(n=60)、GC组(n=69),NOR组均为H.pylori感染阴性,SG组均为H.pylori感染阳性,AG组H.pylori感染阳性率为51.67%,GC组H.pylori感染阳性率为53.62%。各组年龄、性别分布差异均无统计学意义(P>0.05,见表1)。
2.2 血清HA在健康人血清中的表达HA在24名健康人血清中的平均浓度为(12.66±8.98)ng/ml,其中年龄≥60岁组略高于年龄<60岁组,女性组略高于男性组,但两组比较,差异均无统计学意义(P=0.456、0.601,见表2)。
表1 研究对象的基本特征
Tab 1 Characteristics of the study subjects

组别样本量年龄(岁)范围x-±sP值年龄分组[n(%)]<60岁≥60岁P值性别[n(%)]男女P值H.pylori-IgG[n(%)](-)(+)P值总体17931~8257.96±9.2520.789α101(56.42)78(43.58)0.304α109(60.89)70(39.11)0.225α85(47.49)94(52.51)NOR2446~6959.13±7.20113(54.17)11(45.83)19(79.17)5(20.83)24(100)0SG2643~6956.65±6.8700.220β18(69.23)8(30.77)0.273β14(53.85)12(46.15)0.059β026(100)AG6041~7858.35±8.5780.697γ29(48.33)31(51.67)0.629γ34(56.67)26(43.33)0.054γ29(48.33)31(51.67)GC6931~8257.70±11.1350.475δ41(59.42)28(40.58)0.653δ42(60.87)27(39.130.104δ32(46.38)37(53.62)0.824ε
注:α:NORvsSGvsAGvsGC;β:SGvsNOR;γ:AGvsNOR;δ:GCvsNOR;ε:GCvsAG。
2.3 血清HA在不同胃疾病来源患者血清中的表达随着疾病的发展,血清HA表达水平逐渐升高,GC组显著高于SG组,差异有统计学意义(P=0.025,见表2)。
表2 血清HA在健康人和不同胃疾病来源患者血清中的表达
Tab 2 Levels of serum HA in normal population and different gastric disease groups

分组样本量HA(ng/ml)P值NOR2412.66±8.98年龄(岁) <601311.37±9.780.456 ≥601114.19±8.11性别 男1912.15±9.180.601 女514.59±8.81SG268.32±8.47-AG6013.10±15.600.146*GC6914.76±13.420.025**
注:*:AGvsSG;**:GCvsSG。
2.4 H.pylori感染对血清HA表达的影响分析H.pylori感染阴性患者中,NOR组、AG组、GC组血清HA表达水平无明显规律,差异无统计学意义(P=0.618,见表3)。
进一步比较H.pylori感染阳性患者中血清HA表达的差异,从SG组到AG组,再到GC组,血清HA表达水平逐渐升高,三组间差异有统计学意义(P=0.017),癌组显著高于非癌组(P=0.005,见表3)。
2.5 质量控制因所有检测不能在同一批次完成,在每一批次中都对同一例血清进行了重复检测,其平均浓度为102.89 ng/ml,求得其变异系数CV为14.6%,以此来判定批间差,因<20%,所以认为检测方法较稳定,不同批次间有可比性 。
表3 不同H.pylori感染状态患者在不同胃疾病组间血清HA表达的差异
Tab 3 Difference of serum HA expression among different H.pylori infected patients with different gastric diseases
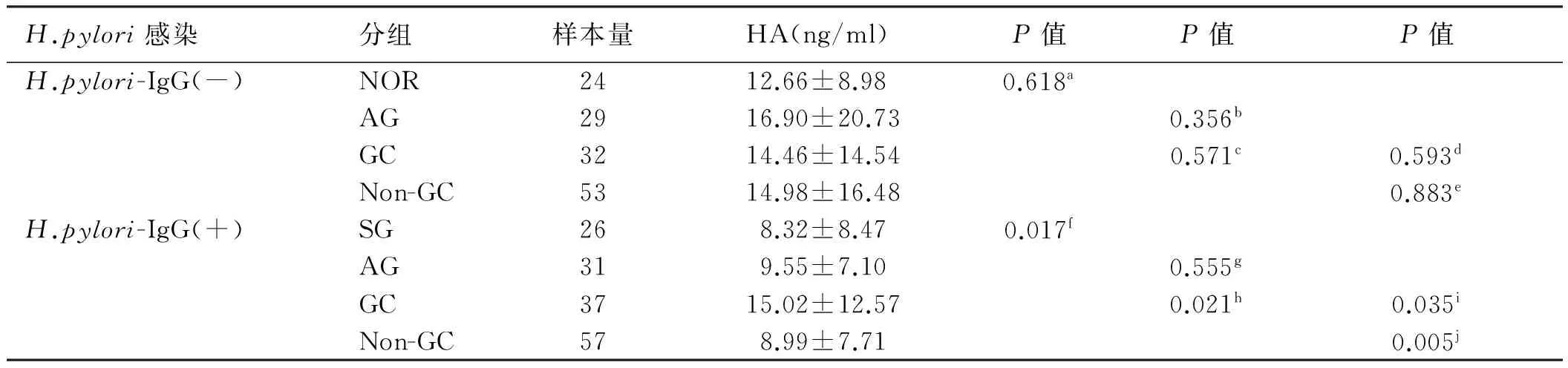
H.pylori感染分组样本量HA(ng/ml)P值P值P值H.pylori-IgG(-)NOR2412.66±8.980.618aAG2916.90±20.730.356bGC3214.46±14.540.571c0.593dNon-GC5314.98±16.480.883eH.pylori-IgG(+)SG268.32±8.470.017fAG319.55±7.100.555gGC3715.02±12.570.021h0.035iNon-GC578.99±7.710.005j
注:a:NORvsAGvsGC;b:AGvsNOR;c:GCvsNOR;d:AGvsGC;e:Non-GCvsGC;f:SGvsAGvsGC;g:AGvsSG;h:GCvsSG;i:AGvsGC;j:Non-GCvsGC。
3 讨论
癌细胞和癌旁间质细胞的相互作用形成的肿瘤微环境是GC发生、发展重要的原因之一。HA作为肿瘤微环境的重要组成成分,在GC发生、发展中的突出作用不容忽视。HA与GC的关系研究目前较多集中在HA的高表达与GC转移和不良预后之间的关系[9-14]及HA在内镜下黏膜切除术(endoscopic mucosal resection,EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)术前黏膜下注射与术后并发症之间的关系研究[15-16],但HA在GC及其癌前疾病中表达的研究较少[17]。H.pylori是胃感染的最常见细菌病原体,是GC的主要致病因素,其与HA表达的关系如何尚未见报道。本研究检测了来自179例不同胃疾病患者HA的表达规律及可能的影响因素,进一步探讨HA在胃疾病进展中的作用。
以往很多研究表明,HA的表达与GC的侵袭、转移相关,HA的聚集多提示肿瘤的不良预后和低生存期,但很少有关于HA在胃疾病进展中的作用研究,其作用机制及影响因素尚不明确。本研究发现血清HA平均浓度从SG组到AG组再到GC组,随着胃疾病严重程度的增加,HA表达水平逐渐增强,GC组显著高于SG组。已知HA在癌中表达增强的原因主要有三个方面[9]:(1)合成增加;(2)代谢增强;(3)肿瘤细胞发生的上皮-间质转化(epithelial mesenchymal transition,EMT)[18]。这些表达增强的HA可以刺激肿瘤细胞的非停泊性生长及增殖,也可与肿瘤细胞膜上的HA受体结合后, 形成保护性外壳, 降低免疫细胞对肿瘤细胞的黏附和攻击[19];也可使受体蛋白质相关的酪氨酸激酶磷酸化, 产生一系列细胞内信号, 使细胞骨架发生移动, 引发肿瘤细胞伪足样伸展运动, 从而增强肿瘤细胞的运动性和趋化性[20]。AG被认为是一个主要的GC癌前疾病[21],我们看到血清HA的表达GC组高于AG组,AG组高于SG组,可以推断HA具有代表胃疾病严重程度的潜能,但其在诊断GC中的效能及其敏感性、特异性需要在更大的样本中得到证实。
已知H.pylori感染是GC的主要致病因素之一,但目前很少有关于H.pylori感染直接影响HA表达的研究。Khurana 等[22-23]研究发现H.pylori感染有可能通过影响调节萎缩的ERK-CD44-STAT3轴中的CD44受体、参与淋巴系统代谢的淋巴管内皮细胞透明质酸受体-1(LYVE-1)及与肿瘤细胞迁移相关的HA介导的流动性受体(RHAMM)等受体的作用而间接影响HA的表达。本研究结果显示在H.pylori感染阴性组中,NOR组、AG组、GC组之间HA表达水平无明显差异,而在H.pylori感染阳性组,HA表达水平从SG组到AG组,再到GC组呈显著升高趋势,GC组HA平均浓度显著高于SG组和AG组,差异有统计学意义。结果提示H.pylori感染很可能是影响HA表达的重要影响因素,且血清HA在H.pylori感染患者中更能很好地预测疾病的进展风险。
值得注意的是,研究中我们看到H.pylori感染对GC与非GC患者中血清HA表达水平的影响不甚一致。均为H.pylori感染阳性的SG组血清HA平均浓度较均为H.pylori感染阴性的NOR组降低明显,同时H.pylori感染阳性的AG组血清HA平均浓度较H.pylori感染阴性的AG组也降低明显。我们已知HA具有很多有利的生理功能[7, 24],如空间填充、水化组织、抗血管生成、抑制凋亡、抑制免疫反应和炎症反应等。上述结果提示在感染了H.pylori的非GC患者中HA主要起到抑制炎症反应的作用。有研究者试图利用HA的衍生物-透明质酸铋抗H.pylori感染治疗,其作用机制尚不明确,但HA是一种糖胺聚糖,感染存在时糖类代谢增强可能是HA减少的主要原因之一。而与非GC患者不同,H.pylori感染阳性的GC组血清HA平均浓度高于H.pylori感染阴性的GC组。提示H.pylori感染与HA的表达在GC进展中可能起到协同作用。H.pylori感染促进HA抑制炎症反应的作用及其与HA协同促进疾病进展的作用之间的转换分界点尚不明确。
总之,通过本研究可看到在健康人中血清HA表达水平与年龄、性别无明显相关性。血清HA表达水平随胃疾病进展呈逐渐升高趋势,表明HA可以反映胃疾病的严重程度,HA与胃疾病的发生、发展密切相关,具有作为GC筛查标记物的潜能。在H.pylori感染状态下,随着胃疾病进展,血清HA水平显著升高,提示H.pylori感染可以影响血清HA表达水平。
[1]祁晓莉, 戴洁, 任平, 等. 胃癌组织中bcl-2表达与预后的关系[J]. 临床与实验病理学杂志, 2006, 22(3): 384-384. Qi XL, Dai J, Ren P, et al. Relationship between expression of Bcl-2 and prognosis in gastric carcinoma[J]. J Clin Exp Pathol, 2006, 22(3): 384-384.
[2]肖凤, 王伴青, 唐和生, 等. 胃癌及其癌前病变组织中p53、p73蛋白的表达[J]. 临床与实验理学杂志, 2006, 22(1): 113-114. Xiao F, Wang BQ, Tang HS, et al. Expressions of p53 and p73 protein in gastric cancer and precancerous lesions [J]. J Clin Exp Pathol, 2006, 22(1): 113-114.
[3]刘希双. 胃癌发生的分子机制及其临床意义[D]. 山东大学, 2011. Liu XS. Molecular mechanism of gastric cancer and its clinical significance [D]. Shandong University, 2011.
[4]吴倩倩, 孙琦, 黄勤, 等. TGF-β/Smads信号转导通路与胃癌关系的研究进展[J]. 胃肠病学, 2015, 20(1): 55-57. Wu QQ, Sun Q, Huang Q, et al. Advances in study on relationship between TGF-β/Smads signal pathway and gastric cancer [J]. Chin J Gastroenterol, 2015, 20(1): 55-57.
[5]Chanmee T, Ontong P, Itano N. Hyaluronan: a modulator of the tumor microenvironment [J]. Cancer Lett, 2016, 375(1): 20-30.
[6]Necas J, Bartosikova L, Brauner P, et al. Hyaluronic acid (hyaluronan): a review [J]. Veterinarni Medicina, 2008, 53(8): 397-411.
[7]Stern R, Asari AA, Sugahara KN. Hyaluronan fragments: an information-rich system [J]. Eur J Cell Biol, 2006, 85(8): 699-715.
[8]Jacobson A. Regulation of hyaluronan biosynthesis: expression in vitro and importance for tumor progression [D].Uppsala University, 2002.
[9]Tammi RH, Kultti A, Kosma VM, et al. Hyaluronan in human tumors:pathobiological and prognostic messages from cell-associated and stromal hyaluronan[J]. Semin Cancer Biol, 2008, 18(4): 288-295.
[10]Vizoso FJ, del Casar JM, Corte MD, et al. Significance of cytosolic hyaluronan levels in gastric cancer [J]. Eur J Surg Oncol, 2004, 30(3): 318-324.
[11]Morita H, Ishikawa Y, Akishima-Fukasawa Y, et al. Histopathological predictor for regional lymph node metastasis in gastric cancer [J].Virchows Arch, 2009, 454(2): 143-151.
[12]Ishigami S, Ueno S, Nishizono Y, et al. Prognostic impact of CD168 expression in gastric cancer [J]. BMC Cancer, 2011, 11: 106.
[13]Kamata I, Ishikawa Y, Akishima-Fukasawa Y, et al. Significance of lymphatic invasion and cancer invasion-related proteins on lymph node metastasis in gastric cancer [J]. J Gastroenterol Hepatol, 2009, 24(9): 1527-1533.
[14]Rudno-Rudzinska J, Kielan W, Grzebieniak Z, et al. High density of peritumoral lymphatic vessels measured by D2-40/podoplanin and LYVE-1 expression in gastric cancer patients: an excellent prognostic indicator or a false friend [J]. Gastric Cancer, 2012, 16(4): 513-520.
[15]Sohn DK, Chang HJ, Choi HS, et al. Does hyaluronic acid stimulate tumor growth after endoscopic mucosal resection [J]. J Gastroenterol Hepatol, 2008, 23(8 Pt 1): 1204-1207.
[16]Hayashi S, Takayama T, Masuda H, et al. Bioresorbable membrane to reduce postoperative small bowel obstruction in patients with gastric cancer: a randomized clinical trial [J]. Ann Surg, 2008, 247(5): 766-770.
[17]Ruan HL, Hong RT, Xie HJ, et al. Significance of elevated levels of collagen type IV and hyaluronic acid in gastric juice and serum in gastric cancer and precancerous lesion [J]. Dig Dis Sci, 2011, 56(7): 2001-2008.
[18]Petersen OW, Nielsen HL, Gudjonsson T, et al. Epithelial to mesenchymal transition in human breast cancer can provide a nonmalignant stroma [J]. Am J Pathol, 2003, 162(2): 391-402.
[19]Itano N, Atsumi F, Sawai T, et al. Abnormal accumulation of hyaluronan matrix diminishes contact inhibition of cell growth and promotes cell migration[J]. Proc Natl Acad Sci U S A, 2002, 99(6): 3609-3614.
[20]Güler G, Sarac S, Uner A, et al. Prognostic value of CD44 variant 6 in laryngeal epidermoid carcinomas [J]. Arch Otolaryngol Head Neck Surg, 2002, 128(4): 393-397.
[22]Khurana SS, Riehl TE, Moore BD, et al. The hyaluronic acid receptor CD44 coordinates normal and metaplastic gastric epithelial progenitor cell proliferation[J]. J Biol Chem, 2013, 288(22): 16085-16097.
[23]Shi J, Li YJ, Yan B, et al. Interleukin-8:A potent promoter of human lymphatic endothelial cell growth in gastric cancer [J]. Oncol Rep, 2015, 33(6): 2703-2710.
[24]Deed R, Rooney P, Kumar P, et al. Early-response gene signalling is induced by angiogenic oligosaccharides of hyaluronan in endothelial cells. Inhibition by non-angiogenic, high-molecular-weight hyaluronan [J]. Int J Cancer, 1997, 71(2): 251-256.
(责任编辑:李 健)
Expression of hyaluronic acid in different gastric diseases and the influence of Helicobacter pylori infection on the expression of hyaluronic acid
JIN Xing1, SUN Mingjun1, GONG Yuehua2
1. Department of Gastroenterology; 2. Tumor Etiology and Screening Department of Cancer Institute and General Surgery, and Key Laboratory of Cancer Etiology and Prevention (China Medical University), Liaoning Provincial Education Department, the First Affiliated Hospital of China Medical University, Shenyang 110001, China
Objective To explore the correlation of the hyaluronic acid (HA) with gastric cancer and its precancerous disease and the effect of Helicobacter pylori (H.pylori) infection on the expression of HA. Methods A total of 179 patients were enrolled, including 94 cases ofH.pyloripositive infection and 85 cases ofH.pylorinegative infection. The levels of serum HA were measured by ELISA.Results The level of serum HA in normal population (NOR) was (12.66±8.98)ng/ml, the differences of the levels of serum HA between age<60 years old group and age≥60 years old group, between men and women were not significant (P>0.05). Serum HA levels were increased from SG to AG to GC, HA level was especially higher in patients with GC compared with SG group (P=0.025). InH.pylori-IgG (-) group, the differences of serum HA levels in NOR, AG, GC group were not obvious, while inH.pylori-IgG (+) groups, the level of serum HA in GC group was evidently higher than that in SG group or AG group (P=0.021 orP=0.035).Conclusion The level of serum HA in normal population has no significant correlation with age and gender. The HA level is increased with the progression of gastric diseases, indicate that it chould reflect the severity of the diseases, HA is closely related to the genesis and development of gastric diseases, it might be an useful marker for the screening of gastric cancer. In the condition ofH.pyloriinfection, the HA levels obviously increase with the development of gastric diseases, suggests thatH.pyloriinfecton probably affect the expression of HA.
Hyaluronic acid; Gastric cancer; Atrophic gastritis; Superficial gastritis; Helicobacter pylori
沈阳市科委攻关项目(F13-220-9-30)
金星,硕士,助教,研究方向:胃癌及其癌前疾病的早期诊断与治疗。E-mail:jinxing73@hotmail.com
孙明军,教授,博士研究生导师,研究方向:消化道早癌内镜下诊断与治疗。E-mail:smjmw@sina.com;宫月华,副教授,硕士研究生导师,研究方向:胃癌病因学研究。E-mail:gongyueh75@163.com
10.3969/j.issn.1006-5709.2017.02.013
R573
A 文章编号:1006-5709(2017)02-0164-04
2016-05-19

