Ni/La2O2CO3催化剂对山梨醇氢解产物的选择性调控
张涛,刘琪英,张彩红,张琦,马隆龙
Ni/La2O2CO3催化剂对山梨醇氢解产物的选择性调控
张涛1,2,刘琪英1,张彩红2,3,张琦1,马隆龙1
(1中国科学院广州能源研究所,可再生能源与天然气水合物重点实验室,广东广州 510640;2中国科学技术大学纳米科学技术学院,江苏苏州 215123;3中国科学院大学,北京 100049)
采用共沉淀法制备了具有协同稳定作用的Ni/La2O2CO3催化剂,用于山梨醇选择性氢解为小分子醇的研究。采用X射线衍射、氢气程序升温还原、CO2程序升温脱附和扫描电镜对催化剂进行了表征。考察了不同配比Ni、La的加氢位点和碱性调控对山梨醇氢解产物的影响。结果表明,Ni、La摩尔比为2:3时,山梨醇转化率达到98.6%,C2~C3多元醇的产率达到43.8%,催化剂经2次反应后对山梨醇的转化率仍高达90%。探究了催化剂从酸性到碱性调变过程中,山梨醇氢解的产物分布,并提出了反应路径。
山梨醇;选择性催化还原;纳米材料;加氢;共沉淀;C2~C3多元醇
引 言
化石能源依然是人们在现阶段生产生活主要依靠的能源,但由于化石能源的不可再生性,以及在利用过程中的环境污染,迫使人们不得不寻找可替代的非化石能源。生物质能作为一种清洁新能源,由于其来源广泛,是一种比较理想的替代能源,一直备受人们关注[1]。在生物质能源的利用上,将生物质转化为高附加值的化学品,能够提高能源的合理配置和高效利用,是生物质能源主要的发展路线之一[2-4]。而木质纤维素作为一种广泛的生物质来源,由此展开的一系列的水解产物——单分子多元糖醇,如山梨醇、葡萄糖、木糖醇等也受到了研究者的青睐。工业上山梨醇一般由淀粉、蔗糖、葡萄糖转化产生,是一种有潜力的平台化合物[5-6]。由山梨醇氢解产生的乙二醇、1,2-丙二醇是合成树脂、可降解塑料、防冻剂、化妆品、药物的重要原料[7-9]。目前合成的小分子二元醇多以石油化工过程中乙烯、丙烯为原料合成,Shell 公司、Degussa 公司都有制备丙二醇的相关报道[10-12]。
围绕山梨醇加氢脱氧 (HDO) 反应,生成具有高附加值的小分子醇,研究主要集中在金属活性位点和碱性位点调控[13-14]。Ni、Cu、Ru、Pt是比较常用的金属活性位点[15-18],碱性助剂有Mg(OH)2、Ca(OH)2、CeO2、La2O3、Ba(OH)2等[9,13, 18-20]。Guo等[21]报道用RuWO/CNTs 催化剂,加入Ca(OH)2,得到山梨醇完全转化,1,2-PDO和EG的总产率达60.2%。Banu等[19]用Ni-NaY、Pt-NaY在6 MPa、220℃、山梨醇的浓度15%、加入Ca(OH)2的条件下,发现Ni-NaY氢解山梨醇的主要产物为1,2-PDO,而Pt-NaY的主要氢解产物为甘油。
但对于催化剂的寿命而言,加入的碱性助剂稳定性普遍不高,通常不能二次利用,不利于工业化生产。在保证催化剂对山梨醇高的转化率和小分子醇的选择性的同时,催化剂稳定性的提高和制备方法的设计也是山梨醇加氢脱氧的重要研究方向。
Yuan等[22]利用Ce修饰的Ni/Al2O3对山梨醇的加氢脱氧进行了探究,他们分别用沉积浸渍和共沉淀法进行了对比,研究发现共沉淀法得到的催化剂在保证选择性和产率的同时,具有更高的稳定性,最终得到山梨醇转化率90%以上,小分子二元醇的选择性达到50%~60%。
最近,Hou等[23-24]报道了Ni-Mg-Al类水滑石层状结构的固体催化剂,他们分别用无水研磨方法和并流共沉淀法制备了Ni-Mg-Al催化剂,通过比较,无水研磨方法得到的催化剂Ni的粒径更小、分散度更好,另外水滑石结构能够提供更多的羟基位点,活性和稳定性都有所提高,层状结构固体催化剂受到越来越多研究人员的关注。
本文通过不同酸碱性的催化剂筛选,并通过XRD、SEM、H2-TPR和CO2-TPD的表征,初步探究了弱酸性条件下山梨醇氢解的主要路径,并且随着酸性减弱,碱性增强,分析了各产物的分布。为了提高催化剂的稳定性和简化制备流程,通过已有文献报道的镧的碳氧化合物直接作为催化剂碱性供体,外层附着片状NiO,设计和制备出了Ni/ La2O2CO3碱性纳米棒状催化剂,并对其活性和稳定性进行了探究。
1 实验部分
1.1 样品的制备
1.1.1 Ni/La(OH)3催化剂的制备 Ni/La(OH)3催化剂采用并流共沉淀法制备,以Ni(NO3)2为Ni源,La(NO3)3为La源,NaOH和Na2CO3为沉淀剂。方法如下:配制总浓度为1 molL-1的硝酸镍[Ni(NO3)26H2O]和硝酸镧[La(NO3)36H2O]水溶液20 ml,配制0.8 molL-1NaOH水溶液60 ml,并加入一定量的Na2CO3固体,得到碱溶液。将碱以1 mlmin-1的速率滴入剧烈搅拌的10 ml水中至pH=10时,缓慢加入盐溶液使pH保持在10左右,继续80℃水浴加热搅拌30 min,倒入100 ml水热釜中120℃下水热10 h,待冷却后过滤洗涤,100℃干燥12 h,经研磨得到Ni(OH)2/La(OH)3白色粉末。其中,镍和镧的摩尔比分别为1:4、2:3、3:2、4:1,(Na2CO3):(La(OH)3)=2:1。所得固体经550℃焙烧,反应前500℃还原2 h。
1.1.2 Ru/ZrP、Ni/CeO2-ZrO2、Ni/La2O2CO3/ZrO2催化剂的制备 Ru/ZrP的制备方法:先制备ZrP,参照文献[25-26]方法,称取ZrOCl28H2O 3.84 g和NH4H2PO43.98 g,分别溶解于适量蒸馏水中,然后搅拌状态下以P/Zr摩尔比=2:1混合两溶液,形成沉淀,继续搅拌1 h,白色沉淀用蒸馏水洗涤,100℃干燥过夜,最后空气氛围中400℃焙烧4 h,得到ZrP白色固体。后用等体积浸渍法负载3%(质量分数)的Ru,100℃干燥过夜,空气中400℃焙烧4 h,得到Ru/ZrP。反应前样品300℃H2还原2 h。
Ni/CeO2-ZrO2的制备方法:配制CeCl3和ZrOCl2混合溶液,其中(Ce3+)=(Zr4+)=0.05 molL-1,剧烈搅拌下缓慢加入25%氨水,至pH=11.5,加入的氨诱导沉淀得到棕黄色沉淀,继续搅拌1 h,密封90℃过夜,去离子水过滤洗涤,60℃干燥过夜,600℃空气中焙烧,得CeO2-ZrO2。然后用等体积浸渍法负载10% Ni,得到Ni/CeO2-ZrO2,在反应前催化剂500℃H2还原2 h。
Ni/La2O2CO3/ZrO2的制备方法:参照文献[27-28],称取一定量的ZrO2载体,浸渍5%(质量分数)的碱性前体La(OH)3,100℃干燥8 h,然后以3℃min-1升温速率升至550℃空气中焙烧4 h,冷却研磨得到La2O2CO3/ZrO2。再次采用湿浸渍的方法浸渍10%(质量分数)的Ni(NO3)2,搅拌4 h,100℃烘干,3℃min-1升至550℃空气中焙烧4 h,冷却研磨,得NiO/La2O2CO3/ZrO2。反应前500℃H2还原2 h。
1.2 样品的表征
XRD采用荷兰PANalytical公司生产的X’Pert Pro MPD型X 射线衍射仪(XRD)对试样进行物相分析;采用CuKα射线(=0.15406 nm),管电压(靶压)为40 kV,管电流(靶流)为40 mA,扫描范围(2)为5°~80°。该仪器采用Peltier固体探测器,能量窗口范围1.72~1.94 V。
采用美国Quantachrome公司生产的SI-MP-10/PoreMaster 33型全自动独立多站比表面和孔隙度分析仪测定。测试前,样品在真空条件下250℃脱气10 h,以N2为介质在-196℃的温度下进行吸附。样品的比表面积用标准BET方法在相对压力0.05~0.3之间计算求得。用BJH等效圆柱模型计算孔径分布。
采用日立公司生产的Hitachi S-4800场发射扫描电镜(SEM)对样品微观表面形貌进行表征,操作电压10 kV。样品置于导电胶上调整支架高度后进行测试。
采用美国Quantachrome公司的CHEMBET3000型化学吸附仪测量催化剂的H2程序升温还原曲线。催化剂填装量为20 mg,400℃下He气吹扫40 min后降低到50℃,切换到5% H2/N2混合气体保持1 h,调整基线运行平稳后进行程序升温还原程序,升温速率为10℃min-1,TCD检测H2耗量。同时用联用的质谱仪(DYCOR四极质谱仪)在线检测管路中气流组分变化。
采用日本电子公司生产的JEM-2100F型高分辨场发射透射电镜对样品微观形貌进行表征,并用EDS分析各元素分布。
采用美国珀金埃尔默仪器公司OPTIMA 8000型电感耦合等离子体发射光谱仪(ICP)对溶液中离子含量进行测定。
1.3 山梨醇氢解产物的选择性调配
向20 ml 10%的山梨醇水溶液加入还原处理后的各催化剂0.4 g,将上述溶液倒入100 ml不锈钢高压反应釜中,先用N2排空气,再通入4 MPa H2,加热温度220℃,搅拌速率500 rmin-1,反应时间4 h。
气相产物分析:本实验反应后气体采用日本岛津公司2010气相色谱仪联用进行分析。采用TDX01填充柱和TCD检测,用于检测尾气中的CO、CO2等;采用Porapak Q柱,FID检测,用于检测尾气中的烃类。
液相产物分析:液体产物采用高效液相色谱仪(Waters 2695 HPLC)分析。采用SH1011分离柱,柱温度45℃,检测器采用折光示差(RID-2414)和可见紫外联用检测器。流动相为0.005 molL-1的硫酸溶液,流量为0.50 mlmin-1。产物分析方法采用外标法定量。
山梨醇转化率以及主要产物(EG、glycerol和1, 2-PG)选择性按照式(1)、式(2)计算
(1)

定量计算基于碳摩尔量守恒计算。
2 结果与讨论
2.1 催化剂表征
从图1 XRD谱图中可以看出,在不同摩尔比的Ni、La调控过程中,经550℃焙烧还原处理的催化剂主要表现为碳酸化的氧化镧,这主要可能由La(OH)3在空气中焙烧结合CO2反应产生;当Ni、La比为1:4时,XRD未能检测到NiO的峰,是因为NiO能够较均匀地分散在La2O2CO3表面,随着Ni含量的增加,La2O2CO3的峰逐渐减弱,NiO的峰逐渐增强。500℃还原后的催化剂NiO还原为单质Ni,La2O2CO3晶相未发生较明显变化。而经过一次反应过后的Ni-La比为2:3催化剂上主要为LaCO3OH,这可能是由于催化剂放置过程中缓慢吸收空气中的H2O所引起,LaCO3OH的峰强度高,可知催化剂的结构发生了变化,晶格化程度高,另外未反应的Ni-La比2:3催化剂NiO峰强度不明显,反应过后的峰强度有所增强,可以推测NiO出现了团聚。
图2(a)~(d)分别为Ni、La比为1:4、2:3、3:2、4:1时的催化剂的SEM图,为了比较还原前后的催化剂形貌变化,加入还原后的Ni、La比为2:3的SEM图2(e)。由图可以看到,在Ni-La比1:4时,NiO主要以自身团聚的形式依附在La2O2CO3纳米棒上。Ni-La比为3:2、4:1时随着Ni的含量增加,NiO会产生大量的团聚,造成La2O2CO3表面的碱性得不到释放。只有在Ni、La比为2:3时,NiO能够比较均匀地分布于纳米棒状La2O2CO3的表面,并且由于其片层扦插结构并不会影响La2O2CO3的碱性的释放,这也是导致Ni-La比为2:3时的催化剂对山梨醇氢解实验转化率和目标产物最优的主要原因。还原后的催化剂外层金属Ni聚集成纳米颗粒,而La2O2CO3主体部分并未发生太大变化,仍然保持纳米棒状。
由图3可以看到在透射电镜下观察到催化剂呈纳米棒状结构,这与SEM观察到的相同,通过EDS图可以看到Ni原子和La原子的分布情况,以La2O2CO3为主体的纳米棒,周围较均匀地分布着NiO,由于表面的NiO呈片状分布导致Ni密度分布不均。另外通过EDS能谱分析Ni-La原子数之比为11.05/17.35,基本符合原来设定的Ni-La比2/3,可知催化剂制备过程中金属离子全部沉淀。
blue—Ni; yellow—La
从催化剂NiO/ La2O2CO3的H2-TPR曲线图(图4)可以看出,主要出现3个峰,360、530、630℃。由XRD图可以看出,550℃焙烧之后催化剂主要以NiO/La2O2CO3形式存在,360℃被认为是NiO晶粒还原峰,530℃被认为是Ni-La形成的固溶体La2NiO4中Ni2+的还原峰[29-30],而单质NiO的还原温度为550℃,可知催化剂中NiO的分散性较好,导致还原温度下降。630℃则不属于催化剂的还原峰,可能是产生的其他杂质气体引起的。
图5显示了不同配比的NiO/La2O2CO3的CO2吸附随温度变化曲线。把得到的峰积分成3个高斯峰,温度从低到高依次将峰归属为弱碱,中强碱和强碱峰[31],通过对3个峰的积分比例计算,随着NiO比例的增加,强碱峰所占总吸附峰的比例依次为71.67%、63.1%、52.3%和22.0%,呈现强碱性逐渐减弱的趋势;而相对的弱碱的比例14.8%、14.1%、22.7%和40.9%,中强碱的比例13.5%、22.7%、25.1%和37.4%,二者总量呈现逐渐增加的趋势,而反应后的催化剂弱碱峰所占比例为66.8%,从催化剂对于山梨醇氢解的结果来看,山梨醇转化率变化与催化剂的中强碱和强碱所占比例之和呈正相关,由此可以推测催化剂对于山梨醇氢解反应的催化活性主要受催化剂的碱性强弱的影响。
通过不同配比的Ni-La催化剂的比表面积、孔体积、孔径的比较(表1),Ni-La比为2:3时的催化剂的比表面积最大,孔径最小,而此配比的催化剂活性较高,可知在此环境中,比表面积越大,孔径越小,越有利于山梨醇的转化。

表1 不同配比Ni-La的NiO/La2O2CO3的比表面和孔结构
① NiO/Ni crystal size was calculated, depending on crystallographic (111) plane by Scherrer equation.
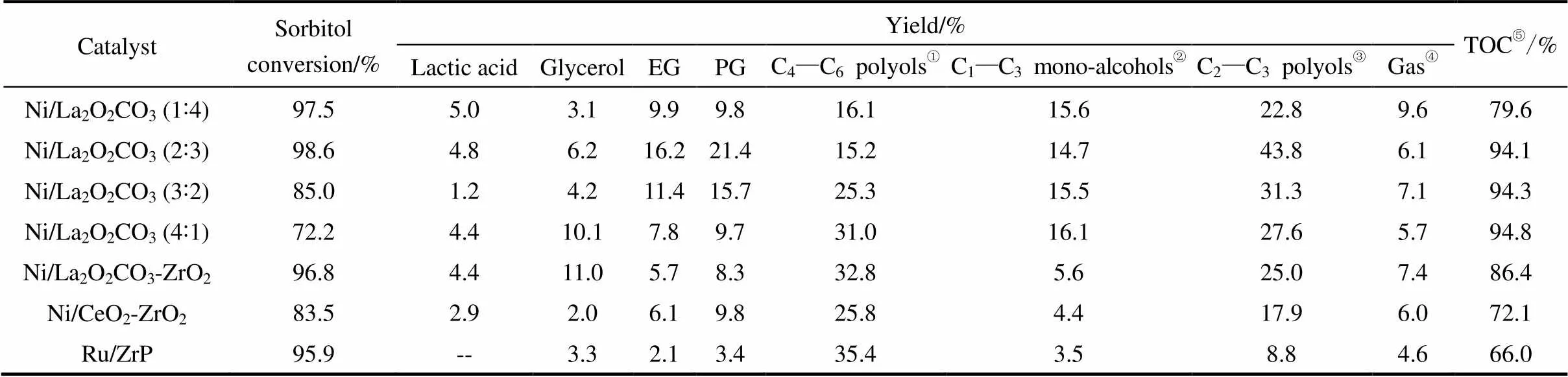
表2 不同催化剂对山梨醇氢解产物的影响
① Includes 2,5-anhydrosorbitol, isosorbide, 1,4-anhydroxylitol, 1,4-anhydroerythritol,. ② Methyl alcohol, ethyl alcohol, propyl alcohol. ③ Glycerol, EG and PDO. ④ Mainly CH4and CO2.⑤ Total organic carbons of aqueous phase.
2.2 不同活性催化剂对山梨醇氢解的产物分析
从表2中可以看出,使用不同Ni-La比的催化剂,随着Ni-La比的增加,山梨醇转化率逐渐降低,可以推测La2O2CO3对于山梨醇的转化具有决定作用,即碱性越强山梨醇的转化率越高,而经500℃ H2还原后的Ni则对于目标产物甘油、EG、PG有较高的选择性。C2~C3多元醇的产率是由碱性和活性位点共同作用的结果,通过Ni-La的协同作用,在Ni-La比为2:3时获得C2~C3多元醇的最高转化率43.8%。对于Ni/La2O2CO3-ZrO2催化剂,由于引入了弱酸性载体ZrO2[32],反应体系中pH降低,发生质子化反应,导致C4~C6多羟基环状醚产率增加,而C2~C3小分子醇产率减少。Ni/CeO2-ZrO2则属于酸性催化剂[33],从TOC可以看到溶液中有机碳的含量明显下降,而气体产物为6%左右,可知反应产生了一定的无机碳。催化剂Ru/ZrP的TOC降至66.0%,可知积炭更加严重。而积炭附着在催化剂表层,导致催化剂失活[34],从而使山梨醇的选择性氢解受到影响。可知,对于山梨醇选择性氢解为小分子醇的反应,碱性介质是反应的必要条件。
2.3 反应条件的优化
从不同的反应温度(图6)所得产物来看,目标产物甘油、EG、PDO的产率呈现先增加后降低的趋势。反应温度220℃时的最高产率43%,而山梨醇的转化率均在90%以上,温度较低时催化剂活性较低,温度升高,各分子产物逐渐增加,温度高至240℃以上,C4~C6多元醇消失,C2~C3多元醇也逐渐减少,最后占比例较高的产物是C1~C3一元醇和气相产物,由此可以推测温度过高导致化学平衡右移,副产物增加,多元醇进一步氢化,产生更多的一元醇和CO2、CH4等气相产物。
反应时间总体来说对反应的影响不大(图7),2 h以前,目标产物C2~C3多元醇的产率变化不大,而随着反应时间的增加,山梨醇的转化率增加,目标产物的产率降低,继而转化成C1~C3的一元醇和气相产物,与之前的温度变化趋势相似,可以推测山梨醇氢解为C2~C3多元醇的反应主要为动力学影响,而在热力学作用下,最终产物倾向于小分子一元醇和气相产物。可知控制反应时间和反应温度是获得C2~C3多元醇的关键。
反应压强和还原温度的影响如图8、图9所示。反应压强小于4 MPa时,C2~C3多元醇的产率趋于稳定,而C4~C6多元醇的产率在3 MPa时达到最低,这可能是不同碳链的化合物对于H2的敏感程度不同。就C2~C3多元醇的产率而言,当压强大于4 MPa时,产率相对减少,而C4~C6多元醇的含量则逐渐增加。催化剂还原温度对最终产物的分布影响不明显,随还原温度的升高,山梨醇转化率有所降低,各产物的产率也稍有降低,这可能是因为还原温度过高(500℃以上),引起La2NiO4中的Ni2+还原为Ni0,导致催化剂自身结构发生变化,从而影响催化效果。这与催化剂H2-TPR峰型相吻合。
2.4 稳定性实验
由图10可以看出,随着反应次数的增加,催化剂对山梨醇的催化效果有所降低,经过两次反应,催化剂使山梨醇转化率达90%,经过5次循环之后转化率降至65%,目标产物C2~C3多元醇的选择性由33%降至20%左右,最终山梨醇转化率和各产物选择性趋于稳定。由ICP测得一次反应后的Ni仅损失1.83%,而催化剂碱性明显减弱,可以推测随着反应次数的增加,催化剂的碱性部分降低,致使山梨醇脱水产物增加,形成比较稳定的环状多羟基醚,从而C4~C6多元醇的选择性升高,最终趋于稳定。可以推测山梨醇选择性氢解产物的分布依赖于加氢位点和碱性的协同作用。
2.5 反应路径的推测
如图11所示,由不同催化剂的产物分布可知,在中性和弱酸性水溶液中,由于H+含量较多,C4~C6多羟基化合物在H+存在下容易质子化脱水,自身形成较稳定的五元环状醚。C6产物中仅检测到了2,5-酐-山梨醇和异山梨醇,这主要是因为山梨醇自身脱水形成不稳定的1,4-酐-山梨醇和相对稳定的2,5-酐-山梨醇,而1,4-酐-山梨醇则易继续脱水形成异山梨醇[35-36],与文献描述相符。对于C5和C4产物,检测到1,4-酐-木糖醇和1,4-酐-赤藓糖醇,1,4-酐-木糖醇可能是山梨醇C3位羰基化生成己酮糖,进而断裂端位碳生成木糖醇[8],木糖醇在酸性条件脱水形成1,4-酐-木糖醇[37];1,4-酐-赤藓糖醇则是山梨醇通过逆羟醛缩合断裂C2~C3键形成C4和C2化合物,C4化合物脱水生成1,4-酐-赤藓糖醇[38],C2化合物则可能生成EG。形成的五元环状醚影响了山梨醇氢解过程中C—C键的断裂。
而在碱性水溶液中,主要的产物为C2~C3小分子醇。这是由于H+含量较低,山梨醇不易质子化成环,使山梨醇在催化剂的作用下脱氢,形成多羟基醛,进一步通过逆羟醛缩合反应,引起C—C键的断裂,从而得到甘油,甘油再经进一步氢化生成PDO和EG[39]。如果催化剂反应活性较高则会引起小分子多元醇的进一步氢解产生甲醇、乙醇、丙醇等小分子一元醇,甚至更进一步生成气态甲烷。而产物中CO2则可能是逆羟醛缩合过程中端位碳的断裂,经热解产生。反应路径中,C2~C3多元醇的进一步氢解系反应的副产物,如C1~C3单分子醇、CO2、CH4等,图11中不再一一列出。
3 结 论
(1)通过催化剂的酸碱调配,筛选出能够有效催化山梨醇氢解为C2~C3多元醇的碱性催化剂Ni/ La2O2CO3。
(2)采用共沉淀法成功制备出纳米棒状的Ni/La2O2CO3催化剂,由表征结果可知,还原前该催化剂Ni以片状物分布在La2O2CO3表面,分散性好,对山梨醇氢化反应活性高,稳定性较好。
(3)通过对山梨醇的催化氢化工艺优化,得出在催化剂Ni-La摩尔比为2:3,山梨醇质量分数为10%,反应温度220℃,氢气压强4 MPa,反应时间4 h的条件下得到C2~C3多元醇的产率最高,达到43.8%,催化剂经4次反应后对山梨醇的选择性氢解仍然显示较高的活性。
符 号 说 明
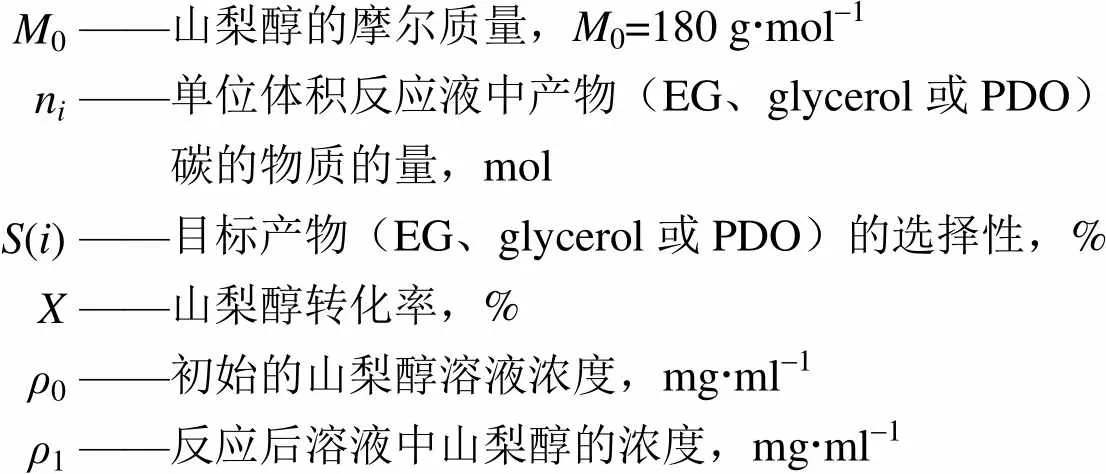
M0——山梨醇的摩尔质量,M0=180 gmol-1 ni——单位体积反应液中产物(EG、glycerol或PDO)碳的物质的量,mol S(i)——目标产物(EG、glycerol或PDO)的选择性,% X——山梨醇转化率,% ρ0——初始的山梨醇溶液浓度,mgml-1 ρ1——反应后溶液中山梨醇的浓度,mgml-1
References
[1] Huber G W, Iborra S, Corma A. Synthesis of transportation fuels from biomass: chemistry, catalysts, and engineering[J]. Chemical Reviews, 2006, 106(9): 4044-4098.
[2] Serrano-Ruiz J C, Luque R, Sepulveda-Escribano A. Transformations of biomass-derived platform molecules: from high added-value chemicals to fuelsaqueous-phase processing[J]. Chemical Society Reviews, 2011, 40(11): 5266-5281.
[3] Gallezot P. Conversion of biomass to selected chemical products[J]. Chemical Society Reviews, 2012, 41(4): 1538-1558.
[4] Kunkes E L, Simonetti D A, West R M,. Catalytic conversion of biomass to monofunctional hydrocarbons and targeted liquid-fuel classes[J]. Science, 2008, 322(5900): 417-421.
[5] 沈宜泓, 王帅, 罗琛, 等. 生物质利用新途径: 多元醇催化合成可再生燃料和化学品[J]. 化学进展, 2007, 19(2): 431-436. SHEN Y H, WANG S, LUO S,. Biomass-derived polyols as new bio-platform molecules for sustainable production of fuels and chemicals[J]. Progress in Chemistry, 2007, 19(2/3): 431-436.
[6] 周日尤, 伍玉碧. 我国山梨醇工业的现状与发展[J]. 现代化工, 2000, 20(9): 49-51.Zhou R y, Wu Y b. Current situation and development of sorbitol’s production and application in China[J]. Modern Chemical Industry, 2000, 20(9): 49-51.
[7] Leo I M, Granados M L, Fierro J L G,. Sorbitol hydrogenolysis to glycols by supported ruthenium catalysts[J]. Chinese Journal of Catalysis, 2014, 35(5): 614-621.
[8] Jin X, Shen J, Yan W,Sorbitol hydrogenolysis over hybrid Cu/CaO-Al2O3catalysts: tunable activity and selectivity with solid base incorporation[J]. ACS Catalysis, 2015, 5(11): 6545-6558.
[9] Hoffer B W, Crezee E, Devred F,. The role of the active phase of Raney-type Ni catalysts in the selective hydrogenation of D-glucose to D-sorbitol[J]. Applied Catalysis A: General, 2003, 253(2): 437-452.
[10] 刘琪英, 廖玉河, 石宁, 等. 生物质多元醇选择性催化氢解制小分子二元醇研究进展[J]. 化工进展, 2013, 32(5): 1035-1042.Liu Q Y, Liao Y H, Shi N,. A review on small molecular diols production by catalytic hydrogenolysis of biomass derived polyols[J]. Chemical Industry & Engineering Progress, 2013, 32(5):1035-1263.
[11] Che T M, Westfield N J. Production of propanediols from glycerol: US4642394[P]. 1987-02-10.
[12] Maris E P, Davis R J. Hydrogenolysis of glycerol over carbon-supported Ru and Pt catalysts[J]. Journal of Catalysis, 2007, 249(2): 328-337.
[13] Zhang J, Lu F, Yu W,Effects of alkaline additives on the formation of lactic acid in sorbitol hydrogenolysis over Ni/C catalyst[J]. Chinese Journal of Catalysis, 2016, 37(1): 177-183.
[14] Zhang J, Li J, Wu S B,. Advances in the catalytic production and utilization of sorbitol[J]. Industrial & Engineering Chemistry Research, 2013, 52(34): 11799-11815.
[15] Liu H, Huang Z, Xia C,. Selective hydrogenolysis of xylitol to ethylene glycol and propylene glycol over silica dispersed copper catalysts prepared by a precipitation-gel method[J]. ChemCatChem, 2014, 6(10): 2918-2928.
[16] Zhao L, Zhou J, Chen H,. Carbon nanofibers supported Ru catalyst for sorbitol hydrogenolysis to glycols: effect of calcination[J]. Korean Journal of Chemical Engineering, 2010, 27(5): 1412-1418.
[17] Zhang Q, Jiang T, Li B,. Highly selective sorbitol hydrogenolysis to liquid alkanes over Ni/HZSM-5 catalysts modified with pure silica MCM-41[J]. ChemCatChem, 2012, 4(8): 1084-1087.
[18] Sun J, Liu H. Selective hydrogenolysis of biomass-derived xylitol to ethylene glycol and propylene glycol on Ni/C and basic oxide-promoted Ni/C catalysts[J]. Catalysis Today, 2014, 234(10): 75-82.
[19] Banu M, Sivasanker S, Sankaranarayanan T M,. Hydrogenolysis of sorbitol over Ni and Pt loaded on NaY[J]. Catalysis Communications, 2011, 12(7): 673-677.
[20] Zhang J, Lu F, Yu W,. Selective hydrogenative cleavage of C—C bonds in sorbitol using Ni-Re/C catalyst under nitrogen atmosphere[J]. Catalysis Today, 2014, 234(10):107-112.
[21] Guo X, Guan J, Li B,. Conversion of biomass-derived sorbitol to glycols over carbon-materials supported Ru-based catalysts[J]. Scientific Reports, 2015, 5:16451.
[22] Ye L, Duan X, Lin H,. Improved performance of magnetically recoverable Ce-promoted Ni/Al2O3catalysts for aqueous-phase hydrogenolysis of sorbitol to glycols[J]. Catalysis Today, 2012, 183(1): 65-71.
[23] Du W, Zheng L, Li X,. Plate-like Ni-Mg-Al layered double hydroxide synthesizeda solvent-free approach and its application in hydrogenolysis of D-sorbitol[J]. Applied Clay Science, 2016, 123: 166-172.
[24] Du W C, Zheng L P, Shi J J,. Production of C2and C3polyols from D-sorbitol over hydrotalcite-like compounds mediated bi-functional Ni-Mg-AlOcatalysts[J]. Fuel Processing Technology, 2015, 139: 86-90.
[25] Weingarten R, Conner W C, Huber G W. Production of levulinic acid from cellulose by hydrothermal decomposition combined with aqueous phase dehydration with a solid acid catalyst[J]. Energy & Environmental Science, 2012, 5(6): 7559-7574.
[26] Liao Y, Liu Q, Wang T,. Zirconium phosphate combined with Ru/C as a highly efficient catalyst for the direct transformation of cellulose to C6alditols[J]. Green Chemistry, 2014, 16(6): 3305-3312.
[27] Cao X, Zhang Q, Jiang D,. Sorbitol hydrogenolysis to glycols over baisic additive promoted Ni-based catalysts[J]. Chinese Journal of Chemical Physics, 2015, 28(3): 338-344.
[28] Wang F, Shi R, Liu Z Q,. Highly efficient dehydrogenation of primary aliphatic alcohols catalyzed by Cu nanoparticles dispersed on rod-shaped La2O2CO3[J]. ACS Catalysis, 2013, 3(5): 890-894.
[29] Ruckenstein E, Hu Y H. Interactions between Ni and La2O3in Ni/La2O3catalysts prepared using different Ni precursors[J]. Journal of Catalysis, 1996, 161(1): 55-61.
[30] Sutthiumporn K, Kawi S. Promotional effect of alkaline earth over Ni-La2O3catalyst for CO2reforming of CH4: role of surface oxygen species on H2production and carbon suppression[J]. International Journal of Hydrogen Energy, 2011, 36(22): 14435-14446.
[31] Shi R, Wang F, Li Y,. A highly efficient Cu/La2O3catalyst for transfer dehydrogenation of primary aliphatic alcohols[J]. Green Chemistry, 2010, 12(1): 108-113.
[32] Hengne A M, Rode C V. Cu-ZrO2nanocomposite catalyst for selective hydrogenation of levulinic acid and its ester to-valerolactone[J]. Green Chemistry, 2012, 14(4): 1064-1072.
[33] Gutiérrez-Ortiz J I, De Rivas B, López-Fonseca R,. Catalytic purification of waste gases containing VOC mixtures with Ce/Zr solid solutions[J]. Applied Catalysis B: Environmental, 2006, 65(3): 191-200.
[34] Wolf E E, Alfani F. Catalysts deactivation by coking[J]. Catalysis Reviews Science and Engineering, 1982, 24(3): 329-371.
[35] Yamaguchi A, Hiyoshi N, Sato O,. Sorbitol dehydration in high temperature liquid water[J]. Green Chemistry, 2011, 13(4): 873-881.
[36] Fleche G, Huchette M. Isosorbide. Preparation, properties and chemistry[J]. Starch‐Stärke, 1986, 38(1): 26-30.
[37] Szafranek J, Wiśniewski A. Gas-liquid and high-performance liquid chromoatographic analyses of the acid-catalyzed dehydration reaction of xylitol[J]. Journal of Chromatography A, 1980, 187(1): 131-143.
[38] Yamaguchi A, Muramatsu N, Mimura N,. Intramolecular dehydration of biomass-derived sugar alcohols in high-temperature water[J]. Physical Chemistry Chemical Physics, 2017, 19: 2714-2722.
[39] Tajvidi K, Hausoul P J C, Palkovits R. Hydrogenolysis of cellulose over Cu-based catalysts—analysis of the reaction network[J]. ChemSusChem, 2014, 7(5): 1311-1317.
Selective hydrogenolysis of sorbitol on Ni/La2O2CO3catalysts
ZHANG Tao1,2, LIU Qiying1, ZHANG Caihong2,3, ZHANG Qi1, MA Longlong1
(1Key Laboratory of Renewable Energy and Gas Hydrate, Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, Guangdong, China;2Nano Science and Technology Institute, University of Science and Technology of China, Suzhou 215123, Jiangsu, China;3University of Chinese Academy of Sciences, Beijing 100049, China)
Ni/La2O2CO3catalysts with different Ni/La ratios were prepared by co-precipitation and the performance was tested in selective hydrogenolysis of sorbitol to C2—C3polyols. The catalysts were characterized by X-ray diffraction(XRD), H2temperature-programmed reduction(H2-TPR), CO2temperature-programmed desorption(CO2-TPD) and scanning electron microscopy(SEM). The effect of hydrogenation and base regulation was investigated by varying the Ni / La ratios. The result shows that the conversion of sorbitol was 98.6% and the yields of C2—C3polyols was 43.8% when the mole ratio of Ni to La is 2:3. After two times of reaction, the catalyst still achieved a sorbitol conversion of 90%. From acidic to alkaline, the products distribution of hydrogenolysis of sorbitol was discussed. The reaction pathway was also proposed based on the experiment results.
sorbitol; SCR; nanomaterials; hydrothermal; co-precipitation; C2—C3polyols
10.11949/j.issn.0438-1157.20170043
O 643.3
A
0438—1157(2017)06—2359—09
刘琪英。
张涛(1990—),男,硕士研究生。
国家自然科学基金项目(51376185,51536009,51576199)。
2017-01-10收到初稿,2017-02-24收到修改稿。
2017-01-10.
Prof. LIU Qiying, liuqy@ms.giec.ac.cn
supported by the National Natural Science Foundation of China(51376185, 51536009, 51576199).

