微波辅助酶解花生粕同步提取多糖和抗氧化肽的工艺研究
江 晨,林荣丽,毕 洁,于丽娜,张初署,王明清,冯楚楚,张建成,孙 杰*,徐同城
(1. 山东省花生研究所,山东 青岛 266100; 2. 青岛农业大学,山东 青岛 266600;3. 山东省农业科学院农产品研究所,山东 济南 250100)
微波辅助酶解花生粕同步提取多糖和抗氧化肽的工艺研究
江 晨1,林荣丽2,毕 洁1,于丽娜1,张初署1,王明清1,冯楚楚1,张建成1,孙 杰1*,徐同城3
(1. 山东省花生研究所,山东 青岛 266100; 2. 青岛农业大学,山东 青岛 266600;3. 山东省农业科学院农产品研究所,山东 济南 250100)
本文以花生饼粕为原料通过微波辅助碱性蛋白酶(Alcalase)水解技术同步提取花生多糖和抗氧化肽,研究了提取反应时间、底物浓度、加酶量及pH值等因素对提取花生多糖和抗氧化肽抗氧化活性的影响。在单因素实验基础上,进行响应面分析实验。结果表明,花生多糖和抗氧化肽的最佳同步提取条件为:底物浓度12%,加酶量0.8mL,反应液pH值8.0,温度50℃。
花生粕;响应面实验;多糖;抗氧化肽;提取工艺
花生粕是花生仁经压榨炼油后的副产品,花生榨油后的花生粕中含蛋白质44%以上[1],大部分作动物饲料利用。国内外研究表明[2-4],花生蛋白质经过酶解得到的多肽类具有特殊的生理功能,如抗高血压、抗氧化作用、免疫调节、促进生长、抗血栓、激素作用、降胆固醇、改善元素吸收和矿物质运输、抑制细菌、病毒和抗癌作用等。花生多肽活性高、应用范围广,近年来成为研究和应用的热点[5-8]。花生粕中除含有大量的蛋白质外,糖类物质也是花生粕中主要组成成分,仅次于蛋白质。花生粕中可溶解性糖含量高达32.50%[9]。大量临床以及药理研究表明,多糖具有降血糖、调节免疫、降血脂、抗氧化、抗肿瘤、保护造血系统、保护肝脏等多种生物活性[10-13]。花生粕中多糖提取工艺有传统的热水浸提、酸提法、碱提法,但是传统方法对多糖结构有一定的破坏,提取效率低。近几年来用酶解技术和超声技术提取多糖成为热点;其中酶解法提取多糖的条件比较温和,可加速多糖的释放或提取[14]。
花生多肽和多糖都是具有多种生物功能的活性物质,之前有大量关于花生多肽及多糖的提取以及抗氧化性的研究[15-22],但是没有二者同步提取技术的报道,本文以花生粕为原料,探讨了利用微波辅助酶解技术同步提取花生多糖和抗氧化肽的工艺条件,为花生粕中同步提取多糖和抗氧化肽提供参考。
1 材料与方法
1.1 仪器与设备
DE-500g万能高速粉碎机(衢州普润日用品有限公司);KQ-300VDE型三频数控超声波清洗器 (昆山市超声仪器有限公司);RE52CS-1旋转蒸发器 (上海亚荣生化仪器厂); XH-100A型祥鹄电脑微波催化合成/萃取仪 (北京祥鹄科技发展有限公司); WFZ UV-4802 型紫外可见分光光度计 (尤尼可仪器有限公司)。
1.2 实验方法
1.2.1 花生粕同步提取多糖和抗氧化肽基本工艺
花生粕→脱脂→抽滤→收集滤液→滤渣按实验设计提取→抽滤→收集滤液→活性检测
① 花生粕脱脂:取200g花生粕,于烘箱中烘干。烘干后的花生粕研磨成粉末,以1∶10(m/v)的比例加入石油醚,30℃震荡5h,随后抽滤。滤渣置于通风橱内去除残余石油醚,收集脱脂后的花生粕,于干燥器中备用。
② 超声溶解:取脱脂后的花生粕28.8g,加入480mL蒸馏水,用玻璃棒搅拌溶解。然后在超声波清洗器中,在一定条件下超声溶解30min。
③ Alcalase蛋白酶水解花生粉:将上述液体在一定pH值下,加入Alcalase酶液(溶液∶酶液=100∶1),在微波催化/合成仪中以微波反应10min。反应结束后,放入100℃水浴中灭活10min。灭酶结束后,立即用冰水浴冷却到室温。
④ 制备抗氧化肽和多糖溶液:酶解溶液经3000r/min离心10min,上清液倒入100mL三角瓶中,离心后的沉淀用少量蒸馏水洗涤后,再经3000r/min离心10min,上清液与第一次离心的上清液合并后,倒入100mL容量瓶中,用少量蒸馏水清洗三角瓶,清洗液也倒入100mL容量瓶,用蒸馏水定容,作为酶解液待测样品。
⑤ 清除DPPH自由基及清除羟自由基抗氧化活性检测参照Amarowicz[23]及徐怀德方法[24]。
1.2.2 单因素实验
分别以不同反应时间、底物浓度、加酶量、微波功率、pH值和温度为因素,考察各单因素对花生多糖和抗氧化肽的清除DPPH自由基及清除羟自由基抗氧化活性的影响。
① 反应时间对花生多糖和抗氧化肽提取率的影响。超声溶解后的花生饼粕溶液用0.5mol/L氢氧化钠溶液调节pH到8.0,加入Alcalase酶液(溶液∶酶液=100∶1)0.8mL(底物浓度为6%),在微波催化/合成仪中以700W微波功率,50℃ 的温度,微波反应时间分别为6、8、10、12、14和16min。反应结束后,放入100℃水浴中灭酶10min。灭酶结束后,立即用冰水浴冷却到室温。按照1.2.1方法制备抗氧化肽和多糖溶液,检测抗氧化活性。
② 底物浓度对花生多糖和抗氧化肽提取率的影响。超声溶解后的花生饼粕溶液用0.5mol/L氢氧化钠溶液调节pH到8.0,加入Alcalase酶液(溶液∶酶液=100∶1)0.8mL(调节底物浓度分别为4%,6%,8%,10%,12%,14%),调节在微波催化/合成仪中以700W微波功率,50℃的温度,微波反应时间为10min。反应结束后,放入100℃水浴中灭酶10min。灭酶结束后,立即用冰水浴冷却到室温。按照1.2.1方法制备抗氧化肽和多糖溶液,检测抗氧化活性。
③ 加酶量对花生多糖和抗氧化肽提取率的影响。超声溶解后的花生饼粕溶液用0.5mol/L氢氧化钠溶液调节pH值到8.0,分别加入Alcalase酶液(溶液∶酶液=100∶1) 0.2,0.4,0.6,0.8,1.0,1.2,1.6mL(底物浓度为6%),在微波催化/合成仪中以700W微波功率,50℃的温度,微波反应时间为10min。反应结束后,放入100℃水浴中灭酶10min。灭酶结束后,立即用冰水浴冷却到室温。按照1.2.1方法制备抗氧化肽和多糖溶液,检测抗氧化活性。
④ pH值对花生多糖和抗氧化肽的提取率的影响。超声溶解后的花生饼粕溶液用0.5mol/L氢氧化钠溶液分别调节pH到7.0,7.5,8.0,8.5,9.0和9.5,加入Alcalase酶液(溶液∶酶液=100∶1)0.8mL(底物浓度为6%),在微波催化/合成仪中以700W微波功率,50℃ 的温度,微波反应时间为10min。反应结束后,放入100℃水浴中灭酶10min。灭酶结束后,立即用冰水浴冷却到室温。按照1.2.1方法制备抗氧化肽和多糖溶液,检测抗氧化活性。
⑤ 微波功率对花生多糖和抗氧化肽提取率的影响。超声溶解后的花生饼粕溶液用0.5mol/L氢氧化钠溶液调节pH到8.0,加入Alcalase酶液(溶液∶酶液=100∶1)0.8mL(底物浓度为6%),在微波催化/合成仪中分别以500W,600W,700W,800W,900W和1000W微波功率,50℃ 的温度,微波反应时间为10min。反应结束后,放入100℃水浴中灭酶10min。灭酶结束后,立即用冰水浴冷却到室温。按照1.2.1方法制备抗氧化肽和多糖溶液,检测抗氧化活性。
⑥ 反应温度对花生多糖和抗氧化肽提取率的影响。超声溶解后的花生饼粕溶液用0.5mol/L氢氧化钠溶液调节pH到8.0,加入Alcalase酶液(溶液∶酶液=100∶1)0.8mL(底物浓度为6%),在微波催化/合成仪中以700w微波功率,分别以45℃,50℃,55℃ ,60℃ 和65℃ 的温度,微波反应时间为10min。反应结束后,放入100℃水浴中灭酶10min。灭酶结束后,立即用冰水浴冷却到室温。按照1.3.1方法制备抗氧化肽和多糖溶液,检测抗氧化活性。
1.2.3 Alcalase 蛋白酶水解花生粕响应面涉及实验
在单因素试验基础上,固定微波催化仪的功率为700W,反应时间为14min,采用Box-Behnken试验设计方案,以底物浓度、加酶量、pH、微波反应温度4个因素,用Design expert 7.0软件设计了四因素三水平的试验组合,实验设计见表1。
2 结果分析
2.1 单因素实验
2.1.1 反应时间对多糖和多肽抗氧化活性影响
图1可看出,提取液的羟基自由基清除率随着反应时间延长出现先升高后降低的趋势,在反应时间为14 min的时候,提取液的羟基自由基清除率高达99.707%,DPPH清除率达92.29%,提取液的DPPH清除和羟基自由基清除率都是最高的,故这时候多糖和多肽的抗氧化活性最大。
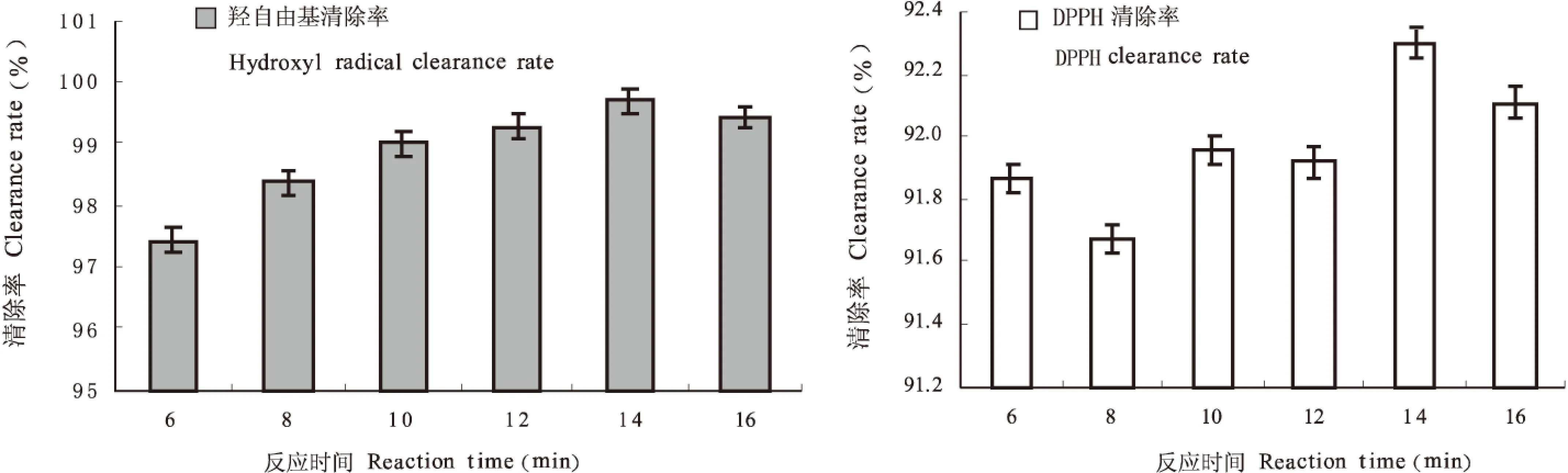
图1 反应时间对多糖和多肽抗氧化活性影响Fig.1 Effect of reaction time on the antioxidant activity of non starch polysaccharides and peptides
2.1.2 底物浓度对多糖和多肽抗氧化活性影响
由图2可以看出,羟自由基清除率在不同的底物浓度下变化相对明显,有先升高后降低的趋势,而DPPH清除率呈逐渐降低的趋势,最高为90.03%,最低为89.12%,前后变化不大。综合两个抗氧化活性检测结果,当待测样品底物浓度为12%的时候,羟基自由基清除率高达99.23%,DPPH清除率是89.27%,此时多糖和多肽的抗氧化性最大。
2.1.3 加酶量对多糖和多肽抗氧化活性影响
由图3可以看出,随着Alcalase蛋白酶加入量的提高,羟自由基清除率和DPPH清除率都有略微先升高后下降的趋势,但是两者在达到最高清除率时加酶量是不同的。加酶量为0.8mL时,DPPH清除率最高达88.194%,此时羟基自由基清除率为97.56%;而加酶量为0.4mL时,羟基自由基清除率达到最高是98.407%,此时DPPH清除率为87.40%。综合两个抗氧化活性检测结果,加酶量为0.6~0.8 mL时多糖和多肽抗氧化活性较大。

图2 底物浓度对多糖和多肽抗氧化活性影响Fig.2 Effect of substrate concentration on the antioxidant activity of non starch polysaccharides and peptides
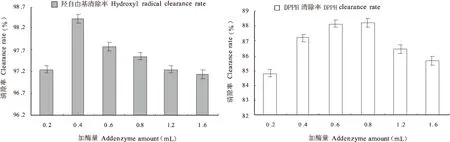
图3 加酶量对多糖和多肽抗氧化活性影响Fig.3 Effect of enzyme adding amount on the antioxidant activity of non starch polysaccharides and peptides

图4 pH对多糖和多肽抗氧化活性影响Fig.4 Effect of pH on the antioxidant activity of non starch polysaccharides and peptides
2.1.4 pH对多糖和多肽抗氧化活性影响
图4可见,羟自由基清除率随pH增大而呈现总体增大,而DPPH清除率随pH增大呈现不断减小。总体来说,pH在7.0~9.0时,提取液的羟自由基清除率保持在97%以上,DPPH清除率保持在75%以上,花生多糖和多肽抗氧化活性较大。
2.1.5 微波功率对多糖和多肽抗氧化活性影响
由图5可以看出,随着微波功率的增大,羟自由基清除率和DPPH清除率都有总体的升高趋势,但是升高的比例不大,考虑到功率的增大对于实验来说成本比较高,选择微波功率为700W进行了后续的响应面实验。

图5 微波功率对多糖和多肽抗氧化活性影响Fig.5 Effect of microwave power on the antioxidant activity of non starch polysaccharides and peptides
2.1.6 温度对多糖和多肽抗氧化活性影响
由图6可以看出,不同反应温度下提取的花生多糖和多肽羟自由基清除率随温度升高呈现先升高后降低趋势,当微波萃取的温度在55℃时达到了最大值,高达99.05%。而DPPH清除率呈现不断升高趋势,在65℃时DPPH清除率最大,高达90.55%,在45℃时清除率为88.63%。其清除率的变化幅度较羟自由基清除率略强。

图6 温度对多糖和多肽抗氧化活性影响Fig.6 Effect of temperature on the antioxidant activity of non starch polysaccharides and peptides
2.2 响应面实验结果
在单因素实验的基础上进行了响应面实验,实验设计与结果见表2。
2.2.1 模型的建立及其显著性检验
用Design Expert软件对表2中的数据进行多元回归拟合,选择对响应值显著的各项,可得样品的抗氧化活性(Y)与底物浓度(A)、提取温度(B)、pH值(C)和加酶量(D)之间的多项回归方程,Y=12.448+2.983A+0.9593B+1.092C-0.678D+0.724AB+0.276AC+0.397AD+0.345BC-0.224BD+0.103CD+2.036A2-1.705B2-1.541C2-1.712D2回归方程显著性检验及方差分析结果见表3。
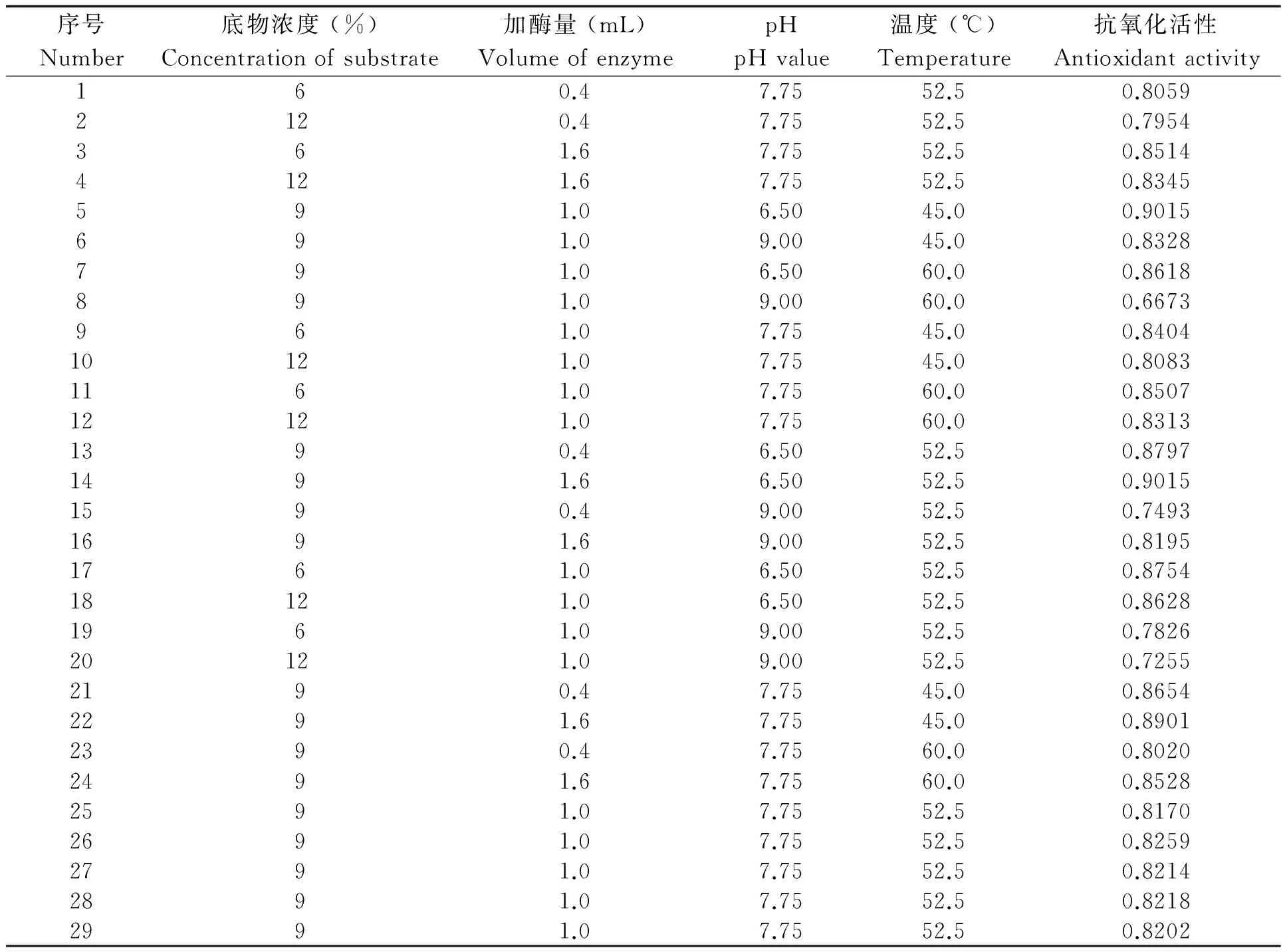
表2 实验设计与结果
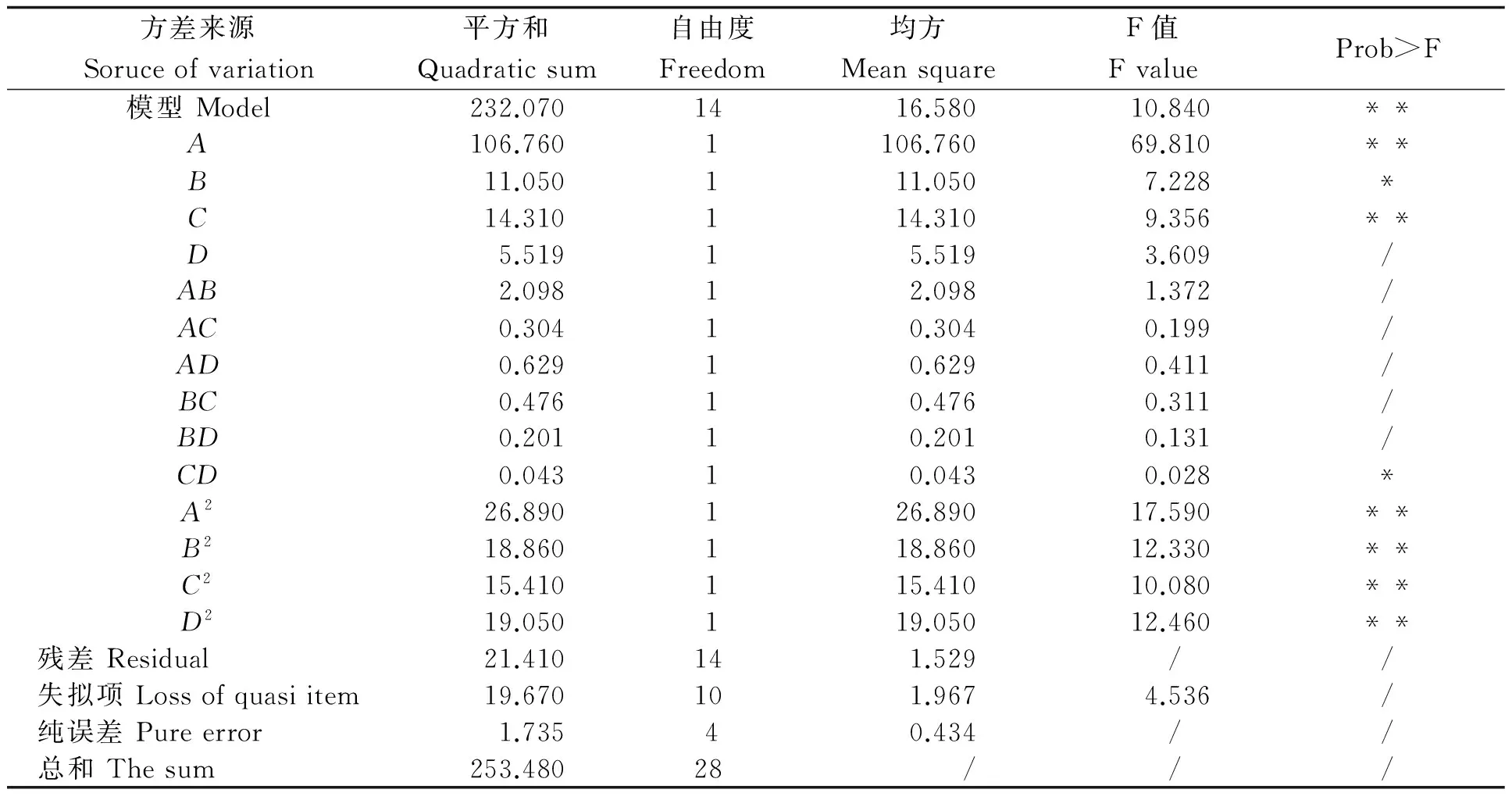
表3 响应面二次回归方程模型方差分析结果
注:Prob>F小于0.05说明模型或考察因素有显著性影响;Prob>F小于0.01说明影响极显著。
Note: Prob>F is less than 0.05, which shows that the model has a significant impact on the factors. Prob>F less than 0.01 indicating extremely significant effect.
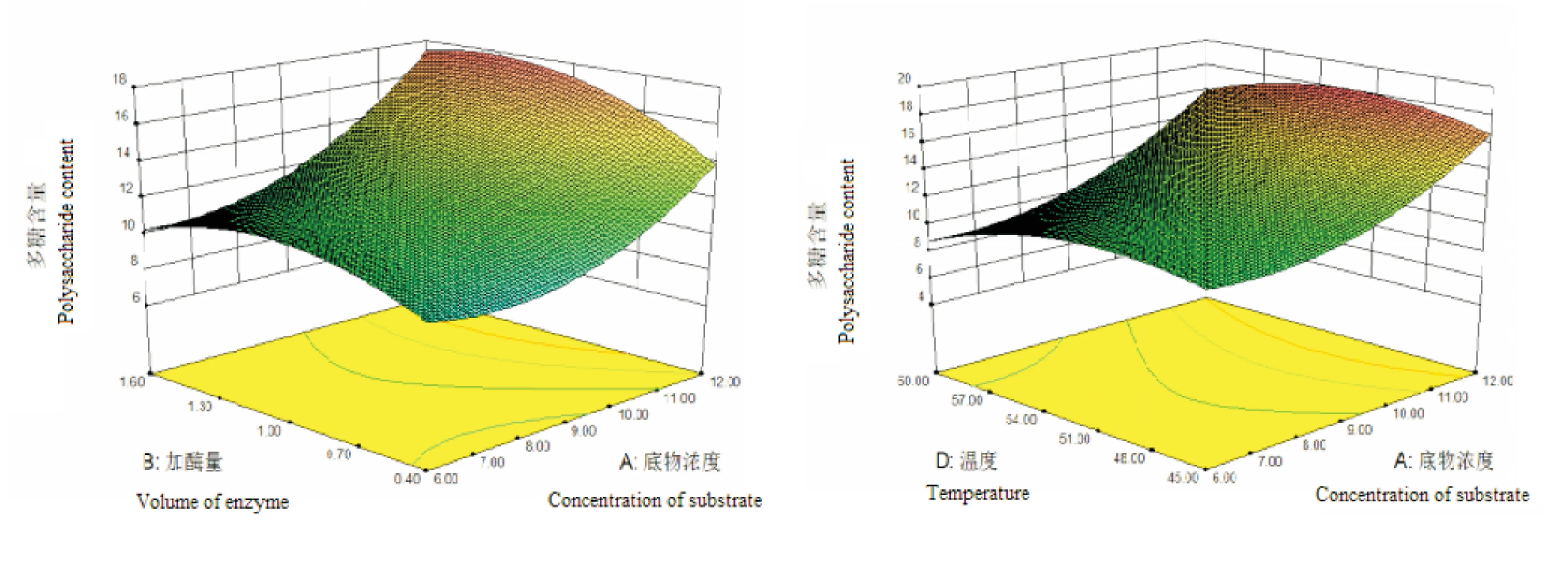
图7 加酶量和底物浓度对多糖含量的影响 图8 温度和底物浓度对多糖含量的影响Fig.7 Effect of enzyme amount and substrate Fig.8 Effect of temperature and substrate concentration on the antioxidant activity of concentration on the antioxidant activity of non starch polysaccharides and peptides non starch polysaccharides and peptides

图9 pH和底物浓度对多糖含量的影响 图10 pH和加酶量对多糖含量的影响Fig.9 Effect of pH and substrate concentration Fig.10 Effect of pH and enzyme amount on the antioxidant activity of non starch on the antioxidant activity of non starch polysaccharides and peptides polysaccharides and peptides

图11 温度和加酶量对多糖含量的影响图12 温度和pH对多糖含量的影响Fig.11 Effect of temperature and enzyme Fig.12 Effect of temperature and pH on amount on the antioxidant activity of non the antioxidant activity of non starch starch polysaccharides and peptides polysaccharides and peptides
由表3可见,模型Prob>F值小于0.01,表明该模型回归方程极显著,不同的实验因子之间差异高度显著,该实验方法是可靠的。模型相关系数的平方即R2为93.42%,回归方程拟合程度良好,失拟性较小,试验误差小,可用该方程代替真实试验点进行分析。各实验因子对响应值的影响不是线性关系,其中A、C、A2、B2、C2、D2对Y值的影响极显著,B、CD对Y值影响显著。通过比较方程中一次项系数绝对值的大小,可以判断影响因子的主次性,本实验中对花生多糖和多肽提取率影响的大小依次为底物浓度、提取温度、pH值和加酶量,其中底物浓度对花生多糖和多肽提取率的影响最大。
2.2.2 双因素交互作用分析
RSM的图形可以直观地反应各因素对响应值的影响,从响应面分析图上可以解析他们之间的相互作用。图7~12是根据分析结果绘制的双因素交互作用图谱。
由图7加酶量与底物浓度的响应面图可知,其交互作用显著,在加酶量较小时,提取率随着加酶量升高而增加,到达一定量后提取率又有减小的趋势,变化幅度较小;但是随着底物浓度的升高,变化幅度变大,说明在不同的加酶量条件下,底物浓度对提取率的影响也不同,因此两者有显著的交互作用。由图8温度与底物浓度的响应面分析图可知,随着底物浓度的增加,提取率是不断变大的,但在不同的温度条件下,其变化的曲线是不相同的,二者交互作用显著。由图9 pH值与底物浓度的响应面分析图可知,随着底物浓度的变化,提取率是不断变化的,但随着pH值的增加,其变化的幅度是不相同的,因此二者有明显的交互作用。由图10~12的响应面分析图可知,温度与pH值、pH与加酶量及温度与加酶量的交互作用明显,存在极值的条件出现在圆心处。
根据分析结果,预测在稳定状态下的最佳工艺条件为:底物浓度11.89%,加酶量1.2 mL,反应液pH值8.04,温度50.1℃,在此条件下理论多糖提取率为17.95%。为了验证分析结果的准确性,采用得到的最佳工艺条件进行了花生多糖和多肽同步提取实验,考虑到实际操作的便利,将提取条件修正为将最佳反应条件略微调整为底物浓度12%,加酶量1.2 mL,反应液pH值为8.0,温度50℃。三次平行实验得到的提取率平均值为17.86%,与预测值相符,说明响应面法对花生多糖和多肽同步提取条件的优化是可行的,具有实际应用价值。
3 结 论
(1) 利用酶解法从花生饼粕中同步提取了花生多糖和多肽,单因素实验结果表明在提取温度40~60℃、底物浓度6%~12%、pH值7.0~9.0和加酶量0.6~1.2mL的范围内,不同提取条件对提取率有显著影响。
(2) 利用响应面分析优化了花生多糖和多肽的同步提取条件,得到各因素间回归方程:Y=12.448+2.983A+0.9593B+1.092C-0.678D+0.724AB+0.276AC+0.397AD+0.345BC-0.224BD+0.103CD+2.036A2-1.705B2-1.541C2-1.712D2
(3) 花生多糖和多肽同步提取的最佳工艺参数为:底物浓度12%,加酶量1.2 mL,反应液pH值为8.0,温度50℃。
[1] 梅娜. 花生粕化学成分的研究[D]. 杨凌:西北农林科技大学, 2007.
[2] Dakappagari N K, Douglas D B, Triozz P L, et al. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine [J]. Cancer Res, 2000,60(14):3782-3789.
[3] Dinakar P, Arvn K. Enhancing the functionality of food proteins by enzymatic modification [J]. Trends in Food Science and Technology, 1996,7(4):120-125.
[4] Tang L, Sun J, Zhang Zhang H C, et al.Evaluation of physicochemical and antioxidant properties of peanut protein hydrolysate[J]. PLOS ONE, 2012, 7 (5): 5-13.
[5] 张伟,孙智达,徐志宏. 花生多肽的制备及生理功能评价的研究进展[J]. 中国油脂,2007,32(1):74-76.
[6] 何东平,张世宏. 冷榨花生饼制备花生多肽的研究[J]. 中国油脂,2004,29(11):18-20.
[7] 陈贵堂,赵立艳,丛涛,等. 花生多肽的制备及其对氧化损伤模型小鼠抗氧化作用的研究[J].食品科学,2007,28(3):324-327.
[8] 史军,王金水,蔡凤英,等. 花生蛋白酶解条件及活性肽抗氧化特性研究[J]. 河南工业大学学报:自然科学版,2006,27(6):29-34.
[9] 梅娜, 周文明, 胡晓玉, 等. 花生粕营养成分分析[J]. 西北农业学报, 2007,16(3):96-99.
[10] 方积年, 丁侃. 天然药物—多糖的主要生物活性及分离纯化[J].中国天然药物化学,2007,5(5):338-347.
[11] Jiang B, Zhang H Y, Liu C J, et al. Extraction of water-soluble polysaccharide and the antioxidant activity from Ginkgo biloba leaves [J]. Medicinal Chemistry Research, 2010, 19(3):262-270.
[12] Liu W, Zheng Y, Zhang Z Z, et al. Hypoglycemic, hypolipidemic and antioxidant effects ofSarcandraglabrapolysaccharide in type 2 diabetic mice [J]. Food & Function, 2014, 5(11):2850~2860.
[13] 高思思, 高航, 张文静,等. 微波辅助提取花生粕多糖的五种脱蛋白方法研究[J]. 粮食与油脂, 2015, 28(12):29-32.
[14] 阎欲晓, 唐斌. 超声波协同复合酶法提取花生粕多糖工艺优化[J]. 食品科技,2013,38(4):186-190.
[15] 姜楠, 刘红芝, 刘丽,等. 花生粕多糖的制备、结构表征及功能评价研究进展[J]. 中国粮油学报,2013, 28(12): 119-123.
[16] 林勉, 刘通讯. 内肽酶与端解酶水解花生粕蛋白的研究[J]. 食品科学, 2000,21:22-25.
[26] Hwang J Y, Shue Y S, Chang H M. Antioxidative activity of roasted and defatted peanut kernels[J]. Food Research International, 2001,34: 639-647.
[18] 谭斌, 曾凡坤, 吴永娴. 花生肽的酶法生产工艺研究[J]. 食品与机械, 2000(3):14-17.
[19] 李晓刚, 张永丹. 花生粕的酶解新工艺研究[J]. 食品工业科技, 2004(2):102-103.
[20] 陈贵堂, 赵立艳, 王岁楼. 制备花生抗氧化肽的蛋白酶筛工艺[J]. 中国粮油学报, 2008,23(3):164-168.
[21] 梁蓉, 杨瑞金, 王璋. 高温花生粕酶法制备低苦味多肽的研究[J]. 中国油脂, 2008,33:24-28.
[22] 高明侠, 苗敬芝, 吕兆启. 超滤技术分离花生抗氧化肽及其性能研究[J]. 食品科学, 2009,30:54-57.
[23] Amarowicz R, Naczk M, Shahidi F. Antioxidant activity of various fractions of non-tanin phenolics of canola hulls[J]. Journal of Agriculture Food Chemistry, 2000, 48:2755-2759.
[24] 徐怀德,闫宁环,陈伟,等. 黑莓原花青素超声波辅助提取优化及抗氧化性研究[J]. 农业工程学报,2008,24(2):264-269.
Microwave Assisted Enzymatic Hydrolysis Technology on Simultaneous Extraction of Polysaccharide and Antioxidant Peptide from Peanut Meal
JIANG Chen1, LIN Rong-li2, BI Jie1, YU Li-na1, ZHANG Chu-shu1, WANG Ming-qing1, FENG Chu-chu1, ZHANG Jian-cheng1, SUN Jie1*, XU Tong-cheng3
(1.Shandong Peanut Research Institute, Qingdao 266100, China; 2. Qingdao Agri. Univ., Qingdao 266600, China; 3. Institute of Agricultural Products, Shandong Academy of Agri. Sci., Jinan 250100, China;)
Peanut polysaccharides and antioxidant peptides were extracted from peanut meal at the same time by using microwave assisted extraction and alkaline protease hydrolysis methods. The factors,such as reaction time, extraction temperature, volume of enzyme and the pH value, which influence the antioxidant activities of the extracted peanut polysaccharides and antioxidant peptides were systematically discussed in this article. Based on the single factor experiments, the response surface analysis results showed that the optimum extraction condition for peanut polysaccharides and antioxidant peptides is:substrate concentration 12%, volume of enzyme 0.8 mL, pH value 8.0, and extraction temperature of 50℃.
peanut meal; response surface experiment; polysaccharide; antioxidant peptide; extraction technology
10.14001/j.issn.1002-4093.2017.01.008
2016-12-17
山东省农业科学院农业创新工程(CXGC2016B16);山东省农业科学院青年英才培养项目;山东省农业科学院青年科研基金(2014QNM22);山东省自主创新与成果转化(2014CGZH0709);山东省重点研发计划(2015GGX108006);山东省基金(ZR2016YL021,ZR2016CM43);山东省农业科学院青年科研基金(2016CGPY10);山东省农科院重大科技成果培育计划(2016CGPY10)
S565.2099;TS209
A
作者:江晨(1983-),女,山东青岛人,山东省花生研究所农艺师,本科,主要从事花生营养与食品加工的研究。
*通讯作者:孙杰,博士,副研究员,主要从事功能食品方面的研究。Tel:0532-87611087,E-mail: sjj605@163.com

