赛山梅组培快繁技术初探
张 琦,臧巧路,林新春
(浙江农林大学 亚热带森林培育国家重点实验室培养基地,浙江 临安 311300)
赛山梅组培快繁技术初探
张 琦,臧巧路,林新春
(浙江农林大学 亚热带森林培育国家重点实验室培养基地,浙江 临安 311300)
以赛山梅Styrax confusus的带芽茎段为外植体,MS为基本培养基,对其进行微繁实验。结果表明,赛山梅的最佳增殖培养基为MS+1 mg·L-1BA,其最高增殖系数为4.00,且芽丛生长旺盛;最佳生根培养基为1/2MS +1 mg·L-1IBA,生根率为40%,根系较长且健壮;试管苗移栽至泥炭、蛭石、珍珠岩配制比例为1:1:1的混合基质中,成活率为58%。
赛山梅;组织培养;快繁
赛山梅Styrax co nfusus,安息香科Styracaceae安息香属Styrax落叶乔木,广泛分布于浙江、江苏、四川、广东、广西、福建等省海拔100 ~ 1 700 m的丘陵、山地疏林中[1-2]。安息香属植物具有生长迅速的特点而被作为一种速生树种利用;安息香科中秤锤树Sinojackia xylocarpa,野茉莉Styrax japonicus等植物的花或成熟果实颜色艳丽,可作为观赏植物[3];另有中华安息香S. ch inensis的树干通直,材质坚硬,纹理清晰致密,便于加工,可作为工业用材;安息香属植物分泌的树脂称“安息香”,含较多的香脂酸,是贵重的药材,还可用于制作高级香料[4-5]。安息香具有提神、活血、止痛等功能,安息香属植物具有很高的经济及社会价值而具有广阔的市场前景。安息香属植物的传统繁殖技术主要有种子繁殖、扦插繁殖、根蘖繁殖,但这些技术往往繁殖周期较长、增殖系数较低,且受季节限制,而组织培养具有繁殖速度快、增殖系数大、缩短生产周期、不受季节限制等优点,已在各种观赏、药用和材用植物中得到了广泛应用[6-8]。赛山梅传统的繁殖方式为种子繁殖,其繁殖周期过长,种子发芽率低,无法满足市场需求,利用植物组织培养技术有望实现其快速繁殖[9-11]。目前在安息香属植物中,仅对越南安息香Styrax tonkinensis(又名白花树)进行了组培快繁技术研究[12]。本实验通过植物组织培养技术来实现赛山梅的离体快速繁殖,为赛山梅的无性快繁和产业化育苗提供技术支持,对安息香属其他树种的组织培养具有重要的参考和借鉴价值。
1 材料与方法
1.1 试验材料
试验材料为赛山梅的无菌试管苗,来自浙江农林大学智能实验楼培养室,赛山梅种子来自浙江省林业科学研究院。
1.2 试验方法
1.2.1 初代培养 选用MS为赛山梅增殖培养的基本培养基,添加BA浓度为0.3 mg·L-1,选取长势良好带有2 ~ 5个芽的茎段为试验材料,每试管一茎段。4周后,选取生长良好、健壮的植株进行实验。
1.2.2 芽增殖培养 选用MS为赛山梅芽增殖培养的基本培养基,采用完全随机区组设计,6苄基腺嘌呤(BA)设置0,0.3 mg·L-1,1.0 mg·L-13个浓度梯度,萘乙酸(NAA)设置0,1.0 mg·L-1,3 mg·L-13个浓度梯度,共9组处理(表1)。各培养基中添加30 g·L-1蔗糖以及3 g·L-1固化剂,pH为5.7。选取长度2 cm左右,带有一个顶芽且长势一致的茎段为试验材料(图1a),接种于增殖培养基中。每组处理20管,4周后,统计芽的生长和增殖状况,实验重复2次。
1.2.3 生根培养 选用 1/2 MS为赛山梅生根培养的基本培养基,分别添加0,0.3,1.0,3.0,10.0 mg·L-1浓度的吲哚乙酸(IBA)和1,2,4 mg·L-1浓度的NAA,共8组处理(表2)。各培养基中添加30 g·L-1蔗糖以及3 g·L-1固化剂,pH为5.7。选取芽长大于1 cm和长势一致的带芽茎段为试验材料,接种于生根培养基中。每组处理20管,4周后,统计根的生长状况,实验重复2次。
1.2.4 试管苗移栽 选取高4 ~ 5 cm,根系长且粗壮的试管苗于强光下(20 000 lx)炼苗1周。1周后取出试管苗,在40℃左右温水中洗净残余的培养基后,移栽到混合基质中(泥炭:蛭石:珍珠岩=1:1:1),4周后统计移栽成活率。
1.2.5 培养条件和数据统计分析 光培养条件:温度(25±2)℃,光周期16 h/8 h,光照强度2 400 lx;芽增殖系数=新生总芽数/接种总芽数;试管苗根诱导率=诱导出根的试管苗/试管苗总数×100%;运用SPSS 19.0与DPS 6.50进行数据分析,方差分析采用Duncan法。
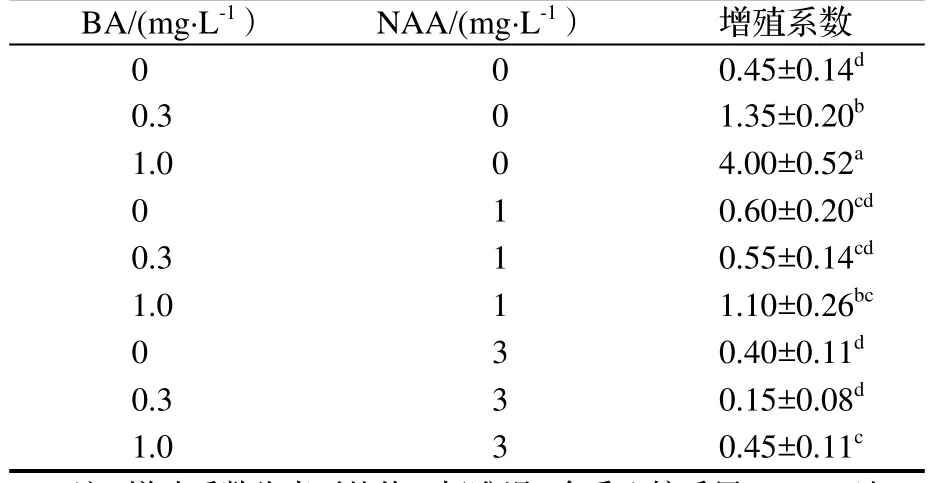
表1 不同植物激素对赛山梅增殖的影响Table 1 Effect of different hormones on proliferation of shoot
2 结果与分析
2.1不同浓度BA和NAA组合对赛山梅芽增殖的影响
不同的NAA和BA配比会对赛山梅芽的增殖产生不同的影响。从表1可以看出,NAA浓度不变时,随BA浓度的增加,芽的增殖系数总体呈上升的趋势;当BA浓度不变时,随NAA浓度的增加,芽的增殖系数呈下降趋势。在BA浓度1.0 mg·L-1,NAA浓度为0 mg·L-1时,叶片嫩绿,不易褐化,芽生长旺盛(图1b)且增殖系数达到4.00。实验显示,赛山梅的最佳增殖培养基为MS+1mg·L-1BA。
2.2 不同浓度的IBA和NAA对赛山梅生根诱导的影响
5个不同浓度的IBA和3个不同浓度的NAA对赛山梅进行生根诱导。由表2可知,随着IBA浓度的增加,根的数量先增加后减少,在浓度为1 mg·L-1和3 mg·L-1的IBA中达到峰值,但在含有3 mg·L-1IBA的培养基中诱导出的根基部有愈伤化现象(图1c)。在1 mg·L-1浓度的IBA中,根粗壮,较长,生根数也最多(图1d)。而

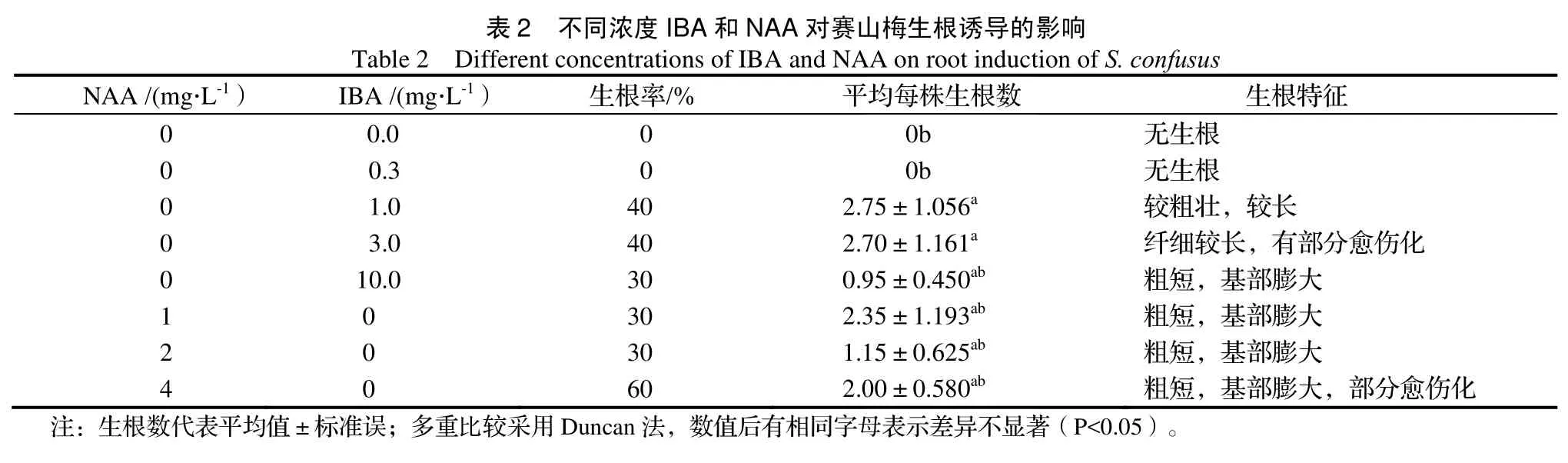
2 不同浓度IBA ent concentration生根率/% NAA /(mmg·L-1) IB表2 Table 2 Differe BA /(mg·L-1)A和NAA对赛山ns of IBA and NA % 平 生根特征0影响tion of S. confusus 0.00无生根根0 0 0 0 1 2 4 0.3 1.0 3.0 10.0 0 0 0 0 40 40 30 30 30 60 2.7 2.7 0.9 2.3 1.1 2.0无生根较粗壮纤细较粗短,粗短,粗短,粗短,根壮,较长较长,有部分愈伤基部膨大基部膨大基部膨大基部膨大,部分伤化分愈伤化注:生根数代代表平均值±标准准误;多重比较采采用Duncan法,数数值后有相同字母山梅生根诱导的影AA on root induct平均每株生根数0b 0b 75±1.056a70±1.161a95±0.450ab35±1.193ab15±0.625ab00±0.580ab母表示差异不显著著(P<0.05)。



研究结果表明,一定浓度的BA可以促进芽的增殖,而NAA会抑制芽的增殖且随着NAA浓度的增加抑制作用更强。该结论与张亮亮的研究结果一致,NAA对安息香属的白花树芽增殖也有抑制作用[12],但白花树的最佳增殖的BA的浓度为0.3 mg·L-1,而赛山梅最佳的增殖所需BA浓度更高,为1 mg·L-1。
大多研究认为,IBA和NAA都有促进植株生根的作用[13-14]。本实验结果表明一定浓度的IBA,NAA都可以促进生根,但过高质量浓度的IBA易导致基部膨大,出现愈伤化现象严重且根较短,不利于移栽成活,这与陈芳等的研究存在较大差异[10]。不同的木本植物对生根诱导所需生长调节剂的浓度不同,因此 NAA的浓度不适宜用来进行赛山梅试管苗的诱导。更低浓度的NAA是否有利于促进赛山梅生根将在今后的实验中做进一步论证。同时,本研究中试管苗的生根率不高,仍需对生根条件进行优化。
[1] 中国科学院中国植物志编辑委员会. 中国植物志(第60卷、第2分册)[M]. 北京:科学出版社,1987:113.
[2] 黄淑美. 安息香科的系统位置及地理分布[J]. 亚热带热带植物学报,1994,2(4):15-33.
[3] 彭重华,张程,巫涛,等. 湖南安息香科种质资源及其在园林中的应用前景[J]. 广东农业科学,2011,38(7):76-79.
[4] 王峰,鄢琼芳,华会明. 安息香属植物化学成分及药理作用研究进展[J]. 广东药学院学报,2009,25(5):541-545.
[5] 王一波,陈欢,王淑美,等. 中药安息香药理作用研究进展[J]. 亚太传统医药,2015,11(3):48-49.
[6] 张程. 中国安息香科植物种质资源及研究进展[J]. 江西林业科技,2010,(6):42-46.
[7] 曹天旭,宿肇辉,韩超慧. 铁皮石斛组培快繁技术的研究[J]. 黑龙江农业科学,2014,(5):30-34.
[8] 闫海霞,蒋月喜,黄昌艳,等. 月季‘卡罗拉’的组培快繁技术[J]. 热带作物学报,2016,37(9):1741-1746.
[9] 王江民. 安息香的生产与栽培技术[J]. 农村实用技术,2005,(2):17-18.
[10] 陈芳,白平,李勇杰,等. 西南桦优良无性系组培快繁技术[J]. 西部林业科学,2015,44(5):8-12.
[11] 董玉玲,陈茂盛,王秀兰,等. 木本油料作物美藤果组织培养植株再生体系的建立[J]. 分子植物育种:2016,14(2):462-470.
[12] 张亮亮,何云核,柳新红,等. 白花树组织培养技术研究[J]. 浙江林业科技,2013,33(3):16-19.
[13] Chand P K, Sahoo Y, Pattnaik S K, et al. In vitro meristem culture-an efficient ex situ conservation strategy for elite mulberry germplasm. In: Mohanty RC (ed) Environment: change and management[M]. Kamla Raj Enterprises,New Delhi,India, 1995,127-133.
[14] Saxena S. In vitro propagation of the bamboo (Bambusatulda Roxb.) through shoot proliferation[J]. Plant Cell Rep,1990,9(8):431-434.
Experiment on Microprapagation of Styrax confuses
ZHANG Qi,ZANG Qiao-lu,LIN Xin-chun
(State Key Laboratory Cultivation Base of Subtropical Silviculture, Zhejiang A & F University, Lin’an 311300, China)
Experiments were conducted on tissue culture of Styrax confuses by stem with bud as explants. The results showed that MS supplemented with 1 mg/L of BA had the best effect for bud multiplication, with the highest proliferation coefficient of 4.00, and the bud cluster grew well. The best medium for rooting was 1/2 MS supplemented with 1 mg/L of IBA, with rooting rate up to 40%, and the roots were long and strong. Plantlets were transplanted in medium of peat, vermiculite and perlite with a ratio at 1:1:1. Survival rate was 58% after 4 weeks.
Styrax; S. confusus; tissue culture; micropropagation
S723.1+32.6
A
1001-3776(2017)01-0051-04
10.3969/j.issn.1001-3776.2017.01.009
2016-09-21 ;
2016-12-31
浙江省科技厅项目(2012C22097),浙江农林大学学生科技创新项目(1011210047)
张琦,硕士研究生,从事森林培育方向研究;E-mail:754989034@qq.com。通信作者:林新春,教授,博士,从事植物生物技术研究;E-mail:lxc@zafu.edu.cn。

