酸枣仁皂苷A对糖尿病模型大鼠肾小球细胞凋亡的影响
司芹芹,牛晓红,李俊岩,杨海卿
(山西省长治医学院附属和济医院内分泌科,山西长治 046000)
酸枣仁皂苷A对糖尿病模型大鼠肾小球细胞凋亡的影响
司芹芹,牛晓红,李俊岩,杨海卿
(山西省长治医学院附属和济医院内分泌科,山西长治 046000)
目的研究酸枣仁皂苷A对糖尿病模型大鼠肾小球细胞凋亡的影响,并初步探讨其可能的机制。方法SD大鼠ip给予链脲菌素100 mg·kg-1,空腹血糖>16 mmol·L-1显示造模成功。糖尿病模型大鼠ip给予酸枣仁皂苷A 10和20 mg·kg-1,共4周。酶联免疫检测法测定大鼠血液中糖化血红蛋白(GHb)的含量,过碘酸雪夫(PAS)染色观察肾小球组织形态,TUNEL法检测肾小球细胞凋亡,免疫组化法检测肾组织中Bcl-2和Bax蛋白表达,Western蛋白印迹法检测肾组织中活化的胱天蛋白酶3和活化的胱天蛋白酶9蛋白表达,实时荧光PCR检测肾组织中转化生长因子β1(TGF-β1)mRNA表达。结果与模型组相比,给予酸枣仁皂苷A10和20 mg·kg-1处理的大鼠血液中GHb含量均显著下降(mmol·L-1:10.9±0.8vs17.5±1.5,P<0.05;7.6±0.5vs17.5±1.5,P<0.05),肾小球的PAS阳性得分均明显降低(26.8±3.2vs36.4±3.8,P<0.05;18.4±2.1vs36.4±3.8,P<0.05),肾小球细胞凋亡均减少〔(8.2±0.8)%vs(17.6±1.8)%,P<0.05;(5.1± 0.5)%vs(17.6±1.8)%,P<0.05〕,肾组织中Bcl-2蛋白表达均显著增加(P<0.05),而Bax(P<0.05)、活化的胱天蛋白酶9(P<0.05)和活化的胱天蛋白酶3(P<0.05)蛋白表达均显著降低,肾组织中TGF-β1mRNA明显降低(P<0.05)。结论酸枣仁皂苷A可以抑制糖尿病模型大鼠肾小球细胞凋亡,可能与内源性线粒体通路和TGF-β1mRNA的表达有关。
糖尿病肾病;酸枣仁皂苷A;细胞凋亡;内源性线粒体通路;转化生长因子β1
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的微血管并发症之一,主要特征表现为肾小球和肾小管的结构与功能的改变,体现为高滤过、高灌注状态与肾小球滤过屏障的改变[1]。由于DN的起病隐匿,早期无明显临床症状,但随病情发展与病变程度加剧,是导致终末期肾病和患者死亡的主要原因。据统计,全球糖尿病患者中有20%~40%由于终末期肾病需要进行换肾替代治疗。DN的发病机制十分复杂,迄今尚未明确。
酸枣仁皂苷A(jujuboside A)是中药酸枣仁的主要成分之一。多项研究发现,酸枣仁皂苷具有镇静作用,减少小鼠的自发活动,呈剂量依赖性拮抗苯丙胺的中枢兴奋作用[2]。国内学者研究发现,正常大鼠腹腔注射酸枣仁皂苷后,总胆固醇和低密度脂蛋白胆固醇的含量明显降低,高密度脂蛋白胆固醇含量明显升高,提示酸枣仁皂苷A具有调节血脂和胆固醇的作用[3]。尚无关于酸枣仁皂苷A对DN的相关研究,本研究通过制备糖尿病模型大鼠,观察酸枣仁皂苷A对DN的影响,并初步探讨可能的作用机制。
1 材料与方法
1.1 主要试剂和主要仪器
酸枣仁皂苷A购自上海邦景实业有限公司;链脲菌素(streptozotocin,STZ)购自美国Sigma公司(配制溶液:将STZ溶于pH为4.2、柠檬酸/柠檬酸钠0.1 mol·L-1缓冲液中);糖化血红蛋白(glycated hemoglobin,GHb)ELISA试剂盒购自上海信裕生物科技有限公司;TUNEL试剂盒购自北京中杉金桥生物技术有限公司。辣根过氧化酶(HRP)标记Bcl-2兔单克隆IgG抗体、HRP标记Bcl-2相关X蛋白(Bax)和β肌动蛋白兔单克隆IgG抗体购自碧云天生物技术有限公司;HRP标记活化的胱天蛋白酶9兔单克隆IgG抗体和HRP标记活化的胱天蛋白酶3兔单克隆IgG抗体购自美国Santa curz公司。Thermo scientific 3100二氧化碳培养箱(美国Thermo公司);微注射仪器(美国,World Preci⁃sion Instruments,Sarasota);荧光倒置显微镜(美国Evos FL,AMG,USA);显影仪(Thermo Fisher Scientific Inc.)。
1.2 动物分组和糖尿病模型的制备
健康雄性SD大鼠40只,体质量200~220 g由长治医学院动物实验中心提供,动物许可证号为SCXK(晋)2013-0002,动物合格证:0001152。饲养于室温21~25℃,空气流通,昼夜各12 h,进行适应性饲养1周,正常进食饮水。
除正常对照组(n=10)外,其他大鼠造模前禁食18 h,ip给予STZ 100 mg·kg-1,注射后72 h眼内眦静脉取血测空腹血糖,若>16 mmol·L-1则显示造模成功。正常对照组ip给予等量的pH为4.2、柠檬酸/柠檬酸钠0.1 mol·L-1缓冲液。造模成功的大鼠随机分为模型组、酸枣仁皂苷(ip)10和20 mg·kg-1组,每组10只,模型组给予等量的生理盐水,共给药4周。
1.3 血液中糖化血红蛋白含量测定
严格按照GHb ELISA试剂盒进行操作,测定各组大鼠血液中GHb的含量。
1.4 PAS染色观察肾组织病理形态
给药完成后,将大鼠处死,分离切除肾,用生理盐水冲洗干净,置于4%多聚甲醛溶液,制作石蜡切片,常规脱蜡,加入高碘酸染色10 min,蒸馏水冲洗,加Schiff氏液染色15 min,倾去液体,加偏重亚硫酸钠2 min,共2次,自来水清洗10 min,显示红色后蒸馏水冲洗,苏木素复染2 min,梯度乙醇脱水,二甲苯透明,中性树脂封片。肾小球内紫红色为PAS染色阳性区,每组任选6张样本计算肾小球的PAS阳性得分平均值。
1.5 TUNEL法检测肾小球细胞凋亡
取大鼠肾石蜡切片用PBS漂洗15 min,加入蛋白酶K 20 mg·L-1工作液,37℃孵育10 min,4%多聚甲醛固定5 min,加入100 μL平衡液10 min,滴加Tunel反应液,并于湿盒中37℃避光孵育30 min,终止反应,PBS漂洗3次,滴入DAPI染液,孵育15 min封片。将切片置于显微镜下观察,细胞核中的棕黄色颗粒显示为凋亡细胞。根据凋亡细胞分布情况在400倍光镜下,每组任选6张样本切片,每张切片拍摄7个阳性视野,每个视野计数200个细胞,以凋亡细胞数所占百分比作为凋亡指数。
1.6 免疫组化检测肾小球Bcl-2和Bax蛋白表达
严格按照试剂盒说明书操作,将石蜡切片常规脱蜡,微波修复,滴入3%H2O2,室温孵育15 min,加入封闭液,室温静置30 min,加入相应一抗Bcl-2(1∶50)、Bax(1∶50),4℃孵育过夜,随后加入HRP标记羊抗兔二抗(1∶100),37℃孵育30 min,DAB显色。光镜下观察,每组任选6张样品切片,每张切片随机选取5个视野,计算阳性细胞率。评分方法:阳性细胞率≤1%为0分,2%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;无染色为0分,弱强度染色为1分,中等强度染色为2分,强染色为3分;以阳性细胞率和染色强度乘积进行综合判断:0~1分为阴性(-);2~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++)。
1.7 Western蛋白印迹法检测活化的胱天蛋白酶3和活化的胱天蛋白酶9蛋白表达
每组任取6只大鼠肾组织,用RIPA细胞裂解液裂解,提取总蛋白后采用BCA法定量,调整蛋白质浓度。取适量裂解产物,上样,进行SDS-PAGE电泳,电转至硝酸纤维素膜,加入5%脱脂奶粉室温封闭1 h,加入抗活化胱天蛋白酶3(1∶2000)、活化胱天蛋白酶9(1∶1000)和β肌动蛋白(1∶4000)抗体(一抗),4℃孵育过夜,洗膜,加入HRP标记山羊抗兔IgG抗体(二抗)(1∶2000)室温孵育1 h,洗膜,使用化学发光法试剂盒对PVDF膜进行曝光显影,成像扫描分析系统测定目的和内参条带的积分吸光度值。
1.8 实时荧光定量PCR(qPCR)检测转化生长因子β11(transforminggrowthfactor-β11,TGF-β11)mRNA表达
每组任取6只大鼠肾组织,按照Trizol说明书提取总RNA,逆转录合成cDNA,采用PCR仪进行扩增,所用引物:TGF-β1:上游:5’-GGACTACTAC⁃GCCAAAGAAG-3’,下游:5’-TCAAAAGACGC⁃CACTCAGG-3’;GAPDH:上游:5’-GGT⁃GAAGGTCGGTGTGAACG-3’,下游:5’-CTC⁃GCTCCTGGAAGATGGTG-3’。扩增条件:93℃30 s,64℃40 s,73℃40 s,共31个循环,75℃延伸3 min。所得结果直接在荧光定量操作系统中进行比较分析,目标基因的相对定量用2-△△Ct计算。
1.8 统计学分析
实验结果采用SPSS15.0统计软件分析,实验结果数据以x±s表示,组间差异采用Bonferroni校正的t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 酸枣仁皂苷A对糖尿病模型大鼠血液中糖化血红蛋白含量的影响
表1结果显示,与正常对照组相比,模型组大鼠血液中GHb含量显著升高(P<0.05);与模型组相比,酸枣仁皂苷A 10和20 mg·kg-1组大鼠血液中GHb含量明显降低(P<0.05)。
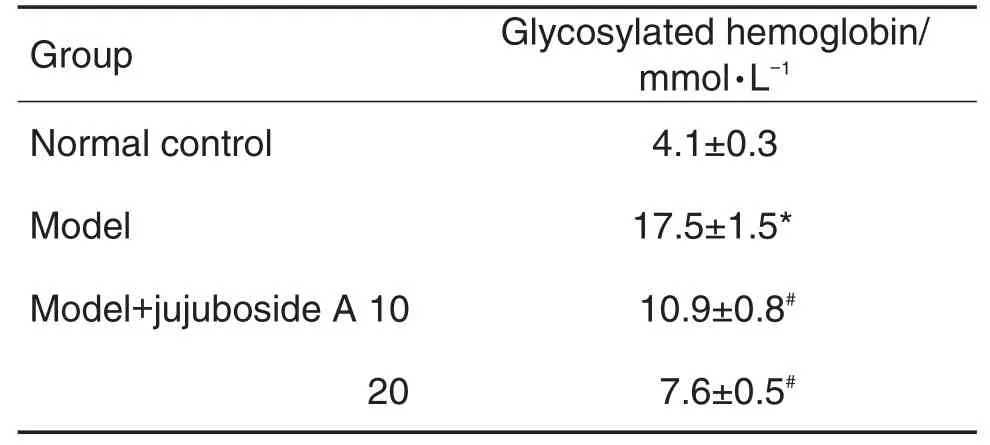
Tab.1 Effect of jujuboside A on content of glycosylat⁃ed hemoglobin in diabetic rats
2.2 酸枣仁皂苷A对糖尿病模型大鼠肾小球组织形态的影响
如图1A所示,正常对照组肾小球均匀光滑;模型组肾小球体积增大,肾小球膜区增宽,基质增厚,PAS染色明显加深,肾小管无明显改变;给予酸枣仁皂苷A后病变减轻。半定量数据结果显示(图1B),与正常对照组相比,模型组大鼠肾组织中肾小球PAS阳性得分显著升高(36.4±3.8vs9.8±0.7,P<0.05);与模型组相比,分别给予酸枣仁皂苷A 10和20 mg·kg-1处理后,肾小球PAS阳性得分降低(26.8±3.2vs36.4±3.8,P<0.05;18.4±2.1vs36.4±3.8,P<0.05),且20 mg·kg-1组分值降低幅度更大。
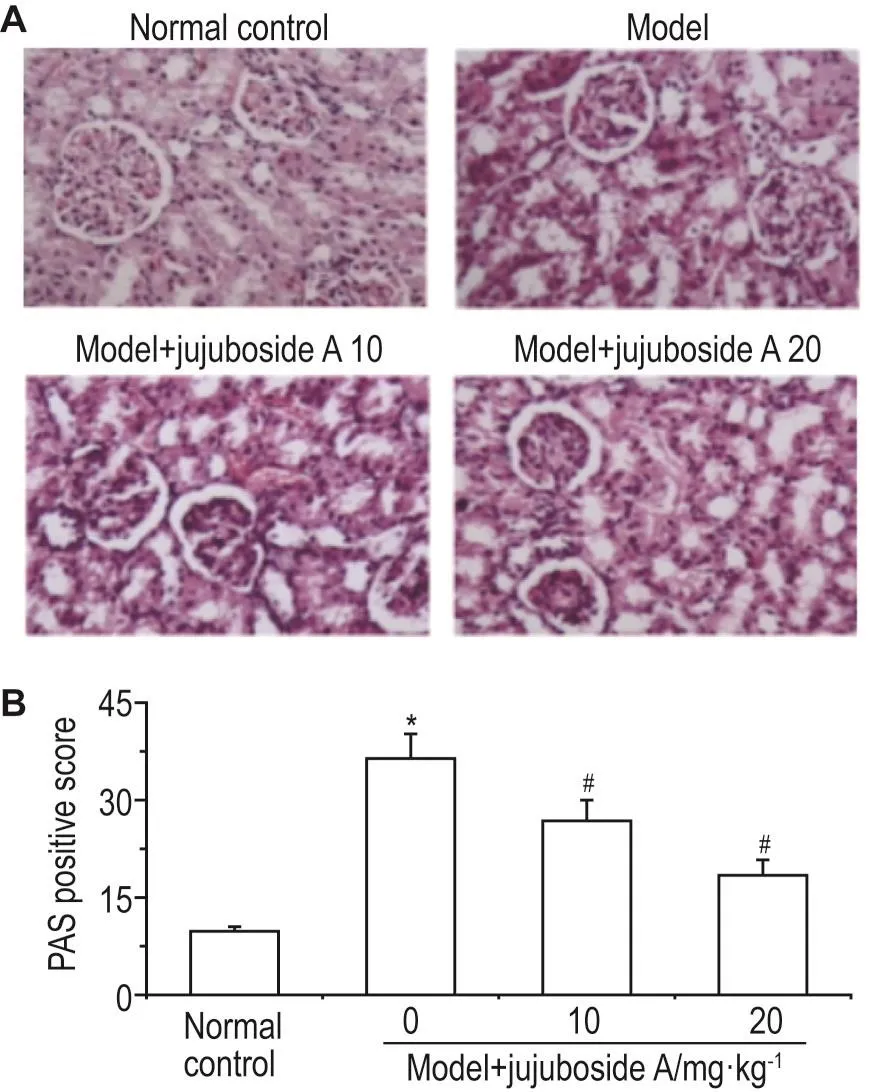
Fig.1 Effect of jujuboside A on changes of glomerular morphology in diabetic rats observed by PAS stain⁃ing(×400).See Tab.1 for the treatment.B was the semi-quan⁃titative result of A.n=6.*P<0.05,compared with normal con⁃trol group;#P<0.05,compared with model group.
2.3 酸枣仁皂苷A对糖尿病模型大鼠肾小球细胞凋亡的影响
如图2A所示,模型组肾小球细胞TUNEL染色明显加深,给予酸枣仁皂苷A后,TUNEL染色明显变浅。半定量数据结果显示(图2B),与正常对照组相比,模型组大鼠的肾小球细胞凋亡显著增加〔(17.6±1.8)%vs(0.5±0.1)%,P<0.05〕;与模型组相比,分别给予酸枣仁皂苷A 10和20 mg·kg-1处理后,大鼠的肾小球细胞凋亡明显减少〔(8.2± 0.8)%vs(17.6±1.8)%,P<0.05;(5.1±0.5)%vs(17.6±1.8)%,P<0.05〕。
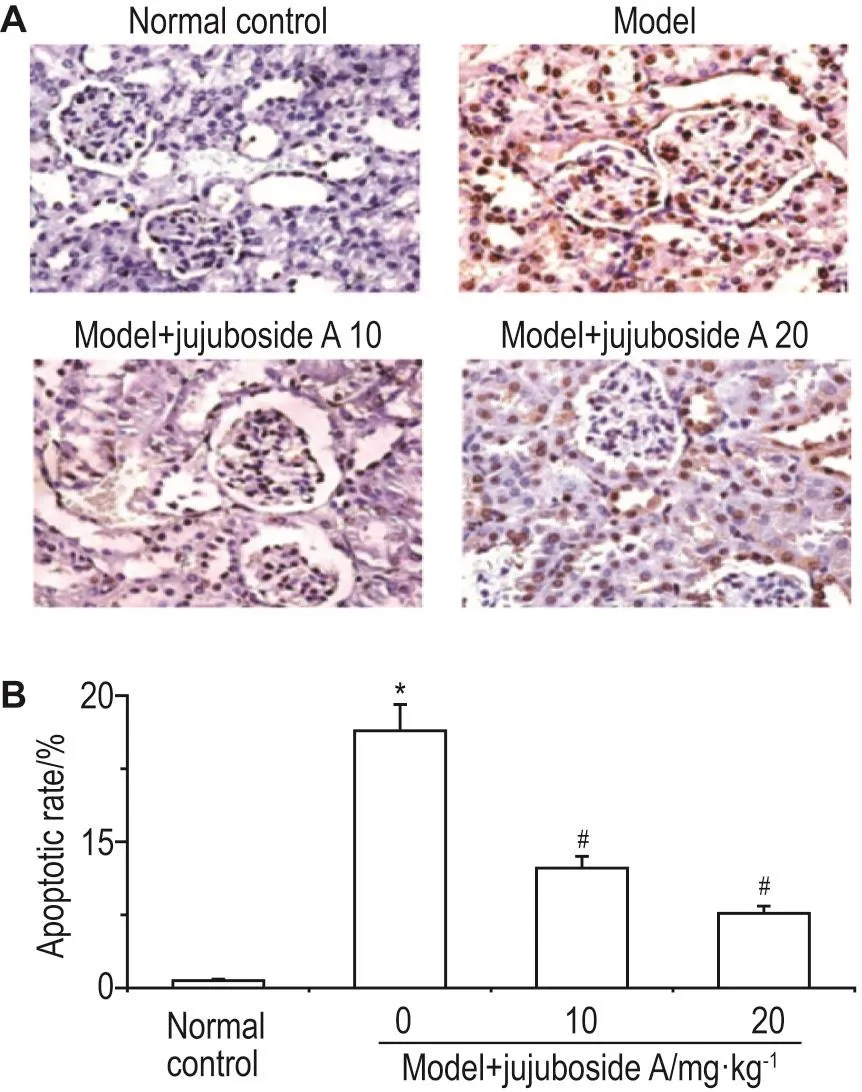
Fig.2 Effect of jujuboside A on apoptosis of glomer⁃ulus cells in diabetic rats observed by TUNEL stain⁃ing(×400).See Tab.1 for the treatment.B was the semi-quan⁃titative result of A.n=6.*P<0.05,compared with normal con⁃trol group;#P<0.05,compared with model group.
2.4 酸枣仁皂苷A对糖尿病模型大鼠肾组织Bcl-2和Bax蛋白表达的影响
如图3所示,正常对照组肾组织Bcl-2染色最深,模型组肾组织Bcl-2染色最浅;给予酸枣仁皂苷A后,Bcl-2染色明显变深正常对照组肾组织Bax染色最浅,模型组肾组织Bcl-2染色最深;给予酸枣仁皂苷A后,Bcl-2染色明显变浅,Bax染色变深。半定量数据结果显示,与正常对照组相比,模型组大鼠肾组织Bcl-2(8.54±0.58vs2.54±0.21)的蛋白表达显著减少(P<0.05),Bax(4.36±0.38vs12.54± 0.78)的蛋白表达显著增加(P<0.05);与模型组相比,给予酸枣仁皂苷A 10和20 mg·kg-1处理后,Bcl-2(4.73±0.35,6.98±0.42)的蛋白表达明显增加(P<0.05),Bax(8.96±0.58,5.76±0.42)的蛋白表达明显减少(P<0.05),且20 mg·kg-1剂量组较10 mg·kg-1剂量组变化更加明显。

Fig.3 Effect of jujuboside A on Bcl-2 and Bax protein expressions detected by immunohistochemistry staining(×400).See Tab.1 for the treatment.B was the semi-quantitative result of A.,n=6.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
2.5 酸枣仁皂苷A对糖尿病模型大鼠肾组织活化的胱天蛋白酶9、胱天蛋白酶9、活化的胱天蛋白酶3和胱天蛋白酶3蛋白表达的影响
Western蛋白免疫印迹检测结果(图4)显示,与正常对照组相比,模型组大鼠肾组织活化的胱天蛋白酶9(0.68±0.04vs4.57±0.31)与活化的胱天蛋白酶3(0.98±0.07vs4.28±0.35)的蛋白表达显著增加(P<0.05);而与模型组相比,给予酸枣仁皂苷A10和20 mg·kg-1处理后,活化的胱天蛋白酶9(3.87± 0.32,2.15±0.24)(P<0.05)与活化的胱天蛋白酶3(3.04±0.25,1.21±0.11)(P<0.05)的蛋白表达均明显减少(P<0.05),且20 mg·kg-1剂量组较10 mg·kg-1剂量组降低更加明显。而各组大鼠肾组织的胱天蛋白酶9和胱天蛋白酶3蛋白表达无显著变化。
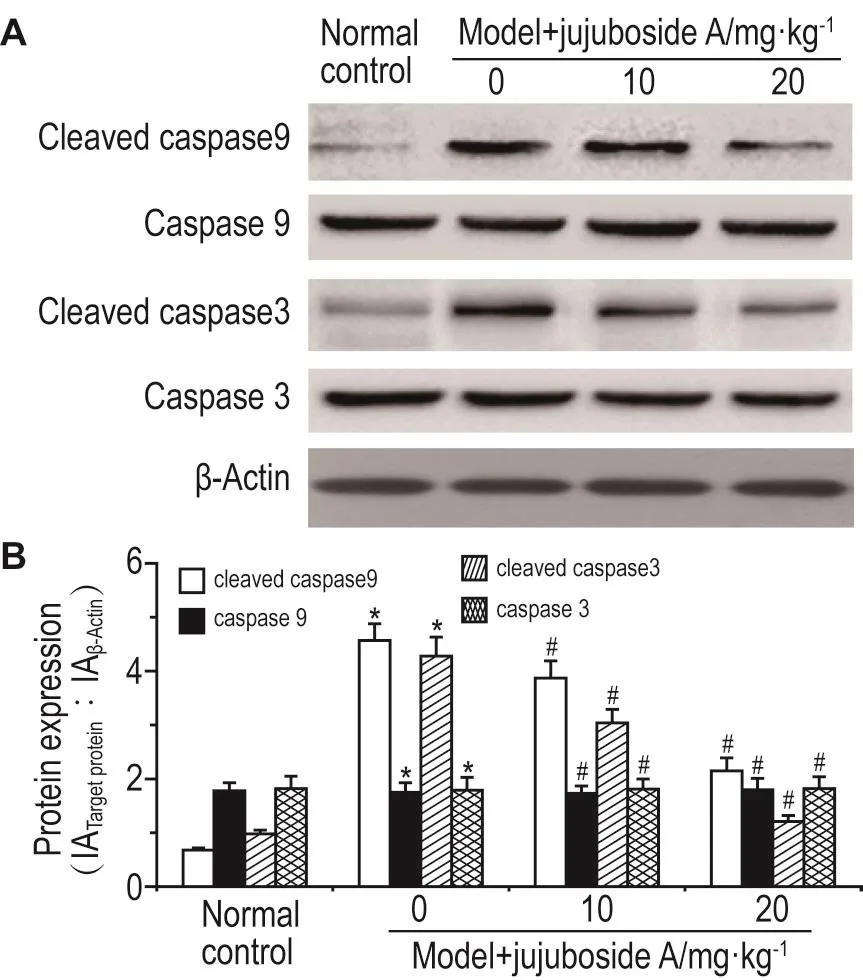
Fig.4 Effect of jujuboside A on protein expressions of cleaved caspase 9,caspase 9,cleaved caspase 3 and caspase 3 detected by Western blotting.See Tab.1 for the treatment.B was the semi-quantitative result of A.x±s,n=6.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
2.6 酸枣仁皂苷A对糖尿病模型大鼠肾组织TGF-β1mRNA表达的影响
qPCR结果显示,与正常对照组(1.02±0.03)相比,模型组大鼠肾组织TGF-β1mRNA表达显著升高(5.76±0.78,P<0.05)(图5);给予酸枣仁皂苷A10和20 mg·kg-1处理后,大鼠肾组织TGF-β1mRNA表达分别为3.64±0.41和2.12±0.23,与模型组相比均明显下降(P<0.05)。
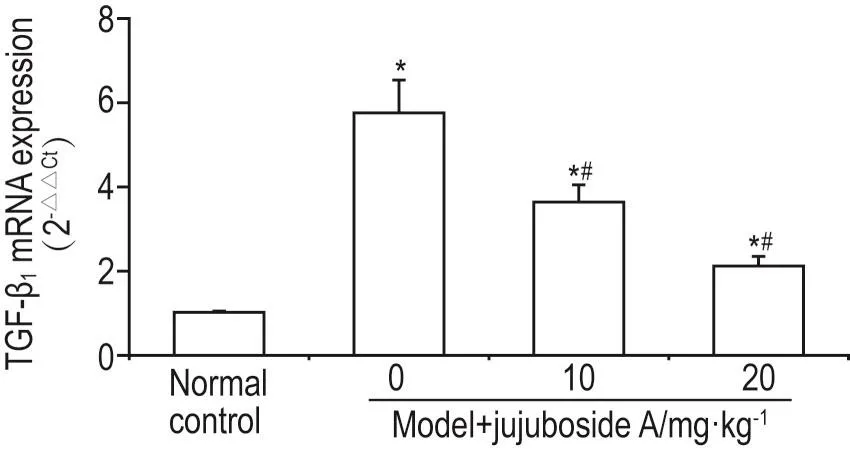
Fig.5 Effect of jujuboside A on transforming growth factor- β11(TGF- β11)mRNA expressions detected by qPCR.See Tab.1 for the treatment.n=6.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
3 讨论
Bcl-2家族构成一个复杂的相互作用的控制细胞凋亡的网络,主要参与线粒体凋亡信号通路,家族成员由抗凋亡蛋白(Bcl-2,Bcl-XL和Bcl-w)和促凋亡蛋白(Bax,Bak,Bad,Bim和Bit等)组成[4-5],通过调节线粒体膜通透性起到双向调节作用[6]。抗凋亡蛋白Bcl-2与促凋亡蛋白Bax之间比例的改变,进而影响下游蛋白的变化。国外学者研究发现,糖尿病大鼠肾小球细胞的凋亡率显著高于非糖尿病大鼠,且bcl-2和bax基因也有相应变化[7-8]。当Bcl-2蛋白表达下降而Bax蛋白表达上升,会促使线粒体中的凋亡因子释放至细胞质基质中,激活胱天蛋白酶9,活化的胱天蛋白酶9进一步激活其下游因子胱天蛋白酶3,随后胱天蛋白酶3的切割底物PARP被切割激活后形成DNA碎片,称为内源性线粒体凋亡途径[9]。糖尿病模型大鼠的肾小球凋亡显著增加,给予酸枣仁皂苷A后,肾小球细胞凋亡明显减少,同时肾组织的Bcl-2蛋白表达显著增加,Bax、活化的胱天蛋白酶9和活化的胱天蛋白酶3蛋白表达显著减少,提示酸枣仁皂苷A可能通过抑制凋亡蛋白Bax的活性和增强Bcl-2的活性;除此之外,通过抑制胱天蛋白酶9的活性,进一步抑制胱天蛋白酶3的活性,抑制内源性线粒体通路的激活,从而抑制肾组织细胞的凋亡,可能具有肾保护的作用。
TGF-β是影响肾小管上皮细胞分化的最重要的一种调控因子,主要分为TGF-β1,TGF-β2和TGF-β33种亚型[10]。其中TGF-β1因子表达的变化对肾小管上皮细胞的分化具有重要的影响。还有研究发现,TGF-β1随浓度增加,使NRK-52E细胞α-平滑肌激动蛋白表达增加,上皮细胞的E-钙黏蛋白表达降低[11]。TGF-β1/Smad通路是肾小管上皮细胞转分化的主要途径之一,TGF-β1与其相应受体结合后,激活胞浆内的Smad2和Smad3,与Smad4形成复合物进入胞核,进而调控一系列相关因子,从而调控肾小管上皮细胞的转分化[12]。本研究结果显示,酸枣仁皂苷A能够降低糖尿病模型大鼠肾组织TGF-β1表达,提示酸枣仁皂苷A可能通过抑制TGF-β1的表达,从而阻断TGF-β1诱导的肾小管上皮细胞的转分化与纤维化,进而减少肾小管间质纤维化,从而可能具有抑制DN进展为终末期肾功能衰竭的作用。
综上所述,本研究结果显示,酸枣仁皂苷A能够抑制糖尿病大鼠肾小球细胞的凋亡,推断可能是通过调节凋亡相关因子Bcl-2以及Bax的表达,并调控肾小管上皮细胞分化的重要因子TGF-β1,从而在糖尿病中可能具有肾保护的作用。
[1]Kim SS,Shin N,Bae SS,Lee MY,Rhee H,Kim IY,et al.Enhanced expression of two discrete isoforms of matrix metalloproteinase-2 in experimental and humandiabeticnephropathy[J].PLoSOne,2017,12(2):e0171625.
[2]Zhang Y,Qiao L,Song M,Wang L,Xie J,Feng H. HPLC-ESI-MS/MS analysis of the water-soluble extract fromZiziphi spinosaesemen and its amelio⁃rating effect of learning and memory performance in mice[J].Pharmacogn Mag,2014,10(40):509-516.
[3]Cai M,Yu Z,Wang L,Song X,Zhang J,Zhang Z,et al.Tongxinluo reduces brain edema and inhibits post-ischemic inflammation after middle cerebral artery occlusion in rats[J].J Ethnopharmacol,2016,181:136-145.
[4]de Jong Y,van Maldegem AM,Marino-Enriquez A,de Jong D,Suijker J,Briaire-de Bruijn IH,et al. Inhibition of Bcl-2 family members sensitizes mesen⁃chymal chondrosarcoma to conventional chemo⁃therapy:report on a novel mesenchymal chondro⁃sarcoma cell line[J].Lab Invest,2016,96(10):1128-1137.
[5]Phatak NR,Stankowska DL,Krishnamoorthy RR. Bcl-2,Bcl-xL,and p-AKT are involved in neuropro⁃tective effects of transcription factor BRN3b in an ocular hypertension rat model of glaucoma[J].Mol Vis,2016,22:1048-1061.
[6]Kelly PN,Strasser A.The role of Bcl-2 and its pro-survival relatives in tumourigenesis and cancer therapy[J].Cell Death Differ,2011,18(9):1414-1424.
[7]Jung DS,Lee SH,Kwak SJ,Li JJ,Kim DH,Nam BY,et al.Apoptosis occurs differentially according to glomerular size in diabetic kidney disease[J].Nephrol Dial Transplant,2012,27(1):259-266.
[8]Kwak SJ,Paeng J,Kim DH,Lee SH,Nam BY,Kang HY,et al.Local kallikrein-kinin system is involved in podocyte apoptosis under diabetic condi⁃tions[J].Apoptosis,2011,16(5):478-490.
[9]Savitskaya MA,Onishchenko GE.Mechanisms ofapoptosis[J].Biochemistry(Mosc),2015,80(11):1393-1405.
[10] Sun H,Zhao Y,Bi X,Li S,Su G,Miao Y,et al. Valsartan blocks thrombospondin/transforming growth factor/Smads to inhibit aortic remodeling in diabetic rats[J].Diagn Pathol,2015,10:18.
[11] Wei MG,Sun W,He WM,Ni L,Yang YY.Ferulic acid attenuates TGF-β1-induced renal cellular fibrosis in NRK-52E cells by inhibiting Smad/ILK/Snail pathway[J].Evid Based Complement Alternat Med,2015;2015:619720.
[12]Li JH,Zhu HJ,Huang XR,Lai KN,Johnson RJ,Lan HY.Smad7 inhibits fibrotic effect of TGF-beta on renal tubular epithelial cells by blocking Smad2 activation[J].J Am Soc Nephrol,2002,13(6):1464-1472.
Effect of jujuboside A on glomerular cell apoptosis in diabetic model rats
SI Qin-qin,NIU Xiao-hong,LI Jun-yan,YANG Hai-qing
(Department of Endocrinology,Affiliated Heji Hospital of Changzhi Medical College, Changzhi 046000,China)
OBJECTIVETo investigate the effect of jujuboside A on glomerular cell apoptosis in diabetic rats,and to explore the possible mechanisms.METHODSSD rats were administered with streptozotocin 100 mg·kg-1to estabilish the diabetic model.Diabetic SD rats
jujuboside A 10 and 20 mg·kg-1daily for 4 weeks by lavage administration,respectively.The level of glycosylated hemoglobin(GHb)in the blood of each group was measured by fructosamine method.The morphological changes in glomerular cells were observed by PAS staining.Glomerular cell apoptosis was determined by TUNEL staining.The protein expression of Bcl-2 and Bax was detected by immunohistochemistry.The protein expression of cleaved caspase 9 and cleaved caspase 3 was detected by Western blotting.Trans⁃forming growth factor β1(TGF-β1)mRNA expression was analyzed by qPCR.RESULTSCompared with model group,jujuboside A 10 and 20 mg·kg-1treatment significantly reduced the level of GHb in blood (mmol·L-1:10.9±0.8vs17.5±1.5,P<0.05;7.6±0.5vs17.5±1.5,P<0.05),PAS positive score of glomerular cells(26.8±3.2vs36.4±3.8,P<0.05;18.4±2.1vs36.4±3.8,P<0.05)and the apoptosis of glomerular cells〔(8.2±0.8)%vs(17.6±1.8)%,P<0.05;(5.1±0.5)%vs(17.6±1.8)%,P<0.05〕.Moreover, Bcl-2 protein expression in kidney tissues was elevated(P<0.05),whereas Bax(P<0.05),cleaved caspase 9(P<0.05)and cleaved caspase 3(P<0.05)protein expression and TGF-β1mRNA(P<0.05) expression were reduced after jujuboside A administration.CONCLUSIONJujuboside A can prevent glomerular cell apoptosis in diabetic rats,which may be associated with the regulation of mitochondrial apoptotic pathways and TGF-β1expression.
diabetic nephropathy;jujuboside A;apoptosis;mitochondrial apoptotic pathways; transforming growth factor β1
The project supported byScientific and Developing Research Project of Shanxi University and College(3012430)
SI Qin-qin,E-mail:czyxysqinqin@126.com;Tel:(0355)2093926
R285.5
:A
:1000-3002-(2017)05-0399-06
10.3867/j.issn.1000-3002.2017.05.004
2016-08-30 接受日期:2017-03-20)
(本文编辑:乔 虹)
山西高等学校科技研究开发项目基金(3012430)作者简介:司芹芹,女,讲师,硕士研究生,主要从事糖尿病和骨代谢研究。
司芹芹,E-mail:czyxysqinqin@126.com,Tel:(0355)2093926

