复合菌种固态发酵饲料的工艺优化
阮 萍,黄 威,李铁柱*
(1.吉林农业大学 食品科学与工程学院,长春130118;2.吉林省农业科学院农产品加工研究所, 长春 130033)
复合菌种固态发酵饲料的工艺优化
阮 萍1,2,黄 威2,李铁柱1,2*
(1.吉林农业大学 食品科学与工程学院,长春130118;2.吉林省农业科学院农产品加工研究所, 长春 130033)
以玉米粉和豆粕为底料,采用复合菌种进行固态发酵。在单因素实验的基础上,确定接种量、发酵温度、发酵时间作为实验参数。以可消化粗蛋白含量作为指标,利用正交实验对发酵条件进行优化。结果表明,最佳发酵参数为接种量1%、发酵时间3d、发酵温度30℃。在此条件下,发酵产物中可消化粗蛋白含量为29.58%,较初始物料提高了57.09%。
复合菌种;发酵饲料;正交实验;可消化粗蛋白
随着人类生活水平的提高,人们对于优质蛋白食物的需求量逐渐攀升,从而刺激了养殖业的发展。但是,在养殖业的发展过程中,对饲料业的依赖性也在与日俱增。据统计,我国的饲料产量供不应求,主要靠进口解决,预计到2030年,我国蛋白饲料的缺口将要达到2790万吨[1-2]。而发酵饲料作为一种新型环保饲料,已经成为当今热点研究方向。通过微生物发酵手段来发酵农副产物,可以改善产品品质以及适口性[3-5],且微生物分泌的蛋白酶可分解胰蛋白酶抑制剂等抗营养因子,提高消化吸收率和饲用价值,降低生产成本,减少疾病的发生,改善饲料对环境的污染,最终为人类提供全天然无公害营养价值高的饲料产品[6-7]。目前,微生物发酵生产蛋白饲料的发酵方式已从单一菌种的发酵趋向于复合菌株的协同发酵,并注重不同微生物之间的协同性、互补性[8]。由于发酵产物中含有丰富的维生素、矿物质和其他生物活性物质,将其添加于饲料中,可有效提高畜禽的生长率[9-12]。此外,固态发酵本身成本低,可利用资源丰富,对环境污染小,在许多方面要优于液态发酵,现已成为能源开发的新途径[13-15]。
利用50L全自动固体发酵罐,进行复合菌种发酵饲料的生产。将四种菌种混合作为发酵种子液,以玉米粉和豆粕为底料,确定接种量、发酵时间、发酵温度、搅拌转速作为参数,进行单因素实验。最后通过进行正交实验,优化发酵罐生产的最佳工艺条件。
1.材料与方法
1.1 实验材料
1.1.1 供试材料
玉米粉和豆粕(比例2:1)由吉林省农业科学院提供。
1.1.2 实验菌种
复合菌种:包括植物乳杆菌、纳豆芽孢杆菌、酿酒酵母、产朊假丝酵母。菌种保存于吉林省农业科学院农产品加工研究所实验室。
1.1.3 培养基
LB培养基:氯化钠10.0g、蛋白胨10.0g、酵母浸粉5.0g、蒸馏水1L。121℃灭菌20min[16]。
MRS培养基:蛋白胨10.0g、牛肉浸粉10.0g、酵母浸粉2g、葡萄糖20.0g、吐温80 1ml、磷酸氢二钾2.0g、乙酸钠5.0g、柠檬酸钠2.0g、硫酸镁0.2g、硫酸锰0.05g、蒸馏水1L。115℃灭菌20min[16]。
1.1.4 实验试剂
蛋白胨、酵母浸粉、牛肉浸粉:北京奥博星生物技术有限责任公司。氯化钠、葡萄糖、磷酸氢二钾、乙酸钠、氢氧化钠、浓硫酸、浓盐酸、磷酸二氢钾:北京化工厂。吐温80、柠檬酸钠、胰蛋白酶:北京鼎国昌盛生物技术有限责任公司。硫酸镁、硫酸锰、硫酸铜:天津市福晨化学试剂厂。胃蛋白酶:Biosharp试剂公司。三氯乙酸:天津市光复精细化工研究所。 硫酸钾、氯化钾:西陇化工股份有限公司。所用试剂均为分析纯。
1.2 实验仪器
MLS-3780高压蒸汽灭菌锅:日本Sanyo公司。AUY220电子分析天平:日本岛津有限公司。HZQ-X100恒温振荡培养箱:上海一恒科技有限公司。Evolution RC高速冷冻离心机:Thermo Stovall公司。101A-2电热恒温鼓风干燥箱:上海试验仪器厂有限公司。HY-04A高速粉碎机:北京环亚天元机械技术有限公司。BCN-1360B超净工作台:哈东联电子技术开发有限公司。Molgene1810a超纯水器:重庆摩尔水处理设备公司。 HYP-Ⅱ消化炉:上海纤检仪器有限公司。2300全自动凯氏定氮仪:FOSS。DELTA320pH计:METTLER。55SS-50L固态发酵罐:上海保兴生物设备有限公司。
1.3 实验方法
1.3.1 单因素实验
对可能影响微生物饲料发酵的主要因素进行单因素实验,主要包括:接种量、发酵温度、发酵时间、搅拌转速。通过对发酵产物中可消化粗蛋白含量的测定,确定影响发酵的因素。
1.3.2 正交实验
根据单因素实验结果,进行正交实验分析,从接种量、发酵温度、发酵时间、搅拌转速四个因素中筛选出对发酵工艺有重要影响的三个参数,以发酵样品中的可消化粗蛋白为指标,通过正交试验,对发酵条件进行工艺优化。
1.3.3 可消化粗蛋白的测定
体外消化率的测定采用两步酶法测定[17]。称量发酵样品1g置于100mL三角瓶中,加入10mL,0.03g的胃蛋白酶溶液(pH=2.0)后,放入摇床中,以37℃、180r/min恒温振荡6h。取出后,加入少许10mol/L的NaOH溶液,调节至中性pH。加入50mL、0.025g的胰蛋白酶(pH=7.6)后,放入摇床中以37℃、180r/min恒温振荡18h。取出后,用5%的三氯乙酸溶液分三次,每次5mL冲洗三角瓶后,转入100mL离心管中,离心管先称重、编号。放入离心机,4℃、8000g、离心20min后取出。取出后,倒出上清液,剩余残渣及离心管一起放入60℃烘箱中,烘干至恒重,计算残渣重量。将发酵残渣及发酵样品一起用凯式定氮仪测定蛋白含量。可消化粗蛋白的计算方法见参考文献[18-19]。
可消化粗蛋白含量计算公式如下:
V1:滴定试样时所需标准盐酸溶液的体积(mL);
V2:滴定空白时所需标准盐酸溶液的体积(mL);
C:盐酸标准溶液浓度(mol/L);
m:试样质量(g);
0.014:每毫克当量氮的克数;
6.25:氮换算成蛋白质的平均系数。
2 结果与分析
2.1 接种量对可消化粗蛋白的影响
发酵条件为发酵温度30℃、发酵时间3d、搅拌转速35rpm时,接种量分别为0.5%、1%、1.5%、2%、2.5%时,可消化粗蛋白含量如图1所示。由图1可知,当接种量为0.5%~1%时,可消化粗蛋白含量随着接种量的增大而增大;当接种量为1%时,可消化粗蛋白含量为26.51%;当接种量超过1%时,可消化粗蛋白含量开始下降,且趋于平稳。以节约成本为前提,在接种量为1%时,发酵效果最佳。
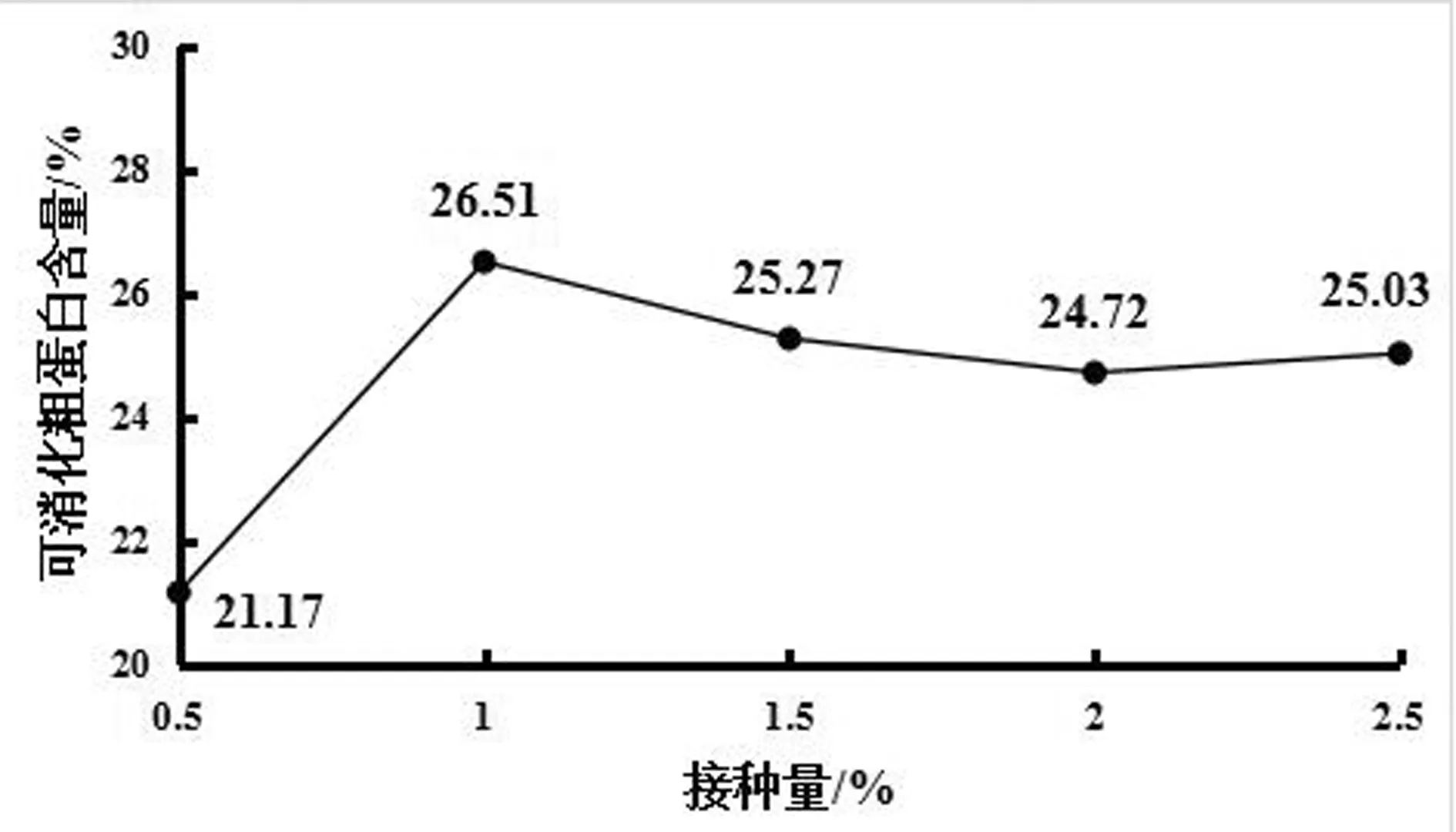
图1 接种量对可消化粗蛋白含量的影响
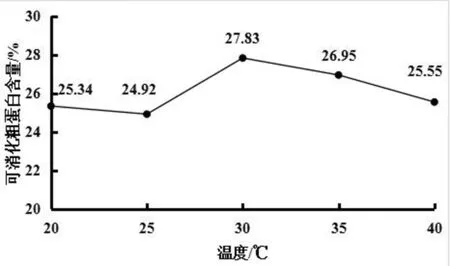
图2 发酵温度对可消化粗蛋白含量的影响
2.2发酵温度对可消化粗蛋白的影响
发酵条件为接种量为1%、发酵时间为3d、搅拌转速为35rpm时,发酵温度分别为20℃、25℃、30℃、35℃、40℃时,可消化粗蛋白含量如图2所示。由图2可知,当发酵温度为20℃~25℃时,可消化粗蛋白含量趋于平稳;当发酵温度为25℃~30℃时,可消化粗蛋白含量随着发酵温度的升高而逐渐上升;当发酵温度为30℃时,可消化粗蛋白含量为27.83%;当发酵温度高于30℃时,可消化粗蛋白含量开始随着发酵温度的升高而逐渐下降。原因可能是,随着发酵温度增加,菌体生长速度快,如果发酵温度持续增加,菌体生长过快,易产生衰老,导致菌体自溶使粗蛋白含量降低。所以,当发酵温度为30℃时,可消化粗蛋白含量最高,发酵效果最佳。
2.3 发酵时间对可消化粗蛋白的影响
发酵条件为接种量为1%、发酵温度为30℃、搅拌转速为35rpm时,发酵时间分别为1d、2d、3d、4d、5d时,可消化粗蛋白含量如图3所示。由图3可知:当发酵时间为1d~3d时,可消化粗蛋白含量随着时间的增加而增加;当发酵时间为3d时,可消化粗蛋白含量为26.78%;当发酵时间超过3d时,可消化粗蛋白含量开始下降。可能是由于时间的增加,发酵物质缺乏,菌体繁殖分解了部分蛋白。所以,当发酵时间为3d时,可消化粗蛋白含量最高,发酵效果最佳。
2.4 搅拌转速对可消化粗蛋白的影响
发酵条件为接种量为1%、发酵温度为30℃、发酵时间为3d时,搅拌转速分别为25rpm、30rpm、35rpm、40rpm、45rpm时,可消化粗蛋白含量如图4所示。由图4可知:当搅拌转速为25rpm~35rpm时,可消化粗蛋白含量随着搅拌转速的增加而增加;当搅拌转速为35rpm时,可消化粗蛋白含量为24.97%;当搅拌转速超过35rpm时,随着搅拌转速的增加可消化粗蛋白含量减少。原因可能是,转速过高,容易剪切菌丝造成细胞损伤,形成短矮的分支;转速过低,溶氧供给不足,发酵变缓。虽然搅拌转速为35rpm时,可消化粗蛋白含量最高,但是如图4所示,整条折线变化趋势平稳,差异不明显。所以搅拌转速可以不作为影响发酵条件的重要参数。
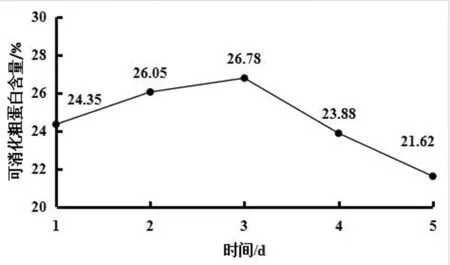
图3 发酵时间对可消化粗蛋白含量的影响
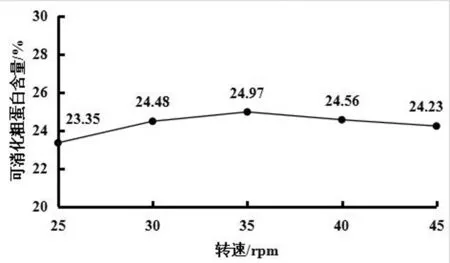
图4 搅拌转速对可消化粗蛋白含量的影响
2.5 正交实验
在上述实验的基础上,进一步对发酵条件进行工艺优化。选择接种量、发酵温度、发酵时间三个因素作为实验参数,进行L9(33)三因素三水平的正交实验,如表1所示。

表1 正交实验因素和水平
正交实验结果如表2所示。可见,RA>RC>RB,即接种量对发酵产物的可消化粗蛋白含量影响最为显著,然后是发酵时间,而发酵温度的影响最小。最佳发酵条件组合为A2B2C2,即接种量为1%、发酵时间为3d、发酵温度为30℃。此时发酵产物的可消化粗蛋白含量为29.58%。
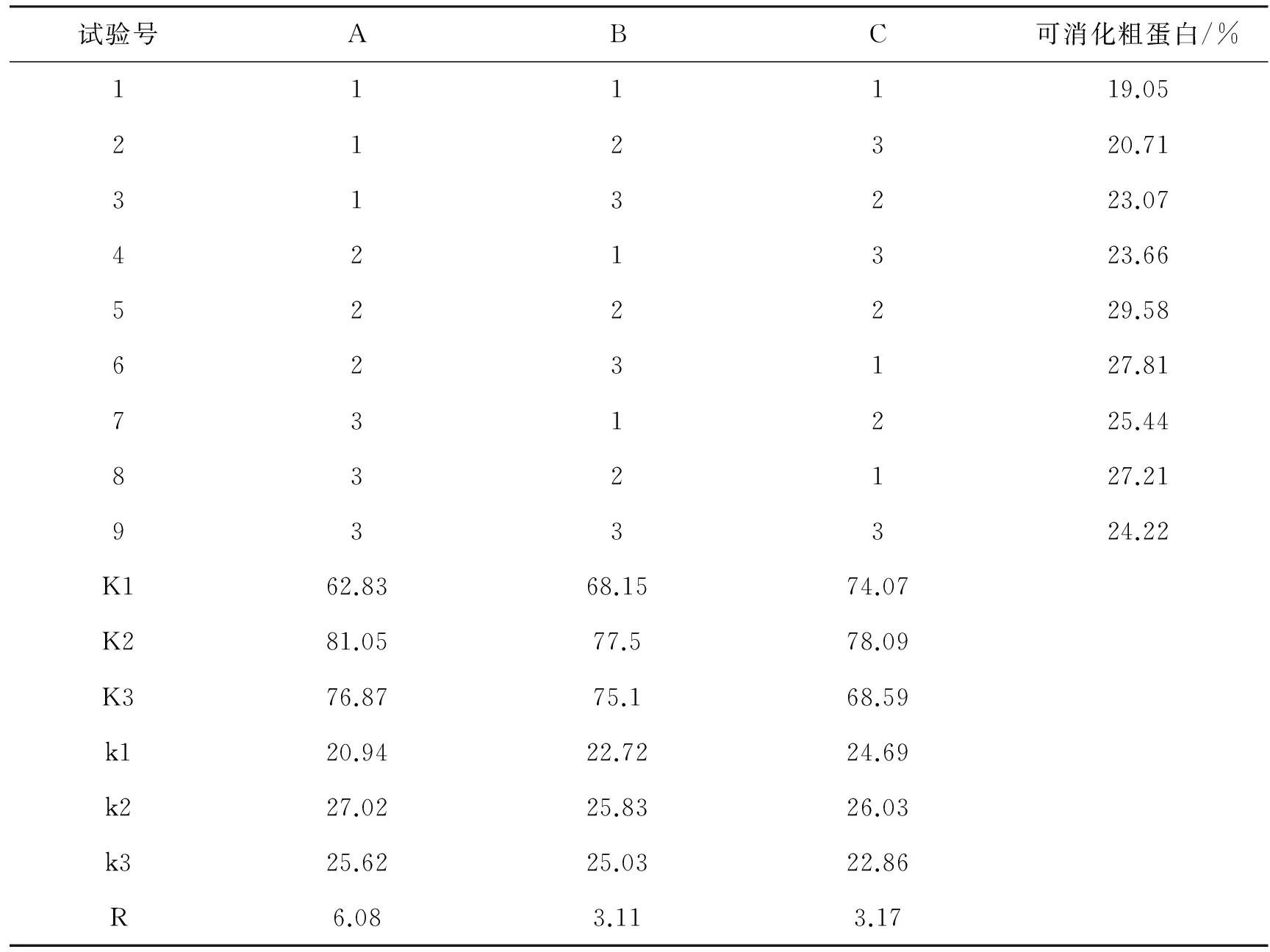
表2 正交实验结果
3 结果与讨论
利用混合菌种进行固态发酵,可以将非蛋白氮转化为菌体蛋白,而且菌体分泌的胞外酶可以有效地分解大分子蛋白为小肽和氨基酸,大大提高了可溶性蛋白的含量[20]。由此可见:通过复合菌种固态发酵,可提高饲料的营养价值,有利于动物的消化吸收。在本项工作中,利用单因素实验,确定了影响发酵效果的三个参数,分别为接种量、发酵温度、发酵时间。通过正交实验得到的最佳工艺条件为:接种量1%、发酵时间3d、发酵温度30℃。经测定,未经发酵的饲料底物中可消化粗蛋白含量为18.83%。在最优实验条件下,发酵产物中可消化粗蛋白含量为29.58%,较初始物料提高了57.09%。
[1] 杨振海, 张志青. 21世纪初中国饲料工业发展战略研究[J]. 中国饲料, 2001(16): 3-6.
[2] 崔耀明, 董晓芳, 佟建明. 我国食品及制造业糟渣类饲料资源的应用[J]. 动物营养学报, 2014, 26(7): 1728-1737.
[3] 谭燕宏. 餐厨垃圾处理工艺及资源化技术进展[J]. 绿色科技,2012(3): 177-179.
[4] 袁世岭, 李鸿炫, 毛捷, 等. 餐厨垃圾饲料化处理的研究进展[J]. 资源节约与环保, 2013(7): 78.
[5] 陈贵才, 戴德慧, 黄光荣, 等. 泔水垃圾发酵生产微生态蛋白饲料工艺条件的研究[J]. 饲料工业, 2007, 28(9):26-30.
[6] Czech B.The neoclassical production function as a relic of anti-George politics:implications for ecological economics[J].Ecological Economics,2009,68(8-9):2193-2197.
[7] 潘天玲, 张东峰, 赵昌盛, 等. 混菌固态发酵豆渣生产菌体蛋白的研究[J]. 化学与生物工程, 2004(6): 35-41.
[8] 曹钰, 蔡国林, 陆健. 提高豆粕营养价值的研究进展[J]. 新饲料, 2007(6): 13-15.
[9] 陈贵才, 戴德慧, 黄光荣, 等. 多菌种发酵餐饮废弃物生产蛋白饲料研究[J]. 浙江大学学报, 2007, 33(4): 429-434.
[10] Tsai C C, Chiu T H, Ho CY, et al. Effects of anti-hypertension and intestinal microflora of spontaneously hypertensive rats fed gamma-aminobutyric acid-enriched purple sweet potato fermented milk by lactic acid bacteria[J].African Journal of Microbiological Research,2013, 7(11): 932-940.
[11] Díaz I, González C, Reyes J L, et al. Digestion of sweet potato foliage in pigs Ileal and fecal in vitro digestibility[J].Cuban Journal of Agricultural Science,2013, 47(1): 289.
[12] Soo C S, Yap W S, Hon W M, et al. Mini review: Hydrogen and ethanol coproduction from waste materials via microbial fermentation[J].World Journal of Microbiology and Biotechnology,2015, 31(10): 1475-1488.
[13] Sanusi G O, Belewu M A, Oduguwa B O, et al. Changes in chemical composition of curcas kernel cake after solid-state fermentation using some selected fungi[J].Global Journal of Biology, Agriculture and Health Science,2013, 2(2): 66-68.
[14] 徐福建, 陈洪章, 李佐虎. 固态发酵工程研究进展[J]. 生物工程, 2002, 122(1): 44-48.
[15] 刘超, 李学如, 柳乐, 等. 固态发酵生产新型蛋白饲料工艺研究[J]. 粮食与饲料工业, 2006(9): 29-31.
[16] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[17] 唐茂妍. 胃蛋白酶-胰酶两步法体外评定加酶饲料蛋白质消化率的研究[D].南京:南京农业大学, 2002.
[18] 胡艳丽, 王克然. 饲料中真蛋白的测定[J]. 河南畜牧兽医, 2007, 28(10): 31-32.
[19] 张世仙, 余永华, 金茜, 等. 凯氏定氮法测定茅台酱香型酒酒糟蛋白质含量[J]. 中国酿造, 2013, 32(1): 130-132.
[20] 安晓萍, 王哲奇, 齐景伟, 等. 菌种对发酵豆粕营养成分的影响[J]. 饲料工业, 2013, 34(21): 40-43.
[21] 齐春艳,丽春,张颖,等.液态饲料在家畜生产上的应用[J].内蒙古民族大学学报(自然科学版),2013(2):307-309.
[22] 王欣,李卯生.自然发酵东北酸菜中植物乳杆菌的分离与鉴定[J].黑龙江八一农垦大学学报,2013(3):63-67.
[23] 程皓,于长青,王长远.酶解米糖清蛋白功能性质的研究[J].黑龙江八一农垦大学学报,2014(4):53-56.
责任编辑:程艳艳
Optimization for Process of Solid State Fermentation Feed with Composite Bacteria
RUAN Ping1,2,HUANG Wei2,LI Tiezhu1,2*
(1.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118, China;2. Institute of Agricutural Products Processing Research, Jilin Academy of Agricultural Sciences,Changchun 130033, China)
With corn flour and soybean meal as the base materials, the solid state fermentation was carried out by composite bacteria. On the basis of single factor experiment, the inoculation amount, fermentation temperature and fermentation time were chosen as the experimental parameters. The fermentation conditions were optimized by orthogonal experiment with utilizable crude protein (uCP) as indexes. The results showed that the optimal fermentation parameters were inoculation amount 1%, fermentation time 3d and fermentation temperature 30℃. Under this condition, the content of utilizable crude protein in fermentation products was 29.58%, which was increased by 57.09% compared to the raw materials.
composite bacteria; fermentation feed; orthogonal experiment; utilizable crude protein
2016-12-23
吉林省科技厅重大科技攻关专项(20140203014NY),吉林省科技厅重点科技攻关项目(20140204051YY)。
阮萍(1992-),女,辽宁鞍山人,研究实习员,硕士研究生,主要从事水产品加工及储藏工程方面研究。
李铁柱(1978-),男,吉林长春人,博士,副研究员,主要从事农产品加工及储藏工程方面的研究。
TQ920.6
A
1009-3907(2017)04-0033-05

