钙调磷酸酶抑制剂筛选方法的研究进展
徐翔,崔志峰,丁东栋,朱廷恒
(浙江工业大学生物工程学院,浙江杭州310014)
钙调磷酸酶抑制剂筛选方法的研究进展
徐翔,崔志峰,丁东栋,朱廷恒
(浙江工业大学生物工程学院,浙江杭州310014)
筛选和开发新型低毒的钙调磷酸酶抑制剂(CNI)宜扬长避短,充分利用各方法的优势。本文综述了酵母“正筛选”模型,酵母报告基因高通量CNI筛选模型和钙调磷酸酶(CaN)活性检测法3种常用的筛选方法的适用范围、优缺点以及多方法联合。其中,酵母“正筛选”模型利用生长圈来代替抑菌圈,有效避免了抑菌化合物造成的“假阳性”;酵母报告基因的高通量筛选模型有较高的筛选效率,适合于大量样品的初步筛选;CaN活性检测法具有作用靶点明确和抑制效率直观准确的优点。本文旨在为筛选和开发新型、低毒的CNI提供参考。
钙调磷酸酶;抑制剂;筛选方法
钙调磷酸酶(calcineurin,CaN),又称蛋白磷酸酶2B(protein phosphatase 2B,PP2B),是一种在真核生物中高度保守、Ca2+/钙调素(calmodulin,CaM)依赖的丝氨酸/苏氨酸蛋白磷酸酶。CaN作为一种Ca2+信号调控途径的关键酶,在多种细胞功能中扮演关键角色,包括T细胞的活化、肌肉量的调节和学习记忆的形成、以及阿尔茨海默病与帕金森病的发生[1-2]。
钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)是一类以CaN为作用靶点的免疫抑制剂,如环孢素A(ciclosporin A,CsA)和他克莫司(tacrolimus,FK506)是目前临床中广泛使用的CNI。在免疫细胞中,CsA和FK506分别与亲环蛋白(cyclophilin)和12 ku FK506结合蛋白(12 ku FK506 binding protein,FKBP12)结合形成复合物,并以复合物形式结合至CaN,从而抑制CaN催化蛋白脱磷酸化的活性,即在T细胞和其他免疫细胞中抑制NFATc脱磷酸,发挥免疫抑制剂的作用[3-4]。尽管CsA和FK506以其高抑制率和强特异性在器官移植和自身免疫病的临床治疗中广泛应用,但长期使用CsA和FK506会产生一些副作用,包括神经毒性、肾毒性、高血压、高胆固醇、糖尿病和颤抖[5-6]。因此,开发新型免疫抑制剂有重要意义。
目前文献报道的大部分具有抑制CaN活性的化合物均源于对自然界中大量微生物代谢产物或植物提取物的筛选,也有少部分筛选自小分子化合物库。如目前临床应用最广泛的CsA与FK506,均源自于微生物的代谢产物。因此,通过对自然界的大量天然化合物或小分子化合物库进行筛选从而获得CaN活性抑制物质,已成为开发新型CNI的主要方式。本文中列举了酵母“正筛选”模型、酵母报告基因高通量筛选模型以及CaN活性检测法3种应用较多的筛选方法。迄今,CNI筛选方法已有诸多报道,但目前还未有利用这些方法筛选到的CaN活性抑制物质应用于临床治疗。因此,在进一步扩大原有的筛选范围的同时,有必要分析目前的CNI筛选方法的优势与不足,合理利用多种方法提高筛选新型CNI的效率和准确性。
1 酵母“正筛选”模型
在酵母细胞中,Ca2+信号调控细胞周期是通过激活CaN通路和Mpk1丝裂原活化的蛋白激酶(mitogen-activation protein kinase,MAPK)信号通路这2条信号通路协同激活Swe1[7]。Shitamukai等[8]发现,在Δzds1酵母中Swe1是被Ca2+信号高度诱导的,增加培养基中Ca2+浓度对Δzds1酵母生长的抑制现象尤为明显。据此,他们开发了用Δzds1酵母筛选Ca2+信号通路抑制剂的“正筛选”方法,即能解除高Ca2+浓度对Δzds1酵母生长抑制的物质为Ca2+信号通路抑制剂。用此方法既可筛选到CaN抑制剂,也可筛选到Mpk1 MAPK激酶抑制剂。
Boonkerd等[9]利用酵母“正筛选”模型从69种泰国药用植物中筛选出穿心莲、提琴形凹唇姜以及小白花地榆的提取物中含有较高的CaN活性抑制物质,并已分离鉴定出小白花地榆中4种黄酮类化合物是CaN活性抑制物质[10]。这4种黄酮物质分别为5-羟基3,7-二甲氧基黄酮和5-羟基-7-甲氧基黄酮,5-羟基-3,7,4’-三甲氧基黄酮,5,7-二甲氧基黄酮。由于天然植物提取物中可能含有一些抑菌抗菌化合物,因此利用“正筛选”模型的生长圈作为筛选标准,能够顺利将抑菌抗菌化合物排除,提高筛选的针对性。
Suauam等[11]也通过酵母“正筛选”模型筛选到萜类化合物香豆素具有抑制CaN活性的能力,由于许多香豆素类化合物具有抗菌活性,因此利用“正筛选”模型筛选可以有效避免因为该化合物可能存在抗菌活性而造成假阳性。随后,他们又通过酵母敲除菌株Δcnb1(缺少编码CaN的基因)和Δmpk1(缺少编码Mpk1 MAPK的基因)对该香豆素化合物进行了进一步实验,并验证了该物质作用于CaN通路而非Mpk1 MAPK级联反应。最近,有文献报道对上述“正筛选”模型进行了改进。Uesugi等[12]利用对酿酒酵母中RSP5基因编码的E3泛素连接酶的401位氨基酸进行了突变,使得该酵母突变株(rsp5A401E)对高温非常敏感,在37℃下,能够产生明显的生长抑制现象。并通过实验证明了抑制CaN通路能够使得rsp5A401E菌株对高温具有一定的耐受性而恢复生长。根据该方法,他们筛选了近800种自然界来源的甲醇提取物,并最终鉴定出了2种双萜类化合物,脱氢枞酸和海松酸具有抑制CaN的活性。Kume等[13]通过敲除VRP1基因,使得Δvrp1酵母菌株对高温极其敏感。该基因编码与肌动蛋白组织和内吞作用有关的富脯蛋白。Δvrp1菌株在35.5℃下就会产生严重的生长抑制,而FK506能够完全消除该菌株在高温下的生长抑制,而FK506本身则对该菌株在常温下的生长无影响。
酵母突变株rsp5A401E与酵母敲除株Δvrp1与Δzds1都利用了酵母生长圈作为筛选标准。而后两种方法相较于第一种“正筛选”方法,省去了在培养基中加入高浓度Ca2+,使得操作进一步简化。
2 基于酵母报告基因的高通量筛选
在哺乳动物中,CaN最重要的底物是转录因子NFATc[14],而在酵母细胞中,CaN的重要靶标是转录因子Crz1。Stathopoulos等[15]发现,在酵母中由Ca2+诱导激活转录的基因(如FKS2),其启动子序列中均存在一个24 bp区域,被称为CaN依赖性反应元件(calcineurin-dependent response element,CDRE),是转录因子Crz1的结合位点。转录因子Crz1一般以磷酸化状态存在于细胞质中,一旦CaN被Ca2+和钙调素激活,则催化Crz1去磷酸化。脱磷酸化的Crz1转移至细胞核内,并与CDRE序列结合以激活下游目标基因的转录表达。由于CaN在真核生物中具有高度保守性,Margassery等[16]构建了基于酵母报告基因(CDRE∶∶LacZ)的高通量筛选CaN抑制剂模型。该方法的优点是在96孔板中进行检测,能快速检测出具有抑制CaN活性的化合物,可以实现高通量筛选。但是由于该方法需要利用酵母活菌表达半乳糖苷酶,因此若遇能够抑制酵母生长的物质,则该方法亦会出现假阳性。他们用该模型对海绵共栖菌提取物库中的81种化合物进行了筛选,得到3种化合物具有CaN活性抑制活性。
Prescott等[17]也应用上述酵母报告基因模型筛选了360种植物提取物,筛选出石生屈曲花来源的化合物3,4,5-三甲氧基苄基异硫氰酸酯(3,4,5-trimethoxybenzylisothiocyanate,TMBITC)具有抑制酵母CaN活性的作用,并通过人体CaN活性检测试剂盒实验确定了该物质直接作用于人CaN,且不需要额外的结合蛋白。
吴鹏飞等[18]也应用酵母报告基因模型从杭州的土样中筛选出一株链霉菌CZW-15,其发酵液稀释100倍后仍具有较强的抑制CaN活性(抑制率约80%)。目前,本实验室仍在对CZW-15发酵液的抑制CaN活性物质进行分离纯化和结构鉴定。
3 CaN活性检测法
直接检测重组人CaN的酶活可以精准地鉴定出待测物质是否作用于CaN,常用于检测和鉴定潜在的CaN活性抑制物质,也可以用于CaN活性抑制物质的筛选。
3.1 利用磷同位素标记CaN底物
Fruman等[19]利用[32P]标记磷酸化的RII肽作为CaN的底物,CaN催化底物脱磷酸化产生游离的[32P]磷酸盐和去磷酸化的肽链,将反应液通过阳离子交换柱,未被脱磷酸化的肽链将被吸附于柱上,而具有放射性的[32P]磷酸盐则被收集,根据放射性强度,利用液体闪烁计数法检测收集液中的放射强度,从而确定被CaN脱磷酸化的底物的量,以此来检测CaN的酶活。该方法检测灵敏度高,且结果准确,但由于阳离子交换柱的使用步骤繁琐,降低了实验的可靠性,很难应用于大规模高通量筛选。随后,Martin等[20]在原来筛选方法的基础上,将阳离子交换柱,改为使用聚偏二氟乙烯(PVDF)疏水滤膜过滤除去未被水解的磷酸肽,并将反应、过滤以及检测等过程均置于96孔板中。该方法既适合用于高通量筛选,又有利于实现自动化操作,对提高筛选效率有极大的帮助。
Aramburu等[21]利用[32P]标记CaN底物磷酸RII肽,筛选和鉴定了合成短肽SPRIEIT具有抑制CaN酶活的性质。该合成短肽的序列与NFATc1用于结合CaN的保守序列110SPRIEITPS118极为相似,使得该合成短肽能够与NFATc1竞争CaN的结合位点,从而竞争性地抑制CaN催化NFATc1脱磷酸化,而不影响CaN本身的磷酸酶活性。
Baumgrass等[22]利用[33P]标记CaN底物磷酸RII肽,从小分子化合物库筛选出棉子酚具有抑制CaN活性的能力。棉子酚不同于他克莫司和CsA,直接结合于CaN上,不需要与额外的免疫亲和蛋白结合,其在CaN上的结合位点与亲环素-CsA复合物抑制CaN的结合位点相同,以非竞争性可逆抑制的方式抑制CaN活性。
Wang等[23]利用[32P]标记CaN底物磷酸RII肽,筛选到一种具有抑制CaN酶活能力的天然黄酮类化合物山奈酚。山奈酚不同于他克莫司和CsA,不需要与额外的免疫亲和蛋白结合,而是直接以非竞争性方式抑制CaN。山奈酚直接作用于CaNA的催化域,并且在CaM和CaNB存在的情况下,能够提高山奈酚对CaN的抑制作用。
Wang等[24]还利用[32P]标记CaN底物磷酸RII肽,筛选出另一种天然黄酮类化合物槲皮素,它能够抑制CaN活性。槲皮素以非竞争性的方式抑制CaN的磷酸酶活性,同样不需要与免疫亲和蛋白结合,直接作用于CaN的催化域,并且在CaNB存在的情况下,能够提高槲皮素对CaN的抑制作用。
Erdmann等[25]利用[32P]标记CaN底物磷酸RII肽,通过筛选化合物库,得到具有CaN活性抑制能力的有机小分子化合物6-(3,4-二氯苯基)-4-(N,N-二甲基氨基乙巯基)-2-苯基嘧啶(CN585)。CN585能够通过非竞争性的方式可逆抑制CaN活性,且具有很高的特异性;在抑制CaN的同时,不会影响其他丝氨酸/苏氨酸蛋白磷酸酶或肽基脯氨酰顺反异构酶的活性。此外,CN585在有效浓度下并不显示细胞毒性,有利于其作为CaN抑制剂应用于临床治疗。
由于在该筛选方法的生化反应体系中,未加入任何免疫亲和蛋白,因此上述报道的CaN活性抑制化合物不需要与额外的免疫亲和蛋白结合,均可以直接作用于CaN,从而抑制其活性,相比于FK506与CsA,对CaN具有更高的特异性。
3.2 利用绿色荧光标记CaN底物磷酸肽
由于前一种方法需要使用具有放射性的同位素,所以在应用上具有一定的局限性,且对环境有不利影响。因此,Roberts等[26]在CaN的底物磷酸肽的氨基酸残基上添加荧光标记,在CaN与底物反应后,用氧化钛(TiO4)吸附未被脱磷酸的底物,从而通过荧光强度检测被脱磷酸化的底物数量,即可确定CaN酶活。
Qian等[27]利用荧光标记CaN底物的方法,验证了人工合成的ZIZIT-cisPro小肽具有CaN活性抑制作用。该合成小肽能够与NFAT竞争CaN上的结合位点,并且合成小肽本身对CaN具有更高的亲和度,能够高效抑制CaN催化NFAT脱磷酸化。且该合成小肽末尾增加的反式脯氨酸残基能够有效抵御蛋白酶的水解,进一步延长了该合成小肽的抑制有效期。
3.3 利用CaN酶解产物显色反应
Sellar等[28]基于孔雀绿和游离磷酸盐之间可以形成一个在620~640 nm处吸光的复合物的原理,在CaN与底物磷酸肽的反应液中加入孔雀绿,使其中的游离磷酸盐与孔雀绿形成复合物,随后在620 nm下检测吸光度,从而通过检测被CaN脱磷酸化的底物的量来确定CaN活性。Harish等[29]利用孔雀绿显色定磷法鉴定了来自CaN自抑制域的一段多肽链具有抑制CaN活性的能力。该法来源于在生化反应中常用的孔雀绿定磷法,本身并非专用于筛选新型CaN抑制剂,但是借助该方法能够准确定量测定溶液中的游离无机磷,因此可以方便快速地检测CaN的活性。
Prescott等[30]利用对硝基苯磷酸盐(p-NPP)被磷酸酶水解后,产生黄色末端产物,利用吸光度定量检测磷酸酶活性。CaN水解p-NPP后,可以通过检测其酶解产物,确定CaN活性,从而鉴定出矮探春植株的根和叶提取物中含有抑制人CaN活性的物质,且叶提取物的抑制效果高于根提取物。
Cen等[31]也利用CaN水解p-NPP的方法,从一系列来自山竹子植株的天然化合物,并从中筛选出异藤黄酚(isogarcinol)具有抑制CaN活性的能力。该化合物的抑制活性在一定范围内与浓度呈正相关,且在有效浓度下,对细胞毒性相当低。该化合物在小鼠急性毒性试验中比CsA毒性更低,且长期使用能明显延长皮肤移植小鼠的存活时间。这些结果表明,异藤黄酚用于临床治疗自身免疫病的潜力极大,且更适于长期用药。
3.4 利用CaN产物荧光淬灭现象
在上述孔雀绿检测游离磷酸盐以测定CaN活性方法的基础上,Mukherjee等[32]利用荧光384孔板本身被激发出的荧光能被孔雀绿磷酸盐复合物淬灭,进而通过荧光强度测定CaN活性,使CaN活性与荧光强度呈负相关。该方法较之借助吸光度检测法,需要的检测样品体积更小,在检测体积<10μL时依然可以准确检测,且对荧光变化很敏感。他们亦利用自动移液工作站成功将该方法实现机械化高通量筛选,极大地减少了工作量,进一步提高了实验的准确率,并提高了筛选的效率。随后他们用该方法筛选了包含1400多种小分子物质的化合物库,最终筛选出盐酸氟桂利嗪(LDN-0013905)和盐酸三氟拉嗪(LDN0013906)2种具有抑制CaN活性的化合物。
表1总结了本文中提及的部分被筛选出的CaN活性抑制物质及其筛选方法。
4 展望
由于目前临床上广泛应用的CNI具有诸多不足之处,因此,有必要开发新型、低毒的CNI。采取适宜的方法,对大量化合物进行筛选,寻找具有CaN活性抑制能力的化合物,应成为开发新型CNI的主要工作。
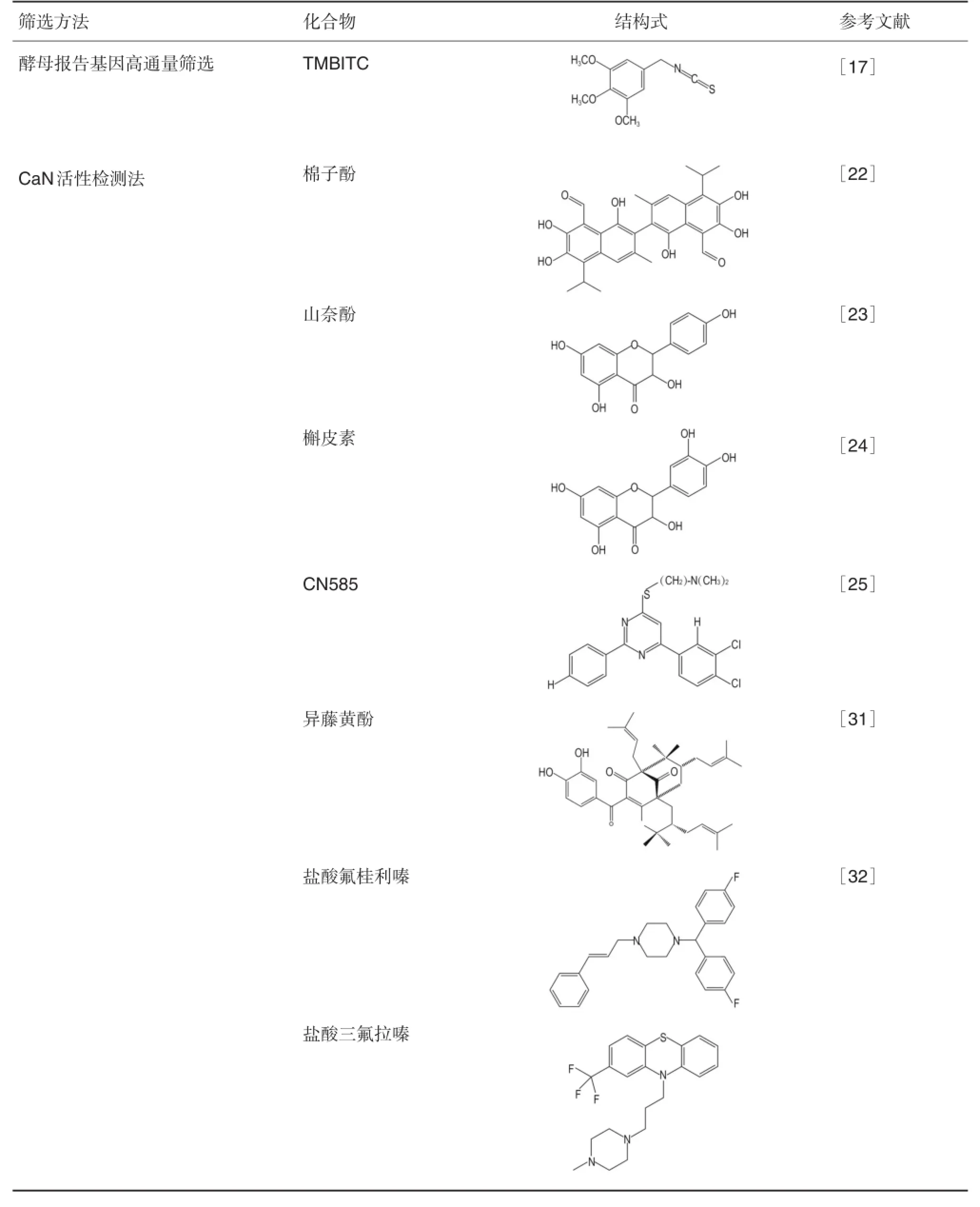
续表1
本文列举的筛选方法中,酵母“正筛选”模型使用生长圈而非抑菌圈作为筛选的标准,有效避免了待筛选物质中可能包含具有抑菌活性物质而造成“假阳性”。对于筛选天然植物或药用植物提取物时,可以避免提取物中含有抑菌化合物而对筛选结果造成干扰。该筛选方法使用活酵母作为筛选模型,筛选到的活性物质具有透过细胞膜的特性,从而避免了某些生化检测方法筛选到的活性物质无法透过细胞膜的缺陷。但受酵母生长周期限制,检测周期一般需要2~3 d,且较难实现高通量筛选,因此该方法比较适合于较少数样品的筛选工作。
而基于酵母报告基因(CDRE∶∶LacZ)高通量筛选模型利用LacZ表达量与CaN活性呈正相关,巧妙地将CaN活性检测转化为可通过仪器方便和准确量化的LacZ表达量,且该反应可以置于96孔板中实现高通量筛选。然而该方法若遇抑菌物质或能够杀灭酵母的毒性物质,极有可能造成“假阳性”,因此筛选到的潜在的CaN抑制物质仍需要利用其他方法进一步验证。该方法适用于对大量样品进行初筛。
CaN活性检测法通过直接检测CaN酶活来确定待测物质是否对CaN有抑制作用,若有抑制作用,则该化合物的作用靶点必定为CaN,避免了筛选到作用靶点非CaN的免疫抑制化合物。但是该方法筛选出的化合物可能无法透过活细胞的细胞膜,因而在实际应用中亦可能无法进入胞质,无法抑制CaN的酶活。所以该方法筛选的化合物需要联合其他方法进一步验证,才能最终确定被筛选出的化合物是否有应用价值。
综上所述,若只采用单种方法,很难准确、高效地筛选到具有CaN抑制活性的化合物。因此,采用多种方法联合筛选,既能够充分利用其优势,又可以相互弥补各自的不足之处,即提高效率,又能保证筛选的准确性。
首先,酵母报告基因检测模型与CaN活性检测法均可实现高通量筛选,适合于对大量候选化合物进行筛选。但是由于CaN活性检测法采用重组人CaN参与反应,实验成本较高,且部分检测手段较为复杂。因此,宜采用酵母报告基因检测模型对大量候选化合物进行初步筛选。
其次,由于酵母“正筛选”模型利用CaN活性抑制物质对该酵母有“生长挽救”的特性,通过生长圈作为筛选标准,可以进一步验证酵母报告基因筛选模型的筛选结果中,是否含有本身具有抑菌或杀菌能力的化合物,除去初步筛选中可能出现的“假阳性”,提高筛选的准确性。也同时验证了筛选出的化合物能够顺利通过细胞膜进入胞质。
最后,CaN活性检测法由于其为生化反应的特性,较适宜检测已初筛出的化合物对CaN活性的抑制率。亦可用于目标靶点为CaN的人工合成小分子化合物。
本实验室就联合采用了酵母报告基因高通量筛选模型与酵母“正筛选”模型,利用酵母报告基因模型对大量土壤微生物进行初步筛选,以期获得其代谢产物对CaN活性具有抑制作用的菌株,并进一步利用酵母“正筛选”模型验证其作用位点,并取得了初步成效。
筛选并开发新型低毒的CNI,对推动器官移植与自身免疫病的治疗都将具有重大意义。合理利用多种筛选方法,能够更高效,准确地筛选出目标化合物,达到事半功倍的效果。
[1]Shibasaki F,Hallin U,Uchino H.Calcineurin as a multifunctional regulator[J].J Biochem,2002,131(1):1-15.
[2]Hudson MB,Price SR.Calcineurin:a poorly understood regulator of muscle mass[J].Int J Biochem CellBiol,2013,45(10):2173-2178.
[3]Grigoriu S,Bond R,Cossio P,Chen JA,Ly N,Hummer G,et al.The molecular mechanism of substrate engagement and immunosuppressant inhibition of calcineurin[J].PLoS Biol,2013,11(2):e1001492.
[4]Li H,Rao A,Hogan PG.Interaction of calcineurin with substrates and targeting proteins[J].Trends Cell Biol,2011,21(2):91-103.
[5]Guitard J,Rostaing L,Kamar N.New-onset diabetes and nephropathy after renal transplantation[J]. Contrib Nephrol,2011,170:247-255.
[6]Rezzani R.Exploring cyclosporine A-side effects and the protective role-played by antioxidants:the morphological and immunohistochemical studies[J].HistolHistopathol,2006,21(3):301-316.
[7]Mizunuma M,Hirata D,Miyahara K,Tsuchiya E,Miyakawa T.Role of calcineurin and Mpk1 in regulating the onset of mitosis in budding yeast[J]. Nature,1998,392(6673):303-306.
[8]Shitamukai A,Mizunuma M,Hirata D,Takahashi H,Miyakawa T.A positive screening for drugs that specifically inhibit the Ca2+-signaling activity on the basis ofthe growth promoting effect on a yeast mu⁃tant with a peculiar phenotype[J].Biosci Biotech⁃nolBiochem,2000,64(9):1942-1946.
[9]Boonkerd S,Yompakdee C,Miyakawa T,Chavasiri W.Screening of Thai medicinal plants for inhibitors of Ca2+signaling using a yeast cell growth-based assay[J].Res J Pharm Biol ChemSci,2011,2(2):549-557.
[10]Boonkerd S,Yompakdee C,Miyakawa T,Chavasiri W.A flavonoid,5-hydroxy-3,7-dimethoxy⁃flavone,from Kaempferia parviflora Wall.Ex.Baker as an inhibitor of Ca2+signal-mediated cell-cycle regulation in yeast[J].Ann Microbiol,2013,64(3):1049-1054.
[11]Suauam P,Yingyongnarongkul BE,Palaga T,Miyakawa T,Yompakdee C.Clausmarin A,potential immunosuppressant revealed by yeast-based assay and interleukin-2 production assay in Jurkat T cells[J].PLoS One,2015,10(8):e0136804.
[12]Uesugi S,Watanabe D,Kitajima M,Watanabe R,Kawamura Y,Ohnishi M,et al.Calcineurin inhibitors suppress the high-temperature stress sensitivity of the yeast ubiquitin ligase Rsp5 mutant:a new method of screening for calcineurin inhibitors[J]. FEMS Yeast Res,2014,14(4):567-574.
[13]Kume K,Koyano T,Takata J,Wakabayashi K,Mizunuma M,Miyakawa T,et al.Screening for a gene deletion mutant whose temperature sensitivity is suppressed by FK506 in budding yeast and its application for a positive screening for drugs inhib⁃iting calcineurin[J].Biosci Biotechnol Biochem,2015,79(5):790-794.
[14]Rao A,Luo C,Hogan PG.Transcription factors of the NFAT family:regulation and function[J].Annu Rev Immunol,1997,15:707-747.
[15]Stathopoulos AM,Cyert MS.Calcineurin acts through the CRZ1/TCN1-encoded transcription factor to regulate gene expression in yeast[J].Genes Dev,1997,11(24):3432-3444.
[16]Margassery LM,Kennedy J,O′Gara F,Dobson AD,Morrissey JP.A high-throughput screen to identify novel calcineurin inhibitors[J].J Microbiol Methods,2012,88(1):63-66.
[17]Prescott TA,Panaretou B,Veitch NC,Simmonds MS. A yeast chemical genetics approach identifies the compound 3,4,5-trimethoxybenzylisothiocyanate as a calcineurin inhibitor[J].FEBS Lett,2014,588(3):455-458.
[18]Wu PF,Zhou L,Liu JL,Cui ZF.Screening,identi⁃fication and fermentation conditions optimization of Streptomyces CZW-15 with inhibitory activities on calcineurin[J].Microbiol China(微生物学通报),2015,42(12):2417-2425.
[19]Fruman DA,Pai SY,Klee CB,Burakoff SJ,Bierer BE.Measurement of calcineurin phospha⁃tase activity in cell extracts[J].Methods,1996,9(2):146-154.
[20]Martin MM,Wiederrecht GJ.A filter-based,96-wellmicrotiter plate calcineurin phosphatase assay[J].Methods,1996,9(2):155-159.
[21]Aramburu J,Garcia-Cózar F,Raghavan A,Okamura H,Rao A,Hogan PG.Selective inhibition of NFAT activation by a peptide spanning the calci⁃neurin targeting site of NFAT[J].Mol Cell,1998,1(5):627-637.
[22]Baumgrass R,Weiwad M,Erdmann F,Liu JO,Wunderlich D,Grabley S,et al.Reversible inhibition of calcineurin by the polyphenolic aldehyde gossypol[J].J Biol Chem,2001,276(51):47914-47921.
[23]Wang H,Zhou CL,Lei H,Zhang SD,Zheng J,Wei Q.Kaempferol:a new immunosuppressant of calcineurin[J].IUBMB Life,2008,60(8):549-554.
[24]Wang H,Zhou CL,Lei H,Wei Q.Inhibition of cal⁃cineurin by quercetin in vitro and in Jurkat cells[J]. J Biochem,2010,147(2):185-190.
[25]Erdmann F,Weiwad M,Kilka S,Karanik M,Pätzel M,Baumgrass R,et al.The novelcalcineu⁃rin inhibitor CN585 has potent immunosuppressive properties in stimulated human T cells[J].J Biol Chem,2010,285(3):1888-1898.
[26]Roberts B,Pohl J,Gooch JL.A fluorimetric method for determination of calcineurin activity[J].Cell Cal⁃cium,2008,43(5):515-519.
[27]Qian Z,Dougherty PG,Liu T,Oottikkal S,Hogan PG,Hadad CM,et al.Structure-based opti⁃mization of a peptidyl inhibitor against calcineurinnuclear factor of activated T cell(NFAT)interaction[J].J Med Chem,2014,57(18):7792-7797.
[28]Sellar KJ,van Rossum HH,Romijn FP,Smit NP,de Fijter JW,van Pelt J.Spectrophotometric assay for calcineurin activity in leukocytes isolated from human blood[J].Anal Biochem,2006,358(1):104-110.
[29]Harish BM,Saraswathi R,Vinod D,Devaraju KS. Discovery of a latent calcineurin inhibitory peptide from its autoinhibitory domain by docking,dynamic simulation,and in vitro methods[J].J Biomol Struct Dyn,2016,34(5):983-992.
[30]Prescott TA,Ariño J,Kite GC,Simmonds MS. Inhibition of human calcineurin and yeast calcineurindependent gene expression by Jasminum humile leaf and root extracts[J].J Ethnopharmacol,2012,140(2):293-297.
[31]Cen J,Shi M,Yang Y,Fu Y,Zhou H,Wang M,Su Z,et al.Isogarcinol is a new immunosuppressant[J].PLoS One,2013,8(6):e66503.
[32]Mukherjee A,Syeb K,Concannon J,Callegari K,Soto C,Glicksman MA.Development of a fluores⁃ cent quenching based high throughput assay to screen for calcineurin inhibitors[J].PLoS One,2015,10(7):e0131297.
Resevrch progress in screening methods ofcalcineurin inhibitors
XU Xiang,CUIZhi-feng,DING Dong-dong,ZHU Ting-heng
(College ofBiotechnology and Bioengineering,Zhejiang University ofTechnology,Hangzhou 310014,China)
Calcineurin inhibitor screening should benefit from the strengths of each method.This paper reviews three calcineurin inhibitor screening methods:yeast"positive screening"model,yeast reporter gene high through-put screening model and calcineurin activity detection method.We have compared the range of application,advantages and disadvantages of each method,and combined effect of multiple methods.The yeast"positive screening"model can prevent the false positiveness caused by bacteriostat by using growth zooms instead of inhibition zooms.The yeast reporter gene high through-putscreening modelis suitable for pilotscreening among a wide range ofsamples and is more efficientthan the other methods.The calcineurin activity detection method can directly report the inhibitory ratio to a specific target.This review is expected provide a model-selection reference for the developmentofnovellow-toxic calcineurin inhibitors.
calcineurin;inhibitor;screening methods
ZHU Ting-heng,Tel:(0571)88320741,E-mail:thzhu@zjut.edu.cn
R965.1
:A
:1000-3002-(2017)04-0367-08
10.3867/j.issn.1000-3002.2017.04.011
2017-01-13接受日期:2017-03-31)
(本文编辑:贺云霞)
徐翔,男,硕士研究生,主要从事酶抑制剂的分离纯化研究。
朱廷恒,Tel:(0571)88320741,E-mail:thzhu@zjut. edu.cn

