黄芪糖蛋白对胶原诱导性关节炎小鼠脾组织T-bet及GATA-3表达的影响
张 娜 赵俊云 薛慧清 刘 慧 李彩彩 杨向竹 周 然
(1 北京中医药大学基础医学院,北京,100029; 2 山西中医学院,太原,030024)
黄芪糖蛋白对胶原诱导性关节炎小鼠脾组织T-bet及GATA-3表达的影响
张 娜1赵俊云1薛慧清2刘 慧1李彩彩1杨向竹1周 然2
(1 北京中医药大学基础医学院,北京,100029; 2 山西中医学院,太原,030024)
目的:探讨黄芪糖蛋白对胶原诱导性关节炎(Collagen-induced Arthritis,CIA)小鼠特异性转录因子T-bet和GATA-3表达的影响,阐述黄芪糖蛋白治疗胶原诱导性关节炎小鼠的免疫作用机制。方法:建立牛Ⅱ型胶原诱导的小鼠关节炎模型,随机分为CIA模型组、氢化可的松阳性对照组、黄芪糖蛋白低剂量组、中剂量组、高剂量组;HE染色观察CIA小鼠脾组织损伤程度;采用流式细胞术检测CIA小鼠外周血IFN-γ和IL-4的水平;Western blot法检测CIA小鼠脾组织中T-bet和GATA-3蛋白的表达。结果:与模型组比较,黄芪糖蛋白改善了CIA小鼠脾组织损伤情况,减轻炎性反应细胞浸润,下调了外周血IFN-γ和IL-4水平(P<0.05);同时,降低了T-bet和GATA-3蛋白的表达(P<0.05)。结论:黄芪糖蛋白对CIA小鼠的治疗作用,可能是与降低T-bet、GATA-3表达,调整Th1/Th2功能失衡有关。
黄芪糖蛋白;牛Ⅱ型胶原诱导性关节炎小鼠;GATA-3;T-bet
类风湿关节炎(Rheumatoid Arthritis,RA)是一个以累及周围关节为主的多系统炎性反应性的自身免疫性疾病[1],在世界范围内患病率为0.01%~1.07%不等,最终将导致关节畸形、功能丧失,具有很高的致残率。因RA病因和发病机制尚不明确,目前对RA尚无特效治疗方法。研究己证明正常生理状态下Th1与Th2细胞分化存在着一种动态平衡与交互抑制,Th1/Th2细胞分化的动态平衡一旦被打破,T细胞就会朝着Th1细胞分化占优势或Th2细胞分化占优势的“漂移状态”发展,机体因此而发病。因此T细胞亚群Th1、Th2分化失衡被认为是诱导RA发病的中心环节。
黄芪的药理研究显示其具有良好的抗炎、镇痛和免疫调节等作用,但黄芪对RA Th1/Th2漂移的干预实验还鲜有报道。黄芪糖蛋白(Huang Qi Glycoprotein,HQGP)是本研究组从膜荚黄芪中提取到一种具有免疫抑制活性的物质,并已申请专利[2]。实验研究表明HQGP对小鼠脾淋巴细胞体外增殖具有明显的抑制作用[3-4]。体内实验发现HQGP对大鼠佐剂性关节炎(AA)的关节炎性反应有明显的改善作用[5]。本文复制小鼠CIA模型,通过病理形态学观察、特异转录因子的表达,初步探讨HQGP对CIA小鼠的免疫作用机制。本实验是以Th1、Th2的2个特异性转录因子T-bet和GATA-3来观察CIA小鼠的Th1/Th2细胞分化及HQGP干预后表达变化,以期揭示HQGP对CIA的作用机制。
1 材料与方法
1.1 动物 BALb/c雄性小鼠,60只,体重16~18 g,清洁级,购于北京华阜康生物科技股份有限公司(许可证号:SCXK(京)2009-0015)。
1.2 药物 HQGP乳剂,由山西中医学院提供。
1.3 试剂与仪器 弗氏完全佐剂,sigma公司;胶原蛋白Ⅱ型(牛),Chondrex公司;Anti-T-bet Purified、Anti-GATA-3 Purified eBioscience公司;β-actin、HRP标记羊抗兔IgG,北京博奥森生物技术有限公司;HRP标记羊抗小鼠IgG、四甲基乙二胺(N,N,N′,N′-tetramethylenediamine,TEMED),北京康为世纪生物科技有限公司;苯甲基磺酰氟(Phenyl Methyl sulfonyl fluoride,PMSF)、聚偏氟乙烯(Polyvinylidene Fluoride,PVDF)微孔转移膜、超敏ECL化学发光试剂盒、Tween-20、浓缩胶缓冲液(Upper stock or stacking buffer)、分离胶缓冲液(Lower stock or separating buffer)、过硫酸铵(Ammonium Persulfate,AP)、5%脱脂奶粉、Tris、SDS、BCA蛋白定量试剂盒,均由Solarbio公司提供;Cell Stimulation Cocktail(PMA+Ionomysin+BFA),Sigma公司;APC/Cy7 anti-mouse CD3、FITC anti-mouse CD4、PE anti-mouse IL-4、APC anti-mouse IFN-y,美国BioLegend公司。JY600C型电泳仪,北京君益东方电泳设备有限公司;酶联免疫检测仪,Tecan公司;流式细胞仪,美国BD公司。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 分组 将造模成功的小鼠50只随机分为模型组(CIA)、氢化可的松(HC,10 mg/kg)阳性对照组、HQGP低剂量组(HQGP1,0.5 mg/kg)、HQGP中剂量组(HQGP2,1.0 mg/kg)、HQGP高剂量组(HQGP3,5.0 mg/kg),每组10只。
1.2.1.2 模型制备 雄性BALb/c小鼠适应性饲养1周。按照参考文献[6]复制CIA模型。模型建立:在超净工作台内将胶原蛋白Ⅱ型(牛)溶解于0.1 mol/L的醋酸中,在4 ℃冰箱中过夜,然后与1 g/L的弗氏完全佐剂等体积混合,在冰浴下完全乳化,制成弗氏完全佐剂与牛Ⅱ型胶原混合乳剂。于小鼠尾根部皮内注射乳剂0.1 mL。将注射当日记为第0天,初次致敏后第21 d再次注射加强免疫。以关节肿胀度评分标准评价模型复制是否成功。
1.2.2 给药方法 第42天给予腹腔注射药物治疗。给药1次/3 d,共给药6次。正常组(10只)注射等体积生理盐水。
1.2.3 检测指标与方法
1.2.3.1 关节肿胀度评分 根据四肢关节的病变程度累计积分,计算出关节炎指数(Arthritis Index,AI)。标准为:关节无红肿,0分;小趾关节稍肿,1分;趾关节和足趾关节肿胀2分;踝关节以下足爪肿胀,3分;踝关节在内全部足爪肿胀,4分。4只足爪均评分,每只小鼠最高16分。AI值≥4分造模成功。
1.2.3.2 HE染色观察脾组织形态 第57天脱颈处死小鼠,取各组小鼠脾组织,立即放入10%甲醛固定液中,常规脱水,石蜡包埋,切片,HE染色,加封盖玻片保存。光学显微镜下观察。
1.2.3.3 流式细胞仪检测小鼠外周血IFN-γ、IL-4水平 第57天脱颈处死小鼠,取小鼠外周血。流式细胞术检测按照说明书进行。外周血淋巴细胞悬液中加入刺激IFN-γ、IL-4分泌的刺激剂,在CO2培养箱中培育4 h。荧光标记辅助性T细胞CD3、CD4抗原,固定细胞,荧光标记胞质内聚集的IFN-γ、IL-4,流式细胞仪检测。IFN-γ、IL-4分别特异性在Th1、Th2细胞分泌,因此以IFN-γ、IL-4的量表示Th1、Th2的数量。
1.2.3.4 Western blot法检测脾组织中T-bet、GATA-3蛋白的表达 第57天处死小鼠,取各组小鼠脾组织,提取总蛋白,BCA法蛋白定量。取蛋白30 μg上样,SDS-PAGE电泳后,转移至PVDF膜上,室温下封闭1 h,加入一抗,4 ℃冰箱封闭过夜;次日TBST脱洗3次,二抗孵育1 h,再脱洗3次后,ECL化学发光液显色,X线片曝光,洗片。显影结果采用Quantity One软件计算灰度值,以目标蛋白与内参比值反应蛋白表达水平。

2 实验结果
2.1 CIA小鼠关节肿胀度评分 CIA模型小鼠于注射佐剂后第10天出现关节红肿反应,逐渐加重,于第42 d评分均值达到模型标准(≥4)。小鼠同时表现出倦怠,食量减少,活动受到障碍。CIA小鼠AI值变化(图1)。
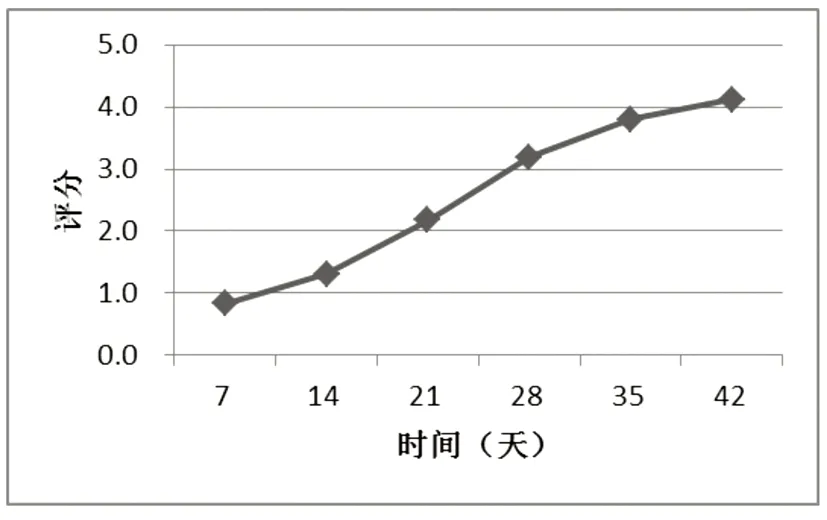
图1 CIA小鼠不同天数AI值
2.2 HQGP对CIA小鼠脾组织病理切片观察 常规HE染色病理切片显示(图2),与正常组比较,模型组脾小结变大,中央动脉周围淋巴鞘炎细胞增生,炎性反应水肿导致组织疏松;与模型组比较,各治疗组改善了炎细胞浸润增生情况。
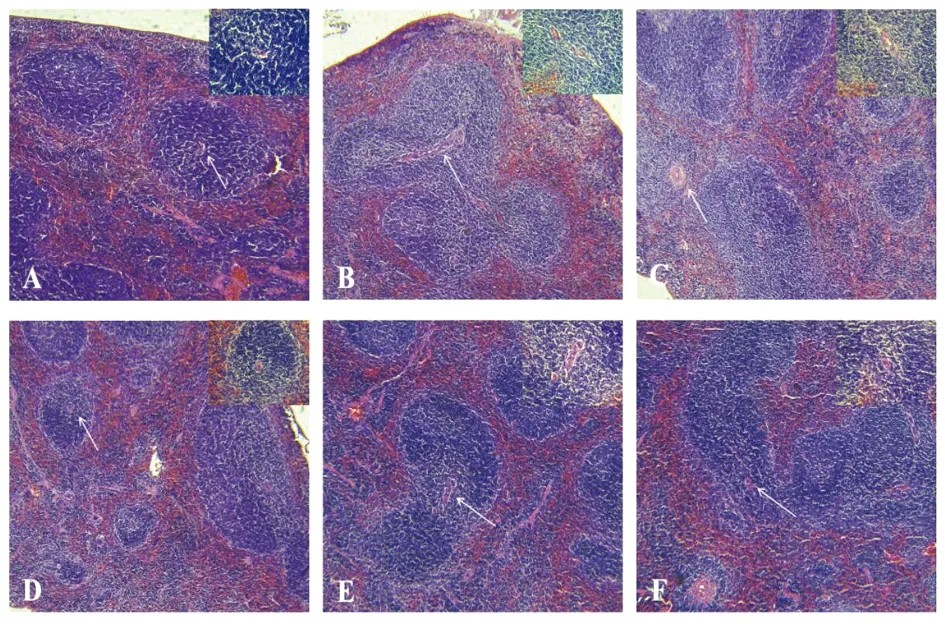
图2 各组小鼠的脾组织形态学观察(HE染色,光镜下×40)
注:A正常组B模型组C氢化可的松组D HQGP低剂量组E HQGP中剂量组F HQGP高剂量组,↑指示中央动脉。
2.3 HQGP对CIA小鼠外周血Th1、Th2比例的影响 实验结果如表1。与正常组比较,模型组小鼠外周血IFN-γ、IL-4比例升高,差异有统计学意义(P<0.05)。治疗后,与模型组比较,HC组和HQGP低、中剂量组IFN-γ、IL-4比例降低,差异有统计学意义(P<0.05)。同时,表1还表明,HQGP低、中剂量组对比模型组,Th1降低的幅度大于Th2降低的幅度。
2.4 HQGP对T-bet、GATA-3蛋白表达的影响 利用Western blot检测脾组织T-bet、GATA-3蛋白的表达。杂交结果如图3所示,数据见表2。与正常组比较,CIA模型组T-bet、GATA-3表达升高(P<0.05);与模型组比较,HC组和HQGP低、中剂量组T-bet、GATA-3的表达降低(P<0.05),HQGP高剂量组T-bet、GATA-3表达降低,但差异无统计学意义。表2结果还显示,HQGP低、中剂量组分别与模型组比较,T-bet降低幅度比GATA-3降低幅度大。
表1 HQGP对CIA小鼠外周血Th1、Th2比例的影响
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05。
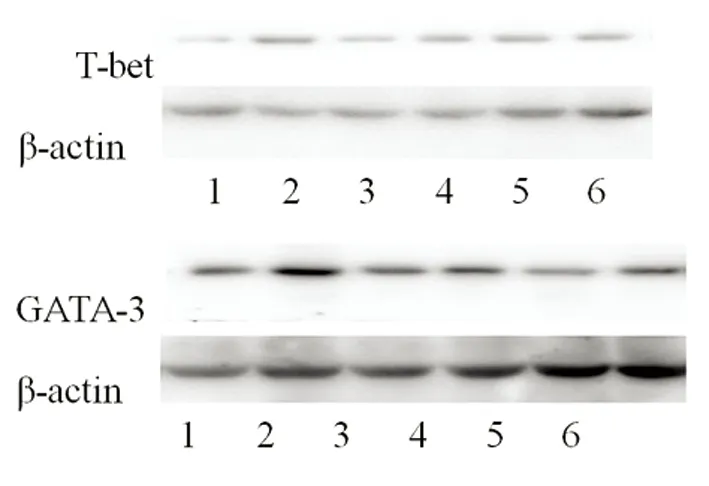
图3 CIA小鼠脾组织T-bet、GATA-3蛋白Western blot
注:1-6泳道:正常组、模型组、HC组、HQGP低剂量组、HQGP中剂量组、HQGP高剂量组。
表2 CIA小鼠脾组织中T-bet与GATA-3蛋白的表达
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05。
3 讨论
目前,RA的病因、发病机制并不是十分清楚,为了更好地研究RA的病因、发病机制及其治疗方法,国内外众多学者成功建立了许多与人类RA类似的动物模型。如AA模型、CIA模型,其中CIA模型是类风湿性关节炎常用的经典动物模型。在建立模型的过程中,动物品系、注射部位、手法、注射剂量以及胶原是否充分混匀、乳化是否完全,都会影响到CIA造模的成功率。本研究采用的是近交系BALb/c雄性小鼠,选取小鼠尾根部皮内注射,进行2次免疫,两次免疫时间间隔21 d,根据对CIA小鼠的关节炎指数评分、关节肿胀程度的评测,结果显示,CIA小鼠病变症状明显。
随着对RA发病机制的深入研究,不断出现越来越多的治疗类风湿性关节炎的药物,但始终没有比较让人满意的治疗方法,中药类治疗药物作为天然药物,具有整体调理、减轻不良反应的优势。其有效成分在治疗RA中表现出一定的优势。有研究显示,五藤汤辨证加减疗法对于类风湿性关节炎的治疗具有显著的临床疗效,且治疗灵活性高,不良反应少[7]。由阳和汤化裁而来的补肾通督胶囊可明显改善肾虚寒凝型RA患者Th1/Th2的比例失衡[8]。益气活血解毒方能够通过调控RA外周血T淋巴细胞的增殖和分化,维持体内自身免疫应答的稳态,抑制炎性反应的发生,缓解因免疫炎性反应造成的关节损伤,这可能是该方治疗RA的关键作用机制[9]。姜黄素衍生物FM0807对佐剂性类风湿性关节炎大鼠有较好疗效[10]。蠲痹颗粒对胶原诱导性小鼠关节炎具有防治作用[11]。健脾化湿通络中药新风胶囊可改善AA大鼠踝关节病理组织学损伤程度[12]。风湿宁胶囊可调节CIA大鼠炎性反应因子的分泌,恢复Th1/Th2的平衡[13]。黄芩茎叶总黄酮能够一定程度上减轻CIA小鼠的炎性反应症状,调节Th1/Th2细胞平衡[14]。
黄芪,属补气类中药,其在免疫调节、抗肿瘤、抗病毒、延缓衰老等方面都表现出活性,具有调节免疫等诸多药理作用[15]。氢化可的松是临床疗效确切的常用药物,具有抗炎和免疫抑制作用,所以选为阳性对照药。在本文中,我们成功复制了小鼠CIA模型,研究HQGP发挥免疫抑制作用的可能途径及其效果。
免疫功能紊乱的研究一直占据第一位,被认为是RA发生的主要发病机制之一,T细胞介导的自身免疫应答反应在RA的发病机制中起到重要作用。
Th1和Th2细胞均来自初始T细胞(Naive T cell,Tn),Tn在不同的细胞因子微环境下通过激活Janus激酶/信号转导子与转录激活子(Janus Kinase/Signal Transducer and Activator of Transcription,JAK/STAT)信号转导通路,分别活化下游各自的特异性转录调节因子T-bet(T-box Expressed in T cells)和GATA-3(GATA-binding Protein-3),继而诱导Tn分化为Th1、Th2亚群。T-bet和GATA-3分别作为特异性调控Th1和Th2分化的转录因子彼此之间相互调节。Th1细胞主要分泌IFN-γ、IL-2、TNF-α等细胞因子,其中IFN-γ是Th1细胞特征性细胞因子,具有双向免疫调节作用。Th2主要产生IL-4、IL-5、IL-6、IL-10等细胞因子,其中IL-4是Th2细胞分泌的特征抗炎性反应细胞因子,它可抑制滑膜巨噬细胞和Th1、Th17细胞合成炎性反应细胞因子及抑制血管新生,还具有保护软骨作用[16]。
很多研究表明,在RA患者中Th1明显增多并占优势,促炎性反应Th1细胞及其分泌的IFN-γ与抗炎性反应Th2细胞及其分泌的IL-4之间的失衡在RA发病机制中具有重要作用[17]。在以Th1反应为主的炎性反应晚期往往会有逐渐增强的Th2反应出现,其作用是阻止Th1反应介导损伤。刘喜德等实验结果提示淋巴细胞表达Th1表型可能是CIA起始疾病的关键步骤,在CIA的进展期,是以IFN-γ水平升高的Th1类细胞增多为主,而IFN-γ表达升高可能与疾病的严重性相关,说明CIA大鼠外周血存在Th1/Th2失衡[18]。郭明等应用流式细胞术从细胞水平也证实了Th1细胞和Th2细胞参与RA整个病程的演变,不同时期CIA小鼠体内二者呈现不同的变化规律,发病早期Th2细胞并不能抑制增多的Th1细胞,不足以抵制CIA恶化,至病情进展到中期和晚期Th2细胞开始有所升高抑制CIA病情发展,使RA症状趋于稳定[19]。
任舒婷等通过检测RA患者外周血及关节液中IL-4、IL-6、IFN-γ等表达情况,结果发现RA患者外周血和关节液中IL-4和IFN-γ水平均比正常对照组高,Th1/Th2的失衡引起RA炎性反应性损伤,其诱导的免疫性炎性反应是主要表现[20]。
实验结果显示,CIA组小鼠的脾细胞中T-bet、GATA-3表达明显增高,与正常组比较,差异有统计学意义(P<0.05);相应的CIA组外周血IFN-γ、IL-4的比例也升高,与正常组比较,差异有统计学意义(P<0.05),即外周血中Th1、Th2的比例增大,与特异性转录因子呈现出相同的变化趋势。T-bet表达的增高,促使Tn向Th1转化,外周血中Th1比例增高;同理GATA-3表达的增高,部分Tn也向Th2转化,外周血中Th2比例也增高。但T-bet与Th1的增高幅度均大于GATA-3与Th2的增高。说明造模后CIA小鼠Th1分泌炎性反应细胞因子占优势,机体抵抗炎性反应发生自然也同时提高Th2分泌抗炎因子,但增加的幅度远不及Th1,致使机体患病,表现CIA病症。
本实验中CIA小鼠经HQGP治疗后,脾细胞中T-bet、GATA-3的表达降低,外周血中Th1、Th2的比例也相应降低,与模型组比较均有统计学意义(P<0.05)。脾组织中转录因子表达的变化同样与外周血中Th1、Th2的变化一致。与模型组比较发现,HQGP治疗组T-bet与Th1的降低幅度均大于GATA-3与Th2的降低,也说明HQGP的治疗抑制了Th1的分化,同时其分泌的炎性反应细胞因子也减少。Th2没有Th1降低的幅度大,使机体处于抗炎相对优势,症状好转。本实验是在第57天取材,即药物治疗了16 d,治疗时间短,Th2还未完全占有优势,因此在与模型组比较时,仍然表现出降低。
本文表明,HQGP对于CIA小鼠的治疗作用可能是通过不同程度的降低脾组织中T-bet、GATA-3的表达实现的,这样初始Tn细胞分化为Th1、Th2均减少,但Th1、Th2降低的幅度明显不同,抗炎细胞因子相对占优势,但还未完全纠正Th1、Th2细胞平衡紊乱。是否继续延长HQGP的治疗时间,HQGP的免疫调节作用是否还与其他相关转录因子和通路具有相关性还有待深入研究。
[1]粟占国,张奉春,鲍春德,等.类风湿关节炎[M].北京;人民卫生出版社,2009:112-114.
[2]冯前进,薛慧清,杨向竹,等.一种黄芪糖蛋白及其制备方法和用途[P].中国专利:200910089580.5.
[3]杨向竹,薛慧清,冯前进,等.黄芪糖蛋白对T淋巴细胞增殖活性的影响[J].上海中医药大学学报,2009,23(5):66-68.
[4]杨向竹,薛慧清,冯前进,等.黄芪糖蛋白对小鼠淋巴细胞体外活化的抑制作用[J].山西中医,2009,25(8):45-46.
[5]赵俊云,刘亚明,冯前进,等.黄芪糖蛋白对佐剂性关节炎小鼠外周血细胞因子及关节滑膜组织形态学的影响[J].上海中医药杂志,2010,44(5):78-80.
[6]Welles WL,Battisto JR.Suppression of adjuvant arthritis by antibodies specific for collagen type II[J].Immunol Commun,1981,10(8):673-685.
[7]岳双林.五藤汤加减对类风湿性关节炎的治疗效果研究[J].内蒙古中医药,2016,35(3):3.
[8]郭丽萍,周璐,李树倩,等.熊去氧胆酸单药或联合免疫抑制剂治疗原发性胆汁性肝硬化-自身免疫性肝炎重叠综合征的疗效分析[J].中华消化杂志,2016,36(3):155-160.
[9]柴立民,董玢,娄利霞,等.益气活血解毒方对胶原诱导性关节炎大鼠T淋巴细胞增殖和分化的影响[J].中药药理与临床,2014,30(5):118-121.
[10]王霆钧,邱扬凌,蔡嘉莉,等.姜黄素衍生物FM0807对佐剂性类风湿性关节炎模型大鼠疗效观察[J].中国现代医生,2016,54(11):20-22.
[11]于明宇.蠲痹颗粒通过Th1/Th17细胞介导免疫抑制效应作用机制研究[D].昆明:云南中医学院,2015.
[12]姜辉,刘健,高家荣,等.新风胶囊上调佐剂性关节炎大鼠滑膜组织Bax和caspase-3表达并下调Bcl-2表达[J].细胞与分子免疫学杂志,2016,32(4):457-461.
[13]马艳苗.风湿宁胶囊对胶原诱导性关节炎大鼠的治疗作用及机制研究[D].武汉:湖北中医药大学,2013.
[14]封桂英,宋鸿儒,郭明,等.卡介苗含量对成功建立C57BL/6小鼠CIA模型的影响[J].中国免疫学杂志,2014,30(3):378-382.
[15]尹鑫鑫,黄荣.黄芪的免疫药理作用研究进展[J].黑龙江科技信息,2013,16(36):8.
[16]Sandoghchian SS,Zhang Y,Baidoo SE,et al.IL-4 can inhibit IL-17 production in collagen induced arthritis[J].Iran J Immunol,2011,8(4):209-217.
[17]Boissier MC.Cell and cytokine imbalances in rheumatoid synovitis[J].Joint Bone Spine,2011,78(3):230-234.
[18]刘喜德,刘风云,陈滢,等.温化蠲痹方对CIA大鼠外周血Th1/Th2细胞平衡的影响[J].中国中医药科技,2011,18(1):10-12.
[19]郭明,封桂英,郭亚春,等.Th1型细胞因子在胶原蛋白诱导性关节炎小鼠血清中的动态变化[J].细胞与分子免疫学杂志,2014,30(3):250-253.
[20]任舒婷,李玉生.Th1/Th2失衡对于类风湿性关节炎炎症损伤的临床意义[J].标记免疫分析与临床,2015,22(9):864-866.
(2016-07-07收稿 责任编辑:王明)
Effect of Astragalus Glycoproteins on T-bet and GATA-3 Expression in Mice Spleen with Collagen-induced Arthritis
Zhang Na1, Zhao Junyun1, Xue Huiqing2, Liu Hui1,Li Caicai1, Yang Xiangzhu1,Zhou Ran2
(1SchoolofBasicMedicalScience,BeijingUniversityofChineseMedicine,Beijing100029,China; 2ShanxiUniversityofTraditionalChineseMedicine,Taiyuan030024,China)
Objective:To explore the effects of Astragalus glycoproteins on collagen-induced arthritis mice′s specific transcription factors, T-bet and GATA-3, expression, and to clarify the immune mechanism of Astragalus glycoprotein on the treatment in collagen-induced arthritis mice. Methods:CIA model was induced by bovine Ⅱcollagen in mice. Mice were randomly divided into a CIA model group, a hydrocortisone positive control group, a Astragalus glycoprotein low dose group, a middle dose group and a high dose group. HE was used to observe the CIA mice spleen tissues damage. IFN-γ and IL-4 level were measured with flow cytometry in CIA mice. Western blot was used to analyze T-bet and GATA-3 protein expression. Results:Compared with the model group, Astragalus glycoprotein improved spleen tissue damage in CIA mice, and inhibited the infiltration of inflammatory cells. Astragalus glycoprotein reduced IFN-γand IL-4 level (P<0.05) and T-bet and GATA-3 protein expression (P<0.05). Conclusion:The mechanisms of action of Astragalus glycoprotein on CIA mice may be related to the decrease of T-bet and GATA-3 expression and function balance of the Th1 and Th2 cells.
Astragalus glycoprotein;CIA;GATA-3;T-bet
国际科技合作专项(编号:2013DFA30700)
张娜(1987.11—),女,硕士研究生,研究方向:免疫药理学方向,E-mail:zhangnaanna@126.com
杨向竹(1970.11—),女,博士,副教授,中医学院实验教学中心副主任,研究方向:中药的现代物质基础,E-mail:xiangzhuy@126.com
R285.5
A
10.3969/j.issn.1673-7202.2017.05.039

