健脾止泻宁颗粒的长期毒性研究
陈 犁 吕姗珊 谯志文 陈晓雪 杨 超 周年华
(重庆希尔安药业有限公司,重庆,401121)
中药研究
健脾止泻宁颗粒的长期毒性研究
陈 犁 吕姗珊 谯志文 陈晓雪 杨 超 周年华
(重庆希尔安药业有限公司,重庆,401121)
目的:考察健脾止泻宁颗粒(简称JPZX)对大鼠的长期毒性,为其临床安全使用提供实验依据。方法:实验设4组,JPZX高、中、低剂量组分别按187.1 g生药/(kg·d)、119.3 g生药/(kg·d)、51.07 g生药/(kg·d)组,相当于临床拟用量55倍、35倍、15倍,及空白对照组。连续给药92 d及停药14 d,分别检测各组大鼠的一般状况、体质量、血常规、血液生化指标,并对大鼠脏器进行系统观察和组织病理学检查。结果:各剂量组大鼠给药期及恢复期一般状况、血液学、血生化、脏器重量及系数、大体解剖观察与组织病理学检查均未见明显异常改变。结论:JPZX无明显的长期毒性,未发现毒性靶器官,在临床剂量55倍以下有较好的安全性,按临床拟用剂量服用是安全的。
健脾止泻宁颗粒;大鼠;长期毒性
健脾止泻宁颗粒(以下简称JPZX)处方组成为党参、莲子、白扁豆、黄连、黄芩、金银花、建曲、山楂、车前子(盐炙)和干姜,是重庆希尔安药业股份有限公司按照中药颗粒剂的制剂工艺生产而成,可清热除湿,健脾止泻,临床上用于小儿脾虚湿热所致的腹泻。取得了较好的疗效[1]。已有研究发现,JPZX具有止泻、调节腹泻所致的电解质紊乱、抗炎、抗病毒、镇痛、助消化、促吸收、调节肠道微生态和增强机体免疫功能的药理作用[2-6]。毒理学研究是保证临床用药安全的关键,其中长期毒性实验是主要的内容。本研究根据《中华人民共和国药品管理法》规定的长期毒性实验必须执行“药物非临床研究质量管理规范”,以《中药、天然药物长期毒性研究技术指导原则》(2005)为依据[7-9],通过对实验SD大鼠长期重复给予受试药物JPZX干浸膏粉,观察该药物可能引起毒性反应的性质、程度、量效关系及可逆性;推测毒性靶器官或靶组织,为重复给药毒性实验的设计提供参考;为其临床安全应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 SD大鼠,SFP级,120只,雌雄各半,体重50~60 g,4~5周龄,由四川省医学科学院实验动物研究所提供,实验动物生产许可证号:SCXK(川)2008-24。大鼠饲养在成都中医药大学药学院实验动物观察室,每笼5只。室内光照、湿度、温度标准。大鼠购回后饲养观察1周,观察各大鼠的一般外观、行为活动、进食饮水情况、大小便性状,并进行称重。给药前进行1次,符合实验要求的大鼠供实验用。
1.1.2 药品 JPZX干浸膏粉(重庆希尔安药业有限公司提供,批号:120701),每克干浸膏粉含12.16 g生药。
1.1.3 试剂与仪器 使用3%CMC-Na溶液分散本品,沉降性能得到较大改善,性质稳定。相应可通过大鼠灌胃针的最大配制浓度约为0.51 g/mL。血液生化、血液学指标检测的试剂(上海特康科技有限公司提供)。全自动生化分析仪(上海特康科技有限公司提供,型号:TC6010L);全自动三分群血液分析仪(上海特康科技有限公司,型号:TEK-Ⅱ MINI);电子分析天平(上海越平科学仪器有限公司,型号:FA1204L);电子称(福州华志科学仪器有限公司,型号:LED-5001,批号:11062);离心机(湖南湘仪实验仪器开发有限公司,型号:TD25-WS多管架自动平衡);切片机(徕卡2015,德国);TSJ-Q型全自动封闭式组织脱水机;BMJ-Ⅲ型包埋机;PHY-Ⅲ型病理组织漂烘仪(常州市中威医疗仪器有限公司);显微镜Motic BA400;图像分析软件Motic Images Advanced。
1.2 方法
1.2.1 动物分组 SD大鼠120只,随机分为4组,空白对照组、JPZX干浸膏粉高、中、低剂量组,每组30只,雌雄各半。
1.2.2 给药方法 JPZX高剂量组187.1 g生药/(kg·d)[相当于15.39 g干浸膏/(kg·d)]、中剂量组119.3 g生药/(kg·d)、低剂量组51.07 g生药/(kg·d),分别相当于临床拟用量55倍、35倍、15倍,剂量设计符合长期毒性实验[10]。各组大鼠均按15 mL/kg的体积2次经口灌胃给予相应浓度的供试品或等体积的溶媒(3%CMC-Na溶液)。给药当天定义为实验第1天。每天观察各组大鼠一般状况。每周停药1天,停药当天称量体重,每周测定摄食量;并根据新体重值调整相应给药量,连续92 d。给药92 d后,每组各随机处死大鼠20只(雌雄各10只),停药恢复14 d,各组处死大鼠10只(雌雄各5只)。各组大鼠麻醉后腹主动脉采血进行血液学及血生化检测,并施以安乐死后进行大体解剖观察及病理组织学检查。
1.2.3 检测指标与方法
1.2.3.1 一般观察 观察记录给药前7 d、给药92 d和停药恢复14 d期间,每日每只动物的一般外观和行为活动,粪便形状、颜色,尿色,外观体征、五官等。每周记录一次体重和饲料消耗情况以观察动物生长情况(饲料消耗量以称重当天每笼大鼠消耗的饲料量表示)。
1.2.3.2 血液生化学检测 给药第92天及停药恢复第14天时,取空腹大鼠腹主动脉血,分离血清,检测以下指标:谷丙转氨酶,谷草转氨酶,碱性磷酸酶,谷氨酰转移酶,总胆红素,直接胆红素,总蛋白,白蛋白,球蛋白,白球比,尿素氮,肌酐,尿酸,胆固醇,三酰甘油,肌酸激酶,乳酸脱氢酶,羟丁酸脱氢酶,高密度脂蛋白,低密度脂蛋白,胆碱酯酶,葡萄糖,K+(钾离子)、Cl-(氯离子)、Na+(钠离子)等25项血液生化指标。
1.2.3.3 血液学检测 给药第92天及停药恢复第14天时,取空腹大鼠腹主动脉血,用全自动三分群血液分析仪测定红细胞数,血红蛋白含量,红细胞比积,平均红细胞体积,平均血红蛋白含量,平均血红蛋白浓度,红细胞宽度变异系数,红细胞宽度标准差,血小板数,平均血小板体积,白细胞数,淋巴细胞绝对值,中间细胞绝对值,粒细胞绝对值,淋巴细胞百分比,中间细胞百分比,粒细胞百分比,血小板比积,血小板分布宽度,网织红细胞百分率及凝血酶原时间等21项血液学指标。
1.2.3.4 系统尸解 给药第92天及停药恢复第14天时,按“抓阄法”确定动物号数,分批处死检测。大鼠用戊巴比妥钠麻醉,腹主动脉取血后脱颈处死。按本实验室实验动物尸体解剖标准操作规程进行全面系统尸解。肉眼观察主要脏器大小及形状、色泽、质地,有无肉眼可见病变或异常,并取心、肝、脾、肺、肾、脑、胸腺、肾上腺、子宫、卵巢、睾丸、附睾等组织器官称重,计算脏器系数(脏器系数=脏器质量/体质量×100%)。
1.2.3.5 组织病理学检查标本 JPZX干浸膏粉大鼠长期毒性给药92 d及停药14 d药物高、中、低剂量组和空白组各30只动物(雌雄各半),分别取心、肝、脾、肺、肾、脑(大脑、小脑、脑干)、垂体、脊髓(颈段、胸段、腰段)、子宫、卵巢、乳腺、甲状腺、甲状旁腺、胸腺、胰腺、肾上腺、胃、十二指肠、回肠、结肠、膀胱、淋巴结、食管、气管、睾丸、附睾、前列腺、坐骨神经、唾液腺(下颌下腺)、胸骨、主动脉。10%甲醛固定。脱水、修剪、包埋、切片、HE染色、封片等,最后镜检并显微照像。以上标本均按四川省医学科学院·四川省人民医院实验动物研究所质量监控室病理组病理检验SOP程序进行。

2 结果
2.1 一般观察 给药92 d和停药14 d期间,空白组及JPZX高、中、低剂量组各动物容态、步态均正常,被毛光滑;眼睑无充血水肿,眼结膜无水肿出血点,瞳孔大而圆;外耳无异常分泌物;口腔黏膜红润,无溃疡及出血点;各大鼠生殖系统无异常分泌物,大、小便形状,气味均正常。其中JPZX高、中剂量组大便带药色,形状、气味均无异常。
2.2 对大鼠摄食量及体重的影响 给药前1周和给药92 d期间,大、中、低剂量组大鼠的饲料消耗量分别与空白组比较,差异无统计学意义(P>0.05)。大鼠体重结果见表1、2、3、4。表1显示给药92 d期间,低剂量组雌性大鼠4~12周体重有明显增长(P<0.05);中剂量组6~12周体重有明显增长(P<0.05),高剂量组有促进体重增长的趋势,但多数时间差异无统计学意义(P>0.05)。表2结果显示给药92 d期间,低剂量组雄性大鼠第3周后体重均有明显增长(P<0.05);由表3、4等表可见长期给药(3个月)停药14 d后,JPZX中剂量组雄性大鼠的体重有明显促进增长影响(P<0.05);其余时间点各组体重增长正常(P>0.05)。
2.3 对血液生化学指标的影响 结果见附表5、6、7、8。给药92 d期结束:表5显示,雌性大鼠与空白组比较,低剂量组白蛋白升高、钾降低,高剂量组葡萄糖降低、钠降低,以上差异有统计学意义(P<0.05)。表6显示,雄性大鼠与空白组比较,低剂量组白蛋白升高、总蛋白降低、钾降低,中剂量组三酰甘油降低、高密度脂蛋白降低、葡萄糖降低、钾降低,高剂量组葡萄糖降低,以上差异有统计学意义(P<0.05)。停药恢复14 d结束:表7显示,雌性大鼠与同期空白组比较,低剂量组总蛋白降低、球蛋白降低、高密度脂蛋白升高、低密度脂蛋白升高、葡萄糖升高,高剂量组总蛋白降低、球蛋白降低、白球比升高、钾降低,以上差异有统计学意义(P<0.05)。表8显示,雄性大鼠与同期空白组比较,低剂量组总蛋白降低、球蛋白降低、胆固醇降低、高密度脂蛋白升高、钾降低,中剂量组胆固醇降低、钾降低、氯降低,高剂量组总蛋白降低、白蛋白升高、球蛋白降低、白球比升高、胆固醇降低、高密度脂蛋白升高、葡萄糖降低、钾降低,以上差异有统计学意义(P<0.05)。
除以上指标外,给药结束及恢复期结束,JPZX各组大鼠天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、肌酸磷酸激酶(CK)、碱性磷酸酶(ALP)、尿素(Urea)、乳酸脱氢酶(LDH)、肌酐(Crea)、总胆固醇(CHOL)及电解质浓度等各项血生化指标均未见明显异常改变。
综上所述,上述总蛋白、球蛋白、钾、氯、葡萄糖指标变化幅度较小,且在正常参考值范围内;白蛋白、胆固醇、高密度脂蛋的改变具有一定防治作用。故认为其改变在给药期与恢复期均无明显毒理学意义。
2.4 对血液学的影响 结果见附表9、10、11、12。给药92 d期结束:表9结果表明,雌性大鼠与同期空白组比较,低剂量组平均血红蛋白含量升高,中剂量组平均血红蛋白含量升高、平均血红蛋白浓度升高、红细胞宽度标准差降低,高剂量组平均血红蛋白含量升高、平均血红蛋白浓度升高、红细胞宽度标准差降低,以上差异有统计学意义(P<0.05)。表10结果表明,雄性大鼠与空白组比较,高剂量组平均白细胞数降低、中间细胞绝对值降低,以上差异有统计学意义(P<0.05)。停药恢复14 d结束:表11结果表明,雌性大鼠与同期空白组比较,低剂量组血小板分布宽度升高,中剂量组平均血红蛋白浓度升高、血小板分布宽度升高,高剂量组平均血红蛋白浓度升高、血小板分布宽度升高,以上差异有统计学意义(P<0.05)。表12结果表明,雄性大鼠与同期空白组比较,低剂量组中间细胞百分比升高、粒细胞百分比降低,中剂量组中间细胞百分比升高、粒细胞百分比降低,高剂量组血小板数升高、淋巴细胞绝对值升高、中间细胞百分比升高、粒细胞百分比降低、血小板比积升高,以上差异有统计学意义(P<0.05)。
除以上指标外,给药结束及恢复期结束,JPZX各组大鼠红细胞计数(RBC)、红细胞容积(HCT)、网织红细胞百分比(RET%)、血小板计数(PLT)、凝血酶原时间(PT)等各项血液学指标均未见明显异常改变。
综上所述,上述白细胞、粒细胞、淋巴细胞绝对值、中间细胞百分比、血小板数指标变化幅度较小,且在正常参考值范围内;平均血红蛋白浓度、平均血红蛋白含量、红细胞宽度标准差的改变具有一定防治作用。故认为其改变在给药期与恢复期均无明显毒理学意义。
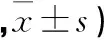
表1 雌性大鼠给药92 d体重变化(g,♀
注:与空白组比较,*P<0.05;**P<0.01。
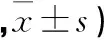
表2 雄性大鼠给药92 d体重变化(g,♂
注:与空白组比较,*P<0.05;**P<0.01。
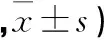
表3 雌性大鼠恢复期体重变化(g,♀
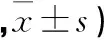
表4 雄性大鼠恢复期体重变化(g,♂
注:与空白组比较,*P<0.05;**P<0.01。
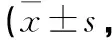
表5 雌性大鼠给药92 d血液生化学检测♀,n=10)
注:与空白组比较,*P<0.05。
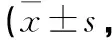
表6 雄性大鼠给药92天血液生化学检测♂,n=10)
注:与空白组比较,*P<0.05;**P<0.01。
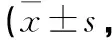
表7 雌性大鼠恢复期血液生化学检测♀,n=5)
注:与空白组比较,*P<0.05;**P<0.01。
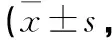
表8 雄性大鼠恢复期血液生化学检测♂,n=5)
注:与空白组比较,*P<0.05;**P<0.01。
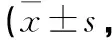
表9 雌性大鼠给药92 d血液学指标检测♀,n=10)
注:与空白组比较,*P<0.05;**P<0.01。
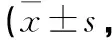
表10 雄性大鼠给药92 d血液学指标检测♂,n=10)
注:与空白组比较,*P<0.05。
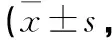
表11 雌性大鼠恢复期血液学指标检测♀,n=10)
注:与空白组比较,*P<0.05;**P<0.01。
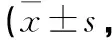
表12 雄性大鼠恢复期血液学指标检测♂,n=10)
注:与空白组比较,*P<0.05;**P<0.01。
2.5 系统尸解、脏器重量和脏器系数 连续灌胃给药92 d和停药恢复14 d后,对各组大鼠实施麻醉腹主动脉取血脱颈处死,进行详细的解剖观察。肉眼观察心脏、肝脏、脾脏、肺、肾脏、生殖脏器、胃肠道等各脏器,其大小、形态、颜色或质地均未见与供试品相关的异常改变。给药结束及恢复期结束,与同期对照组比较,JPZX各组大鼠心脏、肝脏、脾脏、胸腺、肺、肾脏、卵巢、子宫、睾丸、附睾等脏器的绝对重量、脏体系数未见明显改变,差异均无统计学意义(P>0.05)。
2.6 组织病理学检查结果 肺脏:间质性肺炎(给药92 d对照组雌性1只、对照组雄性1只、低剂量组雌性1只)。肺脓肿:(给药92 d对照组雄性3只、中剂量组雌性2只、高剂量组雄性1只,停药14 d低剂量组雄性1只、中剂量组雌性1只、中剂量组雄性1只);心脏:心肌炎(低剂量组雄性1只);胸腺:胸腺萎缩,胸腺免疫细胞减少(低剂量组雄性1只)。各组随机发生的间质性肺炎、肺脓肿、心肌炎均属于实验动物自发性病变,为非特异性病变,病变散在于对照组及各药物组,无统计学意义;胸腺萎缩,胸腺免疫细胞减少,本实验只发生1例,是否为药物一起还有待进一步研究。JPZX 92 d长期毒性实验高、中、低剂量组对大鼠连续给药92 d及停药恢复14 d,所检脏器未见由药物引起的明显组织形态、结构异常。
3 讨论
JPZX是儿科用药。儿童患者正处于生长发育过程,各脏器功能以及酶系统、免疫中枢系统发育不完善,药效学和药物代谢动力学有其自身规律[11]。美国FDA[12]和欧洲药品评价局(EMEA)[13]均已发布有关儿科药物非临床安全评价的指导原则,其中明确提出有些药物对儿童特殊发育时期的影响难以在临床试验中发现,因此有必要开展幼龄动物的非临床安全评价。本实验通过对幼龄大鼠长期重复给予受试药物JPZX干浸膏粉,描述大鼠重复接受受试药物后的毒性特征,1)预测受试物可能引起的临床不良反应,包括不良反应的性质、程度、剂量—反应和时间—反应的关系,可逆性等;2)推测受试物重复给药的临床毒性靶器官或靶组织;3)预测临床实验的起始剂量和重复用药的安全剂量范围;4)提示临床实验中应重点检测的指标;5)为临床实验中的解毒或解救措施提供参考信息。
本实验模拟3~4岁儿童,4~5周龄SD大鼠连续92 d经口灌胃给予187.1 g生药/(kg·d)[相当于15.39 g干浸膏/(kg·d)]、119.3 g生药/(kg·d)、51.07 g生药/(kg·d)的JPZX,分别相当于临床拟用量55倍、35倍、15倍,各组大鼠一般状况、血液学、血生化、脏器重量及系数、大体解剖观察与组织病理学检查均未见明显异常改变。实验大鼠停药14 d,进行恢复期观察及检测,结果未见延迟性不良反应。血液生化和血液学测定有少部分指标与正常对照组比较,显示有统计学意义,但是从专业角度分析,认为没有毒理学意义[14]。各组少数样本随机发生的间质性肺炎、肺脓肿、心肌炎均属于实验动物自发性病变,为非特异性病变,病变散在于对照组及各药物组,考虑为自发性病变;胸腺萎缩,胸腺免疫细胞减少,本实验只发生1例,是否为药物一起还有待进一步研究。
综上所述,本实验条件下,大鼠连续92 d经口灌胃给予JPZX的无毒性反应剂量(NOAEL)为187.1 g生药/(kg·d)(临床拟用量的55倍),提示JPZX用于临床是安全的。
[1]高银辉,张磊.健脾止泻宁颗粒治疗小儿迁延性腹泻病(脾虚湿热证)60例[J].中国药业,2016,25(4):127-128.
[2]邹福琛.健脾止泻宁颗粒合云南白药治疗溃疡性结肠炎36例[J].中国中医急症,2012,21(8):1324-1325.
[3]朱艳萍,孙兴荣,滕永华,等.健脾止泻宁颗粒治疗轮状病毒肠炎39例[J].医药前沿,2014,4(24):337-338.
[4]陈欢,谯志文,杨发龙,等.健脾止泻宁颗粒对肠道微生态的影响[A].中华中医药学会中药实验药理分会2014年学术年会论文摘要汇编[C].太原:2013.
[5]任香怡,吕姗姗,张荫杰,等.健脾止泻宁颗粒对免疫功能的影响[A].中华中医药学会中药实验药理分会2014年学术年会论文摘要汇编[C].太原:2013.
[6]周年华,吕姗珊,谯志文,等.健脾止泻宁颗粒止泻作用的实验研究[J].世界中西医结合杂志,2016,11(2):190-195.
[7]王治乔,袁伯俊.新药临床前安全性评价与实践[M].北京:军事医学科学出版社,1997:89-102.
[8]国家食品药品监督管理局新药审评中心.中药、天然药物长期毒性研究技术指导原则[S].北京:2005.
[9]国家食品药品监督管理局.局令第2号《药物非临床研究质量管理规范》[Z].北京:2003.09.01.
[10]袁伯俊,顾长虹.新药长期毒性实验的剂量设计[J].国外医学药学分册,1997,24(2):97-101.
[11]林小芳,湖里娅,缪小红.浅谈儿科安全用药管理[J].中医药管理杂志,2014,22(10):1701.
[12]US FDA,Center for Drug Evaluation and Research.Guidance for industry,nonclinical afety evaluation of pediatic drug products.Rockville,MD:US Department of Health and SHuman Services[Z].February 2006.
[13]European Medicines Evaluation Agency (EMEA),Committee for Human Medicinal Products (CHMP).Guideline on the need for nonclinical testing in juvenile animals on human pharmaceuticals for pediatric indications[Z].January 2008.
[14]张兰,杨凯,刘娇.软坚消瘿颗粒长期毒性实验对大鼠血液学及血液生化学的研究[J].世界中西医结合杂志,2016,11(3):410-415.
(2016-06-14收稿 责任编辑:王明)
Study on the Long-term Toxicity of Jianpizhixiening Granule
Chen Li, Lyu Shanshan, Qiao Zhiwen, Chen Xiaoxue, Yang Chao, Zhou Nianhua
(ChongqingHealnPharmaceuticalCo.,Ltd,Chongqing401121,China)
Objective: To observe the long-term toxiciy t of Jianpizhixiening granule (JPZX) on rats to provide a scientific experimental basis for clinical treatment. Methods: The rats were randomly divided into four groups: a high, medium and low dose group of JPZX with 187.1, 119.3, 51.07 g crude drug · kg-1· day-1 respectively, equal to 55, 35 and 15 times of clinic dose, and a control group. Parameters were examined, including general condition, body weight, the indexes of hematology, blood biochemistry and the related organ histopathology after successive administration of 92 days and 14 days′ recovery. Results: In each group, there was no significant changes in the outer appearance and behavior, the indexes of hematology, blood biochemistry, organ weight and coefficient, gross anatomical observation and histopathological examination. Conclusion: In the 55 times of clinical dose, JPZX has no significant long-term toxicity, no toxicity target organ and is relatively safe under clinical proposed dose.
Jianpizhixiening granule; Long-term toxicity; Rats
重庆市科学技术委员会科技计划项目(编号:cstc2011ggC10003-37)——健脾止泻宁颗粒药理药效再评价研究
陈犁(1963.07—),男,大学本科,正高级工程师,重庆希尔安药业有限公司总经理,研究方向:药物研究,Tel:(023)67893740,E-mail:1401228930@qq.com
周年华(1979.06—),男,大学本科,高级工程师,重庆研发副总经理,研究方向:中成药新药研发,Tel:(023)67893754,E-mail:244279691@qq.com
R285.5
A
10.3969/j.issn.1673-7202.2017.05.049

