金属基氧电极材料催化机理研究进展
张旭+张慧娟


摘要:
燃料电池作为一种高效、无污染的能源转换器件,受到广泛关注.其阴极氧还原反应是决定电池性能最重要、最关键的因素之一,也是制约其商业化的关键瓶颈因素之一.因此,研究和开发高效氧还原催化剂及其催化机理,对于燃料电池的发展和商业化进程具有十分重要的意义.在简要介绍燃料电池的基础上,综述了近年来金属基氧还原电极材料催化氧还原反应的机理,金属基氧还原电极材料包括Pt催化剂、Pt-M催化剂、杂原子掺杂碳载金属类催化剂等,总结了提高催化活性和稳定性、降低催化剂制备成本和催化剂制备工艺等方面所取得的研究结果,并指出了各类催化剂目前尚待解决的问题和发展方向.
关键词:
燃料电池; 氧还原反应; 催化机理; 催化剂; 过渡金属
中图分类号: TM 911.4-文献标志码: A
Catalysts Machanism for Oxygen Electrode
Based on Transition Metal
ZHANG Xu, ZHANG Huijuan
(School of Materials Science and Engineering, University of Shanghai
for Science and Technology, Shanghai 200093, China)
Abstract:
Fuel cell(FC) as a highly efficient,non-pollution energy conversion device,has attracted much attention.The cathode oxygen reduction reaction(ORR) is one of the most important and critical factors for performance of the battery,and restrict the commercialization.Therefore,it is important to develop a high efficiency electrocatalyst for the ORR and the mechanism of oxygen reduction for the development and commercialization of FC.In this paper,research progresses of the ORR mechanism on metal-based electrocatalysts,have been systematically reviewed on the base of a brief introduction of the FC.The materials include the ptelectrocatalyst,Pt-M electrocatalyst and heteroatom-doped carbon supported metal electrocatalysts.The effort to improve the catalytic activity and durability of the electrocatalysts have been summarized.Reseach on decrease the cost of electrocatalysts and novel non-precious metal electrocatalysts are also reported.The urgent problems and future research focuses on these non-precious metal oxygen reduction electrocatalysts have pointed out.
Keywords:
fuel cells; oxygen reduction reaction;catalytic mechanism; catalyst; transition metal
燃料电池是一种高效、无污染的电化学能源转换器件,不经过燃烧直接将燃料和氧化剂的化学能通过电化学反应方式转换成电能,具有燃料多样化、环境友好、噪声低、可靠性高和维修方便等优点[1].在燃料电池工作系统中,氧气沿电极表面扩散进入电极内部,在催化剂的作用下发生还原反应.其阴极氧还原反应是决定电池性能最重要、最关键的因素之一,而氧电极催化剂与缓慢的氧还原动力学,也是制约低温燃料电池发展的关键因素之一.因此,掌握氧还原反应在各类催化剂上的氧还原催化机理,对于提高氧电极活性,降低氧还原反应的电化学极化,以及寻求性价比更高的氧还原反应催化剂都具有重要意义[2].本文主要介绍氧还原反应在Pt催化剂、Pt-M催化剂、碳载金屬/金属氧化物类催化剂、杂原子掺杂碳载金属/金属氧化物类催化剂和M-N-C类催化剂上的催化机理研究进展.
1 氧还原反应
氧还原反应(Oxygen Reduction Reaction,ORR)是一个复杂的多相催化过程,在反应过程中往往会出现中间物种.氧分子外层电子是影响其电化学还原行为的主要因素,其分子轨道为:(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2py)2(π2pz)2(π*2py)1(π*2pz)[1].根据Hunds规则,基态O2的外层2个未成对电子位于二重兼并的π*反键轨道上,为三线态.氧分子键能ΔH=-498.7 kJ/mol,O O键的断裂是O2还原的关键,而超氧离子O2-的键能仅为-350 kJ/mol,因此,一般认为O2-的形成是O2还原的决速步(O2 + e-→[O-2]ad)[1].
关于其反应历程,若不涉及其具体细节,各种电极上ORR可以分为两大类,如图1所示:
(1) 2e反应历程:酸性介质中氧分子先得到两个电子,还原为中间产物H2O2,然后进一步还原成H2O; 碱性条件下氧分子先得到两个电子生成中间产物HO-2,然后进一步得到还原成OH-.2e反应机理特征是氧分子吸附时O O键不断裂,直接生成过氧化氢(酸性介质)和HO-2(碱性介质).
(2) 4e反应历程:氧分子连续得到4个电子而直接还原成H2O(酸性介质)和HO-2(碱性介质),这一机理的特征是氧分子首先被解离吸附.
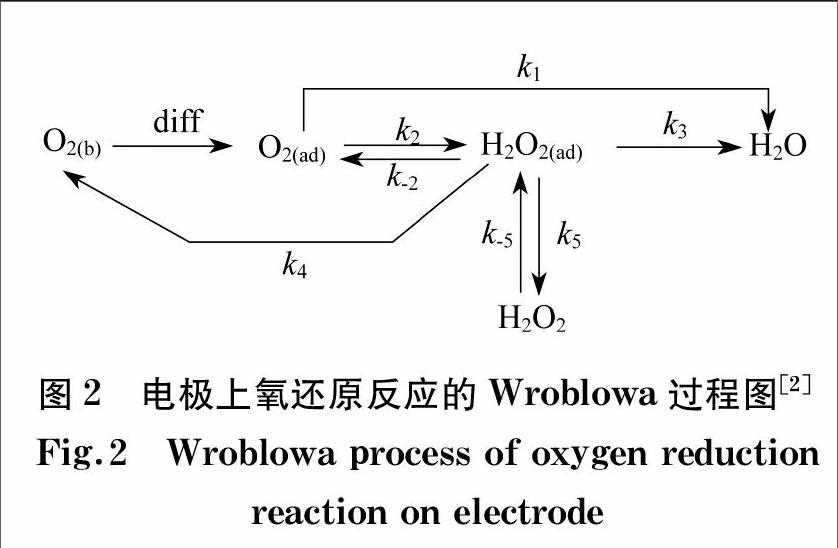
1976年,WROBLOWA等[2]提出了如图2所示的机理来解释复杂的ORR步骤:(1) 溶液本体中氧气向催化剂表面扩散并吸附在催化剂表面上,使氧分子处于活化吸附态;(2) 处于活化吸附态的氧分子在固 液 气三相界面进行反应,变成吸附态产物;(3) 吸附态产物在催化剂表面脱附(O2(b)∶溶液中的溶解氧,O2(ad)∶电极上的吸附氧,diff为扩散,k为反应速率常数).
ORR反应机理在很大程度上取决于催化剂表面和氧分子的吸附模式,如图3所示.YEAGER[3]认为,氧分子在电极上的吸附大致有3种方式:(a) Griffths(侧基式)模式;(b) Pauling(端基式)模式;(c) Bridge(双址式)模式.
(a) Griffths(侧基式)模式
氧分子中的O O键与电极表面平行,2个氧原子同时与1个过渡金属原子M作用(即氧分子中的π轨道与过渡金属原子空的dz2轨道相互作用,而过渡金属原子中部分充满的dxy或dyz轨道向氧分子π*轨道反馈),这种较强的相互作用可以使O O键减弱或伸缩以至断裂,甚至引起O2的解离吸附,有利于氧的4e反应,在Pt/C催化剂表面可能发生这种模式的吸附.
(b) Pauling模式
氧分子中仅有1个氧原子与电极表面的过渡金属原子M作用(即氧分子中的1个原子通过π*轨道与过渡金属原子的dz2轨道相互作用),发生解离吸附,按这种方式吸附氧分子中只有1个原子受到较强活化,有利于2e反应,大多数电极材料上氧的还原可能按该模式进行.
(c) Bridge模式
氧分子的2个氧原子分别被电极表面的2个过渡金属原子吸附而促使氧分子的2个氧原子同时被活化,该模式有利于4e反应.显然,这种模式只能在电极表面的过渡金属原子的性质和空间位置均适合时才发生.
2 氧电极材料催化机理研究现状
2.1 金属基催化剂
2.1.1 Pt催化剂
迄今为止,所有纯金属ORR催化剂中,铂是使用最广泛的电极催化剂[4].Pt催化剂的氧还原性能取决于它的结晶、形态、形状和大小[5].MARKOVIC等[6]发现,在硫酸介质中,不同晶面上硫酸盐吸附速率不相同,Pt(100)的ORR活性明显高于Pt(111)的活性.因此,对于提高催化剂的ORR性能来说,关键是控制Pt纳米粒子的形状和形态[7-8].在此基础上,WANG等[9]合成出单分散的Pt纳米管,它呈现出超过商业Pt催化剂2倍的活性.另外,尺寸为7 nm的Pt纳米管产生的电流密度是尺寸为3 nm或5 nm Pt纳米粒子的电流密度的4倍,这表明主导Pt催化剂ORR性能的是Pt纳米粒子的形状.
2.1.2 Pt-M催化剂
过去几十年,研究人员开发出了铂合金催化剂,它具有更优异的催化活性和稳定性,并且减小了Pt的用量.研究证明,Pt可以与贵金属(例如金,钯,钌,银和铑)或过渡金属(例如铜,铁,钴和镍)形成合金催化剂[10-13].例如,ZHANG等[14]报道了Pt纳米粒子表面喷金会加强ORR的稳定性,与此同时,
LIM等[15]开发Pd-Pt双金属合金也具有很高的氧 还原活性.另一方面,STAMENKOVIC等[16]证明了Pt3Ni(111)表面的ORR活性更好,是对应的Pt(111)的10倍,更是当前最先进PEMFC的Pt/C催化剂的90倍.这是因为Pt3Ni(111)表面具有特殊的电子结构(d能带中心位置)和特殊的原子排列方式[17].STAMENKOVIC等[18]也研究了Pt3Ni和Pt3Co合 金的表面氧还原的动力学,发现电催化活性强弱也取决于电解质中阴离子的性质.在H2SO4电解质中,ORR活性呈现Pt3Ni>Pt3Co>Pt的顺序.然而,在HClO4电解质中的顺序是Pt3Co>Pt3Ni>Pt.纯Pt的催化活性在0.5 md/L H2SO4中比在0.1 md/LHClO4中增强3~4倍[19].研究[20]揭示了一个电化学催化剂的基本类型Pt3M(M=Ni,Co,Fe,Ti,V),通过试验确定表面电子结构和氧还原活性之间的关系.同时,Pt-Cu合金被证明比纯Pt催化剂有更好的催化性能并具有良好的稳定性.
CHEN等[21]报道了Pt-Ni合金纳米颗粒(结晶PtNi3多面体)与氧反应可以溶解Ni粒子内部的Pt3Ni纳米结构,从而产生一个规则的十二面体中空结构,并且保留边缘富Pt的PtNi3多面体结构(图4).由于这种结构模型的外部催化表面由Pt粒子覆盖,让更多的O2与Pt原子接触,Pt3N结构模型的催化剂被证明在质量活性和比活性都有较大的提高,并且具有优良的稳定性.
2.2 碳載金属类催化剂
2.2.1 碳载金属/金属氧化物类催化剂
目前发现的碳纳米材料,包括碳纳米管,石墨烯和石墨,由于具有非常大的比表面积和良好的电化学以及力学性能,逐渐成为ORR金属基催化剂最理想的载体材料.使用碳材料可显著增加催化剂的稳定性和金属催化剂(例如Pt)的氧还原活性.KONGKANAND等[22]报道了以SWCNT为支撑的Pt纳米颗粒在36 h内反复循环条件下,提高了催化剂活性及稳定性.与此同时,将Pt沉积在MWCNTs上也表现出高的ORR性能[23-24].同样,BAGLIO等[25]研究证明由CNTs支持的铂合金催化剂也表现出高的催化活性.此外,WANG等[26]证明了由CNTs支撑的铂合金催化剂比纯铂催化剂表现出更高的抗甲醇中毒的能力.另外,ZHANG等[27]报道了CO2支持CNTs(MgO2/CNTs)作为改进微生物燃料电池的氧还原阴极催化剂,也表现出非常优异的成果.
将碳纳米管和石墨烯用于金属催化剂的载体,发现具有较高的ORR电性能.GUO等[28-29]组装的Co/CoO和FePt的纳米粒子在用石墨烯作为催化剂载体的条件下,氧还原性能有显著的提高.此外,CHOI等[30]报道了石墨烯纳米片作为支撑材料的Fe基催化剂,在PEM燃料电池还原反应中,通过加速耐久性试验观察到更好的氧还原稳定性.
2.2.2 杂原子掺杂碳载金属/金属氧化物类催化剂
研究证明,电子反应过程中在碳纳米材料里掺杂原子(例如氮)能为催化和其他进程提供理想的电子结构.杂原子掺杂碳纳米材料可能成为金属催化剂的理想载体.LIANG等[31]合成了在N掺杂的碳纳米管载体下的CO2O3催化剂,它呈现4e氧还原途径,具有更高的ORR电流密度,比Co3O4/GN混合催化剂和商用Pt/C催化剂有更好的过电位.WU等[32]报道了N掺杂石墨烯产生的气凝胶作为载体的Fe3O4纳米粒子催化剂,也发现具有更高的ORR电流密度、低环电流、低过H2O2产量、高电子转移数以及耐久性好等优点.
LIANG等[33]报道Co3O4纳米晶体在rGO上长大的产物(Co3O4/rGO)和在N掺杂rGO上长大的产物(Co3O4/N-rGO),可以用作提高ORR高性能的双功能催化剂,如图5(a)所示.与Co3O4/rGO比较,Co3O4/N-rGO混合材料的起始电位更佳.从Koutecky-Levich公式得到图5(b),Co3O4/rGO电子转移数确定为3.9,而CO3O4/N-rGO(图5c)为4.0.在0.1 mol/L KOH水溶液中,Co3O4/N-rGO的Tafel斜率为42 mV/dec,比Co3O4/rGO(54 mV/dec)更小如图5(d)所示,也证明了Co3O4/N-rGO具有更加优异的ORR性能.此外,Co3O4/N-rGO混合的方式,也成为其他碱性氧还原催化剂重要催化反应的解决方案.
到目前为止,尽管石墨烯已被用于改善催化剂各项性能,但大部分情况下效率较低.因此,研究催化剂反应机理,从而开发新型的ORR电催化剂还需要更加努力的研究,燃料电池的商业化路程还有很长的路要走.
2.2.3 M-N-C类催化剂
自从JASINSKI[39]在1964年观察到酞菁催化的ORR,许多非贵金属催化剂(NPMCs),包括金属氧化物、金属碳化物和氮化物等也都已得到发展[40].例如,在550 ℃和1 000 ℃时,热解C负载的N4-大环化合物,使大环结构之间的复合结构被破坏,产生一种NPMCs,M-Nx-C催化剂,其中M是一个3 d过渡金属(例如Fe,Co,Ni)和x=1~4.除了热解C负载的富N金属化合物,M-Nx-C催化剂也可通过热解金属盐,含N和C的前驱体混合物来实现[41].GUO等[42-44]研究表明,在800~1 000 ℃热处理过渡金属,N和C前驱体混合物也能产生M-N-C催化剂(M=Fe/Co)(图6).值得关注的是,WU等[45]通过热解钴基铁合成聚苯胺(PANI),并制备一个新型的非贵金属催化剂(NPMCs).试验结果发现,PANI-Fe-C在酸性介质中时,在电位上优于Pt/C催化剂约60 mV,并且明显改善ORR性能、耐久性和稳定性.同时,在0.4 V的恒定电压下,在氢气燃料电池中观察近700 h,LEFVRE等[46-47]进一步证明了M-N-C催化剂合成过程中形成原位C纳米结构,其中包括C管,洋葱状C和片状晶体(多层石墨烯)(图6).
研究发现,通过N-C前体石墨化从而形成高石墨化碳的过程中,发现对于过渡金属催化是不可缺少的.当C2H8N2和Co被用于高温合成时,C纳米管和洋葱状C会出现,当氰胺和Fe作为前驱体时,竹管型C会出现.N将嵌入到原位形成的石墨化碳纳米结构中,并对催化活性提高至关重要,但对于M-N-C催化剂活性部位的具体机制的形成及其与C键交互结构仍然未知.
催化活性位的确认一直是过渡金属大环化合物催化剂研究中倍受关注的课题.关于高温热解条件下的催化活性位存在很多争议[1,49-50]:(1) 高温热解后的催化活性位仍然是FeN4结构(图7);(2) 高温热处理后残留的N与吸附在C表面上的過渡金属离子相互作用所形成的C-Nx-M物种,但文献[49]认为Fe离子与C-Nx基团相结合对ORR的催化活性无影响;(3) N原子和过渡金属原子共同构成了催化活性位,而单纯由含N或过渡金属前驱体制备的物质无催化活性;(4) 热处理后形成的具有化学表面基团的高活泼C,并认为金属的存在只是催化了这种高活泼C的形成,金属可能是起到在高温裂解含N和C前驱体时催化形成活性位的物质,更多的石墨边缘位和吡啶氮有利于提高催化活性,Fe颗粒的形成可能有利于边缘位碳纳米结构的生长(图8);(5) 在高温热解下形成的石墨包覆金属颗粒具有催化活性,石墨层可保护金属颗粒免于外界环境的腐蚀.
3 结 语
阴极氧还原反应是决定电池性能的关键因素之一,而氧电极阴极氧还原催化剂是氧电极的关键因素,因而制备性能优良,工作稳定的催化剂仍是研究者追求的目标,对于氧电极催化机理的研究也需要更加努力.综上所述,近年来经过国内外研究者的共同努力,燃料电池基于3d过渡金属的氧电极催化剂的种类越来越多,对氧的还原都有比较明显的催化活性,但是并没有达到商业化生产所要求的目标,真正投入实际使用的仍然很少.因此,寻找廉价、高效的催化剂仍然是氧电极进一步发展的关键.一旦发现更加高效廉价的催化剂,必将大大推动燃料电池的发展,最终实现产业化的目标.
参考文献:
[1] 张慧娟.新型非贵金属螯合物氧还原催化剂制备及其电化学性能研究[D].上海:上海交通大学,2010.
[2] WROBLOWA H S,PAN Y C,RAZUMNEY G.Electroreduction of oxygen:a new mechanistic criterion[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1976,69(2):195-201.
[3] YEAGER E.Electrocatalysts for O2 reduction [J].Electrochimica Acta,1984,29(11):1527-1537.
[4] NORSKOV J K,ROSSMEISL J,LOGADOTTIR A,et al.Origin of the overpotential for oxygen reduction at a fuel-cell cathode [J].The Journal of physical chemistry.B,2004,108(46):17886-17892.
[5] PENG Z M,YANG H.Designer platinum nanoparticles:control of shape,composition in alloy,nanostructure and electrocatalytic property[J].Nano Today,2009,4(2):143-164.
[6] MARKOVIC N M,GASTEIGER H A,ROSS P N.Oxygen reduction on platinum low-index single-crystal surfaces in sulfuric acid solution:rotating ring-Pt(hkl) disk studies[J].The Journal Physical Chemisyry,1995,99(11):3411-3415.
[7] CHEN J Y,LIM B,LEE E P,et al.Facile syntheses and enhanced electrocatalytic activities of Pt nanocrystals with {hkk} high-index surfaces[J].Nano Today,2009(4):181-189.
[8] WANG C,DAIMON H,ONODERA T,et al.A general approach to the size-and shape-controlled synthesis of platinum nanoparticles and their catalytic reduction of oxygen [J].Angewandte Chemie(International ed.in English),2008,47(19):3588-3591.
[9] WANG C,DAIMON H,LEE Y,et al.Synthesis of monodisperse Pt nanocubes and their enhanced catalysis for oxygen reduction [J].Journal of the American Chemical Society,2007,129(22):6974-6975.
[10] VLIET D VAN DER,WANG C,DEBE M,et al.Platinum-alloy nanostructured thin film catalysts for the oxygen reduction reaction [J].Electrochimica Acta,2011,56(24):8695-8699.
[11] BING Y H,LIU H S,ZHANG L,et al.Nanostructured Pt-alloy electrocatalysts for PEM fuel cell oxygen reduction reaction [J].Chemical Society Reviews,2010,39(6):2184-2202.
[12] MOROZAN A,JOUSSELME B,PALACIN S.Low-platinum and platinum-free catalysts for the oxygen reduction reaction at fuel cell cathodes [J].Energy & Environmental Science,2011(4):1238-1254.
[13] WANG C,MARKOVIC N M,STAMENKOVIC V R.Advanced platinum alloy electrocatalysts for the oxygen reduction reaction [J].ACS Catalysis,2012,2(5):891-898.
[14] ZHANG J,SASAKI K,SUTTER E,et al.Stabilization of platinum oxygen-reduction electrocatalysts using gold clusters [J].Science,2007,315(5809):220-222.
[15] LIM B,JIANG M J,CAMARGO P H C,et al.Pd-Pt bimetallic nanodendrites with high activity for oxygen reduction [J].Science,2009,324(5932):1302-1305.
[16] STAMENKOVIC V R,FOWLER B,MUN B S,et al.Improved oxygen reduction activity on Pt3Ni(111) via increased surface site availability[J].Science,2007,315(5811):493-497.
[17] STAMENKOVIC V,SCHMIDT T J,ROSS P N,et al.Surface composition effects in electrocatalysis:inetics of oxygen reduction on well-defined Pt3Ni and Pt3Co alloy surfaces [J].The Journal of Physical Chemistry B,2002,106(46):11970-11979.
[18] STAMENKOVIC V R,MUN B S,ARENZ M,et al.Trends in electrocatalysis on extended and nanoscale Pt-bimetallic alloy surfaces [J].Nature Materials,2007,6(3):241-247.
[19] MANI P,SRIVASTAVA R,STRASSER P.Dealloyed Pt-Cu core-shell nanoparticle electrocatalysts for use in PEM fuel cell cathodes [J].The Journal of Physical Chemistry C,2008,112(7):2770-2778.
[20] GUPTA G,SLANAC D A,KUMAR P,et al.Highly Stable and Active Pt-Cu Oxygen Reduction Electrocatalysts Based on Mesoporous Graphitic Carbon Supports [J].Chemistry of Materials,2009,21(19):4515-4526.
[21] CHEN C,KANG Y J,HUO Z Y,et al.Highly crystalline multimetallic nanoframes with three-dimensional electrocatalytic surfaces[J].Science,2014,343(6177):1339-1343.
[22] KONGKANAND A,KUWABATA S,GIRISHKUMAR G,et al.Single-wall carbon nanotubes supported platinum nanoparticles with improved electrocatalytic activity for oxygen reduction reaction [J].Langmuir,2006,22(5):2392-2396.
[23] LI X G,GE S H,HUI C L,et al.Well-dispersed multiwalled carbon nanotubes supported platinum nanocatalysts for oxygen reduction[J].Electrochemical and Solid-State Letters,2004,7(9):A286-A289.
[24] SHAIJUMON M M,RAMAPRABHU S,RAJALAKSHMI N,et al.Platinum/multiwalled carbon nanotubes-platinum/carbon composites as electrocatalysts for oxygen reduction reaction in proton exchange membrane fuel cell[J].Applied Physics Letters,2006,88(25):253105.
[25] BAGLIO V,DI BLASI A,DURSO C,et al.Development of Pt and Pt-Fe catalysts supported on multiwalled carbon nanotubes for oxygen reduction in direct methanol fuel cells[J].Journal of the Electrochemical Society,2008,155(8):B829-B833.
[26] WANG J J,YIN G P,LIU H,et al.Carbon nanotubes supported Pt-Au catalysts for methanol-tolerant oxygen reduction reaction:A comparison between Pt/Au and PtAu nanoparticles[J].Journal of Power Sources,2009,194(2):668-673.
[27] ZHANG Y P,HU Y Y,LI S Z,et al.Manganese dioxide-coated carbon nanotubes as an improved cathodic catalyst for oxygen reduction in a microbial fuel cell[J].Journal of Power Sources,2011,196(22):9284-9289.
[28] GUO S,ZHANG S,WU L,et al.Co/CoO nanoparticles assembled on graphene for electrochemical reduction of oxygen[J].Angewandte Chemie(International ed.in English),2012,51(47):11770-11773.

