二穗短柄草钙依赖型蛋白激酶基因BdCDPK14克隆及表达分析
韦淑亚 赵旭东 杨广笑 何光源


摘要:【目的】克隆分析二穗短柄草钙依赖型蛋白激酶(CDPK)基因BdCDPK14,并检测其在干旱胁迫下的表达量,为揭示钙依赖型蛋白激酶的抗旱调控机制打下基础。【方法】根据NCBI检索结果设计特异引物,以二穗短柄草cDNA为模板,采用PCR扩增二穗短柄草CDPK基因家族成员BdCDPK14,利用在线分析软件对BdCDPK14基因编码蛋白进行生物信息学分析,并采用RT-PCR检测PEG-6000干旱胁迫下的BdCDPK14基因表达量。【结果】从二穗短柄草叶片中克隆获得的BdCDPK14基因(GenBank登录号XM_003564390)片段长度1750 bp,其开放阅读框(ORF)1545 bp,编码514个氨基酸,其编码蛋白分子量56.78 kD,理论等电点5.45,脂肪指数78.21,不稳定指数38.66,属于稳定蛋白。BdCDPK14蛋白与小麦TaCPK13蛋白(ABY59018)的亲缘关系最近,含有4个EF-hands结构、蛋白酪氨酸激酶结构域、脂多糖激酶家族、ATP结合区域、丝氨酸/苏氨酸蛋白激酶激活区和预测跨膜区等结构域,主要由无规卷曲和α-螺旋构成,位于叶绿体和细胞质膜上。在PEG-6000干旱胁迫下,BdCDPK14基因在胁迫3 h内的相对表达量无明显变化,胁迫6 h后相对表达量开始升高,至胁迫12 h时的相对表达量最高。【结论】克隆获得的BdCDPK14基因为二穗短柄草CDPK基因家族成员之一,参与其抗干旱胁迫反应,可作为候选基因用于二穗短柄草抗旱机制研究。
关键词: 二穗短柄草;BdCDPK14基因;克隆;生物信息学分析;干旱胁迫;表达
中图分类号: Q949.714.2 文献标志码:A 文章编号:2095-1191(2017)05-0761-07
0 引言
【研究意义】二穗短柄草(Brachypodium distachyon)是一種温带禾本科植物,是用于研究小麦、水稻作物新型模式植物的理想植株,具有重要的经济价值。钙依赖型蛋白激酶(CDPK)为单肽链,在结构上具有明显的特征,从N端到C端存在4个功能区(可变区、催化区、连接区和调控区),是钙离子(Ca2+)信号通路中的重要成员,在植物抗逆境胁迫中发挥重要作用(陈飞等,2013;韦淑亚等,2013)。因此,克隆研究二穗短柄草CDPK相关基因,对揭示其在作物抗干旱中的调控机制具有重要意义。【前人研究进展】自CDPK首次在大豆中得到纯化和鉴定(Harmon et al.,1987)以来,陆续在水稻、拟南芥、杨树、小麦等物种中发现CDPKs成员(Kong et al.,2013;Zuo et al.,2013)。CDPKs是一个基因家族,至今拟南芥中有34个、水稻中有29个、玉米中有40个、大麦中有27个CDPKs基因已被鉴定(Cheng et al.,2002;Asano et al.,2005;Fedorowicz- Strońska et al.,2016)。植物CDPKs在与Ca2+结合后被激活,通过磷酸化下游的底物而启动植物体内的一系列生理生化反应,包括植物生长发育、调节气孔运动、调节碳氮和能量代谢、光信号转导、植物的耐盐抗旱性及超敏反应等(Romeis et al.,2001;Krupa et al.,2006;Wei et al.,2014)。过表达OsCPK9基因的转基因水稻可显著提高对干旱的耐受性,其原因是OsCPK9转基因植株对脱落酸更敏感,而OsCPK9基因干扰转基因植株对脱落酸的敏感性无明显变化,说明OsCPK9基因通过调控依赖ABA信号的传导途径增强植物对干旱胁迫的耐受性(Wei et al.,2014)。此外,拟南芥过表达CPK10基因能提高其对干旱胁迫的耐受性,作用机理是CPK10基因通过依赖ABA和Ca2+调控气孔运动而提高对干旱胁迫的耐受性(Zou et al.,2010);玉米过表达ZmCPK12基因也可提高转基因植物对盐和干旱的耐受性(Wang and Song,2013)。【本研究切入点】CDPKs在拟南芥、水稻和玉米等植物中参与抗干旱胁迫的研究已有报道,但针对新型禾本科植物二穗短柄草CDPKs基因(BdCDPKs)的研究鲜见报道。【拟解决的关键问题】通过克隆BdCDPK14基因,利用蛋白在线分析软件对其编码蛋白进行生物信息学分析和结构功能预测,并比对分析干旱胁迫下BdCDPK14基因的表达情况,为揭示CDPKs的抗旱调控机制打下基础。
1 材料与方法
1. 1 试验材料
二穗短柄草二倍体近交系Bd21种子由华中科技大学中英联合实验室保存提供,大肠杆菌(Escherichia coli)Top10菌株、琼脂糖凝胶DNA回收试剂盒及质粒小量提取试剂盒购自北京天根生化科技有限公司,pMD18-T载体和PrimeStar HS DNA Polymerase购自TaKaRa公司,植物总RNA提取试剂盒购自北京庄盟国际生物基因科技有限公司、2×Es Taq Master Mix(含染料)购自北京康为世纪生物有限公司、cDNA逆转录试剂盒购自Fermentas公司,其余试剂均为国产分析纯。
1. 2 试验方法
1. 2. 1 干旱胁迫处理 挑选优良的二穗短柄草Bd21种子置于铺有无菌水浸湿滤纸的干净培养皿中,22 ℃暗培养1周左右,待种子发芽后移种至花盆,置于人工气候室中培养4周左右,挑取生长状况良好且长势一致的植株,用20% PEG-6000向幼苗叶片喷洒及根部浇灌模拟干旱胁迫,以未经PEG-6000干旱胁迫为对照。干旱胁迫处理0、1、3、6和12 h后,分别剪取二穗短柄草幼苗叶片放入2.0 mL无菌离心管中,液氮迅速冷冻后存放于-80 ℃冰箱中,供RNA提取使用。
1. 2. 2 总RNA提取及cDNA合成 二穗短柄草叶片总RNA提取按照植物RNA提取试剂盒说明进行操作。经琼脂糖凝胶电泳检测后的完整RNA经反转录试剂盒反转录合成cDNA,备用。
1. 2. 3 引物合成及半定量RT-PCR 从数据库NCBI(http://www.ncbi.nlm.nih.gov/BLAST/)获得目的基因BdCDPK14(GenBank登录号XM_003564390)的全长cDNA序列信息,根据序列信息,利用Primer Premier 5.0设计引物,BdCDPK14基因全长引物序列(F:5'-CT
TGCGTTGCGTGCCGACCAG-3',R:5'-GGCCTCTTT
CCTTCCTTCCCT-3')、actin基因(内参基因)引物(F:5'-CCCGATGGACAGGTTATCACTA-3',R:5'-ATAG
AGCCACCAATCCAAACAC-3')和BdCDPK14基因半定量RT-PCR特异性引物(F:5'-CTACACCGCGTTCC
AGTACTTCGAC-3',R:5'-CTGGCTGCTCGCCTCCT
CGGTT-3')均由武汉擎科生物技术有限公司合成。全长基因PCR扩增程序:98 ℃预变性5 min;98 ℃ 10 s,66 ℃ 15 s,72 ℃ 2 min,进行35个循环;72 ℃延伸10 min。半定量RT-PCR扩增程序:94 ℃预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,进行28个循环;72 ℃延伸10 min。重复3次。用1.2%琼脂糖凝胶检测PCR产物,并送至武汉擎科生物技术有限公司进行测序。
1. 2. 4 BdCDPK14蛋白进化分析 利用NCBI数据库信息进行BLAST比对分析,并使用DNAMAN对BdCDPK14与其他物种中同源性较高的CDPKs进行多序列比对分析。为进一步研究BdCDPK14与其他同源CDPKs间的进化关系,以MEGA 5.0构建系统发育进化树。
1. 2. 5 BdCDPK14蛋白序列生物信息分析 利用生物软件和在线工具对BdCDPK14蛋白进行生物信息学分析,主要包括理化性质、疏水性、二级结构、保守结构域、三级结构等。其中,蛋白生理生化信息分析使用http://web.expasy.org/protparam/,分析蛋白疏水性使用Hphob./Kyte & Doolittle法:http://web.expasy.org/
protscale/),二级结构预测(PSIPRED v3.3)http://
bioinf.cs.ucl.ac.uk/psipred/,保守结构域预测http://
plantsp.genomics.purdue.edu/index.html,三级结构预测http://swissmodel.expasy.org/。用TargetP和WoLFPSort对BdCDPK14基因编码蛋白的亚细胞定位进行分析。
2 结果与分析
2. 1 BdCDPK14基因克隆结果
以二穗短柄草Bd21幼苗mRNA逆转录合成的cDNA为模板进行PCR扩增,扩增产物经1.2%琼脂糖凝胶电泳检测,结果显示获得约1750 bp的目的条带(图1),与BdCDPK14基因(GenBank登录号XM_ 003564390)的预期扩增一致,可以用于后续研究。
2. 2 BdCDPK14蛋白结构及生物信息学分析结果
2. 2. 1 BdCDPK14基因编码蛋白的同源性分析结果
将小麦TaCPK13(ABY59018),水稻OsCPK2(NP_
001044575)、OsCPK14(EEE64198)、OsCPK25(NP_00
1065691)和OsCPK26(ABA95733),拟南芥AtCPK17(NP_196779)和AtCPK34(NP_197437),杨树PtCDPK29
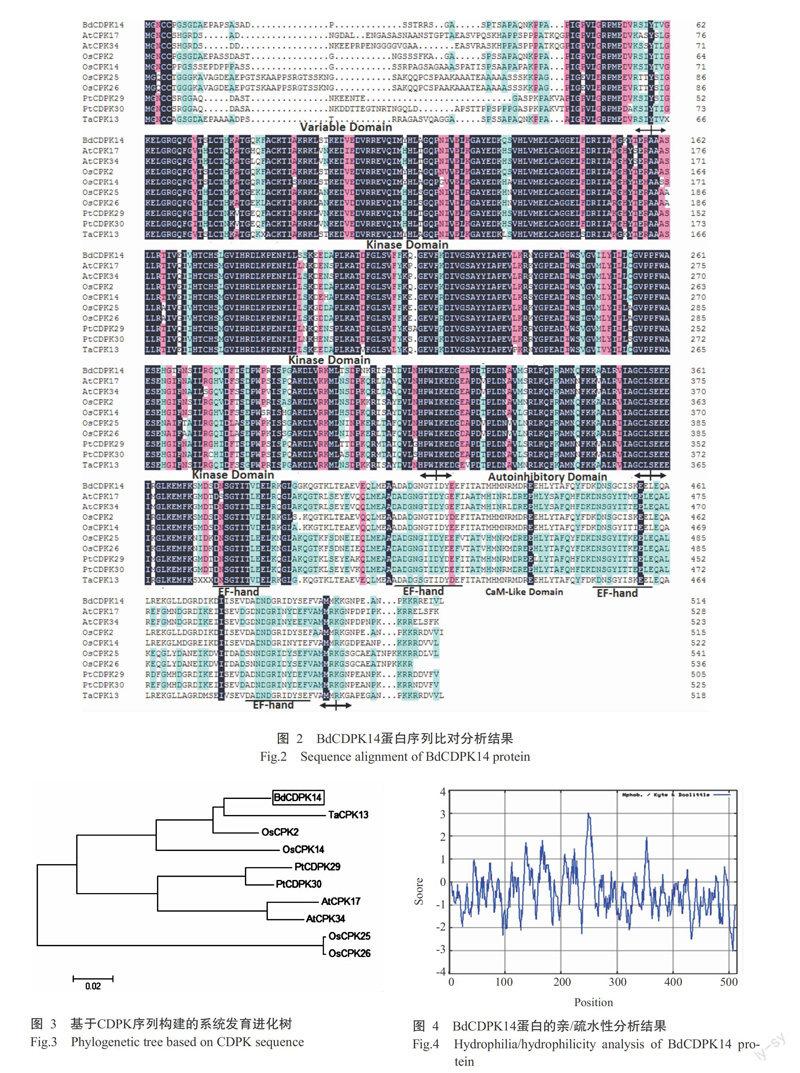
(XP_002299975)和PtCDPK30(XP_002313265)与BdCDPK14蛋白进行多序列比对分析,结果如图2所示,深蓝色区域代表目的蛋白与同源蛋白完全相同的氨基酸序列,粉色和淺蓝色区域代表相似的氨基酸序列。通过箭头和横线标示出N端可变区、蛋白激酶区、自抑制区、EF-hands、类似钙调素结构域。采用MEGA 5.0进行系统发育进化树分析,结果发现,BdCDPK14蛋白与小麦TaCPK13的亲缘关系最近(图3)。综上所述,扩增获得的BdCDPK14基因的确是二穗短柄草CDPK基因家族成员之一,且与禾谷类小麦CDPKs有较高的同源性。
2. 2. 2 BdCDPK14蛋白理化性质及疏水性分析结果
采用在线软件(http://web.expasy.org/protparam/)对BdCDPK14基因编码蛋白进行分析,结果显示,BdCDPK14基因的开放阅读框(ORF)1545 bp,共编码514个氨基酸。其中,含谷氨酸残基(Glu)43个,含量最高(8.4%);色氨酸残基(Trp)4个,含量最低(0.8%);不含吡咯赖氨酸残基(Pyl)和硒半胱氨酸残基(Sec)。BdCDPK14蛋白的氨基酸残基组成及百分比详见表1。
BdCDPK14蛋白的相对分子质量56.78 kD,分子式C2489H3964N694O775S24,总原子数7946,理论等电点5.45,脂肪指数78.21,不稳定指数38.66,属于稳定蛋白。按照Hphob./Kyte & Doolittle法分析该蛋白的疏水性,其总平均亲水性系数为-0.451,为亲水蛋白,蛋白序列的亲/疏水性分析结果如图4所示。
2. 2. 3 BdCDPK14蛋白二级结构预测分析结果 采用在线工具(http://bioinf.cs.ucl.ac.uk/psipred/)对BdCDPK14蛋白进行二级结构分析,如图5所示。图中红色表示α-螺旋,黄色表示β-折叠,直线表示无规卷曲,蓝色代表可信度。预测结果显示,BdCDPK14蛋白所含的二级结构类型中无规卷曲和α-螺旋含量较高,是该蛋白二级结构的主要元件。
2. 2. 4 BdCDPK14蛋白结构域分析结果 采用在线工具(http://plantsp.genomics.purdue.edu/index.html)对BdCDPK14蛋白结构域进行预测,结果表明,BdCDPK14蛋白含有4个EF-hands结构、蛋白酪氨酸激酶结构域、脂多糖激酶家族、ATP结合区域、丝氨酸/苏氨酸蛋白激酶激活区和预测跨膜区等结构域,各结构域的分布情况及对应的蛋白序列如图6所示。
2. 2. 5 BdCDPK14蛋白三级结构预测结果 采用在线工具(http://swissmodel.expasy.org/)对BdCDPK14蛋白同源建模,预测其三级结构,BdCDPK14蛋白以弓浆虫一种CDPK突变体为模板,建立的三级结构模型如图7所示。该蛋白主要由无规卷曲和α-螺旋构成,与二级结构预测结果基本一致。
2. 2. 6 BdCDPK14基因编码蛋白亚细胞定位预测结果 采用TargetP和WoLFPSort对BdCDPK14基因编码蛋白的亚细胞定位进行预测,结果表明,BdCDPK14蛋白主要位于叶绿体和细胞质膜上,位于细胞核、液泡或作为细胞骨架的可能性较小,即该蛋白可能主要在胞质膜和叶绿体中发挥作用。
2. 3 BdCDPK14基因表达分析结果
对干旱胁迫下BdCDPK14基因的表达量进行检测,结果如图8所示。BdCDPK14基因在胁迫3 h内的相对表达量无明显变化,胁迫6 h后相对表达量开始升高,至胁迫12 h时的相对表达量最高。BdCDPK14基因的表达受干旱胁迫诱导,因此推测BdCDPK14基因参与二穗短柄草的抗干旱胁迫反应。
3 讨论
逆境胁迫会引起植物细胞内Ca2+变化,植物中的CDPKs(Ca2+结合蛋白)会识别这些复杂的Ca2+信号,并将Ca2+信号进一步向下游级联放大和传递,进而导致蛋白质磷酸化和胁迫相关基因的表达,以提高植物对逆境胁迫的耐受性(姜珊珊等,2013)。CDPK作为Ca2+信号通路中的重要成员,在信号通路中占据关键位置。二穗短柄草具有遗传背景简单、基因组小(约272 Mb)、染色体基数5条及遗传资源丰富等优点,已成为禾本科植物功能基因组分析的重要工具。每个CDPK家族成员从肽链的N端到C端均由一个同源性最低的N末端可变区、一个同源性较高的蛋白激酶结构域(催化区)、一个最保守的自我抑制区(连接区)和保守性最差的钙调素样结构域(调控区)等4个功能区组成(Harmon et al.,2000)。本研究从二穗短柄草中成功克隆获得BdCDPK14基因,该基因编码的氨基酸序列具有CDPK的基本特征,与其他物种中的CDPK家族成员具有较高的一致性,其中与小麦TaCPK13蛋白的亲缘关系最近。CDPKs的N端可变区包含豆蔻酰化和棕榈酰化的位点,可能负责与膜结合,在细胞定位方面发挥着重要作用(Li et al.,2008)。以TargetP和WoLFPSort两种软件预测BdCDPK14基因编码蛋白,发现BdCDPK14蛋白主要在胞质膜和叶绿体中发挥作用,与ACPK1定位在细胞膜和叶绿体上(Chehab et al.,2004)的结果一致。
CDPK对植物非生物胁迫呈正调节作用,被认为是抗性育種的候选基因(Asano et al.,2012;Zhao et al.,2015)。水稻OsCDPK7基因能够被高盐和低温胁迫诱导,过表达的OsCDPK7基因通过调控胁迫相关基因的表达而增强植物对高盐和干旱的耐受性,但过表达OsCDPK7基因能否增强植物对低温的耐受性有待进一步探究(Saijo et al.,2000);水稻OsCPK9基因也能被干旱胁迫诱导,过表达OsCPK9基因通过增强气孔关闭、调节渗透平衡和依赖ABA的信号传导途径提高植物对干旱胁迫的耐受性(Wei et al.,2014);胡杨PeCPK10基因的过表达能促使气孔关闭而显著提高植物对干旱的耐受性,组成型表达PeCPK10基因则显著增强ABA/非生物胁迫相关基因的表达(Chen et al.,2013)。可见,CDPK家族基因在植物对非生物逆境胁迫应答的信号传导过程中扮演着重要角色。植物响应胁迫应答的信号通路极其复杂,各种通路正在不断地被研究完善。Wang等(2016)将CDPK的研究重点转向其作用底物,发现水稻OsCDPK14能磷酸化下游底物OsDi19-4,而被磷酸化后的OsDi19-4参与了ABA相关基因的调控表达。本研究利用20% PEG-6000对二穗短柄草进行干旱胁迫,并检测BdCDPK14基因的表达情况,结果发现BdCDPK14基因可被干旱胁迫诱导表达,说明BdCDPK14可能是二穗短柄草对干旱胁迫应答的正调控因子。该结论为进一步鉴定BdCDPK14蛋白基因在非生物逆境胁迫中的功能、参与的信号转导途径及BdCDPK14与下游蛋白互作模式研究打下了基础。
4 结论
克隆获得的BdCDPK14基因为二穗短柄草CDPK基因家族成员之一,参与其抗干旱胁迫反应,可作为候选基因用于二穗短柄草抗旱机制研究。
参考文献:
陈飞,尹欢,梁英海,蔡斌. 2013. 苹果钙依赖型蛋白激酶基因家族的进化研究[J]. 江西农业学报,25(9):15-20. [Chen F,Yin H,Liang Y H,Cai B. 2013. Evolution of calcium-dependent protein kinase gene family in apple(Malus domestica)[J]. Acta Agriculturae Jiangxi,25(9):15-20.]
姜珊珊,张丹,孔祥培,周严,李德全. 2013. 植物中的钙依赖蛋白激酶(CDPK)的结构特征和功能研究进展[J]. 生物技术通报,(6):12-19. [Jiang S S,Zhang D,Kong X P,Zhou Y,Li D Q. 2013. Research progress of structural characteristics and function of calcium-dependent protein kinases in plants[J]. Biotechnology Bulletin,(6):12-19.]
韋淑亚,张莹莹,赵旭东,刘小东,罗青晨,卫秋慧,陈鹏,何光源,杨广笑. 2013. 水稻钙依赖型蛋白激酶OsCPK9基因RNAi表达载体的构建及遗传转化[J]. 基因组学与应用生物学,32(5):581-588. [Wei S Y,Zhang Y Y,Zhao X D,Liu X D,Luo Q C,Wei Q H,Chen P,He G Y,Yang G X. 2013. Construction and genetic transformation of RNA interference vectors for OsCPK9 gene in rice[J]. Genomics and Applied Biology,32(5):581-588.]
Asano T,Hayashi N,Kikuchi S,Ohsugi R. 2012. CDPK-media-
ted abiotic stress signaling[J]. Plant Signaling & Behavior,7(7):817-821.
Asano T, Tanaka N, Yang G, Hayashi N, Komatsu S. 2005. Genome-wide identification of the rice calcium-dependent protein kinase and its closely related kinase gene families:Comprehensive analysis of the CDPKs gene family in rice[J]. Plant & Cell Physiology,46(2):356-366.
Chehab E W,Patharkar O R,Hegeman A D,Taybi T,Cushman J C. 2004. Autophosphorylation and subcellular localization dynamics of a salt-and water deficit-induced calcium-dependent protein kinase from ice plant[J]. Plant Physiology,135(3):1430-1446.
Chen J,Xue B,Xia X,Yin W. 2013. A novel calcium-dependent protein kinase gene from Populus euphratica,confers both drought and cold stress tolerance[J]. Biochemical and Biophysical Research Communications,441(3):630-636.
Cheng S H,Willmann M R,Chen H C,Sheen J. 2002. Calcium signaling through protein kinases:The Arabidopsis calcium-dependent protein kinase gene family[J]. Plant Physiology,129(2):469-485.
Fedorowicz-Strońska O,Koczyk G,Kaczmarek M,Krajewski P,Sadowski J. 2016. Genome-wide identification,characterisation and expression profiles of calcium-dependent protein kinase genes in barley(Hordeum vulgare L.)[J]. Journal of Applied Genetics,58(1):11-22.
Harmon A,Gribskov M,Harper J F. 2000. CDPKs-a kinase for every Ca2+ signal?[J]. Trends in Plant Science,5(4):154-159.
Harmon A C,Putnam-Evans C,Cormier M J. 1987. A calcium-dependent but calmodulin-independent protein kinase from soybean[J]. Plant Physiology,83(4):830-837.
Kong X,Lv W,Jiang S,Zhang D,Cai G,Pan J,Li D. 2013. Genome-wide identification and expression analysis of calcium-dependent protein kinase in maize[J]. BMC Genomics,14:433.
Krupa A,Anamika,Srinivasan N. 2006. Genome-wide comparative analyses of domain organization of repertoires of protein kinases of Arabidopsis thaliana and Oryza sativa[J]. Gene,380(1):1-13.
Li A L,Zhu Y F,Tan X M,Wang X,Wei B,Guo H Z,Zhang Z L,Chen X B,Zhao G Y,Kong X Y,Jia J Z,Mao L. 2008. Evolutionary and functional study of the CDPK gene family in wheat(Triticum aestivum L.)[J]. Plant Molecular Biology,66(4):429-443.
Romeis T,Ludwig A A,Martin R,Jones J D. 2001. Calcium-dependent protein kinases play an essential role in a plant defence response[J]. The EMBO Journal,20(20):5556-5567.
Saijo Y,Hata S,Kyozuka J,Shimamoto K,Izui K. 2000. Over-expression of a single Ca2+-dependent protein kinase confers both cold and salt/drought tolerance on rice plants[J]. The Plant Journal,23(3):319-327.
Wang C T,Song W. 2013. Calcium-dependent protein kinase gene ZmCPK12 from maize confers tolerance to drought and salt stresses in transgenic plants[J]. Acta Physiologiae Plantarum,35(5):1659-1666.
Wang L,Yu C,Xu S,Zhu Y,Huang W. 2016. OsDi19-4 acts downstream of OsCDPK14 to positively regulate ABA response in rice[J]. Plant,Cell & Environment,39(12):2740-2753.
Wei S,Hu W,Deng X,Zhang Y,Liu X,Zhao X,Luo Q,Jin Z,Li Y,Zhou S,Sun T,Wang L,Yang G,He G. 2014. A rice calcium-dependent protein kinase OsCPK9 positively regulates drought stress tolerance and spikelet fertility[J]. BMC Plant Biology,14:133.
Zhao R,Sun H,Zhao N,Jing X,Shen X,Chen S. 2015. The Arabidopsis Ca2+-dependent protein kinase CPK27 is required for plant response to salt-stress[J]. Gene,563(2):203-214.
Zou J J,Wei F J,Wang C,Wu J J,Ratnasekera D,Liu W X,Wu W H. 2010. Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca2+-mediated stoma-
tal regulation in response to drought stress[J]. Plant Physio-
logy,154:1232-1243.
Zuo R, Hu R, Chai G, Xu M, Qi G, Kong Y, Zhou G. 2013. Genome-wide identification,classification, and expression analysis of CDPK and its closely related gene families in poplar(Populus trichocarpa)[J]. Molecular Biology Reports,40(3):2645-2662.
(責任编辑 兰宗宝)

