富硒酵母的筛选鉴定及其作为鱼饲料的应用研究
凡敏++黄珍++李欣++王志++陈雄++代俊

摘要:将泡菜汁样品稀释后涂布到含1 g/L Na2SeO3的YEPD培养基上,筛选出一株耐硒菌株FXY-4,用不同Na2SeO3浓度的YEPD培养基培养,发现Na2SeO3的浓度为0.5 g/L时菌株富硒能力最强,为0.54 mg/g(干重)。运用分子生物学和生理生化方法鉴定FXY-4为光滑假丝酵母(Candida glabrata)。将FXY-4添加在鱼饲料中喂食锦鲤,探究其对锦鲤的生长与血清酶学指标的影响,结果显示添加菌株FXY-4能提高锦鲤生长、免疫学指标和鱼肉中有机硒的含量。
关键词:硒;光滑假丝酵母(Candida glabrata);鉴定;鱼饲料
中图分类号:S816.7 文献标识码:A 文章编号:0439-8114(2017)08-1416-04
DOI:10.14088/j.cnki.issn0439-8114.2017.08.004
Isolation,Identification and Application Research of Fish Feed of Selenium-rich Yeast
FAN Min, HUANG Zhen, LI Xin, WANG Zhi, CHEN Xiong, DAI Jun
(Hubei Collaborative Innovation Center for Industrial Fermentation/Key Laboratory of Fermentation Engineering Ministry of Education/College of Bioengineering and Food,Hubei University of Technology,Wuhan 430068,China)
Abstract: A selenium-rich strain FXY-4 in pickle juice was screened from YEPD medium containing 1 g/L Na2SeO3. The concentration of Na2SeO3 of strain FXY-4 was 0.54 mg/g(dry weight) in YEPD culture of 0.5 g/L selenium. Using molecular biology and physiological and biochemical methods,FXY-4 was identified as Candida glabrata. Fish feed containing strain FXY-4 was fed to koi. It showed that feed could increase the growth, immunological parameters and organic selenium content of koi.
Key words: selenium; Candida glabrata; identity; fish feed
隨着生物医学技术的发展,硒(Se)对人体的重要性已逐渐被证实并引起了人们的高度重视。作为人体必需的14种微量元素之一,硒具有抗癌、解毒、保肝和提高人体免疫力等重要生理功能,缺硒会引起人体重要器官功能的失调并最终导致多种疾病的发生[1]。硒也是动物体必需的微量元素,在对动物机体抗应激、促进生长、提高免疫力等方面发挥着重要作用[2]。鱼类饲料中硒的营养学研究表明,饲料中过高或过低的硒含量均会影响鱼类健康,因此硒在动物饲料中最适添加量的研究得到了广泛开展。在水产养殖过程中,一些致病菌能迅速繁殖,进而引发相应的疾病[3]。目前,主要是通过在饲料中添加抗生素的方法来控制解决。然而,抗生素在饲料中的大量使用存在着严重的弊端,如引起内源性感染和二重感染、耐药菌株的产生、免疫力下降和水产品及环境中残留等[4]。相比之下,酵母具有安全、无污染、免疫增强等优点,成为抗生素替代品[5]。筛选得到富硒能力强的酵母,对水产养殖业具有重要的现实意义。目前,关于高产富硒光滑假丝酵母(Candida glabrata)在水产养殖饲料中的应用鲜见报道。
本研究从泡菜中培养得到一系列酵母菌单菌落,通过亚硒酸抗性筛选,得到具有增强免疫和抗应激功能的富硒能力强的酵母菌株。对该菌株进行鉴定,并研究在饲料中添加该菌株后对锦鲤体重、血清酶指标等的影响,以期为强化动物饲料的营养价值、减少抗生素在饲料中的添加提供参考。
1 材料与方法
1.1 材料
泡菜为湖北农家自制。
主要试剂有酵母粉、蛋白胨、硫酸铵、硫酸镁、磷酸氢二钾、盐酸、葡萄糖、氯化钠、氯化钾、环己烷、氨水、硫酸、磷酸、琼脂粉、亚硒酸钠、浓硝酸、溶菌酶(Lysozyme)、蛋白酶K(Protease K)、RNase A、氯仿、异戊醇、水饱和酚、磷酸缓冲液(PBS)EX-Taq DNA聚合酶,购自上海申试化工工贸公司或宝生物工程(大连)有限公司。
主要仪器有生物安全柜,Esco公司;恒温水浴锅(双哈SSY-H型)、恒温振荡培养箱(HZQ-F160型)、全自动控制卧式电热蒸汽消毒器(双哈YX600W型),东联电子技术开发有限公司;隔水式恒温培养箱(GNP-9160BS-III型),新苗医疗器械制造公司;琼脂糖凝胶电泳仪(Mupid-2plus),Advance(日本);紫外凝胶成像系统(DRC-100H/DIX-254A型),Gene公司(美国)。
1.2 菌种的筛选
YEPD液体培养基:葡萄糖2%、蛋白胨2%、酵母粉1%、pH 7.0;加2%琼脂即成固体培养基。
称取1.0 mL泡菜汁加入盛有9 mL无菌水的试管中,在涡旋器上充分振荡10 min,然后静置5 min,采用10倍梯度稀释法将上清液制成10-2、10-3、10-4、10-5稀释液分别涂布到含1 g/L的Na2SeO3 YEPD平板上,倒置,于28 ℃培养箱中培养,观察菌落生长状态、菌落大小和菌落形态,并挑取单菌落,将其命名为FXY-4,转接到YEPD斜面上保存。
1.3 菌株富硒能力测定
将Na2SeO3溶液过滤除菌后加入到YEPD培养基中,配成终浓度分别为0.1、0.5、1.0 g/L的Na2SeO3的培养液。接种后30 ℃培养24 h,先用紫外分光光度计测定OD600 nm,再采用国家标准(GB 5009.93-2010)原子荧光光度计法测定硒元素含量。用未加Na2SeO3的YEPD培养基作为对照。
选取培养18~24 h的FXY-4菌体,用灭菌棉签刮下3 mm左右的待测菌落2~3个,置于装有3 mL 0.45%生理盐水的试管中进行稀释,用标准比浊计测菌液浓度(约0.5个麦氏单位),用菌液填充卡片,置于读数器进行自动读卡。
1.4 酵母基因组提取
染色体DNA的提取步骤[6]如下,①取1.5 mL菌液于1.5 mL EP管中,12 000 r/min离心5 min;②弃上清,900 μL磷酸缓冲液(PBS)重悬沉淀,4 ℃ 12 000 r/min离心5 min;③弃上清,加入300 μL TE和200 μL 10 mg/mL溶菌酶,混匀,37 ℃温育1 h,每隔15 min颠倒混匀一次;④向沉淀加入600 μL TENS裂解液(200 mmol/L NaCl,100 mmol/L Tril-HCl pH 8.0, 2.0% SDS,50 mmol/L EDTA,0.5% Triton X-100)和20 mg/mL蛋白酶K 10 μL,混匀,55 ℃温育1 h,每隔15 min颠倒混匀一次;⑤4 ℃ 12 000 r/min离心5 min,取上清;⑥向上清中加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)充分混匀,4 ℃ 12 000 r/min離心10 min;⑦重复步骤6;⑧将上清转入新的EP管中,加入1/10体积的3 mol/L醋酸钠,2倍体积的无水乙醇,混匀,-20 ℃放置60 min,4 ℃ 12 000 r/min离心10 min;⑨弃上清,将离心管倒扣在吸水纸上,吸干液体后风干,加入30 μL无菌水和10 mg/mL RNase A 0.5 μL,-20 ℃保存。
1.5 26S rRNA基因扩增和测序
根据Kurtzman等[7]的方法,引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′),PCR扩增体系:Premix Taq酶25 μL,上游引物20 μmol/L 1 μL, 下游引物20 μmol/L 1 μL,模板DNA 200 ng/μL 1 μL,无菌水22 μL,总体积50 μL。PCR扩增条件:预变性,94 ℃,10 min;变性,94 ℃,30 s;退火,60 ℃,1 min;延伸,72 ℃,1 min,30个循环;再延伸,72 ℃,10 min。
1.6 26S rRNA基因序列同源性和系统发育分析
将测序后的26S rRNA基因序列通过BLAST[8]比对程序进行同源性分析。利用Clustalx1.8、 MEGA 5.0软件,根据26S rRNA基因序列相似度分析的结果,选取相关模式菌株的26S rRNA基因序列,采用Neigbor-joining(邻位相接法,NJ)算法得到相应的系统发育树[9]。
1.7 富硒光滑假丝酵母FXY-4作为鱼饲料添加剂的应用
采用400条体重相近、健康的锦鲤(约1.80 g/条),随机分成4个处理组,每个处理4个重复,每个重复25条。处理1为对照(CK),商业饲料,不含任何药物添加剂;处理2为抗生素饲料,在商业饲料中添加一定量抗生素;处理3为低量添加富硒光滑假丝酵母FXY-4饲料,在商业饲料中补给富硒光滑假丝酵母FXY-4(饲料中终浓度为5×108 CFU/kg);处理4为高量添加富硒光滑假丝酵母FXY-4饲料,在商业饲料中补给富硒光滑假丝酵母FXY-4(饲料中终浓度为5×1010 CFU/kg),每天投食量按照体重的3%投食2次,喂食30 d后,测定锦鲤体重与血清中过氧化氢酶(CAT)及超氧化物歧化酶(SOD)活性[10]。
1.8 喂食富硒酵母FXY-4饲料对鱼肉中硒含量的测定
随机挑取喂食高量添加富硒酵母FXY-4饲料的锦鲤50条,解剖后混匀鱼肉,称取2.0 g(精确至0.1 mg),放入100 mL烧杯中,加10 mL HNO3浸泡过夜,再加入2 mL HClO4,同时用无富硒酵母FXY-4饲料作为空白对照,摇匀,于电热板上低温加热硝化至白烟冒尽,如果硝解液为黑色或酱褐色,则补加HNO3继续硝化至黑色或酱褐色消失且溶液呈淡黄色,剩余约1 mL溶液时,加入5 mL 6 moI/L HCl,加热微沸5~10 min,冷却,洗入25 mL容量瓶中,用6 mol/L HCl稀释至刻度。采用国家标准方法(GB 5009.93-2010)—原子荧光光度计法测定硒元素含量。
2 结果与分析
2.1 富硒酵母的分离纯化
在1 g/L的Na2SeO3 YEPD平板上培养3 d,挑取出一株直径1~2 mm、圆形、乳白色、表面蜡状光泽的FXY-4单菌落。通过显微镜下观察发现其细胞大小为(3~4) μm×(6~7) μm,椭球形,初步判定为酵母菌属。菌体在0.1、0.5、1.0 g/L Na2SeO3的YEPD培养液中30 ℃培养24 h后,OD600 nm分别为15.4、5.3、2.1,运用国标荧光法检测富硒含量分别为0.39、0.54、0.51 mg/g(DW)。综合菌体在不同Na2SeO3浓度下的生长状况和富硒能力,后续制作饲料时选择0.5 g/L Na2SeO3的培养浓度。
2.2 Bio Mérieux VITEK 2鉴定
分别运用Bio Mérieux VITEK 2自动鉴定分析仪和26S rRNA基因测序技术对FXY-4进行生理生化特性鉴定(表1)。由表1可知,FXY-4与光滑假丝酵母具有相同特征的生理生化反应[11]。
2.3 26S rRNA基因序列分析
2.3.1 菌株FXY-4 26S rRNA基因序列 测序结果显示,菌株FXY-4的26S rRNA基因约570 bp。
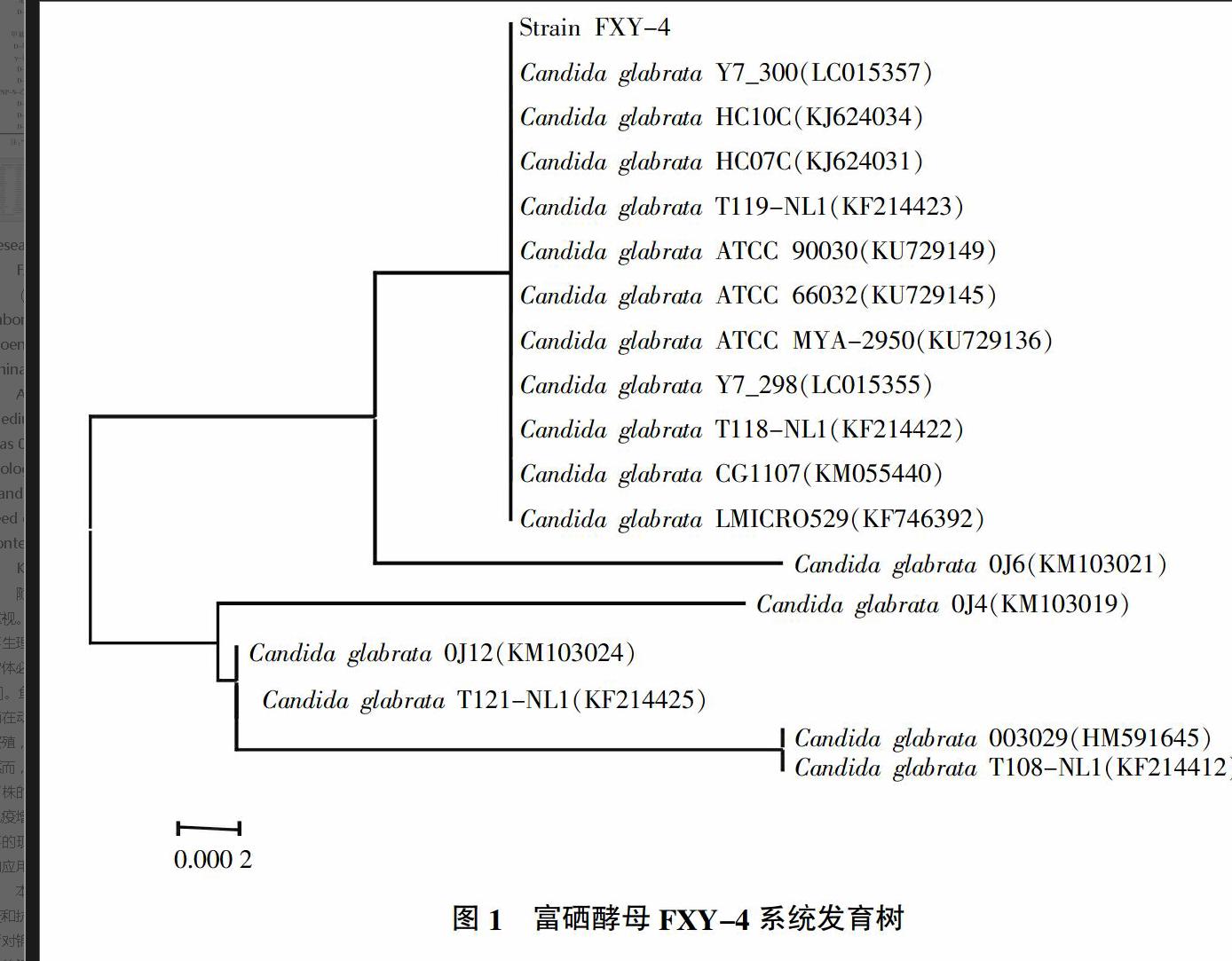
2.3.2 菌株FXY-4 26S rRNA基因系统发育树 将测序后的26S rRNA基因序列通过BLAST比对程序进行同源性分析,FXY-4 26S rRNA基因与Candida glabrata种几十种菌株的相似度为100%。挑选17株有代表性的C. glabrata菌株26S rRNA基因与FXY-4一起构建系统发育树,结果见图1。由图1可知,FXY-4与C. glabrata Y7_300(LC015357)、 C. glabrata HC07C(KJ624031)、C. glabrata HC10C (KJ624031)、C. glabrata T119-NL1(KF214423)、 C. glabrata ATCC 90030(KU729149)、C. glabrata ATCC 66032(KU729145)、C. glabrata ATCC MYA-2950(KU729136)、C. glabrata Y7_298(LC015355)、C. glabrata T118-NL1(KF214422)、C. glabrata CG1107(KM055440)、C. glabrata LMICRO529(KF746392)聚类在一个分支上且进化距离相同。由此可见,该菌株属C. glabrata,将其保藏于中国典型培养物保藏中心,保藏号为CCTCC M 2015664。
2.4 喂食富硒酵母FXY-4饲料对锦鲤体重与血清酶指标的影响
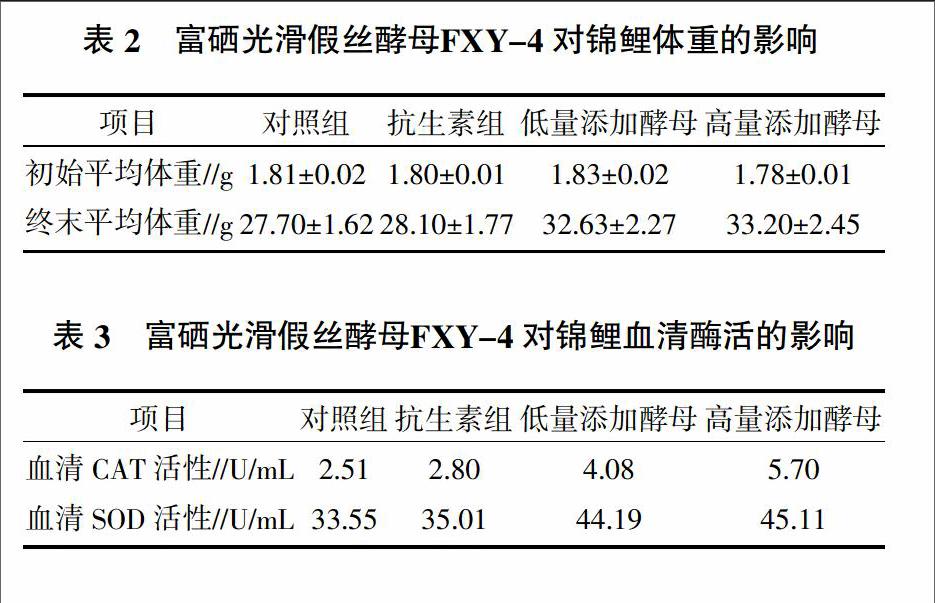
由表2、表3可知,喂养30 d后,低量添加富硒酵母飼料锦鲤体重比对照组提高17.8%,比抗生素组提高16.1%;高量添加富硒酵母饲料锦鲤比对照组提高19.9%,比抗生素组提高18.1%。在血清CAT活性上,低量添加富硒酵母饲料锦鲤体重比对照组提高62.5%,比抗生素组提高45.7%;高量添加富硒酵母饲料锦鲤比对照组提高127.1%,比抗生素组提高103.6%。在血清SOD活性上,低量添加富硒酵母饲料锦鲤比对照组提高31.7%,比抗生素组提高26.2%;高量添加富硒酵母饲料锦鲤比对照组提高34.5%,比抗生素组提高28.8%。
2.5 喂食富硒酵母FXY-4饲料对鱼肉中硒含量的影响
采用国家标准(GB 5009.93-2010)—原子荧光光度计法测定硒元素含量,测得高量添加富硒酵母饲料喂养的锦鲤鱼肉中硒含量为2.23 mg/kg,大于富硒食品硒含量0.20 mg/kg的标准。
3 小结与讨论
本研究从泡菜汁中分离了一株富硒酵母FXY-4菌株,利用分子生物学和生理生化方法鉴定其为光滑假丝酵母。菌体在0.5 g/L Na2SeO3的YEPD培养液中30 ℃培养24 h后,OD600 nm为5.3,菌体硒含量为0.54 mg/g(DW),在含硒培养基中生长快速且富硒能力强。将富硒菌株添加到饲料中喂食锦鲤,与对照组相比体重与血清酶指标均有明显提高。结果表明,该菌株具有较强的富硒能力,在鱼饲料中添加富硒光滑假丝酵母,可以增加鱼饲料中的有机硒,降低抗生素在饲料中的添加量,充分发挥富硒酵母增强免疫和促进生长的活性,强化动物饲料的营养价值,具有良好的市场前景。
参考文献:
[1] FAIRWEATHER-TAIT S J,BAO Y P,BROADLEY M R,et al. Selenium in human health and disease[J].Antioxidants & Redox Signaling,2011,14(7):1337-1383.
[2] KIELISZEK M,BLAZEJAK S. Selenium:Significance and outlook for supplementation[J].Nutrition,2013,29(5):713-718.
[3] 吴 伟,范立民.水产养殖环境的污染及其控制对策[J].中国农业科技导报,2014,16(2):26-34.
[4] 张利民,王际英,李培玉,等.抗生素在水产养殖上的安全性与应用问题[J].养殖与饲料,2007(11):26-29.
[5] 何志刚,李小玲.酵母生物饲料在水产养殖中的应用进展[J].湖南饲料,2014(2):19-22.
[6] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].第三版.黄培堂,译.北京:科学出版社,2002.
[7] KURTZMAN C P,ROBNETT C J. Identification of clinically important ascomycetous yeasts based on nucleotide divergence in the 5′ end of the large-subunit(26S) ribosomal DNA gene[J].J Clin Microbiol,1997,35(5):1216-1223.
[8] JOHNSON M,ZARETSKAYA I,RAYTSELIS Y,et al. NCBI BLAST:A better web interface[J].Nucleic Acids Res,2008, 36(2):5-9.
[9] SAITOU N N M,NEI M. The neighbor-joining method: A new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4(4):406-425.
[10] 林 鑫,毛述宏,杨 阳,等.饲料中添加抗菌肽对锦鲤生长、非特异性免疫力和抗病力的影响[J].动物营养学报,2013,25(8):1860-1865.
[11] KURTZMAN C,FELL J,BOEWHOUT T. The Yeasts―A Taxonomic Study[M].4th ed.Amsterdam:Elsevier Science,1998.

