重金属对日本楤木生理生化特性的影响分析
何安++李德生++李晓晶++彭玲++王硕++张才
摘要:采用盆栽試验,通过对可溶性蛋白质、叶绿素、丙二醛(MDA)以及抗氧化酶活性等的分析来研究不同重金属(Pb、Cd)对日本楤木(Aralia elata var. inermis)的膜系统、光合系统以及抗氧化酶系统生理特性的影响。结果表明,在重金属胁迫下,脯氨酸和MDA的含量均随着胁迫浓度的增加而先减后增,可溶性蛋白质的含量则呈相反趋势。叶绿素的含量则在Pb胁迫下呈先增后减的趋势,而在Cd胁迫下则呈先减后增再减的趋势。日本楤木体内的过氧化物酶(POD)的活性在两种不同重金属胁迫下,随着浓度的增加而逐渐降低,而CAT的活性则相反,但在Pb胁迫下略有不同,在浓度达到1 000 mg/kg时,CAT的活性降低。并且除了CAT活性以外,Pb胁迫下的日本楤木体内的这些含量均比Cd胁迫下的要高,即日本楤木抵抗重金属Pb胁迫的能力比抵抗重金属Cd的能力要强。
关键词:日本楤木(Aralia elata var. inermis);重金属胁迫;生理生化特性
中图分类号:S567.1+9 文献标识码:A 文章编号:0439-8114(2017)08-1463-05
DOI:10.14088/j.cnki.issn0439-8114.2017.08.016
The Effects Analysis of Heavy Metals Stress on Physiological and Biochemical Characteristics of Aralia elata var. inermis
HE An1,LI De-sheng1,LI Xiao-jing2,PENG Ling1,WANG Shuo1,ZHANG Cai3
(1.College of Environmental Science and Safety Engineering, Tianjin University of Technology,Tianjin 300384,China;
2.College of Environmental Science and Engineering, Nankai University,Tianjin 300071,China;
3.Forestry Bureau of Rushan City,Rushan 264500,Shandong,China)
Abstract: The pot experiment was conducted to study the effects of different heavy metals (Pb,Cd) on the effects of physiological and biochemical characteristics of Aralia elata var. inermis,including the membrane system, photosynthetic system and antioxidant enzyme system, by analyzing the soluble protein content, chlorophyll content, lipid peroxidation(MDA) content and oxidation protective enzyme activity and so on. The results showed that the proline and MDA contents increased first, then deceased with increasing concentration of heavy metals, the soluble protein content was opposite. Along with the increase of metal levels,the chlorophyll content showed the trend of firstly increased then decreased and firstly decreased then increased and decreased again separately under the stress of Pb and Cd. The activity of peroxidase (POD) in A. elata var. inermis decreased with increasing the concentration of both Pb and Cd,but the catalase(CAT) was opposite. In addition, when the Pb concentration in soil reached 1 000 mg/kg,the activity of CAT decreased. At the same time, it could be found that these contents analysis under the stress of Pb were higher than the stress of Cd,besides the activity of CAT. And the ability of resistance of A. elata var. inermis under the stress of Pb was higher than Cd.
Key words: Aralia elata var. inermis; the stress of heavy metals; physiological and biochemical characteristics
伴随着城市建设步伐的加快以及工业化进程的发展[1],中国城市环境受到严重的影响,尤其是重金属污染较为严重。通过对中国部分城市公园和居民小区[2-5]重金属污染状况的调查显示,土壤重金属污染的情况十分严重。重金属一旦进入土壤中,具有持续时间长、不易在物质循环和能量交换中分解的特性[1],同时通过食物链等途径易被人体吸收并引发疾病。因此,解决土壤中重金属的污染问题始终是诸多学者的一个重要研究方向。
目前重金属对植物的影响研究主要集中于重金属对草本蔬菜[6]、木本园林植物[7,8]等研究,较少偏重于木本蔬菜的研究,且研究方向主要趋向于单一重金属污染[9,10]及复合重金属污染[11-13]。在自然条件下,植物会经常受到多种重金属的共同胁迫,然而每种重金属对植物的毒性机理与解毒机制可能有所差异,因此需要对不同重金属对同一植物的生理生化指标响应进行比较分析,为土壤重金属污染修复及植物的应用提供参考。
日本楤木(Aralia elata var. inermis)树姿优美,根系发达,生长迅速,具有较强的适应性,容易栽培且具有可观赏价值,是一种兼食用、药用、保健为一体的木本蔬菜[14,15]。试验采用盆栽法,探讨不同重金属(Pb、Cd)对日本楤木体内的膜脂过氧化作用和植物体内自身的抗氧化防御系统的影响,同时研究不同重金属对植物体内的叶绿素和蛋白质含量的影响,比较分析日本楤木在不同重金属胁迫下的生理生化响应,为日本楤木应用Pb、Cd污染土壤修复提供科学依据,并为农产品的安全生产提供参考依据,具有一定的生理学意义和经济价值。
1 材料与方法
1.1 材料与处理
试验于2014年12月初在天津理工大学人工气候室进行,温度为(25±2) ℃,光照12 h/12 h(光照/黑暗),光照强度为1 400 lx。供试材料为两年生日本楤木幼苗,采自于天津市宝坻区青龙湾苗圃场,长势基本一致。将天津理工大学校园土壤与购自河北省兴农生物工程开发有限公司的营养土以20∶1(质量比)的比例混合均匀作为栽培基质,放入半径为30 cm、高20 cm的花盆中,每盆装5 kg,供试土壤的理化性质如表1所示。再将日本楤木幼苗插入土壤中,在人工气候室中培养,待苗木恢复生长后约16 d,进行Pb、Cd胁迫处理,将Pb(NO3)(分析纯)和CdCl2·2.5H2O(分析纯)以溶液的形式加入到土壤中,Pb、Cd各设置4个浓度水平(T1、T2、T3、T4),每个水平3个重复,并以不加重金属为空白对照(CK)。浓度水平设置如表2所示。
1.2 测定指标与方法
采用硫代巴比妥酸法[16]測定丙二醛(MDA)含量,参照植物生理学试验技术的方法[17]测定过氧化物酶(POD)、过氧化氢酶(CAT)以及脯氨酸的含量。可溶性蛋白质的含量采用考马斯亮蓝G-250的方法测定[17]。以上指标均于2015年6月测定。
1.3 数据处理
每个浓度梯度下的植物随机抽取3份进行指标测定,数据以平均值表示。采用Excel 2003软件进行数据整理,并采用Origin 8.5进行制图。
2 结果与分析
2.1 不同重金属胁迫对日本楤木丙二醛含量的影响
丙二醛(MDA)是细胞膜脂过氧化的主要产物之一,其含量变化可作为检测逆境条件下植物受伤害程度的指标之一[18]。从图1可以看出,在重金属Pb的胁迫下,日本楤木中MDA的含量呈下降趋势,在T2处理水平时达到最低,为对照组的86%,其后MDA的含量随着重金属浓度的增加而急剧上升,在T4处理组时达到最高,为对照组的127%。在重金属Cd的胁迫下,日本楤木中MDA的含量也呈先降后升的趋势,但是与Pb处理组不同的是,MDA的含量在T1的时候达到最低,为对照组的85%,随着浓度的增加,MDA在植物体内逐渐积累,并在T4时到达最高,为对照组的121%,其含量低于Pb处理组的含量。从图1中还可发现,除了在T2处理组时,Cd胁迫下日本楤木体内的MDA含量高于Pb胁迫下外,其余均是Pb胁迫下的MDA含量高于Cd胁迫下,这可能是Pb比Cd更能促进日本楤木体内MDA含量的积累,表明Pb可能对细胞产生毒害作用更大。
2.2 不同重金属胁迫对日本楤木脯氨酸含量的影响
脯氨酸是一种重要的渗透调节物质,其积累量可表征植物对逆境适应的能力,所以植物叶片中脯氨酸含量往往被认为是测定逆境胁迫的重要指标[19]。由图2可知,在重金属Pb胁迫下,脯氨酸的含量略有下降,但减少程度仅为对照组的1%。其后,随着重金属浓度的增加,脯氨酸含量急剧上升,但在T2、T3浓度时,上升速度减慢,随后又急剧上升。在重金属Cd胁迫下,在浓度为0.25 mg/kg时,脯氨酸含量达到最低值,为对照组的84%。随着浓度梯度的升高,脯氨酸的含量也相应地急剧上升,在浓度达到5 mg/kg时,脯氨酸的含量增加幅度不大,仅为2%。从图2中还可发现,Pb胁迫下的脯氨酸含量比Cd胁迫下的要高,在T3处理水平时,Pb、Cd胁迫下的日本楤木体内的脯氨酸含量相近,相差仅为4%。植物体内脯氨酸含量增加的原因可能是重金属刺激了脯氨酸的合成,也可能是重金属的胁迫抑制了脯氨酸的氧化,或是阻碍了植物体内蛋白质的合成。
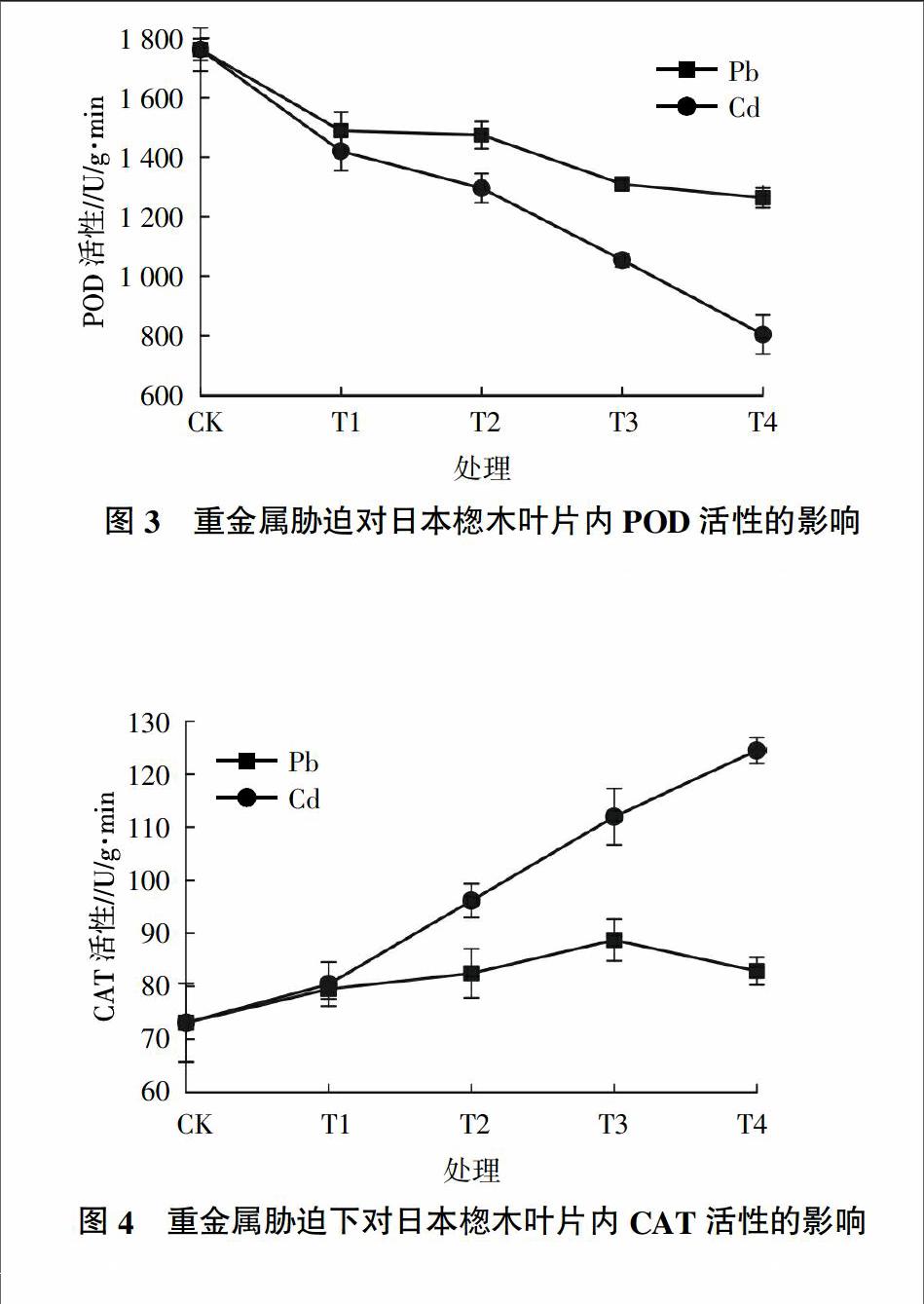
2.3 不同重金属胁迫对日本楤木抗氧化酶活性的影响
在正常情况下,细胞内的活性氧自由基的产生和清除则处于一种动态平衡状态。当植物受到胁迫时,这个平衡就被破坏,从而导致大量的活性氧自由基在体内积累,对细胞造成损害[20]。然而植物细胞自身配有一个抗氧化防御系统来抵抗伤害,其中过氧化氢酶(CAT)、过氧化物酶(POD)都是含血红素Fe的蛋白质,都能分解H2O2,在植物抗逆性、氧伤害以及器官的衰老中发挥着重要的作用。
2.3.1 不同重金属胁迫对日本楤木过氧化物酶活性的影响 过氧化物酶(POD)是一种广泛分布于植物体组织中的一种抗逆适应性酶,它可以反映出植物生长发育、体内代谢以及对外界环境的适应性[20]。由图3可知,无论是在Pb胁迫下还是在Cd胁迫下,日本楤木叶片内的POD活性均随着重金属浓度的增加呈下降趋势,这与杨盛昌等[21]的研究结果不一致。在重金属Pb、Cd的浓度分别达到最高浓度1 500和10 mg/kg时,日本楤木叶片内的POD含量都达到最低,分别为对照组的72%和46%,因此可以发现Pb对日本楤木体内的POD活性影响更小,对于同种浓度水平,可以推测日本楤木对重金属Pb的抗胁迫能力较强。在Pb胁迫下,当土壤中Pb浓度达到1 000 mg/kg时,日本楤木体内的POD活性基本不变,仅下降了3%,可以推测出当Pb胁迫浓度达到 1 000 mg/kg时,POD的活性达到了一个阈值,日本楤木的抗重金属Pb的胁迫能力达到最大。
2.3.2 不同重金属胁迫对日本楤木过氧化氢酶活性的影响 过氧化氢酶(CAT)是植物体内的一种重要的氧化还原酶,可以清除在逆境胁迫下产生的H2O2,避免了H2O2对植物组织的伤害,从而还抑制了由Haber-Weiss反应而产生的毒性更强的·OH,维持了活性氧的代谢平衡,保护了细胞膜的完整性[22]。由图4可知,在重金属Pb胁迫下,随着Pb浓度的增加,日本楤木体内的CAT活性呈先增后减的趋势,在Pb浓度为1 000 mg/kg时,CAT活性达到最高,与对照组相比活性增加了21%,这与龚双姣等[23]研究Cd对3种藓类抗氧化酶活性的影响得出的结论类似,可以推断出在受重金属迫害较轻时,体内活性氧逐渐增多,促进了抗氧化酶活性的升高;在受重金属迫害较重时,超过了植物自身防御反应的极限,导致植物的结构受到破坏,从而使酶的活性降低。而在重金属Cd胁迫下,随着Cd浓度的增加,日本楤木体内的CAT活性急剧上升,在浓度为10 mg/kg时,与对照组相比活性增加了70%,这与孙守琴等[24]的研究结果相反,可能说明Cd有助于促进日本楤木CAT活性的增加。在T1处理组时,Pb胁迫下的CAT活性与Cd胁迫下的CAT活性较相近,可能在较低浓度时,重金属Pb或Cd对日本楤木的CAT活性影响相近,清除活性氧的能力基本一致。
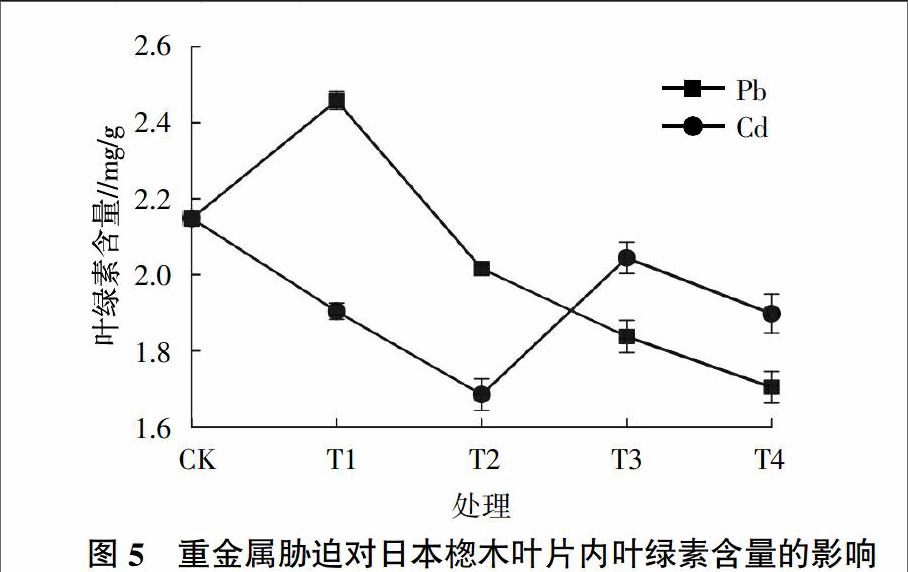
2.4 不同重金属胁迫对日本楤木叶绿素含量的影响
叶绿素是植物进行光合作用的主要色素,其含量高低是植物光合作用效率高低的一个重要指标[25]。由图5可知,在重金属Pb胁迫下,叶绿素的含量有明显的提高,随着Pb浓度的增加,叶绿素的含量呈明显的下降趋势。在Pb浓度为100 mg/kg时,叶绿素的含量达到最高,为空白对照组的114%;在浓度为1 500 mg/kg时,日本楤木体内叶绿素的含量达到1.7 mg/g,与对照组相比降低了21%。在重金属Cd胁迫下,随着Cd浓度的增加,日本楤木体内的叶绿素含量呈先减后增再减的趋势,在Cd浓度达到 1 mg/kg时,植物体内叶绿素的含量达到最低,为1.68 mg/g,在浓度为5 mg/kg时,叶绿素的含量有所增加,但其含量仍低于对照组5%。从图5还可以发现,在T2处理水平之前,Pb胁迫下日本楤木体内叶绿素的含量明显高于Cd胁迫下的含量,但在T3处理水平之后,Cd胁迫下的叶绿素含量要高于Pb胁迫下的含量。有研究表明,重金属胁迫容易导致植物的光合作用受到抑制,叶绿素含量越低,说明植物受胁迫程度越大;反而叶绿素含量越高,植物受胁迫程度越小[26]。因此可以推測在土壤中重金属浓度较高时,Pb对日本楤木的胁迫程度要比Cd对植物的胁迫程度大,而在较低浓度时则相反。
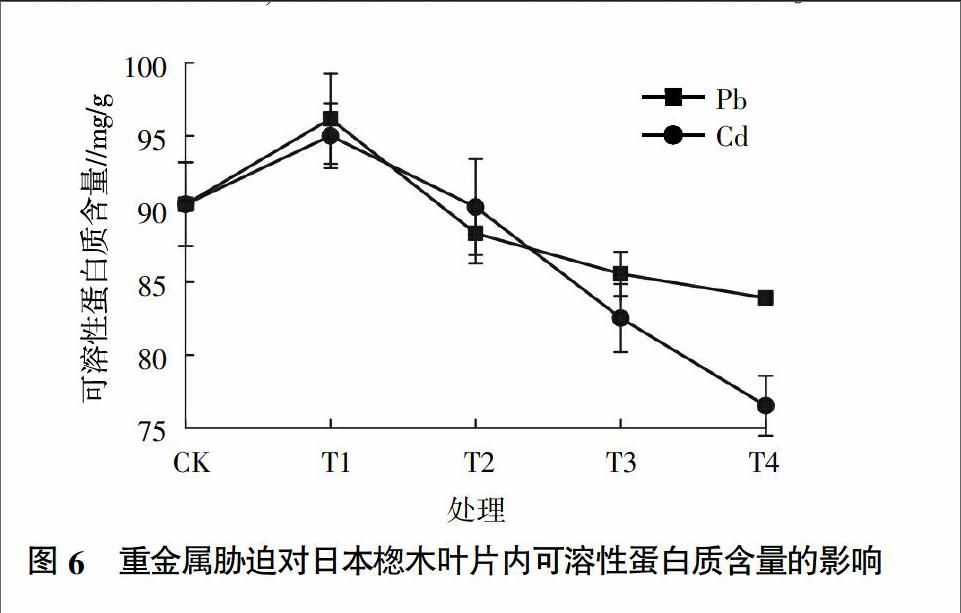
2.5 不同重金属胁迫对日本楤木可溶性蛋白质含量的影响
蛋白质是衡量植物代谢和生理状态的一项重要指标。由图6可知,在重金属Pb胁迫下,随着Pb浓度的增加,植物体内可溶性蛋白质的含量呈先增后减的趋势。在浓度为100 mg/kg时,蛋白质的含量达到最大值,为对照组的107%,随着Pb浓度的增加,蛋白质的含量呈下降趋势,但在浓度为1 000 mg/kg后的下降程度不大。在重金属Cd胁迫下,日本楤木体内的可溶性蛋白质含量也呈先增后减的趋势,这与孙天国等[25]研究的结果相同,表明重金属Cd可以引起可溶性蛋白质含量的增加,这可能是植物为了抵抗重金属Cd对自身的伤害而诱导产生了Cd络合蛋白,从而降低Cd的毒害。可溶性蛋白质含量的增加,有助于维持细胞的正常代谢,增强植物的抗逆性。当土壤中Cd浓度为0.25 mg/kg时,日本楤木内的可溶性蛋白质含量达到最高,为对照组的105%。从图6还可以发现,在T1浓度梯度下,无论是Pb还是Cd胁迫下,日本楤木体内的可溶性蛋白质的含量都有所提高,且Pb胁迫下的比Cd胁迫下的可溶性蛋白质含量要高,可能是低浓度的重金属Pb较Cd更能促进蛋白质含量的增加,间接地使细胞渗透势和功能蛋白的数量得到增加,有利于维持细胞正常代谢,从而提高了日本楤木的抗逆性。
3 小结与讨论
植物在正常生长条件下,活性氧的产生和清除处于一种平衡状态,当处于逆境胁迫时,植物体内活性氧的产生和清除的稳态则会受到破坏,往往会发生膜脂过氧化作用,使植物生长受到了伤害[20]。丙二醛(MDA)是膜脂过氧化作用的最终产物,其含量可以作为膜脂过氧化强弱和质膜破坏程度的重要指标。张凤琴等[22]指出重金属容易导致膜脂过氧化,并且重金属离子的浓度越高,MDA在植物体内就会积累越多。本试验结果表明,在重金属Pb、Cd单一胁迫下,植物叶片内MDA的含量减少,并分别在500、0.25 mg/kg时达到最低,这可能是因为较低浓度的重金属可促进日本楤木体内不饱和脂肪酸的合成,或是因为低浓度的重金属对植物体内活性氧自由基的清除能力被诱导加强,导致MDA含量降低。同时也说明不同重金属对同一植物的过氧化作用表现不同。其后,随着重金属浓度的增加,植物体内的MDA含量相应地增加。
在重金属的胁迫下,细胞膜中的不饱和脂肪酸发生了过氧化反应,从而导致细胞膜的组成和其完整性遭到破坏,细胞的内容物大量外渗,有毒物质自由进出细胞,从而导致植物体内一系列生理生化反应失调。在本试验中,在重金属Pb、Cd胁迫下,植物体内的脯氨酸含量均呈先降后升的趋势。在起初,脯氨酸含量降低可能是因为在植物刚受到胁迫时的一种不适应的表现,其后植物体内脯氨酸含量的增加是植物体对逆境胁迫的一种正常的生理生化反应,其含量增加可能说明细胞的结构和功能遭受到伤害,也可能是植物在逆境胁迫下的一种适应性表现。
在重金属胁迫下,植物体内产生大量的活性氧自由基,破坏了活性氧的代谢平衡,引起蛋白质等大分子的变性,导致膜脂过氧化从而使植物受到伤害。而植物体内的POD、CAT等抗氧化系统通过自身的抗氧化作用来提高对重金属的抗性,从而保护植物免受伤害[15]。本研究结果显示,在重金属Pb的胁迫下,日本楤木体内的POD活性随着Pb浓度的增加而逐渐降低,而CAT的活性则是随着Pb浓度的增加呈先增后减的趋势,可能是因为CAT是一个含有Fe3+的金属酶,重金属离子会取代分子中的Fe3+而使其活性降低,也有可能是因为活性氧自由基的积累导致分子的空间结构发生改变,从而导致CAT活性降低。在重金属Cd胁迫下,日本楤木体内的POD活性随着Cd浓度的增加呈直线下降的趋势,而CAT活性则随着Cd浓度的增加呈直线上升的趋势,由此可以推断出在Cd浓度较低时,日本楤木体内发挥着抗氧化能力的酶主要是POD,在Cd浓度较高时,日本楤木体内的CAT发挥着主要的抗胁迫作用。
当植物生存环境发生变化时,叶绿素的变化在一定程度上可以反映出外界环境因素对植物产生的影响。叶绿素含量的降低是衡量叶片衰老的一个重要指标[25]。受重金属Pb胁迫下的日本楤木体内叶绿素的含量随着Pb浓度的增加呈先增后减的趋势,与宋勤飞等[27]研究Pb胁迫对番茄生长的影响一致。也有研究表明,随着重金属浓度的增加,叶绿素的含量降低,说明植物的光合作用系统受到了不可修复的破坏,使细胞膜和叶绿体的结构发生改变,从而导致叶绿素的含量下降[26]。这与本试验研究的在重金属Cd胁迫下,日本楤木体内的叶绿素含量随着Cd浓度的增加而降低基本一致。本试验中,在Cd浓度为20 mg/kg时,日本楤木体内的叶绿素含量有所上升,具体原因还有待分析。但就总体而言,可以说明受重金属胁迫的植物,叶绿体的合成会受到影响,叶绿素的含量则会相应减少,间接地对植物的光合作用也会产生不利影响,从而加速植物的老化。
可溶性蛋白质大多数是与膜系统特异结合的酶,其含量越高说明其代谢活动越旺盛,越有利于植物抵抗不良环境的胁迫和伤害[28]。重金属可能诱导大量的防御物质形成,然而这些物质往往是蛋白质,这样可以使细胞的渗透势和功能蛋白的数量得到增加来维持细胞的正常代谢[29]。然而这种蛋白质含量的增加是有限度的,随着重金属浓度的进一步增加,加快了可溶性蛋白质的分解,使得合成系统遭到破坏,导致可溶性蛋白质含量下降。本试验结果也验证了这一说法。在Pb、Cd浓度分别为100、0.25 mg/kg时可溶性蛋白质的含量均有所上升,其后可溶性蛋白质的含量都急剧下降,说明植物体内的抗逆性在逐渐减弱,细胞代谢受到阻碍。
综上所述,不同的重金属对同一木本植物的伤害是多方面的,对植物的生理生化指标的影响也不尽相同,而具体响应机制还有待深入研究,同时还可针对其他重金属对日本楤木的影响进行研究分析。
参考文献:
[1] 陈玉梅,王思麒,罗言云.基于抗重金属铅、镉污染的城市道路绿化植物配置研究[J].北方园艺,2010(8):92-95.
[2] 韩东昱,龚庆杰,岑 况.北京市公园土壤Cu、Pb、Zn的含量特征[J].地学前缘,2005,12(2):132.
[3] 符娟林,章明奎,厉仁安.基于GIS的杭州市居民区土壤重金属污染现状及空间分异研究[J].土壤通报,2005,36(4):575-578.
[4] 史贵涛,陈振楼,许世远,等.上海市区公园土壤重金属含量及其污染评价[J].土壤通报,2006,37(3):490-494.
[5] 卢 瑛,龚子同,张甘霖,等.南京城市土壤重金属含量及其影响因素[J].应用生态学报,2004,15(1):123-126.
[6] 胡 超,付庆灵.土壤重金属污染对蔬菜发育及品质的影响之研究进展[J].中国农学通报,2007,23(6):519-523.
[7] 馬 敏,龚惠红,邓 泓.重金属对8种园林植物种子萌发及幼苗生长的影响[J].中国农学通报,2012,28(22):206-211.
[8] 王志香.重金属胁迫对三种木本植物影响的研究[D].北京:中国林业科学研究院,2007.
[9] 谌金吾.三叶鬼针草(Bidenspilosa L.)对重金属Cd、Pb胁迫的响应与修复潜能研究[D].重庆:西南大学,2013.
[10] 孙 健,铁柏清,钱 湛,等.单一重金属胁迫对灯心草生长及生理生化指标的影响[J].土壤通报,2007,38(1):121-127.
[11] 佟 倩,纪薇薇,沈 洋,等.硅对镉锌复合污染下玉米植株体内镉、锌含量及重金属形态的影响[J].西北农林科技大学学报(自然科学版),2016,44(8):171-176.
[12] 李博文,杨志新,谢建治.土壤Cd、Zn、Pb复合污染对植物吸收重金属的影响[J].农业环境科学学报,2004,23(5):908-911.
[13] 张凤琴,王友绍,李小龙.复合重金属胁迫对秋茄幼苗某些生理特性的影响[J].生态环境,2008,17(6):2234-2239.
[14] 孟 丽.重金属铅、镉污染对日本楤木生理特性的影响[D].天津:天津理工大学,2014.
[15] 李海茹.日本楤木对土壤重金属的抗性研究[D].天津:天津理工大学,2013.
[16] MEHER H,IMEEN M. Oxidative stress and antioxidant defense mechanism in mung bean seedings after lead and cadmium treatments[J].Trukish Journal of Agriculture and Forestry,2014(38):55-61.
[17] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[18] 刘建新,赵国林,王毅民.Cd、Zn复合胁迫对玉米幼苗膜脂过氧化和抗氧化酶系统的影响[J].农业环境科学学报,2006,25(1):54-58.
[19] 王继云.Zn2+对Cd2+胁迫下小麦生长与抗氧化系统的影响[D].成都:四川师范大学,2008.
[20] NADG?魷RKA-SOCHA K,PTASI■SKI B,KITA A. Heavy metal bioaccumulation and antioxidative responses in Cardaminopsis arenosa and Plantago lanceolata leaves from metalliferous and non-metalliferous sites:A filed study[J].Ecotoxicology,2013, 22(9):1422-1434.
[21] 杨盛昌,吴 琦.Cd对桐花树幼苗生长及某些生理特性的影响[J].海洋环境科学,2003,22(1):38-42.
[22] 张凤琴,王友绍,董俊德.重金属污水对木榄幼苗几种保护酶及膜脂过氧化作用的影响[J].热带海洋学报,2006,25(2):66-70.
[23] 龚双姣,马陶武,姜业芳,等.镉胁迫下三种藓类植物抗氧化酶活性变化的比较研究[J].西北植物学报,2008,28(9):1765-1771.
[24] 孙守琴,何 明,曹 同,等.Pb、Ni胁迫对大羽藓抗氧化酶系统的影响[J].应用生态学报,2009,20(4):937-942.
[25] 孙天国,沙 伟,刘 岩.复合重金属胁迫对两种藓类植物生理特性的影响[J].生态学报,2010,30(9):2332-2339.
[26] 胡金朝,施国新,王 学,等.Cd对槐叶苹的生理影响及外源La、Ca的缓解效应比较[J].广西植物,2005,25(2):156-160.
[27] 宋勤飞,樊卫国.铅胁迫对番茄生长及叶片生理指标的影响[J].山地农业生物学报,2004,23(2):134-138.
[28] 何晓良,蔡 卓,邱霞琳.铅胁迫对狮子草可溶性蛋白含量的影响[J].广西大学学报(自然科学版),2013,38(3):550-553.
[29] 郭晓音,严重玲,叶彬彬.镉锌复合胁迫对秋茄幼苗渗透调节物质的影响[J].应用与环境生物学报,2009,15(3):308-312.

