后循环脑梗死患者血清HbA1c水平与血管狭窄程度、病情进展及预后的关系
房硕,王建民,胡岩芳,赵晓辉,胡沛霖
(1河北北方学院,河北张家口075000;2邢台市人民医院)
后循环脑梗死患者血清HbA1c水平与血管狭窄程度、病情进展及预后的关系
房硕1,2,王建民2,胡岩芳2,赵晓辉2,胡沛霖2
(1河北北方学院,河北张家口075000;2邢台市人民医院)
目的 观察后循环脑梗死患者血清糖化血红蛋白(HbA1c)水平与血管狭窄严重程度、病情进展及预后的相关性。方法 选择119例后循环脑梗死患者,根据入院时的血清HbA1c水平分为A组(<6.5%,60例)、B组(6.5%~<8.5%,33例)、C组(≥8.5%,26例)。采用CTA或DSA行头颈部血管检查,计算椎基底动脉狭窄程度;采用美国国立卫生院卒中评分量表(NIHSS)评估入院时、出院时的神经功能缺损情况,以入院1周内NIHSS评分较入院时增加1分以上为病情进展;采用改良Rankin评分量表(mRS)评估发病第30天时的神经功能恢复情况。采用线性趋势检验分析HbA1c水平与血管狭窄程度、病情进展比例、第30天mRS评分的相关性。结果 A组轻度狭窄所占比例低于B、C组,中、重度狭窄所占比例高于B、C组(P均<0.01),B组与C组比较差异无统计学意义(P均>0.05)。A、B、C组病情进展患者所占比例依次为8.3%、30.3%、61.5%,组间两两比较差异均有统计学意义(P均<0.05)。A、B、C组第30天时的mRS评分分别为(1.22±1.33)、(2.30±1.38)、(3.00±1.55)分,A组低于B、C组,B组低于C组(P均<0.05)。相关性分析显示,HbA1c水平与椎基底动脉狭窄程度、病情进展患者所占比例、mRS评分均呈正相关(r分别为0.495、0.431、0.742,P<0.05或<0.01)。结论 后循环脑梗死患者血清HbA1c水平与椎基底动脉血管狭窄程度密切相关,随着HbA1c水平升高,患者的病情更容易进展,预后更差。
糖化血红蛋白;后循环脑梗死;血管狭窄;病情进展;预后
糖化血红蛋白(HbA1c)是血红蛋白与葡萄糖或其他糖发生非酶催化反应的产物,是糖尿病病情评价的“金标准”。研究表明,卒中前血糖控制差与缺血性脑卒中的发生呈正相关,HbA1c水平升高可通过多种机制促进大动脉粥样硬化形成,是缺血性卒中的独立危险因素,且更易引起后循环缺血性卒中[1]。HbA1c>6.5%是糖尿病的诊断标准之一,而8.5%是糖尿病血糖控制水平与脑梗死发生相关的重要节点[2~4],因此本研究以6.5%和8.5%作为节点将急性后循环脑梗死患者分为三组,观察患者血清HbA1c水平与椎基底动脉狭窄程度、病情进展及预后的相关性,探讨HbA1c在后循环脑梗死发生发展过程中的作用。
1 资料与方法
1.1 临床资料 收集2015年12月~2016年7月邢台市人民医院收治的急性后循环脑梗死患者119例,均符合全国第四届脑血管病学术会议制定的诊断标准,经颅脑MRI检查确诊。排除标准:①合并严重心、肺、肝、肾功能不全或全身严重并发症;②其他脑部器质性病变如脑肿瘤;③TOAST病因分型中栓塞、其他类型和病因不明者。④入组前90 d内出现颅内出血者。根据入院时的血清HbA1c水平,将患者分为A组(<6.5%)60例、B组(6.5%~<8.5%)33例、C组(≥8.5%)26例。A组男32例、女28例,年龄(61.80±11.72)岁,空腹血糖(5.45±1.10)mmol/L,合并糖尿病8例、冠心病8例、脑梗死11例;B组男17例、女16例,年龄(64.33±9.21)岁,空腹血糖(7.30±1.99)mmol/L,合并糖尿病25例、冠心病3例、脑梗死3例;C组男14例、女12例,年龄(61.50±9.13)岁,空腹血糖(10.45±2.86)mmol/L,合并糖尿病26例、冠心病4例、脑梗死5例。三组性别、年龄、入院时的血压和血脂水平以及冠心病、脑梗死合并症比较差异无统计学意义,糖尿病合并症两两比较差异有统计学意义。
1.2 椎基底动脉狭窄程度观察 采用西门子光子炫速双源CT或荷兰飞利浦DSA Allura Xper FD20大型C形臂X射线机行头颈部血管检查,根据CTA或DSA测量结果计算椎基底动脉血管狭窄程度。狭窄程度=(原管腔直径-最狭窄处管腔直径)/原管腔直径×100%。0~49%为轻度狭窄,50%~69%为中度狭窄,70%~100%为重度狭窄。
1.3 病情进展评价 采用美国国立卫生院卒中评分量表(NIHSS)评估入院时、入院1周时的神经功能缺损情况,以入院1周时NIHSS评分较入院时增加1分以上为病情进展。
1.4 预后评价 采用改良Rankin评分量表(mRS)评估发病第30天时的神经功能恢复情况。
1.5 统计学方法 采用SPSS19.0统计软件。计量资料经方差齐性检验,符合正态分布的数据应用单因素方差分析,不符合正态分布的数据应用非参数秩和检验;计数资料采用χ2检验;相关性分析应用线性趋势检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组椎基底动脉狭窄程度比较 见表1。随着HbA1c水平增高,轻度狭窄所占比例逐渐减少,中、重度狭窄所占比例逐渐增加(P均<0.01)。A组轻、中、重度狭窄所占比例与B、C组比较差异均有统计学意义(P均<0.01),B组与C组比较差异均无统计学意义(P均>0.05)。
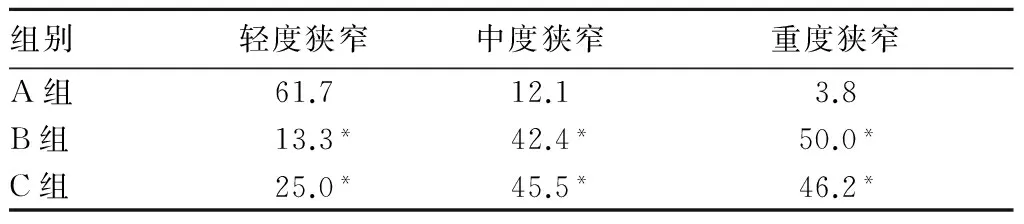
表1 三组椎基底动脉不同狭窄程度发生率比较(%)
注:与A组比较,*P<0.01。
2.2 三组病情进展情况比较 A、B、C组病情进展患者所占比例依次为8.3%、30.3%、61.5%,组间两两比较差异均有统计学意义(P均<0.05)。
2.3 三组mRS评分比较 A、B、C组发病第30天时的mRS评分分别为(1.22±1.33)、(2.30±1.38)、(3.00±1.55)分,A组低于B、C组,B组低于C组(P均<0.05)。
2.4 HbA1c水平与椎基底动脉狭窄程度、病情进展患者所占比例、mRS评分的相关性 相关性分析显示,HbA1c水平与椎基底动脉狭窄程度、病情进展、mRS评分均呈正相关(r分别为0.495、0.431、0.742,P<0.05或<0.01)。
3 讨论
研究显示,HbA1c水平升高对后循环脑梗死的影响较前循环更加明显,是后循环脑梗死尤其是脑干梗死的独立危险因素[5~7]。本研究发现,随着HbA1c水平升高,后循环血管中、重度狭窄的比例逐渐增加,尽管B组与C组没有统计学差异,但进一步分析显示HbA1c与后循环血管狭窄程度存在正相关。表明随着HbA1c水平升高,后循环血管狭窄程度逐渐增加。其机制可能是:①HbA1c激发体内的氧化应激反应,激活血管内皮细胞等发生一系列生物学反应,生成大量氧自由基,直接损伤血管内皮细胞[8]。②高浓度的HbA1c加剧蛋白质糖基化,使糖基化终末产物(AGES)大量增加,破坏蛋白质的分子结构,引起血管结构发生改变和功能受损,导致血管基质增生、管腔变窄;AGES还可抑制血管内皮细胞分泌NO并使其灭活、诱导内皮自然调亡、促进动脉斑块产生,进一步造成血管结构的改变和功能障碍[9]。③糖尿病患者的血管壁上HbA1c受体高表达,HbA1c在血管内皮下大量聚集,引起胶原纤维间的共价交联过度发生,促进动脉粥样硬化的发生发展[10]。④交感神经血管支配具有区域异质性,颈内动脉系统和椎基底动脉系统相比交感神经支配很少;而HbA1c水平升高又可引起自主神经功能紊乱,增加椎基底动脉的交感神经的易感性,加速动脉粥样硬化的进展[11]。
Kamouchi等[12]将3 627例新发缺血性卒中患者根据HbA1c水平分为四组,发现入院前HbA1c水平较高者神经功能缺损更严重,认为入院时HbA1c水平是缺血性卒中神经功能预后的一个预测因子。吴钢等[3]认为,HbA1c>8.5%是后循环脑梗死的独立危险因素,也是患者预后不良的重要因素。本研究显示,HbA1c<8.5%对患者入院NIHSS评分影响相对较小,≥8.5%的患者入院NIHSS评分明显升高。证实高HbA1c患者的神经功能缺损更严重。
陆正齐等[5]认为,HbA1c为脑干梗死严重程度的唯一高风险因子,糖尿病愈严重,对脑干梗死的影响就愈大,进展概率越高。张开容等[13]报道,糖尿病合并脑梗死患者血清HbA1c越高,患者的神经功能恢复越慢,预后越差,脑梗死复发率越高。国外研究[3,4,12]表明,高HbA1c是脑卒中严重程度、早期和长期生存率的良好预测指标。本研究显示,血清HbA1c水平越高,患者病情进展所占比例及第30天时的mRS评分越高。表明HbA1c水平越高,患者的神经功能恢复情况越差,预后越差。其原因可能是:①升高的HbA1c反映长期血糖控制不佳,对血管床的结构和功能有特异的影响,后循环血管情况差。②高水平HbA1c导致红细胞的变形能力低,血液黏稠度增加,脑血管中易形成微小血栓,引起毛细血管闭塞;同时还容易导致血液处于高凝状态,导致大脑局部血管的血流障碍。③高HbA1c使氧离曲线左移,降低氧和血红蛋白的解离程度,使血红蛋白携氧能力下降,引起神经组织缺氧、变性坏死[14]。
综上所述,HbA1c与后循环脑梗死患者血管动脉粥样硬化性狭窄的程度密切相关,随着HbA1c水平升高,患者的神经功能缺损加重,病情更容易进展,预后较差。临床中应加强对后循环脑梗死的血糖管理,尤其是对HbA1c水平的控制。
[1] Kim JS, Nah HW, Park SM, et al. Risk factors and stroke mechanisms in atherosclerotic stroke: intracranial compared with extracranial and anterior compared with posterior circulation disease[J]. Stroke, 2012,43(12):3313-3318.
[2] 张琴,白玉芝,王晶,等.糖化血红蛋白在急性脑梗死患者中的临床意义[J].中国老年学杂志,2008,28(6):610-611.
[3] 吴钢,许映雪,胡志坚.后循环脑梗死的相关危险因素及可能影响预后因素分析[J].中华神经医学杂志,2015,14(1):37-42.
[4] Selvin E, Marinopoulos S, Berkenblit G, et al. Meta-analysis: glycosylated hemoglobin and cardiovascular disease in diabetes mellitus[J]. Ann Intern Med, 2004,141(6):421-431.
[5] 陆正齐,李海燕,胡学强,等.脑干梗死合并糖尿病的临床特点及预后分析[J].中华内科杂志,2011,50(1):27-31.
[6] Ichikawa H, Mukai M, Hieda S, et al. Involvement of the basilar artery in diabetes mellitus: an MRI study of brainstem infarctions[J]. Eur Neurol, 2010,64(4):230-235.
[7] Ichikawa H, Mukai M, Takahashi N, et al. Dilative arterial remodeling of the brain with different effects on the anterior and posterior circulation: an MRI study[J]. J Neurol Sci, 2009,287(1-2):236-240.
[8] 张敏,刘恒方.非糖尿病性急性脑梗死患者血液糖化血红蛋白检测[J].郑州大学学报(医学版),2012,47(4):505-508.
[9] Aronson D. Hyperglycemia and the pathobiology of diabetic complications[J]. Adv Cardiol, 2008,45:1-16.
[10] Friedman EA. Advanced glycosylated end products and hyperglycemia in the pathogenesis of diabetic complications[J]. Diabetes Care, 1999,22(Suppl 2):B65-71.
[11] Li H, Qiu W, Hu B, et al. Ischemic Volumes and Early Neurologic Deterioration in Acute Brainstem Infarctions with Hemoglobin A1c[J]. Eur Neurol, 2013,70(3-4):225-232.
[12] Kamouchi M, Matsuki T, Hata J, et al. Prestroke glycemic control is associated with the functional outcome in acute ischemic stroke: the Fukuoka Stroke Registry[J]. Stroke, 2011,42(10):2788-2794.
[13] 张开容,张伟娟,陈石红.糖化血红蛋白水平对糖尿病合并脑梗死患者的影响[J].中国医药科学,2015,5(11):202-204.
[14] Wu S, Wang C, Jia Q, et al. HbA1cis associated with increased all-cause mortality in the first year after acute ischemic stroke[J]. Neurol Res, 2014,36(5):444-452.
胡沛霖(E-mail: 853776207@qq.com)
10.3969/j.issn.1002-266X.2017.06.030
R743.3
B
1002-266X(2017)06-0085-03
2016-10-10)

