水和氮调控对草场土壤微生物学特性影响研究
马玉亮,张建伟
(青岛大学 环境科学与工程学院,山东 青岛 266071)
水和氮调控对草场土壤微生物学特性影响研究
马玉亮,张建伟*
(青岛大学 环境科学与工程学院,山东 青岛 266071)
通过对内蒙古草场田间试验,研究水和氮调控对草场土壤微生物生物量、土壤呼吸、土壤微生物活性以及微生物群落结构的影响,试验按照裂区设计,主区为降水量(正常降水、增加降水180 mm/年),副区为氮素施用量(0、50、100、150 kg/hm2)。结果表明:土壤微生物碳、氮量随施氮量增加而降低,施氮量为150 kg/hm2时最低,分别为105.23 mg/kg、13.85 mg/kg;增加降水会缓解下降趋势,50 kg/hm2施氮量时数值显著提升50.6%、59.4%;随施氮量增加,土壤基础呼吸、土壤诱导呼吸逐渐降低,CAI、呼吸商逐渐升高,施氮量最大时分别下降30.95%、98.02%,升高73.63%、63.74%,增加降水后各指标均有明显提升,土壤基础呼吸、诱导呼吸增加显著;随施氮量增加,土壤DHA酶、PRO酶、Acld PME酶、Alkaline PME酶逐渐降低,增加降水会使各酶升高;细菌、真菌、丛枝菌根真菌和厌氧菌相对丰度分别在施氮量为100、100、0、150 kg/hm2时最高,增加降水后使厌氧菌、丛枝菌根真菌分别降低11.07%、增加20.59%。
降水;氮素;土壤微生物;微生物学特性
0 引言
近年来,随着我国经济飞速发展,人类活动频繁导致全球气候变化,不仅使草地生态系统面临退化危险,而且还造成降水季节变化不稳以及工业的高速发展使氮沉降逐年增加的现象。内蒙古地区拥有我国陆地面积最大的草原生态系统,草原面积占84.3%,碳素总储量占陆地生态系统的15%,在碳循环研究中占有重要的地位[1]。
内蒙古地区处于全球中纬度最敏感的区域,通过全气候变化模拟预测[2]中纬度地区发现,未来降水将会逐年增加。现有研究对降水与土壤参数及作物产量变化的相关性研究较多,但对土壤微生物学特性的研究尚有不足。在氮素对土壤微生物学特性研究方面,研究相对较多,但结果却不尽相同。例如,Maaroufi[3]研究表明低氮能提高微生物生物量,但Bradly[4]却发现会降低微生物生物量。本文在前人研究的基础上,进一步研究水、氮调控下土壤微生物学特性,为草场土壤微生物学特性提供理论依据,并验证前人研究结果。
1 材料与方法
1.1 气候与土壤
试验地点设置在内蒙古自治区锡林郭勒盟多伦县(2014年),约115°13′3.1″E,42°31′11.6″N,海拔1 344 m,供试土壤为内蒙古自治区典型栗钙土。本区域年活动积温在1 900~2 100℃,年降雨量385 mm,雨热同季,是内蒙古典型草地土壤地区。耕层土壤有机质34.2 g/kg,全氮2.1 g/kg,碱解氮125.4 mg/kg,全磷235.6 mg/kg,全钾15.8 g/kg,pH值6.4。
1.2 试验设计
试验按照裂区设计,将降水量设置为主区因子,分为正常降水和增加降水;副区设置氮素为要素,设置4个水平,分别为不施氮、低氮、中氮、高氮。每个处理4次重复,分为4个区组,每个区组的处理随机分布。小区面积均为50 m2。增加降水以喷灌方式,在6月至8月份10次进行,每次18 mm,年增水量为180 mm。磷肥(以P2O5计)、钾肥(以K2O计)按照当地推荐施肥量施用,与处理中的氮肥混合一次性施入。试验中磷肥用重过磷酸钙,钾肥用硫酸钾,氮肥用尿素。
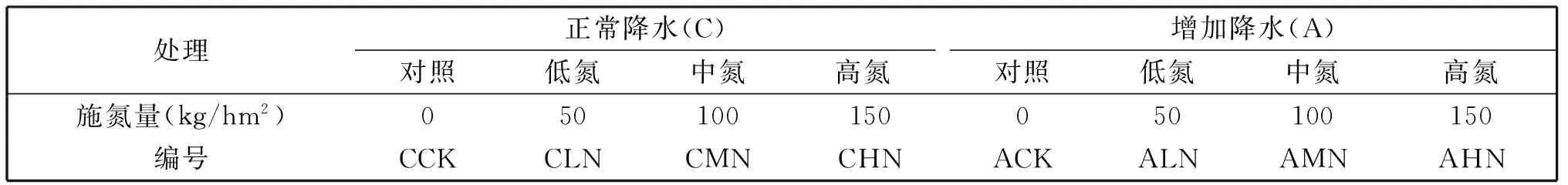
表1 降水量与氮肥处理
1.3 样品采集与分析方法
2014年8月10日用五点法分别在各处理中取表层0~10 cm土壤,保存于4℃的恒温箱中,用于测定土壤微生物量。土壤微生物量碳、土壤微生物量氮采用氯仿熏蒸法进行测定[5]。纤维素酶采用3,5-二硝基水杨酸比色法测定;土壤蛋白酶采用加勒斯江法测定;土壤磷酸单脂酶采用对硝基苯磷酸盐法测定;β-葡糖苷酶采用硝基酚比色法测定;脱氢酶采用TTC还原法测定;土壤过氧化氢酶采用紫外分光光度法测定;β-N-乙酰氨基葡萄糖苷酶采用对硝基酚比色法测定;土壤呼吸、土壤诱导呼吸使用红外线气体分析仪(Li-COR 8100 Infrared Gas Analyzer)测定[6]。土壤微生物群落结构采用磷脂脂肪酸分析法测定[7]。
1.4 计算公式与数据处理
呼吸商(qCO2)=基础呼吸值/微生物生物量碳
(1)
土壤碳的有效可利用性指数(CAI)=基础呼吸值/诱导呼吸值
(2)
运用SPSS 17.0、EXCEL2010和Origin Pro 9.1进行方差分析、相关性分析及作图。
2 结果与分析
2.1 水肥调控对土壤微生物量的影响
2.1.1 水、氮沉降程度对土壤微生物量的影响
不同水肥用量对土壤微生物量的影响如图1。从图1可以看出,土壤微生物量碳与土壤微生物量氮在不同降水的条件下,随氮素施用量增加均呈现下降的趋势。正常降水时,增加氮素施入降低土壤微生物量碳、土壤微生物量氮的幅度分别为23.9%~50.7%,30.9%~55.3%,CCK处理微生物碳、氮量均最高,且与CHN处理具有显著性差异。施用氮素量相同时,增加降水后,土壤微生物量碳、土壤微生物量氮含量均具有显著增加,幅度分别为24.8%~50.6%,10.7%~59.4%,且均在氮素施用量为50 kg/hm2时增幅最大;ACK处理微生物碳、氮量均最高,且与AHN处理具有显著性差异。
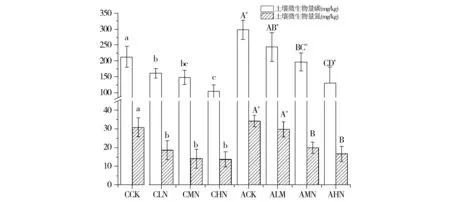
注:不同小写字母表示在不同氮素处理间的差异显著(P<0.05);不同大写字母表示在氮、水调控下处理间的差异显著(P<0.05);*表示在同一氮素水平下正常降水与增加降水处理间的差异显著(P<0.05)。Fig.1 Effect of different water and Fertilizer on soil microbial biomass图1 不同水肥用量对土壤微生物量的影响
2.1.2 水、氮沉降程度对土壤呼吸的影响
土壤微生物的活动是土壤呼吸的主要来源,能够反应土壤微生物量。从表2可以看出,水分与氮素能够明显影响土壤呼吸强度。在正常降水条件下,随施氮量增加土壤基础呼吸作用呈现逐渐减弱的趋势,不施氮肥(CCK)处理土壤基础呼吸作用最强,但处理间无显著差异(P>0.05);土壤诱导呼吸随施氮量增加逐渐减弱,各处理间均存在显著差异(P<0.05),CCK处理诱导呼吸作用最强,较CHN处理增加了98.02%。这两项表明增加氮肥施用会显著降低土壤微生物量,使土壤呼吸速率显著降低(P<0.05)。土壤碳有效可利用性指数(CAI)随氮素施用量增加而显著增加,CHN处理值最高,较CCK处理高73.63%且存在显著性差异(P<0.05)。呼吸商随施氮量增加变化趋势与CAI相同,CHN处理最高且与其他处理存在显著性差异(P<0.05),与CCK处理数值相差1.74,表明增加氮肥施用会使微生物加强对土壤碳的利用,原因可能是微生物为了抵抗外界干扰而加强呼吸。
降水增加后,土壤基础呼吸与土壤诱导呼吸速率在不同氮素用量时变化趋势与正常降水相一致,且均有明显增强,增加范围分别在2.1%~18.6%、14.3%~33.6%,其中土壤诱导呼吸速率在不同氮素用量处理上均显著高于正常降水(P<0.05),表明在同等氮素用量条件下增加降水可以促进土壤微生物量增加,并加快土壤呼吸速率。土壤碳有效可利用性指数(CAI)与呼吸商变化均不明显但有所降低,且无显著差异(P>0.05),表明土壤碳的利用效率有所提升,以CO2形式损失的土壤基质碳含量降低。

表2 水、氮沉降对土壤呼吸的影响
2.2 水肥调控对土壤微生物活性的影响
2.2.1 水、氮沉降程度对土壤胞外酶活性的影响
水肥调控下,土壤胞外酶与降水、氮素间的方差分析如表3。从表3可以看出,降水量与纤维素酶、土壤蛋白酶、碱性磷酸酶、脱氢酶间呈显著相关(P<0.05),β-葡糖苷酶呈极显著相关(P<0.01);施氮量与土壤蛋白酶、酸性磷酸酶、碱性磷酸酶、脱氢酶、β-N-乙酰氨基葡萄糖苷酶呈极显著相关(P<0.01);双因素共同作用下仅与脱氢酶呈显著相关性(P<0.05)。
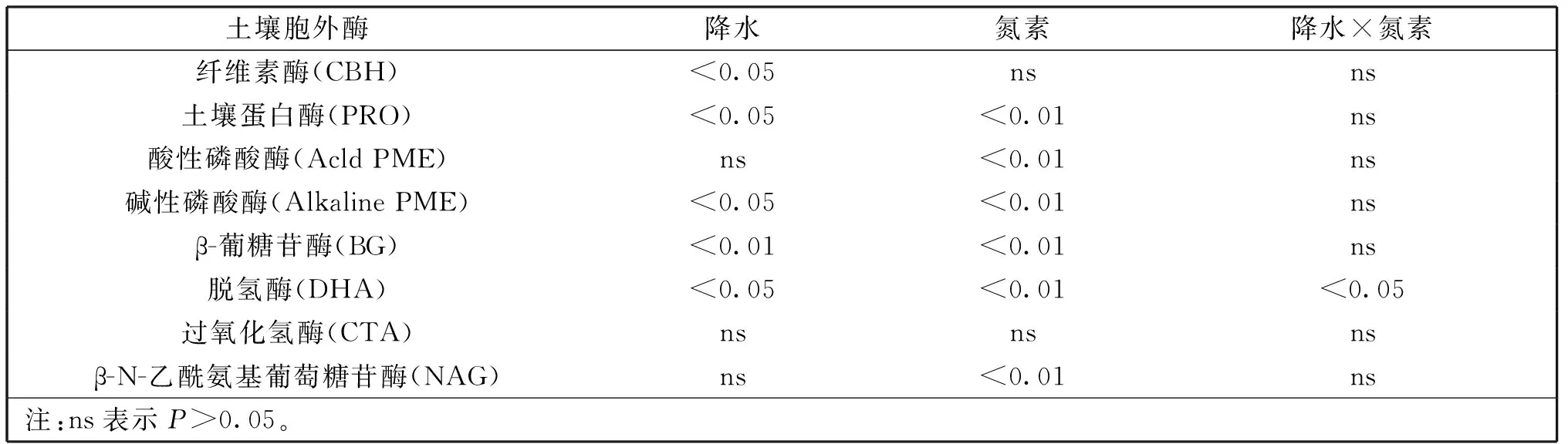
表3 水肥调控条件下土壤胞外酶方差分析结果
从图2可以看出,在降水不变的情况下,土壤中脱氢酶、蛋白酶、碱性磷酸酶、酸性磷酸酶活性随氮素施用量增加而逐渐降低;纤维素酶活性变化不显著(P>0.05);β-葡糖苷酶活性随施氮量增加先升高后降低;β-N-乙酰氨基葡萄糖苷酶活性随施氮量增加先升高后逐渐的平稳。在施氮量不变的情况下,增加降水会使脱氢酶、蛋白酶、纤维素酶、碱性磷酸酶、β-葡糖苷酶活性增加;酸性磷酸酶、β-N-乙酰氨基葡萄糖苷酶活性变化不显著(P>0.05)。
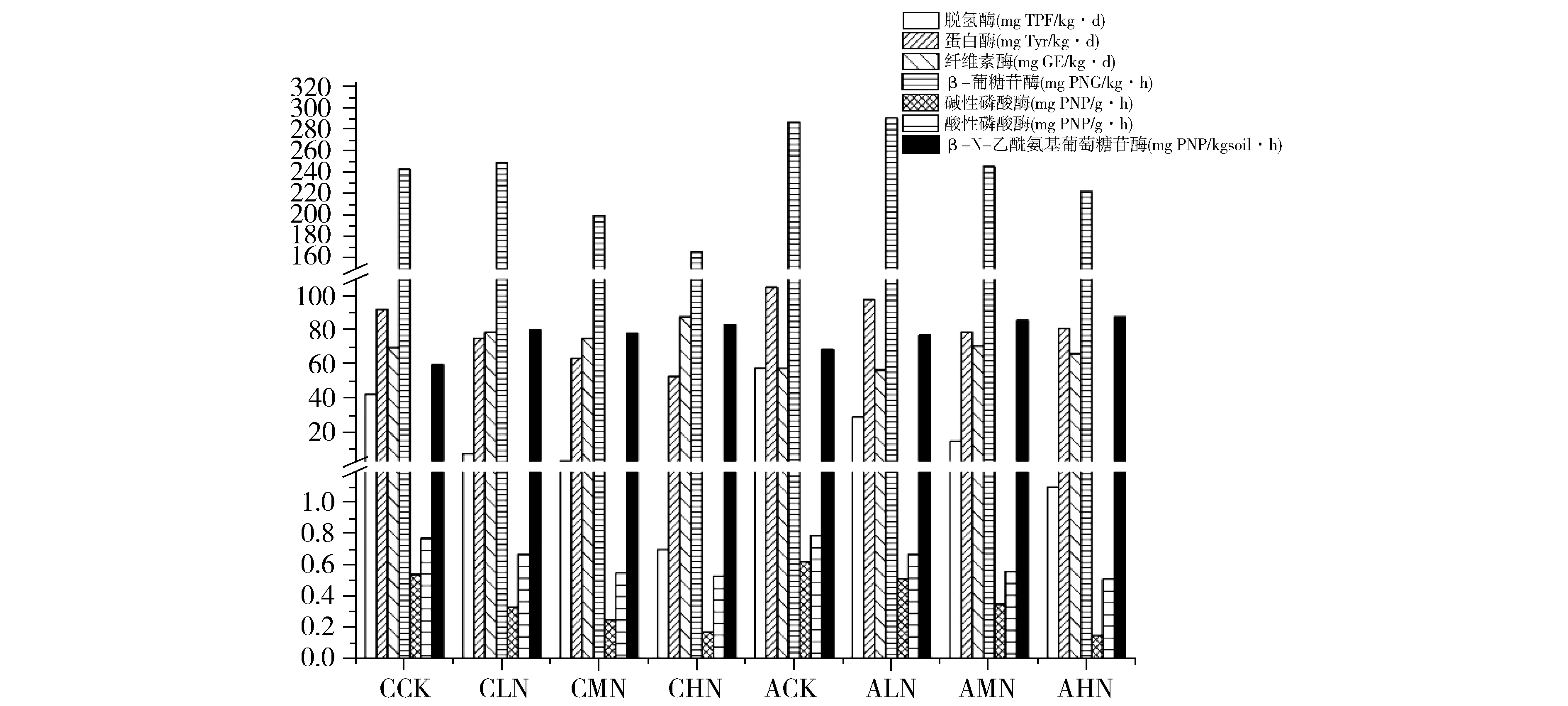
注:不同小写字母表示在不同氮素处理间的差异显著(P<0.05);不同大写字母表示在氮、水调控下处理间的差异显著(P<0.05);*表示在同一氮素水平下正常降水与增加降水处理间的差异显著(P<0.05)Fig.2 Effect of soil water and fertilizer control of extracellular enzyme图2 不同水肥控制对土壤胞外酶的影响
2.2.2 水、氮调控对酶化学计量的影响
酶化学计量能够反映微生物对土壤基质的利用以及对环境变化的敏感程度。从表4可以看出,降水与施氮量对酶化学计量具有显著影响(P<0.05)。随施氮量增加,BG/NAG比值逐渐降低,NAG/Acld PME比值逐渐升高,BG/Acld PME比值先升高后降低,三者均呈现显著性变化。BG/NAG、BG/Acld PME比值随降水增加而增加,NAG/Acld PME比值随降水增加而降低且下降显著(P<0.05)。
2.3 水肥调控对土壤微生物群落结构的影响
利用微生物PLFA总量指示微生物总生物量,可以大致鉴定细菌、革兰氏阴性菌、革兰氏阳性菌、厌氧菌、放线菌、丛枝菌根真菌、真核细胞、真菌类大微生物群。通过表3中方差分析可得出,丛枝菌根真菌、厌氧菌对单因素降水与施氮量均较为敏感,而细菌、真菌仅对施氮量敏感(P<0.05),其余微生物类群对降水与施氮量均不敏感(P>0.05)。
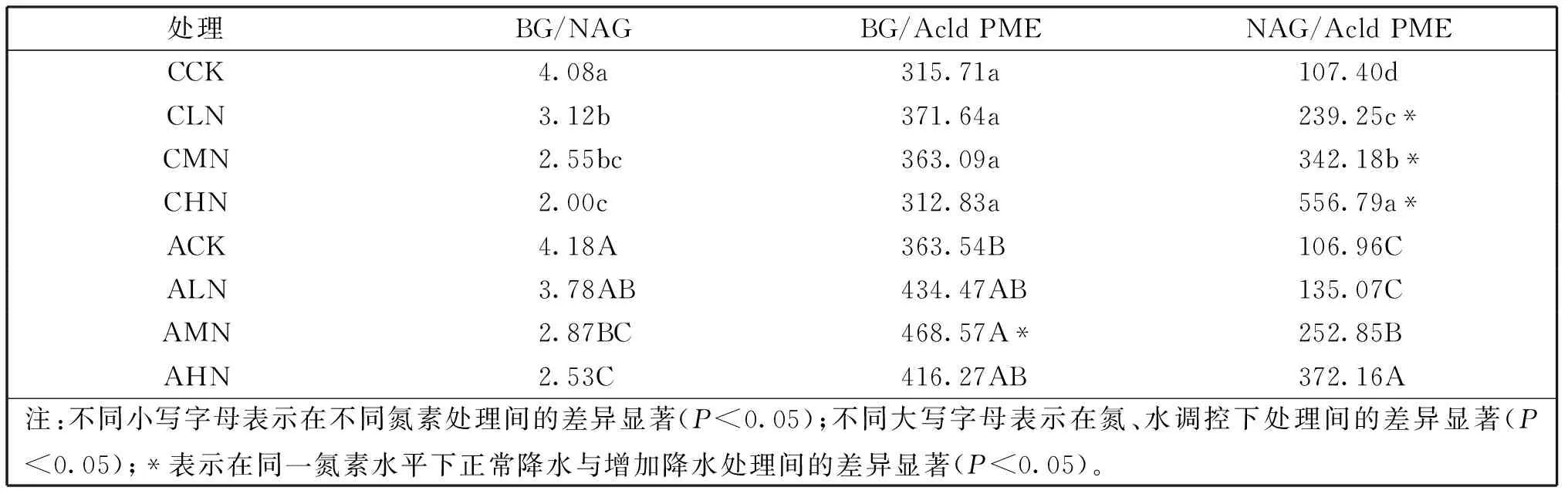
表4 水、氮调控对酶化学计量的影响
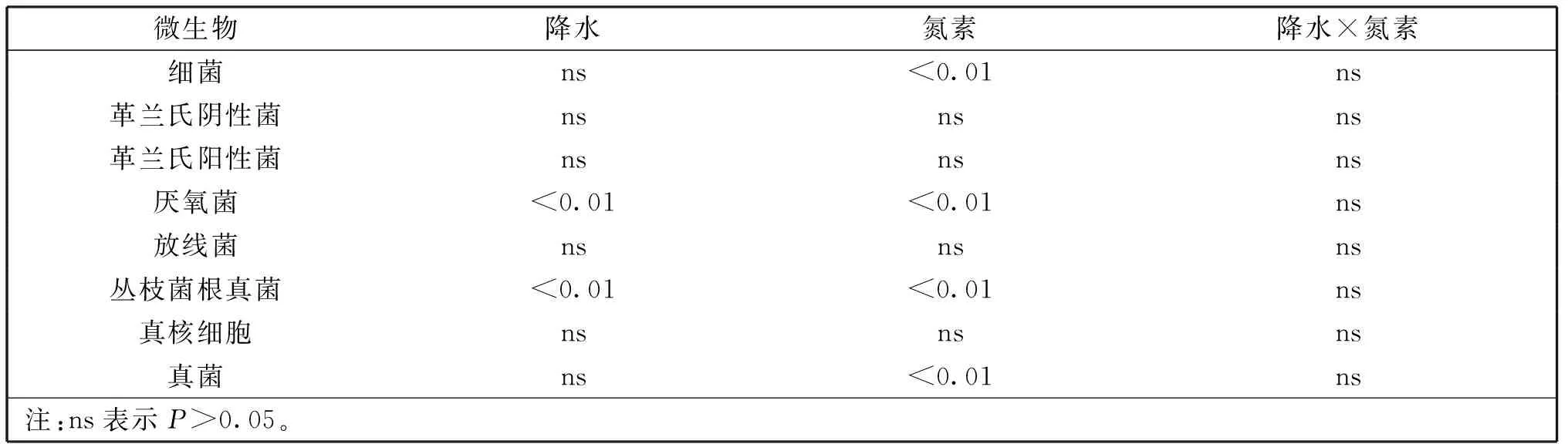
表5 水肥调控条件下微生物生物量方差分析结果
根据方差分析可知,细菌、厌氧菌、丛枝菌根真菌、真菌需要进一步分析。从图3中可以看出,厌氧菌相对丰度、丛枝菌根真菌相对丰度在增加降水后分别降低4.8%~21.6%、增加20.6%~33.2%,最高值分别比常规降水降低0.16%、增加0.98%。厌氧菌相对丰度在CLN、CMN处理显著高于ALN、AMN处理,丛枝菌根真菌增加降水处理均显著高于常规降水处理,表明降水的强度能够影响两种菌群在土壤中的相对丰度。降水不变的条件下,细菌相对丰度随施氮量增加先升高后降低,且在100kg/hm2施氮处理数值最高;真菌相对丰度随施氮量增加先降低后升高,且在100 kg/hm2施氮处理数值最低;丛枝菌根真菌相对丰度随施氮量增加逐渐降低;厌氧菌相对丰度随施氮量成波浪状,且有两个峰值,分别在施氮量50 kg/hm2、150 kg/hm2。

注:不同小写字母表示在不同氮素处理间的差异显著(P<0.05);不同大写字母表示在氮、水调控下处理间的差异显著(P<0.05);*表示在同一氮素水平下正常降水与增加降水处理间的差异显著(P<0.05)。Fig.3 Effect of different water and fertilizer control on soil microorganisms图3 不同水肥控制对土壤微生物的影响
从图4可以看出,降水与施氮可以影响微生物体内环状脂肪酸的比例、真菌与细菌比值以及革兰氏阳性菌与阴性菌的比值。增加降水可显著减小Cyc/Prec的比值,但对真菌/细菌与革兰氏阳性菌/阴性菌无显著影响。施氮可增大Cyc/Prec的比值,最大值较不施氮处理增高42.4%;增加降水后,Cyc/Prec比值降低9.7%~34.8%,说明增加施氮量对Cyc/Prec比值起到正效应,增加降水对Cyc/Prec比值起负效应。真菌/细菌比值对降水不敏感,但增加氮肥会显著降低,ACK处理较AMN处理高45.4%且呈显著差异,表明氮素打破了草场土壤微生物平衡,使真菌的数量相对增加。降雨与施氮量对革兰氏阳性菌/阴性菌比值均无显著影响。
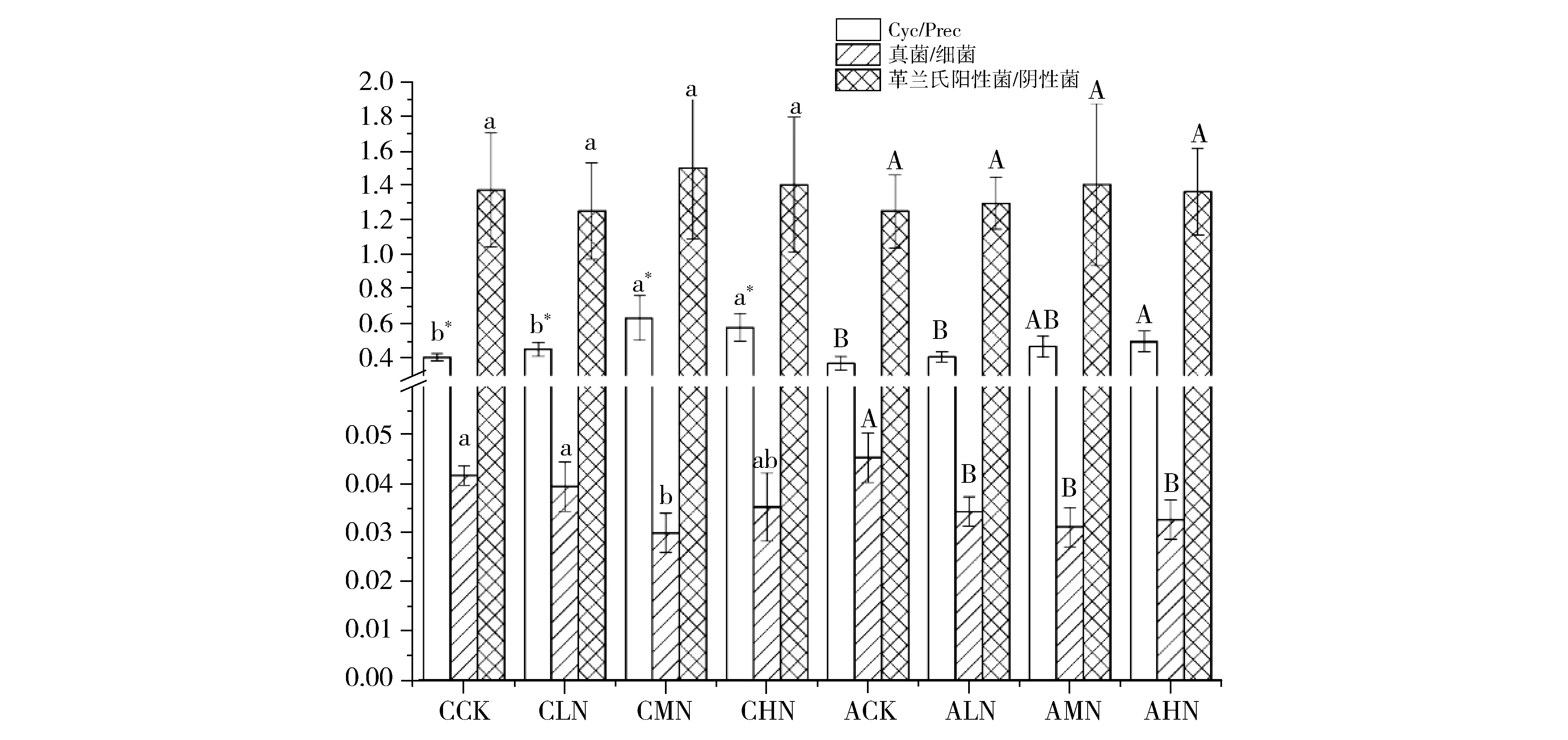
注:不同小写字母表示在不同氮素处理间的差异显著(P<0.05);不同大写字母表示在氮、水调控下处理间的差异显著(P<0.05);*表示在同一氮素水平下正常降水与增加降水处理间的差异显著(P<0.05)。Fig.4 Effect of different water and fertilizer control of cyclic fatty acid, F/B, gram positive/negative bacteria图4 不同水肥控制对环状脂肪酸、真菌/细菌、革兰氏阳性菌/阴性菌的影响
3 讨论
不同水肥调控对土壤微生物的生物量具有显著影响。本试验结果表明,随施氮量增加,土壤微生物量碳、氮均有显著下降(P<0.05),这与Xu[8]研究结果相一致。造成微生物量碳、氮降低的原因主要是土壤氮素增加,降低了土壤pH值[9],抑制了土壤微生物的生长,植物吸收氮素量增加,打破了原有的植物-微生物养分平衡,使微生物的繁殖进一步的受到抑制[10],从而降低了土壤微生物量碳、氮以及土壤呼吸速率[11]。而增加水分能够缓解这种竞争程度,为微生物繁殖提供适宜的条件,使土壤微生物丰度增加,并加快土壤呼吸速率。
不同水肥调控对土壤微生物活性影响显著(P<0.05)。增加施氮量后,土壤中脱氢酶、碱性磷酸酶和酸性磷酸酶活性均显著降低,这与氮素导致土壤pH降低有关[12]。NAG酶活性升高,BG酶活性降低的主要原因是土壤含氮化合物如油脂类、几丁质含量上升,导致细菌分泌NAG酶活性增加[13];同时,淀粉、糖类化合物含量下降,微生物碳源不足,BG酶活性降低[10]。蛋白酶活性降低,与Creamer[14]研究结果相一致,这主要是由土壤微生物量降低导致的。而增加降水后,土壤pH有所上升,营造了微生物繁殖的适宜环境,土壤微生物量增加,使土壤脱氢酶、碱性磷酸酶、BG酶和蛋白酶活性提高,但水分增加抑制了真菌活性,从而使纤维素酶降低。酶化学计量中,随施氮量增加,BG/NAG比值逐渐降低,NAG/Acld PME比值逐渐升高,表明土壤微生物对氮素的需求超过碳和磷,而增加降水后,BG/NAG和BG/Acld PME比值增加说明生物对碳的需求高于氮和磷。比值变化的原因主要是增加施氮后植物吸氮量增加,微生物处于劣势,通过释放胞外酶分解土壤含氮化合物为自身提供营养,而增加降水后使土壤诱导呼吸速率加快,使微生物对碳水化合物需求增加,从而增加了BG酶活性[15]。
水肥调控对细菌、厌氧菌、丛枝菌根真菌和真菌具有显著影响(P<0.05)。增加施氮量使细菌、厌氧菌相对丰度升高,丛枝菌根真菌和真菌的相对丰度降低,这与Wei[16]研究的结果相一致。真菌/细菌比值的变化说明土壤对氮素增加的缓冲能力不足,影响了土壤微生物群落结构[17];革兰氏阳性菌/阴性菌变化不明显,主要原因可能是降水与氮素的变化未导致土壤基质中有机质含量有明显变化。
4 结论
(1)随施氮量增加,土壤微生物量碳、氮含量均显著降低,土壤呼吸速率降低,CAI及呼吸商增加;增加降水会缓解氮素对土壤微生物量的抑制,使土壤微生物碳、氮含量有所提升,土壤呼吸速率加快,CAI及呼吸商降低。
(2)随施氮量增加,土壤中脱氢酶、蛋白酶、碱性磷酸酶、酸性磷酸酶活性显著降低,β-葡糖苷酶活性先升高后降低;β-N-乙酰氨基葡萄糖苷酶活性先升高后逐渐的平稳;增加降水会使脱氢酶、蛋白酶、纤维素酶、碱性磷酸酶、β-葡糖苷酶活性增加。
(3)随施氮量增加,细菌相对丰度先升高后降低,且在100 kg/hm2施氮处理最高,而真菌相对丰度与之相反,厌氧菌相对丰度在150 kg/hm2时最高,丛枝菌根真菌相对丰度在不施氮素时最高;增加降水后厌氧菌相对丰度、丛枝菌根真菌相对丰度分别最多降低21.6%、增加33.2%。
(4)水氮复合调控可平衡土壤环境,增加土壤微生物碳、氮量,但对土壤胞外酶及微生物群落结构影响不明显。
[1] 赵同谦,欧阳志云,贾良清.中国草地生态系统服务功能间接价值评价[J].生态学报,2004,24:1101-1110.DOI:10.3321/j.issn:1000-0933.2004.06.002.
[2] Weltzin J F,Loik M E,Schwinning S,etal.Assessing the Response of Terrestrial Ecosystems to Potential Changes in Precipitation[J].BioScience,2003,53:941-952.DOI:10.1641/0006-3568(2003)053[0941:atrote]2.0.co;2
[3] Maaroufi N I,Nordin A,Hasselquist N J,etal.Anthropogenic Nitrogen Deposition Enhances Carbon Sequestration in Boreal Soils[J].GlobalChangeBiology,2015,21(8):3169-3180.DOI:10.1111/gcb.12904.
[4] Bradley B A,Mustard J F.Characterizing the Landscape Dynamics of an Invasive Plant and Risk of Invasion using Remote Sensing[J].EcologicalApplications,2006,16(3):1132-47.DOI:10.1890/1051-0761(2006)016[1132:CTLDOA]2.0.CO;2.
[5] 南京农业大学.土壤农化分析:第2版[M].北京:农业出版社,1981.
[6] Acosta-Martinez V,Tabatabai M A.Enzyme Activities in a Llimed Agricultural Soil[J].BiologyandFertilityofSoils,2000,31(1):85-91.DOI: 10.1007/s003740050628.
[7] 颜慧,蔡祖聪,钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].土壤学报,2006,43(5):851-859.DOI:10.3321/j.issn:0564-3929.2006.05.021.
[8] Xu Z,Wan S,Zhu G,etal.The Influence of Historical Land Use and Water Availability on Grassland Restoration[J].RestorationEcology,2010,18(s1):217-225.DOI:10.1111/j.1526-100X.2009.00595.x.
[9] Wei C,Yu Q,Bai E,etal.Nitrogen Deposition Weakens Plant-microbe Interactions in Grassland Ecosystems[J].GlobalChangeBiology,2013,19(12):2131-2140.DOI:10.1111/gcb.12348.
[10] Wang R,Filley T R,Xu Z,etal.Coupled Response of Soil Carbon and Nitrogen Pools and Enzyme Activities to Nitrogen and Water Addition in a Semi-arid Grassland of Lnner Mongolia[J].PlantandSoil,2014,381(1):323-336.DOI:10.1007/s11104-014-2129-2.
[11] Tian Q,He H,Cheng W,etal.Pulse-dynamic and Monotonic Decline Patterns of Soil Respiration Inlong Term Laboratory Microcosms[J].SoilBiology&Biochemistry,2014,68:329-336.DOI:10.1016/j.soilbio.2013.10.015.
[12] Creamer C A,Filley T R,Olk D C,etal.Changes to Soil Organic N Dynamics with Leguminous Woody Plant Encroachment Into Grasslands[J].Biogeochemistry,2013,113(1):307-321.DOI:10.1007/s10533-012-9757-5.
[13] Wei Z,Zhang G,Liu G,etal.Bacterial Diversity and Distribution in the Southeast Edge of the Tengger Desert and Their Correlation with Soil Enzyme Activities[J].环境科学学报(英文版),2012,24(11):2004-2011.DOI:10.1016/S1001-0742(11)61037-1.
[14] Creamer C A,Filley T R,Olk D C,etal.Changes to Soil Organic N Dynamics with Leguminous Woody Plant Encroachment Into Grasslands[J].Biogeochemistry,2013,113(1):307-321.DOI:10.1007/s10533-012-9757-5.
[15] Wang R,Dorodnikov M,Yang S,etal.Responses of Enzymatic Activities within Soil Aggregates to 9-year Nitrogen and Water Addition in a Semi-arid Grassland[J].SoilBiology&Biochemistry,2015,81(6):159-167.DOI: 10.1016/j.soilbio.2014.11.015.
[16] Wei C,Yu Q,Bai E,etal.Nitrogen Deposition Weakens Plant-microbe Interactions in Grassland Ecosystems[J].GlobalChangeBiology,2013,19(12):2131-2140.DOI:10.1111/gcb.12348.
[17] 齐玉春,彭琴,董云社,等.不同退化程度羊草草原碳收支对模拟氮沉降变化的响应[J].环境科学,2015(2):625-635.DOI:10.13227/j.hjkX.2015.02.034.
Effects of Precipitation and Nitrogen Regulation on Soil Microbial Characteristics in Grassland
MA Yuliang,ZHANG Jianwei*
(College of Environmental Science and Engineering, Qingdao University, Qingdao 266071,China)
Based on the field experiment in Inner Mongolia grassland, the effects of precipitation and nitrogen regulation on biomass, soil respiration, microbial activity and microbial community structure of soil microbes in grassland were studied.According to split plot design, the main area was precipitation (normal precipitation, increased precipitation 180 mm/a), split-plot was the amount of nitrogen application (0 kg/hm2, 50 kg/hm2, 100 kg/hm2, 150 kg/hm2). The results showed that the amount of soil microbial biomass carbon and nitrogen decreased with the increase of nitrogen application rate. When the amount of nitrogen application was 150 kg/hm2,the soil microbial biomass carbon and nitrogen was lowest in 105.23 mg/kg, 13.85 mg/kg,respectively. The increase in precipitation eased the downward trend, when the amount of nitrogen application was 150 kg/hm2,the value significantly incresed by 50.6%,59.4% respectively. With the increase of nitrogen application rate, the soil basal respiration and soil induced respiration decreased gradually, CAI, respiratory quotient gradually increased. When nitrogen application rate reached maximum, the value decreased by 30.95% and 98.02% and incresed by 73.63% and 63.74%,respectively. The indices were increased significantly after incresing precipitation, the soil basal respiration and the induced respiration increased significantly. With the increase of nitrogen application rate,the soil DHA,PRO,PME Acld and PME Alkaline were gradually decreased, while the increase of precipitation would increased the enzyme activity. When the amount of nitrogen application was 100,100,0 and 150 kg/hm2, the relative abundance of bacteria, fungi, arbuscular mycorrhizal fungi and anaerobic bacteria was highest, while the anaerobic bacteria and arbuscular mycorrhizal fungi decreased by 11.07%, increased by 20.59% respectively after increasing precipitation.
precipitation;nitrogen;soil microorganism;microbiological characteristics
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.02.023
2016-11-10;
2016-12-08
国家自然科学基金(No.41202175)
马玉亮(1991-),硕士研究生,研究领域生态学。E-mail:1210588511@qq.com
*通信作者:张建伟(ZHANG Jianwei),E-mail:drayonzjw@126.com
S154
A
0253-2395(2017)02-0380-08

