高迁移率蛋白 HmgB3和组蛋白Mlh1维持了四膜虫小核稳定性
乔菊霞,王伟
(山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
高迁移率蛋白 HmgB3和组蛋白Mlh1维持了四膜虫小核稳定性
乔菊霞,王伟*
(山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
高迁移率族蛋白(High Mobility Group protein,HMG)和组蛋白H1结合染色质 DNA,在维持染色质的高级结构、基因组基因表达调控以及DNA修复等方面发挥重要作用。嗜热四膜虫细胞含有一个体细胞系的大核和一个生殖系的小核,小核特异定位的高迁移率蛋白HmgB3或组蛋白Mlh1的缺失并未引起生长期细胞的异常表型。本研究通过同源重组的方法构建了HMGB3和MLH1的双敲除细胞突变株ΔHMGB3ΔMLH1。突变细胞在营养生长期能够正常增殖,但对甲基磺酸甲酯较为敏感。缺对PCR检测发现突变株中小核染色体有缺失现象,并且不能完成有性生殖。有性生殖过程中,减数分裂后的小核异常降解。结果表明高迁移率蛋白HmgB3和小核组蛋白Mlh1共同维持了四膜虫小核的稳定性,并可能具有功能上的冗余性。
嗜热四膜虫;高迁移率蛋白HmgB3;组蛋白Mlh1;小核稳定性
0 引言
真核生物细胞中染色质主要由DNA、组蛋白、非组蛋白以及少量的RNA构成,其中组蛋白家族和高迁移率蛋白(High Mobility Group protein,HMG)家族是两类最丰富和最重要的染色质组分。组蛋白H1和HMG蛋白在DNA复制、转录、修复、染色质重塑等方面发挥着重要的作用[1]。HMG蛋白不仅调控基因组功能,而且调节特定基因的表达[2]。组蛋白H1可以与核小体二分体附近的DNA 或者邻近的连接 DNA 结合,促进DNA缠绕在组蛋白八聚体上,保证核小体结构的稳定性[3]。HMG蛋白与组蛋白H1在染色体上有不同的分布,同时在核小体二分体附近占位重叠[4]。哺乳动物细胞中HMGB蛋白可以取代染色质上的组蛋白H1,竞争性结合特异的DNA位点,影响染色质结构,调节基因组转录活性[5]。
嗜热四膜虫(Tetrahymenathermophila)具有核的二态性:营养生长期转录活跃的多倍体大核(MAC)和营养生长期转录沉默的二倍体小核(MIC)。嗜热四膜虫HMG蛋白家族中的HmgB3(TTHERM-00155590)在生长期和饥饿期特异定位在小核上,有性生殖时期定位于减数分裂和有丝分裂有功能的小核上。然而敲除HMGB3之后,没有明显的细胞学缺陷[6]。小核特异的组蛋白基因MLH1(TTHERM-00471820)敲除后,嗜热四膜虫的小核增大,大核保持不变,但MLH1的缺失并不影响嗜热四膜虫的营养生长期小核有丝分裂以及细胞增殖[7]。HMG家族蛋白与组蛋白H1在维持染色质高级结构和表观遗传学调控方面相互影响,然而嗜热四膜虫Mlh1与HmgB3是否存在功能上的补偿,目前并不清楚。本研究首次获得HMGB3和MLH1的双敲除突变株,分析了组蛋白H1和高迁移率蛋白对四膜虫细胞核的稳定性和有性生殖发育的影响。
1 材料与方法
1.1 材料
嗜热四膜虫野生型细胞株B2086和CU428由美国康奈尔大学Peter J. Bruns博士惠赠。ΔHMGB3-5和ΔHMGB3-7突变体,pBsr由本实验室保存。氨苄青霉素、巴龙霉素(上海生工),链霉素、两性霉素、葡萄糖、DAPI(北京索莱宝科技有限公司)。pMD®18-T克隆试剂盒(TaKaRa公司)。限制性内切酶、T4 DNA连接酶和TaqDNA聚合酶(Thermo公司);胰蛋白胨、酵母提取物(英国OXOID公司)。引物合成(上海生工);质粒抽提试剂(北京天根生化公司),质粒回收试剂盒(OMEGA公司)。
1.2 四膜虫细胞培养
嗜热四膜虫于SPP 培养基 (质量浓度为1% 胰蛋白胨,0.2% 葡萄糖,0.1% 酵母提取物,0.003% EDTA铁盐)中30℃、170 r/min摇床培养[8]。两种不同交配型四膜虫生长至浓度为3.0~3.5×105cells/mL后,于10 mmol/L Tris(pH 7.4)中饥饿18~24 h。将浓度为2.5×105cells/mL的两种不同交配型四膜虫等量混合,30℃静置培养,细胞进行有性生殖[9]。
1.3MLH1和HMGB3基因的序列和表达分析
MLH1和HMGB3基因的DNA序列、mRNA序列和表达谱由四膜虫基因组数据库(http:∥www.ciliate.org)和四膜虫功能基因组数据库(http:∥tfgd.ihb.ac.cn)获得[10-11]。HmgB3和Mlh1的HMG-box氨基酸序列比对使用DNAMAN软件。
1.4 pBsr4-MLH1重组敲除载体的构建
以嗜热四膜虫基因组为模板,通过引物KO-MLH1-5-F(5’-TGAGCTCCTTTAGTTAAACTTACTGATTAAATTTTC-3’,下横线为SacI酶切点)/KO-MLH1-5-R(5’-TGCGGCCGCGCAAATCTTTCATAAGTATTGTCAAATC-3’,下划线为NotⅠ酶切位点)和KO-MLH1-3-F (5’-TCTCGAGGTTAATTAATTACAAAATAGTTGGATGG-3’,下划线为XhoⅠ酶切位点)/KO-MLH1-3-R(5’-TGGTACCGGCAAATATTATATCATAAAGCTTATCC-3’,下划线为KpnⅠ酶切位点)分别扩增MLH1基因的上游序列1 054 bp和下游序列571 bp,分别构建到pMD®18-T载体上,得到重组质粒pMD 18-T-5’和pMD 18-T-3’。限制性内切酶SacⅠ和NotⅠ分别酶切质粒pMD18-T-5’和pBsr并回收目的片段。目的片段用T4 DNA连接酶连接(16℃过夜),转化并筛选得到重组质粒pBsr-5’。限制性内切酶KpnⅠ和XhoⅠ分别酶切质粒pMD 18-T-3’和pBsr-5’,胶回收目的片段并连接转化,筛选得到重组质粒pBsr-MLH1(图 1B)。
1.5 基因枪转化以及突变株筛选
将构建成功的重组敲除载体质粒pBsr-MLH1用限制性内切酶SacⅠ和KpnⅠ酶切线性化,浓缩后浓度达到1~1.5 μg/μL。使用高压气体基因枪(GJ-1000,宁波新芝科技有限公司)将线性化质粒转化到不同交配型的已经敲除HMGB3基因的四膜虫细胞ΔHMGB3-5和ΔHMGB3-7。通过同源重组的方法(图1),利用杀稻瘟菌素梯度浓度筛选,PCR鉴定(鉴定引物为5’-CGCTTAATGCTGCAGCTTTTCCC-3’和5’-CATAATGGTGAATATTTGTTAAAATACC-3’),得到稳定的敲减突变株ΔHMGB3ΔMLH1-5和完全敲除突变株ΔHMGB3ΔMLH1-7(图 1C)。

A. 基因MLH1的敲除同源重组示意图。 B. 重组质粒pBsr-MLH1的鉴定。 M, DNA Marker。 1, pBsr-MLH1。 2,4: 以pBsr-MLH1为模板,分别以MLH1的3’ 和5’ 侧翼序列引物扩增的PCR产物。3,5: pBsr-MLH1的Xho Ⅰ/Kpn Ⅰ 和Sac Ⅰ/Not Ⅰ的双酶切产物。 C. 双敲除突变株ΔHMGB3ΔMLH1的鉴定。 M, DNA Marker。W, 野生型条带,大约2.4 kb。 箭头所指为重组条带,大约1.4 kbFig.1 Identification of ΔHMGB3ΔMLH1 mutants图1 双敲除突变株ΔHMGB3ΔMLH1的鉴定
1.6 小核染色体完整性检测
四膜虫五对小核染色体含有小核特异染色体断裂序列(chromosome breakage sequence,Cbs)。利用分别来自五对染色体的特异断裂片段侧翼序列引物,以基因组为模板,进行缺对PCR检测小核的完整性分析[12]。使用的引物分别来自染色体1L-4,2R-1,3L-2,4L-2,5-1。 反应条件为94℃,5 min,以及40个循环的变性94℃,30 s,退火50℃,30 s(引物Ⅱ[12]) 或者54℃,30 s (引物Ⅰ,Ⅲ,Ⅳ,和Ⅴ[12]), 延伸条件为68℃,2 min。 后延伸条件为68℃,10 min。
1.7 细胞核染色观察
将20 μL的10 ng/mL的DAPI加入样品,置于室温15 min,封片,使用Olympus激光共聚焦显微镜观察细胞有性生殖。
2 实验结果
2.1 嗜热四膜虫HMGB3和MLH1基因分析
四膜虫功能基因组数据库显示,MLH1在生长期有着较低的表达量,在有性生殖时期有着较高的表达量,有性生殖6 h达到最大值(图2A)。HMGB3在生长期有较低的表达量,有性生殖时期有着较高的表达量,有性生殖2~4 h达到最大值(图 2B)。MLH1和HMGB3具有相似的表达图谱且在有性生殖过程中表达显著上调。Mlh1和HmgB3的HMG-box有着35%的一致性(图2C),且HmgB3和Mlh1有着相似的氨基酸电荷性分布特征[6],暗示两个基因可能具有功能上的冗余性。
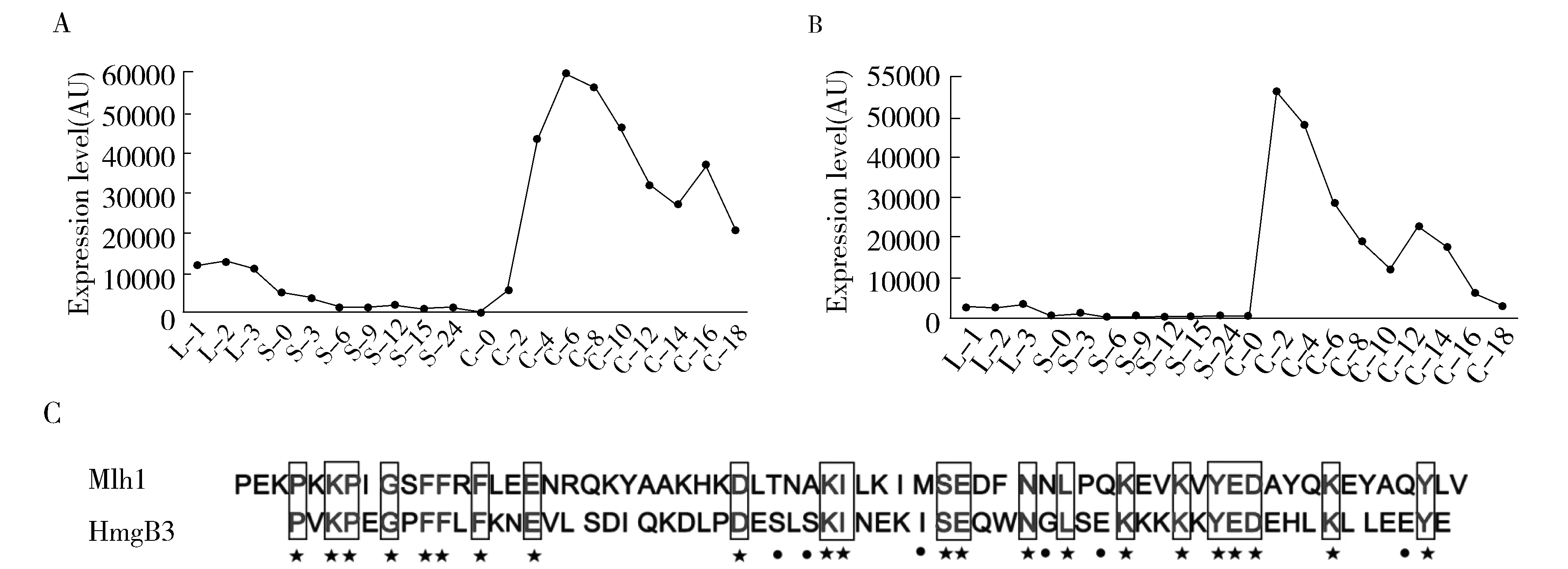
A.MLH1基因的微阵列表达谱。B.HMGB3基因的微阵列表达谱。图A和图B均引自四膜虫功能基因组数据库(http:∥tfgd.ihb.ac.cn)。L-1,L-2,L-3分别表示营养生长期细胞浓度为1×105 cells/mL,3.5×105 cells/mL和1×106 cells/mL;S0-S24表示饥饿期0-24 h的细胞;C0-C24表示有性生殖时期0-24 h的细胞。 C. Mlh1和HmgB3的HMG-box氨基酸序列比对,方框中表示比对一致的氨基酸,使用的软件为DNAMAN。Fig.2 Sequence analysis of MLH1 and HMGB3图2 MLH1和HMGB3基因序列分析
2.2 双敲除细胞株在甲基磺酸甲酯的胁迫下生长受到抑制
甲基磺酸甲酯(methylmercuric sulfate,MMS)是一种单功能烷化剂,修饰后的DNA分子将产生一些非编码碱基,如3-甲基腺嘌呤和7-甲基鸟嘌呤,从而引起碱基错配、暂停或阻断DNA复制,进而造成DNA损伤。HMG蛋白和组蛋白H1均可以参与DNA损伤修复。先前的研究表明敲除MLH1之后,发现突变株和野生型相比没有明显区别。双敲除细胞株ΔHMGB3ΔMLH1和野生型细胞株生长速率没有明显的区别(图3A)。但是双敲除细胞株较野生型细胞株对甲基磺酸甲酯(MMS)敏感(图3B),表明HmgB3与Mlh1缺失的细胞对外源胁迫更为敏感,可能直接参与了染色质的修复过程。
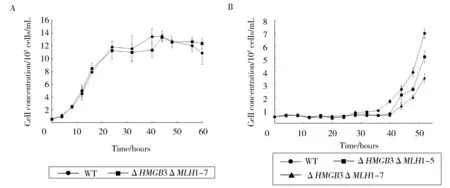
A.野生型四膜虫和双敲除突变株ΔHMGB3ΔMLH1-7的生长曲线。 B.野生型四膜虫和双敲除突变株ΔHMGB3ΔMLH1-5/7在2 mM MMS药物处理下的生长曲线。 四膜虫均于30℃条件下静置培养, 每隔4 h取样计数细胞浓度。 每个样均有3次重复, 试验数据为三组数据的平均值±标准偏差。Fig.3 Prolifiration of T. thermophila during vegetative growing stage图3 嗜热四膜虫细胞在营养生长期的增殖
2.3 双敲除突变体导致小核染色体缺失
双敲除突变株对MMS更为敏感,我们进一步分析了突变株小核基因组DNA的完整性。利用分别来自小核五对染色体的五对特异的断裂片段侧翼序列引物,进行五对染色体的缺对PCR检测,发现完全敲除细胞株ΔHMGB3ΔMLH1-7的5条染色体均有缺失(图4A),而敲减细胞株ΔHMGB3ΔMLH1-5的第3对染色体有缺失(图4B)。

A. 分别以四膜虫5条染色体的5对引物, 野生型四膜虫和双敲除突变株ΔHMGB3ΔMLH1-7的基因组为模板,PCR扩增的产物。 Ⅰ,Ⅱ,Ⅱ,Ⅳ,Ⅴ分别对应五条不同的染色体;B. 分别以四膜虫5条染色体的5对引物,野生型四膜虫和双敲除突变株ΔHMGB3ΔMLH1-5的基因组为模板,PCR扩增的产物。 Ⅰ,Ⅱ,Ⅱ,Ⅳ,Ⅴ分别对应五条不同的染色体。Fig.4 Loss of micronuclear chromosome in ΔHMGB3ΔMLH1图4 ΔHMGB3ΔMLH1突变体中小核染色体的缺失
2.4 ΔHMGB3ΔMLH1突变细胞株进行异常的有性生殖
将双敲除突变株ΔHMGB3ΔMLH1-7和双敲减突变株ΔHMGB3ΔMLH1-5饥饿20 h等数量混合,进行有性生殖。DAPI染色后,发现野生型细胞株配对后,经过两次减数分裂形成配子核(图5c),配子核进行有丝分裂(图5d)以及交换融合后形成合子核,合子核进行两次有丝分裂,分化发育形成2个新大核和2个新小核(图5f)。突变株配对细胞中有一个细胞在配对形成时期的小核(图5h)和Crescent时期(图5i) DNA着色较浅,之后不能进行正常的减数分裂(图5j and 5k);另一个突变株进行正常的减数分裂 (图5j) 和合子核前有丝分裂 (图5k),但是之后由于单倍体配子核不能和另一个细胞的配子进行融合,导致配子降解 (图5l)。最终细胞发育为只有大核的异常细胞 (图5m,5n)。

a,h:配对细胞形成; b,i:Crescent时期,突变株细胞中一个小核DNA着色较弱;c,j:减数第二次分裂; d,k:单倍体配子进行有丝分裂;e:合子核第二次有丝分裂;l:突变株中配子开始降解; f:anlagen时期;m,只有旧大核的配对细胞;g:2个大核和1个小核的细胞;n,只有一个旧大核的异常细胞。标尺,10 μmFig.5 Abnormal micronuclear development of ΔHMGB3ΔMLH1 cells图5 ΔHMGB3ΔMLH1突变株的异常小核发育
3 讨论
组蛋白H1和HMG蛋白在调节染色质结构和功能方面都起着重要的作用。组蛋白H1进化上存在多种变体,但多数H1含有三个结构域:中间保守的球形结构域,较短的N端结构域以及较长的C端结构域[13-14]。四膜虫Mlh1不同于多细胞真核生物的H1,包含有一个HMG-box,且在不同的发育阶段存在水解过程[15]。哺乳动物细胞内HMGB蛋白含有两个HMG-box,植物细胞内HMGB蛋白含有1个HMG-box[16]。四膜虫HmgB3含有一个HMG-box。四膜虫细胞内HmgB3和Mlh1蛋白N端的HMG-box有着35 %的一致性,两个蛋白都没有半胱氨酸,含有几乎相同数目的带同种电荷的氨基酸和相同数目的疏水性氨基酸[6]。HMGB3和MLH1在四膜虫细胞内有着相似的表达图谱,而且具有保守的HMG-box结构,它们在四膜虫细胞中可能存在相互作用或功能的冗余性。
先前我们的研究发现嗜热四膜虫HMGB3的敲除细胞株没有明显的细胞学缺陷,然而HMGB3的过表达细胞株不能产生后代[6]。敲除四膜虫小核组蛋白基因MLH1,发现小核变大,但并不影响四膜虫的营养生长[7]。我们在构建了HMGB3和MLH1的双敲除突变株后,发现突变株的小核染色体会有丢失现象,而且完全敲除突变株比敲减突变株的小核受损严重。嗜热四膜虫小核的缺损对其营养生长的影响并不显著,然而MMS的胁迫影响了突变体细胞株的生长。先前我们的研究结果表明HmgB3在生长、饥饿和有性生殖时期特异定位在小核,因此我们推测在MMS胁迫下,HmgB3和组蛋白H1的功能可能会发生改变,从而参与大核的损伤修复。组蛋白H1可以在DNA损伤之后,起始和扩大泛素化信号,它的泛素化标记为RNF168提供结合位点,进而招募修复因子到DNA双链断裂位点进行DNA损伤修复[17]。在 DT40 细胞中,HMGNs 在紫外照射引起的DNA损伤修复和维持基因组完整性方面发挥着一定的作用[18]。HMGB1/2对化学药物顺铂造成的损伤的DNA有着较高的亲和性[19]。四膜虫HmgB3在生长期和饥饿期特异定位在小核,敲除突变体在有性生殖时期没有明显的细胞学缺陷,而双敲除突变株对MMS敏感性升高。哺乳动物细胞中HMGB蛋白可以取代染色体上的组蛋白H1或者通过和H1相互作用调节DNA的结构[5]。Mlh1的缺失会造成四膜虫小核染色质的松散[7],但不影响细胞在营养生长期的有丝分裂。HmgB3和Mlh1的同时缺失影响了有性生殖的进程。在小核减数分裂时期,突变细胞株小核DNA着色很浅,随着减数分裂的进行,小核降解。我们推测HmgB3和Mlh1的缺失使得染色质的高级结构不能维持,DNA复制和修复异常导致有性生殖异常。 HmgB3和Mlh1在四膜虫中可能存在功能的冗余性或者存在相互调节,它们共同参与维持了染色质的高级结构。真核生物组蛋白H1和高迁移蛋白的相互作用及对染色质的分子调控机制需进一步深入研究。
[1] Bustin M.Revised Nomenclature for High Mobility Group (HMG) Chromosomal Proteins[J].TrendsinBiochemicalSciences,2001,26(3):152-315.
[2] Bianchi M E,Agresti A.HMG Proteins:Dynamic Players in Gene Regulation and Differentiation[J].CurrentOpinioninGenetics&Development,2005,15(5):496-506.DOI:10.1016/j.gde.2005.08.007
[3] Zhou B R,Jiang J,Feng H,etal.Structural Mechanisms of Nucleosome Recognition by Linker Histones[J].MolCell,2015,59(4):628-638.DOI:10.1016/j.molcel.2015.06.025.
[4] Alfonso P J,Crippa M P,Hayes J J,etal.The Footprint of Chromosomal Proteins HMG-14 and HMG-17 on Chromatin Subunits[J].JournalofMolecularBiology,1994,236(1):189-198.DOI:10.1006/jmbi.1994.1128.
[5] Polanska E,Pospisilova S,Stros M.Binding of Histone H1 to DNA is Differentially Modulated by Redox State of HMGB1[J].PlosOne,2014,9(2).DOI:10.1371/journal.pone.0092633.
[6] Xu J,Tian H,Liu X,etal.Localization and Functional Analysis of HmgB3p,a Novel Protein Containing High-mobility-group-box Domain fromTetrahymenathermophila[J].Gene,2013,526(2):87-95.DOI:10.1016/j.gene.2013.05.006.
[7] Shen X,Yu L,Weir J W,etal.Linker Histones are Not Essential and Affect Chromatin Condensation in Vivo[J].Cell,1995,82(1):47-56.
[8] Gorovsky M A,Yao M C,Keevert J B,etal.Isolation of Micro-and Macronuclei ofTetrahymenapyriformis[J].MethodsinCellBiology,1975,9(0):311-327.
[9] 张理光,王清路,朱雅静,等.四膜虫有性生殖过程中特异表达基因TCD3的序列分析[J].山西大学学报:自然科学版,2011,34(2):301-306.
[10] Eisen J A,Coyne R S,Wu M,etal.Macronuclear Genome Sequence of the CiliateTetrahymenathermophila,a Model Eukaryote[J].PLoSbiology,2006,4(9):e286.DOI:10.1371/journal.pbio.0040286.
[11] Miao W,Xiong J,Bowen J,etal.Microarray Analyses of Gene Expression During theTetrahymenathermophilaLife Cycle[J].PLoSOne,2009,4(2):e4429.DOI:10.1371/journal.pone.0004429.
[12] Hamilton E,Bruns P,Lin C,etal.Genome-wide Characterization ofTetrahymenathermophilaChromosome Breakage Sites. Ⅰ. Cloning and Identification of Functional Sites[J].Genetics,2005,170(4):1611-1621.DOI:10.1534/genetics.104.031401.
[13] Bednar J,Hamiche A,Dimitrov S.H1-nucleosome Interactions and Their Functional Implications[J].BiochimicaetBiophysicaActa,2016,1859(3):436-443.DOI:10.1016/j.bbagrm.2015.10.012.
[14] Kowalski A,Palyga J.Modulation of Chromatin Function Through Linker Histone H1 Variants[J].BiologyoftheCell/undertheAuspicesoftheEuropeanCellBiologyOrganization,2016,108(12):339-356.DOI:10.1111/boc. 201600007.
[15] Wu M,Allis C D,Sweet M T,etal.Four Distinct and Unusual Linker Proteins in a Mitotically Dividing Nucleus are Derived from a 71-kilodalton Polyprotein,Lack p34cdc2 Sites, and Contain Protein Kinase A Sites[J].MolecularandCellularBiology,1994,14(1):10-20.
[16] Grasser K D,Launholt D,Grasser M.High Mobility Group Proteins of the Plant HMGB Family:Dynamic Chromatin Modulators[J].BiochimicaetBiophysicaActa,2007,1769(5-6):346-357.DOI:10.1016/j.bbaexp. 2006.12.004.
[17] Thorslund T,Ripplinger A,Hoffmann S,etal.Histone H1 Couples Initiation and Amplification of Ubiquitin Signalling After DNA Damage[J].Nature,2015,527(7578):389-393.DOI:10.1038/nature15401.
[18] Subramanian M,Gonzalez R W,Patil H,etal.The Nucleosome-binding Protein HMGN2 Modulates Global Genome Repair[J].TheFEBSJournal,2009,276(22):6646-6657.DOI:10.1111/j. 1742-4658.2009.07375.x
[19] Pil P M,Lippard S J.Specific Binding of Chromosomal Protein HMG1 to DNA Damaged by the Anticancer Drug Cisplatin[J].Science,1992,256(5054):234-237.
High Mobility Group Protein HmgB3 and Linker Histone Mlh1 Maintain Micronuclear Stability inTetrahymenathermophila
QIAO Juxia,WANG Wei*
(Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education,Institute of Biotechnology,Shanxi University,Taiyuan 030006,China)
High mobility group protein (HMG) and linker histone H1 bind to linker DNA in chromatin and play important roles in establishing chromatin higher structure, regulating gene transcription and DNA repair.Tetrahymenathermophilacontains one somatic macronucleus (MAC) and one germ line micronucleus (MIC), disruption of micronuclear specific HmgB3 or Mlh1 has no significant cytological defects during vegetative growing stage.HMGB3 andMLH1 double knockout strains were constructed by homologous recombination.ΔHMGB3ΔMLH1 mutants normally proliferate during vegetative growing stage, but are sensitive to methylmercuric sulfate treatment. Loss of micronuclear chromosomes was found in ΔHMGB3ΔMLH1 mutants by the nullisomic-based PCR. Furthermore, abnormal conjugation progress and degradation of micronuclei occurred in ΔHMGB3ΔMLH1 mutants.The results show that HmgB3 and Mlh1 were required for micronuclear stability and could had redundant function inT.thermophila.
Tetrahymenathermophila;high mobility group protein (HmgB3);histone H1 (Mlh1);micronuclear stability
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.02.025
2017-02-26;
2017-03-20
国家自然科学基金(31471999);山西省自然科学基金 (2015011078);山西省回国留学人员科研资助项目(2015008)
乔菊霞(1991-),女,硕士研究生,研究方向为细胞分子生物学。
*通信作者:王伟(WANG Wei),E-mail:gene@sxu.edu.cn
Q75
A
0253-2395(2017)02-0358-07

