土壤芽孢杆菌产胞外聚合物对Pb2+吸附特性研究
洪 晨,李益飞,司艳晓,邢 奕,4*,王志强,张莹莹(.北京科技大学能源与环境工程学院,北京0008;2.中国科学院生态环境研究中心,北京 00085;.清华大学环境学院,北京 00084;4.北京科技大学工业典型污染物资源化处理北京市重点实验室,北京 0008)
土壤芽孢杆菌产胞外聚合物对Pb2+吸附特性研究
洪 晨1,2,李益飞1,司艳晓3,邢 奕1,4*,王志强1,张莹莹1(1.北京科技大学能源与环境工程学院,北京100083;2.中国科学院生态环境研究中心,北京 100085;3.清华大学环境学院,北京 100084;4.北京科技大学工业典型污染物资源化处理北京市重点实验室,北京 100083)
根据与细菌菌体结合的紧密程度,胞外聚合物(EPS)可以分为粘液层EPS(S-EPS)、松散附着EPS(LB-EPS)、紧密附着EPS(TB-EPS),以土壤芽孢杆菌作为实验菌株,研究了各层EPS在不同温度、pH值条件下对Pb2+的吸附特性,建立了EPS的吸附动力学模型和吸附等温线模型,并采用扫描电子显微镜(SEM)观察各层EPS吸附Pb2+前后的表观形态的变化.当吸附温度为35℃、pH值为5.5时,S-EPS、LB-EPS、TB-EPS对Pb2+的吸附量分别为91.35、100.61和90.28mg/g,表明LB-EPS对Pb2+的吸附能力更强.各层EPS吸附Pb2+的吸附动力学模型和吸附等温线模型均符合准二级动力学模型和Langmuir等温吸附模型,表明吸附过程分别受化学吸附机理控制和单分子层吸附控制,并通过Langmuir模型计算得到,S-EPS、LB-EPS、TB-EPS对Pb2+的最大吸附量分别为124.224、127.389和119.760mg/g.同时,扫描电镜结果表明吸附前后各层EPS表观形态均差异明显,其中LB-EPS呈肺泡状,具有更大的比表面积,因此更多的Pb2+吸附在其表面.
EPS;吸附;Pb2+;动力学;SEM
我国是矿产资源大国,但长期以来由于资金与管理等原因,在矿山勘探、开采、选矿及矿物加工等矿区活动对周围的环境,尤其是土壤,造成了严重影响[1-3].重金属污染[4-5]是矿区环境的主要污染问题之一,重金属在环境中具有相对稳定性,很难从环境中彻底清除.
重金属污染的生物修复技术一直是国内外研究的热点[6-9].微生物修复法作为一种新兴的处理技术,在处理低浓度重金属污染废水方面,有着广阔的应用前景[10-11].Guibaud等[12]从活性污泥中提取的胞外聚合物,并采用SMDE极谱法测量了胞外聚合物与金属的络合电位,结果表明,SMDE极谱法能够有效测定溶液中游离态金属的含量.Tunali等[13]研究了葡萄孢菌菌体对Zn2+的吸附效果,发现物理化学预处理方法均能够有效提高葡萄孢菌菌体吸附Zn2+的性能.Mesa等[14]发现植物根际部分的细菌对多种重金属具有抗性,并且这些细菌能够有效地促进植物的生长.Oves等[15]从工业污水灌溉的土壤中分离出苏云金芽孢杆菌菌株,发现其对镉、铬、铜、铅和镍等金属离子均具有显著的吸附作用.Guibaud等[16]在研究中发现从活性污泥中提取的胞外聚合物(EPS)对于金属有很强的结合能力,这种能力有助于保护细胞不受到重金属活性污泥中金属成分的有害影响.
微生物菌体生长过程中,随着新陈代谢的进行在菌体表面会产生主要由多糖、蛋白质、核酸、腐殖质等物质组合团聚而成的大分子聚合物[17-19],即胞外聚合物(EPS).根据 EPS与微生物菌体结合的紧密程度,EPS分为三类:粘液层EPS(S-EPS),松散附着 EPS(LB-EPS),紧密附着EPS(TB-EPS).随着生物修复技术研究的发展,EPS在生物修复中的作用也日益受到人们的重视.很多研究表明EPS对重金属离子具有吸附效果,Pe´rez等[20]研究了杰米拉类芽孢杆菌的EPS,发现EPS能够有效地吸附Pb2+.Wei等[21]研究好氧污泥中 EPS对 Zn(II)的吸附过程,发现EPS中的蛋白质在络合 Zn(II)中发挥了重要作用.Ye等[22]从节杆菌中提取EPS,研究了EPS对Cu2+,Pb2+,Cr6+等金属离子的吸附效果,结果表明EPS能够有效地去除废水中的重金属离子.已有的研究在 EPS修复重金属土壤方面已经做了大量的工作,但在不同层组EPS吸附重金属机理方面的研究还较少.
本文从铅锌矿土壤中提取的抗铅微生物,研究培养条件对 EPS产量的影响,分析不同层组EPS对 Pb2+的吸附效果.通过吸附动力学模型、吸附等温线模型、扫描电镜分析明确不同层组EPS吸附 Pb2+的作用机理.以期对于 EPS吸附Pb2+的过程分析提供一定的实验和理论依据.
1 材料与方法
1.1 样品采集及处理
1.1.1 微生物 土壤芽孢杆菌提取自江西上饶德兴银山的某铅锌矿区内的土壤,是通过对土壤中微生物进行抗铅的筛选及纯化,得到具有抗铅性的优化菌种.
1.1.2 EPS提取 (1)菌种在发酵培养基(1000mL)中培养1~3d,取400mL在5000r/min条件下离心10min,收获细胞.
(2) 将上清液在再生纤维素(RC)透析袋内透析得到 S-EPS,转移并保存(-20 ).℃ 试验重复3次.
(3) 将步骤(1)中沉淀物溶解至超纯水中至40mL并在40W下超声处理1min,再将悬浮液在7000r/min下离心20min.透析得到为LB-EPS溶液,转移并保存.
(4) 将步骤(3)中沉淀物溶解至超纯水中至原体积(10mL),在15000r/min下离心20min.透析得到TB-EPS,转移并保存.将3个层组的EPS溶液冷冻干燥,制得EPS固体,置于-20℃保存.
1.2 EPS吸附Pb2+试验
向 Pb2+水溶液中分别加入 EPS,进行如下 4组实验:(1)温度对吸附量的影响实验,Pb2+浓度为150mg/L,EPS投加量为1g/L,pH值为5.5,温度为25~40 ;(2)pH℃ 值对吸附量的影响实验,Pb2+浓度为150mg/L,EPS投加量为1g/L,温度为35 ,pH℃ 值为3~7;(3)吸附时间对Pb2+吸附量的影响实验,Pb2+浓度为 150mg/L,EPS投加量为1g/L,pH 值为 5.5,温度为 35 ;(4)℃ 平衡浓度对Pb2+吸附量的影响实验,Pb2+浓度为 50mg/L~500mg/L, EPS投加量为1g/L,35℃ , pH 5.5.在恒温空气浴振荡培养箱(一恒科学仪器有限公司,DHP-9052,中国)中振荡吸附 120min,将吸附后的溶液通过 0.22µm 的微孔滤膜进行过滤,分离出上清液和吸附后的EPS样品.采用电感耦合等离子体发射光谱仪(ICP-OES)(Varian,720-ES,美国)测定上清液中剩余Pb2+的浓度,计算Pb2+吸附量.
Pb2+吸附量如式(1)
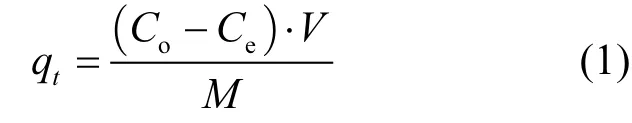
式中:qt为吸附量(mg/g);Co为铅离子初始浓度(mg/L);Ce为铅离子最终浓度(mg/L);V为反应液的体积,L;M为EPS的质量,g.
1.3 SEM测定
分别准确称取两份各层胞外聚合物 0.1g,其中一份并加入到100mL、150mg/L的硝酸铅溶液中,调节pH值5.5,置于35℃空气浴震荡培养箱中震荡吸附 2小时后取出,将吸附后的溶液通过0.22µm的微孔滤膜进行过滤,分离出上清液和吸附后的EPS样品.再经①漂洗(生理盐水);②前固定(2,5%戊二醇,4℃冰箱 2h);③漂洗(磷酸缓冲液,5次,每次7min);④后固定(1%锇酸2h);⑤漂洗(磷酸缓冲液,5次,每次7min);⑥梯度脱水(50%、70%、85%、95%、100%乙醇各一次,每次15min);⑦浸透;⑧纯包埋液过夜处理,将制备好的固定样品送去进行 SEM 检测[23].采用生物扫描电子显微镜(SEM)(卡尔蔡司,ZeissEVO-18,德国)对吸附前后的各层EPS样品进行观察.
2 结果与分析
2.1 EPS产生量分析
培养温度与pH值是影响微生物生长存活的重要因素,也同样影响各层EPS的产量[22,24-26],如图1所示.在适宜的条件下,微生物生长迅速,产生的 EPS的量更多.当温度为 35℃、pH值为 5.5时,S-EPS、LB-EPS、TB-EPS产量均达到最高分别为 762.10mg/L,161.12mg/L,28.61mg/L.三层EPS的所占比例差别明显,S-EPS比例最高(80.06%)、LB-EPS次之(16.93%)、TB-EPS比例最低(3.01%),Hou等[30]的研究也表明 S-EPS、LB-EPS在EPS总量中占主导.
EPS具有抵抗干燥,抵御捕食者以及躲避紫外线等作用,因此EPS大多数以鞘状,胶囊状或粘液状的形式留在细胞表面来隔离或固定营养物质与金属离子,减少外界环境的不利影响.环境温度在25-35℃或pH值在4.0~5.5范围内,温度较低或 pH值较低时,抑制了细胞内酶的活性,使得EPS产量较低,随着温度或pH值的升高,细胞为了适应环境而使得EPS产量逐渐增大.在温度为35~40℃或pH值为5.5~6.0时,EPS产量下降.这是因为环境条件逐渐适于细胞生长,使得细胞将营养物质用于其他代谢物质的合成,许多研究也有类似的结果[27-30].
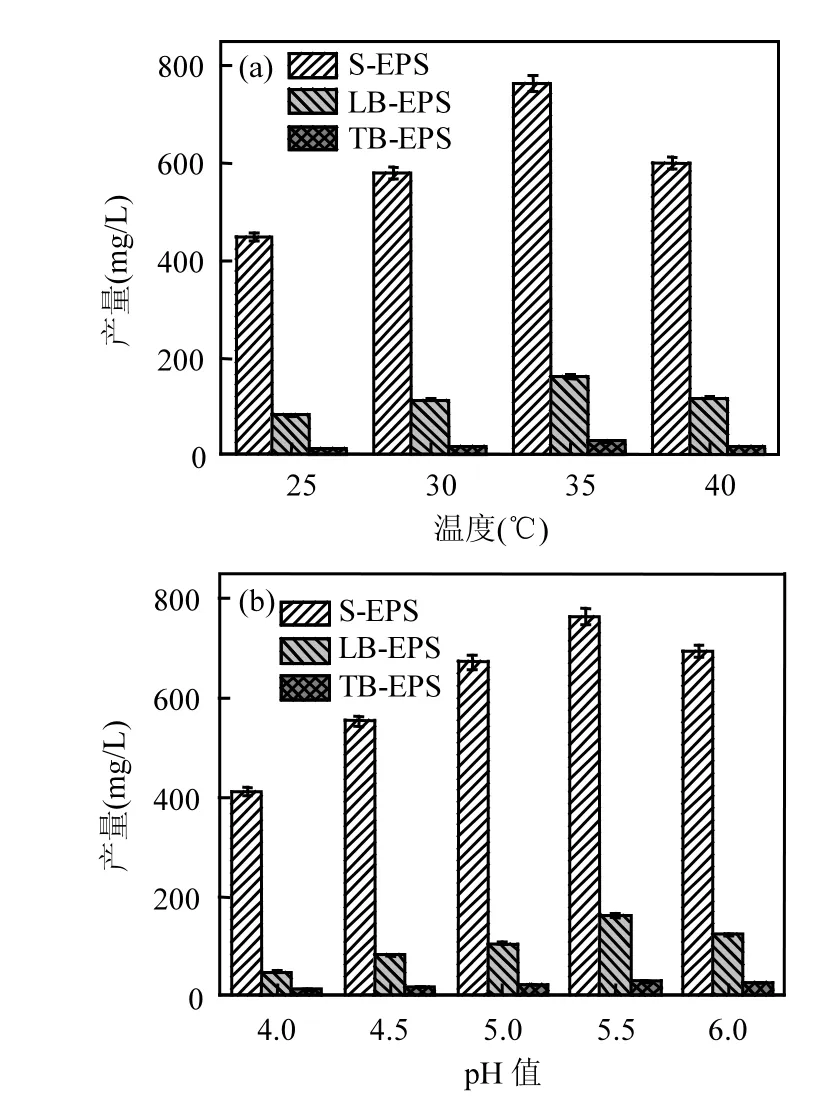
图1 EPS产生量(a)温度影响(培养时间30h,温度25~40℃),pH5.5;pH值影响(培养时间30h,温度35℃,pH 4~6)Fig.1 Effect of (a) temperature (cultivate time 30h, temperature 25~40℃), (b)pH on yield of EPS (cultivate time 30h, temperature 35℃, pH 4~6)
2.2 EPS吸附Pb2+
S-EPS、LB-EPS、TB-EPS在不同温度、pH值条件下对Pb2+的吸附效果如图2所示.随着温度的升高,EPS对铅离子的吸附量先增大后减小,如图2(a)所示.总体而言,各层EPS吸附Pb2+的量随温度升高的变化较小,这可能是由于在 25~40℃范围内,吸附温度对各层 EPS的官能团种类、数量和性质的影响较小.

图2 吸附温度和pH对EPS吸附Pb2+效果的影响Fig.2 Effect of temperature and pH on adsorption of Pb2+
pH值对EPS吸附Pb2+的效果有明显影响,随着pH值(3~5.5)升高,各层EPS对Pb2+的吸附量显著升高,如图2(b)所示.这是由于溶液pH值升高过程中,EPS的表面电荷和官能团也会发生一定的改变[31-32].EPS中蛋白质、多糖等有机物逐渐去质子化并且带负电,形成-NH-,-COO-, -O-等官能团[33].这些官能团易与Pb2+络合,从而增加吸附量.同时,随着吸附过程中 PbOH+含量的逐渐增加,促进络合作用会进一步增强.当 pH值(5.5~7)继续升高,Pb2+会与(OH)2+结合,发生羟基化反应并形成络合物[34].这些络合物在形成过程中会与 EPS中的活性位点发生竞争,从而降低EPS的吸附能力,使得EPS对Pb2+的吸附量下降[35].温度为 35℃的条件下,S-EPS、LBEPS、TB-EPS对Pb2+的吸附量在pH=5.5时达到最大,分别为 91.35mg/g、100.61mg/g、90.28mg/g.
2.3 EPS吸附动力学
随着吸附时间的增加,EPS对 Pb2+的吸附量总体呈现出逐渐增大的变化趋势.在80min时达到吸附平衡,如图3所示.
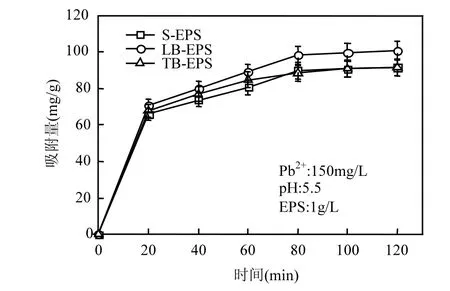
图3 吸附时间对Pb2+吸附量的影响Fig.3 Effect of time on adsorption of Pb2+
采用准一级和准二级模型对 S-EPS、LB-EPS、TB-EPS的吸附动力学进行研究,吸附动力学表达式如式(2)、(3)[34]:
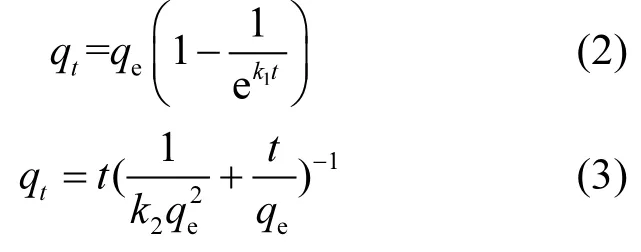
式中:qe(mg/g)和qt(mg/g)是关于平衡和接触时间t (min)的金属离子吸附量,qe,cal(mg/g)是计算得到的平衡吸附量,qe,exp(mg/g)是实验得到的平衡吸附量.K1和K2是准一级和准二级比例常数.
将S-EPS、LB-EPS、TB-EPS吸附Pb2+的实验结果按照上述方程分别进行线性回归运算,得到准一级和准二级动力学模型相关参数[36],结果如表1所示.表1中k1由图4(a)中ln(qe-qt)与t经线性拟合得到,k2分别由图4(b)中t/qt与t经线性拟合得到.根据表 1中的相关性系数(R2)可知,准二级模型可以更好地描述吸附过程(R2>0.99),如图 4(c)所示.S-EPS、LB-EPS、TB-EPS吸附量的计算值与实验结果的吻合度较好(S-EPS、LB-EPS吸附量误差<14%,TB-EPS吸附量误差<10%).EPS吸附 Pb2+符合准二级动力学模型,表明在吸附过程中EPS和Pb2+之间的吸附速率是受化学吸附机理控制的,吸附行为是通过EPS与Pb2+共享电子来完成的.

图4 吸附动力学分析Fig.4 kinetics fit of Pb2+adsorption

表1 EPS对Pb2+的吸附动力学参数Table 1 Kinetic parameters for adsorption of Pb2+by EPS
2.4 EPS吸附等温线
随着Pb2+平衡浓度增加,EPS对Pb2+的吸附量呈现出增大的趋势. Pb2+平衡浓度在0-60mg/L范围内,吸附量快速提高;当 Pb2+平衡浓度>60mg/L,各层 EPS的吸附量增长变缓.Pb2+平衡浓 度 为 140.26mg/L(S-EPS),134.09mg/L(LBEPS), 147.71mg/L(TB-EPS)时,三层EPS吸附量达到最大,分别为 103.74mg/g, 111.91mg/g, 106.29mg/g, 如图5所示.
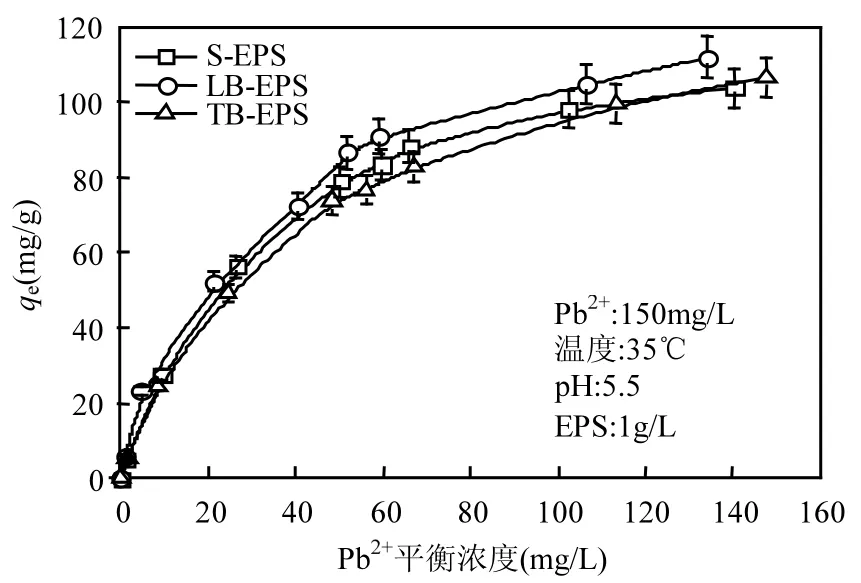
图5 平衡浓度对Pb2+吸附量的影响Fig.5 Effect of equilibrium concentration on adsorption of Pb2+
EPS对 Pb2+的吸附是一个动态平衡过程,为了探讨 EPS吸附过程的规律,采用经典的Langmuir,Freundlich和Temkin模型对吸附等温结果进行分析.Langmuir模型[37-38]假设吸附的发生是通过吸附剂表面的单分子层来实现的,并且没有吸附质间的相互作用[34],如式(4):
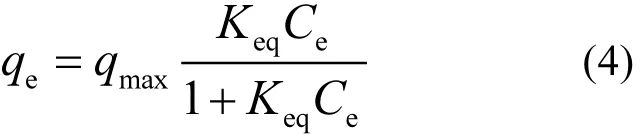
式中:Ce(mg/L)是达到吸附平衡时的Pb2+浓度; qe(mg/g)是吸附量;qmax(mg/g)是最大吸附量, Keq(L/mg)是Langmuir常数与吸附自由能相关[39].
Freundlich模型假设在吸附剂的不均匀表面上发生多分子层吸附[40],如式(5)
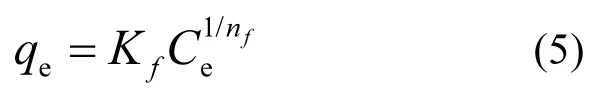
式中:Kf[mg/g·(L·mg)1/n]是 Freundlich常数表示吸附质的吸附量,nf是不均匀因素,该因素表明了吸附剂的吸附强度.
Temkin模型考虑了吸附质间的相互作用,如式(6)
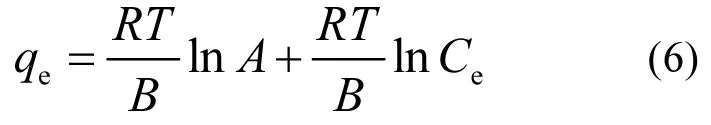
式中:A(L/g)和B(J/mol)是Temkin常数,R是理想气体常数8.314J/(mol·K);T(K)是绝对温度.
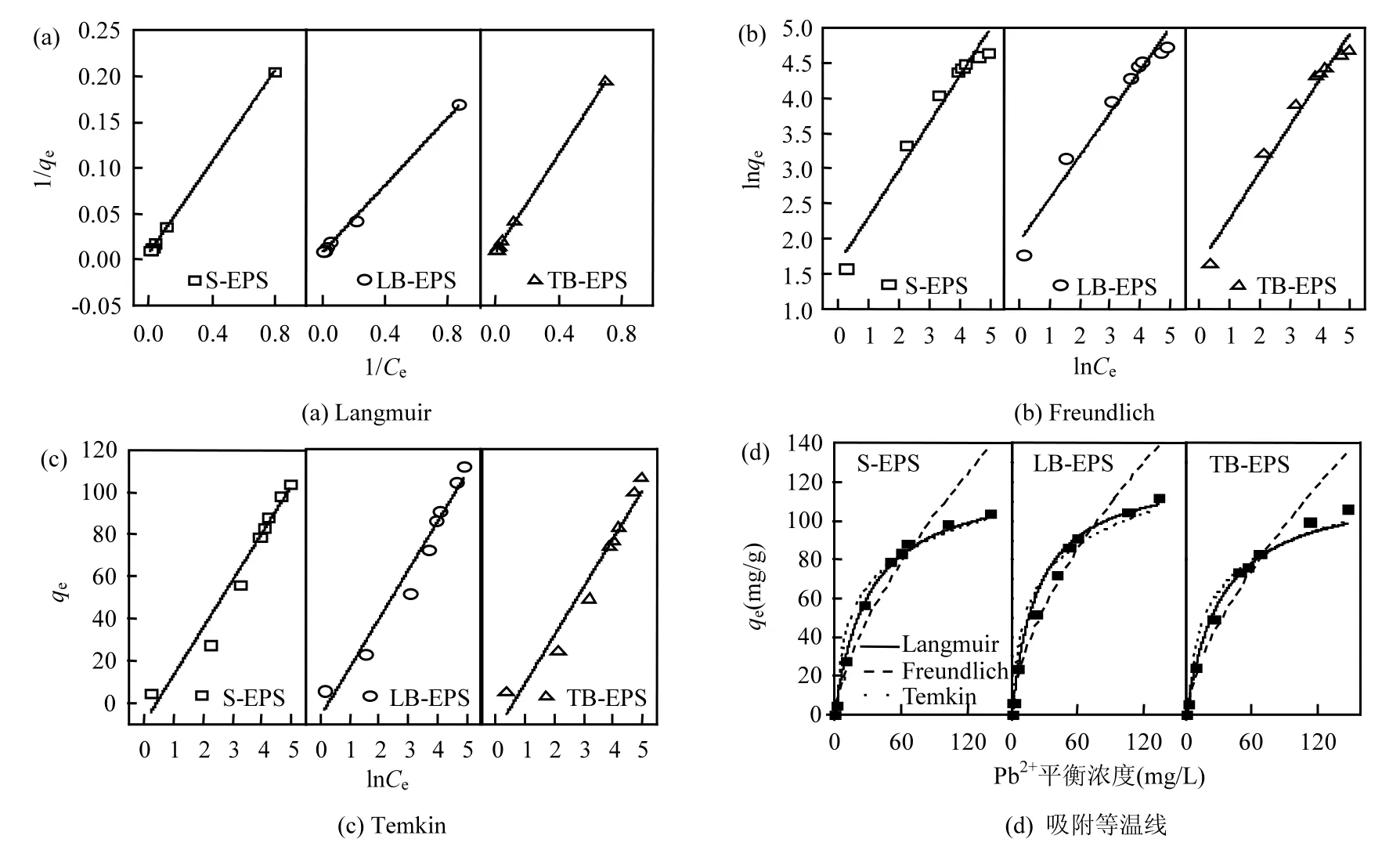
图6 吸附等温线分析Fig. 6 Isotherm for adsorption of Pb2+
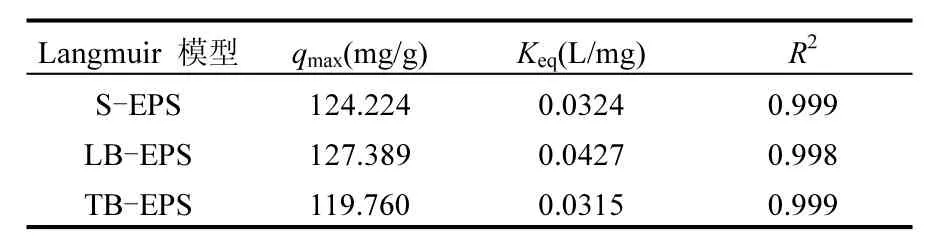
表2 EPS吸附Pb2+的Langmuir等温吸附模型参数Table 2 Langmuir model Isotherm parameters for adsorption of Pb2+by EPS
吸附等温线参数如表2~表4所示,相应的吸附等温线模型如图6所示.表2中keq值由图6(a)中1/qe与1/ce经线性拟合得到,表3中kf值由图6(b)中lnqe与lnce经线性拟合得到,表4中A值与B值由图6(c)中qe与lnce经线性拟合得到.从图 6(d)比较可知,EPS 对 Pb2+的吸附符合Langmuir吸附模型,其中 S-EPS、LB-EPS、TB-EPS的Langmuir吸附模型的相关性系数如表2、表3、表4所示,R2分别为0.999、0.998、0.999.吸附等温线结果表明,S-EPS、LB-EPS、TB-EPS对 Pb2+的吸附作用均为单分子层吸附,即吸附只发生在EPS的外表面,相关研究也得出类似的结论[41].通过 Langmuir模型计算得到,S-EPS、LB-EPS、TB-EPS对Pb2+的最大吸附量分别为124.224, 127.389和119.760mg/g.
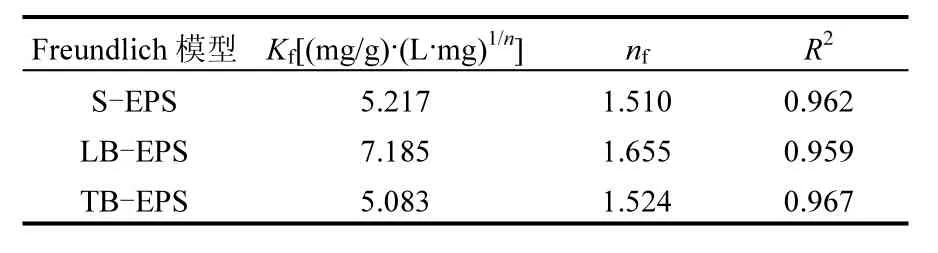
表3 EPS吸附Pb2+的Freundlich等温吸附模型参数Table 3 Freundlich model Isotherm parameters for adsorption of Pb2+by EPS
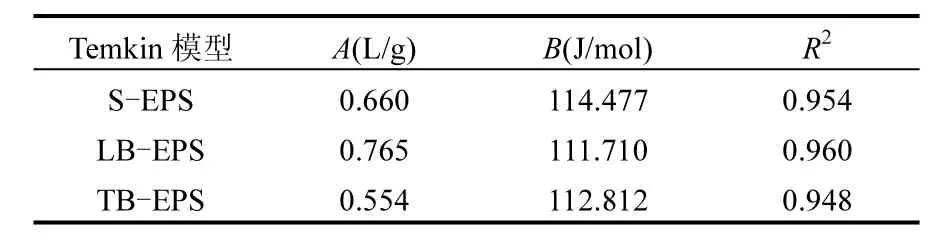
表4 EPS吸附Pb2+的Temkin等温吸附模型参数Table 4 Temkin model Isotherm parameters for adsorption of Pb2+by EPS
2.5 SEM扫描电镜分析
采用生物扫描电子显微镜(SEM)观察各层EPS吸附Pb2+前后的表观形态的变化,如图7所示.可以看出各层EPS的形貌特征有较大差别[23].没有吸附Pb2+的各层EPS中,S-EPS呈现片层状,表面比较光滑;而LB-EPS表面由很多肺泡状突起堆叠而成,与 S-EPS相比,LB-EPS的比表面积明显增大;TB-EPS则呈现丝状,并缠绕在一起.EPS能够与Pb2+发生了离子交换[35],部分基团与Pb2+发生络合,并通过表面沉淀作用沉积在 EPS表层[34].吸附后,呈片状的S-EPS表面附着有大量小的块状铅离子络合产物,即大量铅离子被吸附到 S-EPS表面;肺泡状的LB-EPS表面团聚较多的铅离子络合产物并团聚呈球状,LB-EPS比表面积更大,更多的Pb2+吸附在其表面,这也是LB-EPS对铅离子吸附效果优于 S-EPS的原因;由于吸附 Pb2+并形成络合物,TB-EPS表面也明显附着有大量块状物,丝状的TB-EPS比表面积最小,因而单位质量TB-EPS能够吸附的Pb2+有限,这也是TB-EPS吸附效果不如LB-EPS、S-EPS的原因.

图7 各层EPS吸附铅前后扫描电镜图Fig. 7 scanning electron microscope micrographs of EPS before and after Pb2+adsorption
3 结论
3.1 土壤芽孢杆菌产生的EPS能有效吸附Pb2+,单位吸附量LB-EPS>S-EPS>TB-EPS.吸附温度为35 ,pH℃ 为5.5时,S-EPS、LB-EPS、TB-EPS的吸附量最大,分别为91.35、100.61、90.28mg/g.
3.2 各层EPS对Pb2+吸附均符合准二级动力学模型,吸附速率是受化学吸附机理控制;等温吸附分析结果表明EPS等温吸附过程符合Langmuir吸附等温线模型,各层EPS对Pb2+的吸附是发生在EPS表面的单分子层吸附.
3.3 生物扫描电子显微镜结果表明,S-EPS、LB-EPS、TB-EPS的表观形态差异明显,LBEPS呈肺泡状,比表面积更大,更多的 Pb2+吸附在其表面.
[1] 钱春香,王明明,许燕波.土壤重金属污染现状及微生物修复技术研究进展 [J]. 东南大学学报(自然科学版), 2013,43(3):669-674.
[2] 黄科瑞,刘 芳,张金磊,等.百色不同功能区土壤重金属形态分布及其生态风险评价 [J]. 广东农业科学, 2013,40(11):165-168.
[3] 徐水太,饶运章.矿山开发重金属污染的评价与研究进展 [J].铜业工程, 2010,(4):5-9.
[4] 赵永红,张 静,周 丹,等.赣南某钨矿区土壤重金属污染状况研究 [J]. 中国环境科学, 2015,35(8):2477-2484.
[5] 刘敬勇,常向阳,涂湘林.矿山开发过程中重金属污染研究综述[J]. 矿产与地质. 2006,20(6):645-650.
[6] 邱孟龙,李芳柏,王 琦,等.工业发达城市区域耕地土壤重金属时空变异与来源变化 [J]. 农业工程学报, 2015,31(2):298-305.
[7] 欧阳林男,吴晓芙,李 芸,等.锰矿修复区泡桐与栾树生长与重金属积累特性 [J]. 中国环境科学, 2016,36(3):908-916.
[8] Gutiérrez C, Fernández C, Escuer M, et al. Effect of soil properties, heavy metals and emerging contaminants in the soil nematodes diversity [J]. Environmental Pollution, 2016,213: 184-194.
[9] Banerjee R, Goswami P, Pathak K, et al. Vetiver grass: An environment clean-up tool for heavy metal contaminated iron ore mine-soil [J]. Ecological Engineering, 2016,90:25-34.
[10] Colin V L, Villegas L B, Abate C M. Indigenous microorganisms as potential bioremediators for environments contaminated with heavy metals [J]. International Biodeterioration & Biodegradation, 2012,69:28-37.
[11] Tayel A A, Gharieb M M, Zaki H R, et al. Bio-clarification of water from heavy metals and microbial effluence using fungal chitosan [J]. International Journal of Biological Macromolecules, 2016,83:277-281.
[12] Guibaud G, Comte S, Bordas F, et al. Metal removal from single and multimetallic equimolar systems by extracellular polymers extracted from activated sludges as evaluated by SMDE polarography [J]. Process Biochemistry, 2005,40(2):661-668.
[13] Tunali S, Akar T. Zn(II) biosorption properties of Botrytis cinerea biomass [J]. Journal of Hazardous Materials, 2006,131(1-3): 137-145.
[14] Mesa J, Mateos-Naranjo E, Caviedes M A, et al. Scouting contaminated estuaries: Heavy metal resistant and plant growth promoting rhizobacteria in the native metal rhizoaccumulator Spartina maritime [J]. Marine Pollution Bulletin, 2015, 90(1/2):150-159.
[15] Oves M, Khan M S, Zaidi A. Biosorption of heavy metals by Bacillus thuringiensis strain OSM29 originating from industrial effluent contaminated north Indian soil [J]. Saudi Journal of Biological Sciences, 2013,20(2):121-129.
[16] Guibaud G, Comte S, Bordas F, et al. Comparison of the complexation potential of extracellular polymeric substances (EPS), extracted from activated sludges and produced by pure bacteria strains, for cadmium, lead and nickel [J]. Chemosphere, 2005,59(5):629-638.
[17] Yang Z, Xu R, Zheng Y, et al. Characterization of extracellular polymeric substances and microbial diversity in anaerobic co-digestion reactor treated sewage sludge with fat, oil, grease [J]. Bioresource Technology, 2016,212:164-173.
[18] Deng S, Wang L, Su H. Role and influence of extracellular polymeric substances on the preparation of aerobic granular sludge [J]. Journal of Environmental Management, 2016,173:49-54.
[19] Yue Z, Li Q, Li C, et al. Component analysis and heavy metal adsorption ability of extracellular polymeric substances (EPS) from sulfate reducing bacteria [J]. Bioresource Technology, 2015,194:399-402.
[20] Morillo Pérez J A, García-Ribera R, Quesada T, et al. Biosorption of heavy metals by the exopolysaccharide produced by Paenibacillus jamilae [J]. World Journal of Microbiology and Biotechnology, 2008,24(11):2699-2704.
[21] Wei D, Li M, Wang X, et al. Extracellular polymeric substances for Zn (II) binding during its sorption process onto aerobic granular sludge [J]. Journal of Hazardous Materials, 2016,301: 407-415.
[22] Ye S, Zhang M, Yang H, et al. Biosorption of Cu 2+, Pb 2+ and Cr 6+ by a novel exopolysaccharide from Arthrobacter ps-5 [J].Carbohydrate Polymers, 2014,101(1):50-56.
[23] 韩润平,邹卫华,张敬华,等.谷壳的差热红外扫描电镜分析及对铜铅离子的生物吸附研究 [J]. 环境科学学报, 2006,36(1): 32-39.
[24] Guisado I M, Purswani J, Gonzalez-Lopez J, et al. Physiological and genetic screening methods for the isolation of methyl tert -butyl ether-degrading bacteria for bioremediation purposes [J]. International Biodeterioration & Biodegradation, 2015,97:67-74.
[25] Das S, Jean J S, Kar S, et al. Screening of plant growthpromoting traits in arsenic-resistant bacteria isolated from agricultural soil and their potential implication for arsenic bioremediation [J]. Journal of Hazardous Materials, 2014, 272(10):112-120.
[26] Sahlan O, Belma A, Zekiye S. Evaluation of chromium (VI) removal behaviour by two isolates of Synechocystis sp. in terms of exopolysaccharide (EPS) production and monomer composition. [J]. Bioresource Technology, 2009,100(23):5588-5593.
[27] 旭日花,马世敏,刘丽莎,等.培养条件对双歧杆菌 EPS各组分产量及比例的影响 [J]. 微生物学通报, 2013,(11):2066-2074.
[28] 刘丽波,李 春,孟祥晨.1株高产EPS嗜热链球菌的筛选及培养条件优化 [J]. 中国食品学报, 2007,(3):64-68.
[29] Li D, Li J, Zhao F, et al. The influence of fermentation condition on production and molecular mass of EPS produced by Streptococcus thermophilus 05~34 in milk-based medium [J]. Food Chemistry, 2016,197:367-372.
[30] Hou W, Ma Z, Sun L, et al. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+[J]. Journal of Hazardous Materials, 2013,261:614-620.
[31] Kinoshita H, Sohma Y, Ohtake F, et al. Biosorption of heavy metals by lactic acid bacteria and identification of mercury binding protein [J]. Research in Microbiology, 2013,164(7):701-709.
[32] Comte S, Guibaud G, Baudu M. Biosorption properties of extracellular polymeric substances (EPS) towards Cd, Cu and Pb for different pH values [J]. Journal of Hazardous Materials, 2008,151(1):185-193.
[33] Wei X, Fang L, Cai P, et al. Influence of extracellular polymeric substances (EPS) on Cd adsorption by bacteria [J]. Environmental Pollution, 2011,159(5):1369-1374.
[34] Liu W, Zhang J, Jin Y, et al. Adsorption of Pb(II), Cd(II) and Zn(II) by extracellular polymeric substances extracted from aerobic granular sludge: Efficiency of protein [J]. Journal of Environmental Chemical Engineering, 2015,3(2):1223-1232.
[35] Li W, Yu H. Insight into the roles of microbial extracellular polymer substances in metal biosorption [J]. Bioresource Technology, 2014,160:15-23.
[36] Chen Z, Ma W, Han M. Biosorption of nickel and copper onto treated alga (Undaria pinnatifida): Application of isotherm and kinetic models [J]. Journal of Hazardous Materials, 2008, 155(1/2):327-333.
[37] Akkaya R. Removal of radioactive elements from aqueous solutions by adsorption onto polyacrylamide-expanded perlite: Equilibrium, kinetic, and thermodynamic study [J]. Desalination, 2013,321:3-8.
[38] Figueroa-Torres G M, Certucha-Barragán M T, Acedo-Félix E, et al. Kinetic studies of heavy metals biosorption by acidogenic biomass immobilized in clinoptilolite [J]. Journal of the Taiwan Institute of Chemical Engineers, 2016,61:241-246.
[39] Sudheer Khan S, Mukherjee A, Chandrasekaran N. Interaction of colloidal silver nanoparticles (SNPs) with exopolysaccharides (EPS) and its adsorption isotherms and kinetics [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011, 381(1-3):99-105.
[40] Moon S, Park C, Kim Y, et al. Biosorption isotherms of Pb (II) and Zn (II) on Pestan, an extracellular polysaccharide, of Pestalotiopsis sp. KCTC 8637P [J]. Process Biochemistry, 2006,41(2):312-316.
[41] Yao L, Ye Z, Wang Z, et al. Characteristics of Pb2+biosorption with aerobic granular biomass [J]. Science Bulletin, 2008,53(6): 948-953.
Pb2+adsorption features of extracellular polymeric substance producted by a Brevibacillus agri strain.
HONG Chen1,2, LI Yi-fei1, SI Yan-xiao3, XING Yi1,4*, WANG Zhi-qiang1, ZHANG Ying-ying1(1.School of Civil and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China;2.Research Center for Eco-Environmental Sciences, Chinese Academy Science, Beijing 100085, China;3.School of Environment, Tsinghua University, Beijing 100084, China;4.Beijing Key Laboratory of Resource-oriented Treatment of Industrial Pollutants, University of Science and Technology Beijing, Beijing 100083, China), China Environmental Science, 2017,37(5):1805~1813
Extracellular polymeric substances (EPS) were categorized based on the compactness: soluble EPS (S-EPS), loosely bound EPS (LB-EPS) and tightly bound EPS (TB-EPS). The EPS used for experiment was extracted from Brevibacillus agri strain and the adsorption characteristics of Pb2+onto S-EPS, LB-EPS and TB-EPS were investigated at different temperature and pH. Meanwhile, adsorption kinetics model and adsorption isotherm model were also be established and the change of surface morphology of EPS before and after adsorption were observed by scanning electron microscope (SEM). When temperature was 35 ℃ and pH was 5.5, the Pb2+adsorption capacity of S-EPS, LB-EPS, TB-EPS was 91.35, 100.61, and 90.28mg/g, respectively. The results showed that the Pb2+adsorbability of LB-EPS was better than those of S-EPS and TB-EPS. Additionally, adsorption kinetics and adsorption isotherm of EPS for Pb2+fitted Pseudo second order kinetic model and Langmuir adsorption isotherm model. The results indicated that adsorption process was controlled by chemisorption mechanism and monolayer adsorption, respectively. The largest adsorption capacities calculated by Langmuir adsorption isotherm model of S-EPS, LB-EPS, TB-EPS were 124.224, 127.389 and 119.760mg/g, respectively. Furthermore, SEM analysis confirmed that surface morphology of S-EPS, LB-EPS, and TB-EPS changed significantly before and after adsorption. In which, LB-EPS had the largest adsorption capacity as its pulmonary alveoli structure and large specific surface area.
EPS;adsorption;Pb2+;kinetic;SEM
X703
A
1000-6923(2017)05-1805-09
洪 晨(1984-),男,河北三河人,讲师,博士,从事市政污泥处理与资源化方面的研究.发表论文40篇.
2016-10-10
国家自然科学基金资助项目(41273091);科技北京百名领军人才培养工程资助项目(LJ201620)
* 责任作者, 教授, xingyi@ustb.edu.cn

