头孢替坦异构体研究
黄贵莲??黄滔
[摘要] 目的 研究头孢替坦的两个差向异构体d-头孢替坦和l-头孢替坦的转换规律,明确异构体间的转化条件。方法 采用酸、碱、热、氧化、强光条件对头孢替坦进行破坏试验。结果 在酸、碱、热条件下d-头孢替坦会向l-头孢替坦转化。结论 本研究为头孢替坦及头孢替坦二钠合成过程中的反应条件提供依据,也给生产过程控制提供支持。
[关键词] 头孢替坦;异构体;转换条件
[中图分类号] R917 [文献标识码] A [文章编号] 2095-0616(2017)05-34-03
[Abstract] Objective To study the conversion rule of two epimers of cefotetan, d-cefotetan and l-cefotetan, and determine the transformation conditions between two epimers. Methods We had done the destruction tests (including acid, alkali, heat, oxidation and light) to cefotetan. Results Test results shew that d-cefotetan could convert to l-cefotetan in acid, alkali and heat. Conclusion The study provides the basis for the reaction conditions in the synthesis of cefotetan and cefotetan disodium, and it also provides support for the production process control.
[Key words] Cefotetan; Epimers; Conversion condition
头孢替坦(cefotetan,图1)对革兰阳性菌和阴性菌均有抑制作用,临床用于治疗腹腔内感染、术后伤口感染及复杂性尿路感染等[1-10]。本品收载于美国药典36版(USP 36)[11]和日本药局方16版(JP 16)[12],中国药典2015年版(ChP 2015)尚未收载本品。有关物质相关文献[13-14]未有提及头孢替坦异构体,只有JP 16头孢替坦质量标准项下收载了l-异构体,限度规定l-异构体应为35%≤l-异构体≤45%。有文献[15]指出,头孢替坦两个差向异构体(d-头孢替坦、l-头孢替坦)与互变异构体的转化(图2)。文献进一步指出,两个差向异构体(d-头孢替坦、l-头孢替坦)具有相同的抗菌活性,但具有不同的血清半衰期,可能不会引起不同的临床效果。为了进一步明确两个异构体间的转化条件,我们采用JP 16质量标准项下的l-异构体检测方法,在破坏条件(包括酸、碱、热、氧化、强光)下进行试验。
1 仪器与试药
U3000高效液相色谱仪(Thermo仪器公司),变色龙色谱工作站;BP211D型万分之一电子分析天平,德国赛多利斯科学仪器(北京)有限公司。
头孢替坦(本研究所自制,含量 99.2%,批号 P131001);乙腈为色谱纯;十二水合磷酸氢二钠、磷酸二氢钾、四丁基硫酸氢氨均为分析纯。
2 方法与结果
2.1 色谱条件
仪器:戴安四元 U3000。
色谱柱:Inertsi ODS-3 4.0mm×150mm,5μm。
流动相:流动相A∶pH 7.0磷酸盐缓冲液(0.1mol/L的十二水合磷酸氢二钠水溶液,0.1mol/L的磷酸二氢钾水溶液,混合调节 pH 7.0)∶流动相B(水)∶流动相C(每150mL乙腈含1.0g四丁基硫酸氢氨)=45∶45∶10。
流速:1.2mL/min。
检测波长:254nm。
柱温:40℃。
进样量:5μL。
2.2 试验
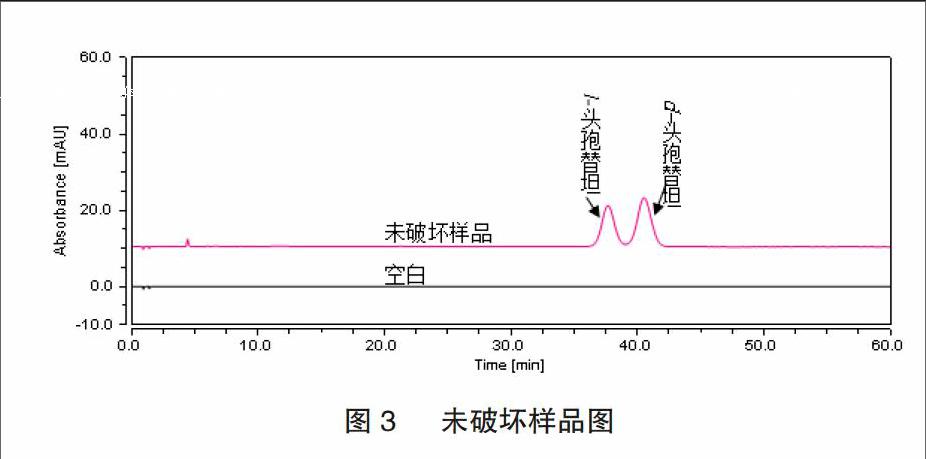
2.2.1 未破坏样品 空白:精密量取空白溶液5μL,照异构体检测方法,进样,记录色谱图;未破坏:取本品约5mg,置10mL量瓶中,加水溶解并稀釋至刻度,摇匀,色谱图见图3。
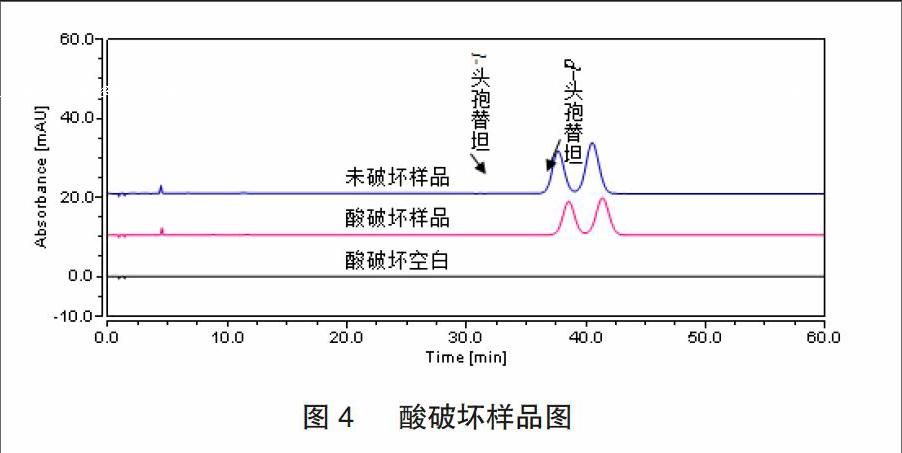
2.2.2 酸破坏试验 酸破坏:取本品约5mg,置10mL量瓶中,加0.1mol/L盐酸溶液1mL,室温下放置1min,用0.1mol/L氢氧化钠溶液调pH至中性,加水稀释至刻度,摇匀;酸破坏空白:加0.1mol/L盐酸溶液1mL置10mL量瓶中,室温下放置1min,用0.1mol/L氢氧化钠溶液调pH至中性,加水稀释至刻度,摇匀,色谱图见图4。
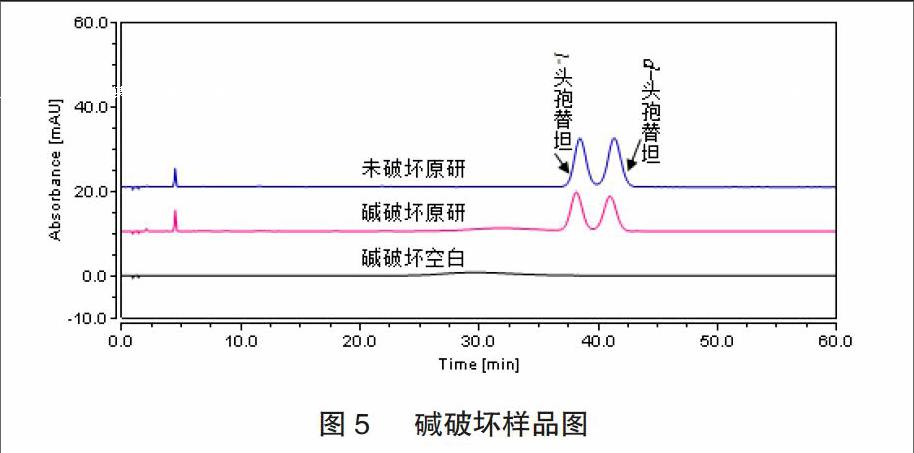
2.2.3 碱破坏试验 碱破坏:取本品约5mg,置10mL量瓶中,加0.01mol/L氢氧化钠溶液1mL,室温下放置5min,用0.01mol/L 盐酸溶液调pH至中性,加水稀释至刻度,摇匀;碱破坏空白:加0.01mol/L氢氧化钠溶液1mL置10mL量瓶中,室温下放置5min,用0.01mol/L 盐酸溶液调pH至中性,加水稀释至刻度,摇匀,色谱图见图5。
2.2.4 氧化破坏试验 氧化破坏:取本品约10mg,置10mL量瓶中,加10%的双氧水1mL,放置5min,40℃超声5min,加水稀释至刻度,摇匀;氧化破坏空白:加10%的双氧水1mL置10mL量瓶中,放置5min,40℃超声5min,加水稀释至刻度,摇匀,色谱图见图6。
2.2.5 热破坏试验 热破坏:精密称取本品10mg,置10mL量瓶中,加入1mL水溶解,置95℃水浴中加热10min,加水稀释至10mL,摇匀;热破坏空白:加入1mL水,置95℃水浴中加热10min,加水稀释至10mL,摇匀,色谱图见图7。
2.2.6 光破坏试验 光破坏:精密称取本品10mg置10mL量瓶中,加入1mL水溶解,置(4500±500)lx照度下照射24h,加水稀释至10mL,摇匀。光破坏空白:加入1mL水,置(4500±500)lx照度下照射24h,加水稀释至10mL,摇匀,色谱图见图8。
2.2.7 破坏试验结果 按上述条件,照异构体检查方法试验,试验结果见表1。结果表明,空白溶剂无干扰,酸、碱、热条件下,l-头孢替坦都会增大,即在酸、碱、热条件下d-头孢替坦会向l-头孢替坦转换。
3 讨论
从上述结果可以得到,在酸、碱、热条件下d-头孢替坦会向l-头孢替坦转换。由于头孢替坦二钠为头孢替坦的常用上市产品形式,在生产过程中,头孢替坦需加入碳酸氢钠反应生成头孢替坦二钠。为了使保证产品质量,严格按照JP 16版头孢替坦的质量标准异构体项下的要求,对自制产品进行异构体的控制并列入生产的内控标准中。通过研究异构体的转化条件,给头孢替坦合成过程中的反应条件、头孢替坦转化为头孢替坦二钠的反应过程提供了强有力地技术支持和依据,也给产品生产的过程控制提供支持,有效地保证了产品的安全有效性。
[参考文献]
[1] Ward A, Richards DM.Cefotetan. A review of its antibacterial activity, pharmacokinetic properties and therapeutic use[J].Drugs,1985,30(5):382-426.
[2] Dav enport R D,Judd W J,Dake L K,et al.Per sistence of cefotetan on red blood cells [J].Tr ansf usion,2004,44(6):849.
[3] Qiu F,He XJ,Sun YX,et al.Pharmacokinetics of intravenous injection cefotetan in healthy volunteers[J].Chin J Hosp Pharm,2012,32(24):1960-1964.
[4] 刘曼虹,狄斌,刘文英.头孢菌素类抗生素—头孢替坦的研究进展[J].抗感染药学,2011,36(2):86-92.
[5] 薛雨,陈宇瑛.头孢菌素类抗生素的最新研究进展[J].中国抗生素杂志,2010,40(6):775-785.
[6] 黄滔,于娜娜,金鑫.UPLC法测定头孢替坦二钠的有关物质[J].沈阳药科大学学报,2016,33(7):555-559.
[7] 黄滔,金鑫,于娜娜.头孢替坦二钠一未知有关物质的结构解析[J].中国医药工业杂志,2016,47(5):597-600.
[8] 杨信怡,胡辛欣,娄人慧,等.头孢替坦二钠的体外抗菌活性研究[J].中国医药指南,2012,10(13):82-85.
[9] 刘亚妮,刘金梅,马林,等.注射用头孢替坦二钠在中国健康人体内的药动学[J].中国药学杂志,2012,47(2):132-136.
[10] 何晓静,刘玉兰.注射用头孢替坦钠的安全性再评价[J].中国抗生素杂志,2007,32(1):59-62.
[11] US Pharmacopeia: The United States Pharmacopeial Convention. US Pharmacopeia / National Formulary[M].35th.Official Monographs/Cefotetan:US Pharmacopeia Origination Press,2012:2561-2562.
[12] 日本藥局方编辑委员会日本药局方[M].16改正版.日本厚生省:日本药局方,2011:570-572.
[13] 李进,张斗胜,姚尚辰,等. LC/MS法分析头孢替坦二钠原料中的杂质[J].中国科学(化学),2010, 40(6):775-785.
[14] 林波,杨建新,向世英,等.高效液相色谱法测定头孢替坦二钠中的有关物质[J].中国抗生素杂志,2010,35(11):S1-S3.
[15] High-performance liquid chromatographic analysis of Cefotetan epimers in human plasma and urine[J].Journal of Chromatography B,1984,305:363-371.
(收稿日期:2016-11-04)

