白腐真菌共培养对磺胺二甲基嘧啶降解的影响
郭晓丹娜 郭夏丽
(郑州大学化工与能源学院,郑州 450001)
白腐真菌共培养对磺胺二甲基嘧啶降解的影响
郭晓丹娜 郭夏丽
(郑州大学化工与能源学院,郑州 450001)
磺胺类抗生素是全国检出频率较高的一种抗菌药物,目前对磺胺类抗生素的生物降解方面研究较少,而生物法具有无二次污染、绿色环保的优点。因此本实验对杂色云芝和黄孢原毛平革菌共培养降解磺胺二甲基嘧啶进行研究。采用高效液相色谱(HPLC)和紫外分光光度计分别分析抗生素的浓度与酶活。结果显示,平板对峙实验中两菌种间菌丝呈僵持状,种间区域漆酶酶活始终高于其他区域。两种白腐真菌液体混配4 d时可以获得具有较高漆酶酶活的粗酶液,该粗酶液在48 h内对磺胺二甲基嘧啶的降解率为25.4%,明显高于杂色云芝纯培养粗酶液的降解率(9.6%)。在加入天然助氧剂和人工助氧剂2,2'-联氨双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(简称ABTS)后,混配粗酶液的降解率分别增至49%和93.1%。种间作用可以通过增加漆酶酶活以及产生助氧剂提升抗生素降解率,因此,共培养的白腐真菌可以作为抗生素污染生物治理的主要手段之一。
白腐真菌;共培养;漆酶酶活;磺胺二甲基嘧啶;降解
近年来,药物及个人护理品(Pharmaceutical and personal care products,PPCPs)作为一种新型污染物日益受到关注[1-3]。大多数磺胺类药物是以母体和代谢中间产物的形式通过畜禽粪便和尿液排到体外,从而进入环境。有研究表明,在养殖废水中,磺胺二甲基嘧啶(Sulfamethazine,SM2)是最常见的抗生素之一,最高含量在23.8-685 μg/L之间[4]。而目前的技术并不能有效的去除环境中残留的抗生素[5],抗生素的污染对于人类健康和生态环境有着更加严重的潜在危害,因此备受关注。
白腐真菌主要是通过合成木质素降解酶降解一些难以被传统的生物方法处理的污染物质,尤其是抗生素[6]。酶法降解抗生素具有酶易获得、易保存,酶浓度不受菌体生长情况的约束,对环境无污染,过程控制简单方便等优点。目前对于白腐真菌降解抗生素的研究大多侧重于单菌株的生物降解,本研究的目的主要是考察白腐真菌的种间相互作用对磺胺二甲基嘧啶生物降解的影响。已有研究表明,杂色云芝(Trametes versicolor,TV)是能产漆酶(Laccase,Lac)的白腐真菌[7],而黄孢原毛平革菌(Phanerochaete chrysosporium,PC)是产生木质素过氧化物酶(Lignin peroxidase,LiP)和锰过氧化物酶(Mn-dependent peroxidase,MnP)的白腐真菌[8]。在该研究中,以这两种菌为实验菌种,探究它们的平板共培养和液体共培养对木质素降解酶酶活的影响,以及对磺胺二甲基嘧啶酶降解的影响,为水体与土壤的抗生素污染的生物治理提供理论和技术依据。
1 材料与方法
1.1 材料
1.1.1 试剂与菌种 磺胺二甲基嘧啶(≥99%)购买自美国Sigma公司;甲醇为色谱纯(99.9%)购买自天津四友有限公司;其他化学试剂均为分析纯。实验菌种为郑州大学环境与生态实验室4℃保存的杂色云芝和黄孢原毛平革菌。
1.1.2 培养基 马铃薯固体培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,pH自然。
液体培养基[9]:马铃薯100 g,葡萄糖10 g,KH2PO41.5 g,MgSO4·7H2O 0.75 g,酵母浸粉5 mg,蒸馏水1 L,pH自然。
1.2 分析方法
磺胺二甲基嘧啶的测定:使用高效液相色谱(HPLC)分析。色谱柱:Agilent 5 TC-C18(5 μm,250×4.6 mm);流动相:甲醇-二次水(体积比为40:60);检测波长为267 nm;流速为1.0 mL/min;进样量20 μL;柱温30℃。利用标准曲线法对SM2进行分析测定。
漆酶活性的测定[10]:4 mL反应混合物中含0.1 mol/L醋酸-醋酸钠缓冲溶液(pH4.5),0.5 mmol/L的ABTS和1 mL的粗酶液,恒温水浴30℃反应5 min,用分光光度计检测420 nm处1 min内吸光度值的变化,定义为1 min内催化氧化1 μmol ABTS的酶量为1个酶活单位(U)。
锰过氧化物酶活性的测定[11]:5 mL反应混合物中含100 mmol/L酒石酸-酒石酸钠缓冲溶液(pH5.0),0.1 mmol/L硫酸锰,0.1 mmol/L过氧化氢和以及1 mL粗酶液,恒温水浴30℃反应5 min,用紫外分光光度计检测238 nm处10 s内吸光度值的变化定义为1 min内氧化1 μmol Mn2+为Mn3+所需的酶量为1个酶活单位(U)。
1.3 试验方法
1.3.1 菌种的平板共培养及漆酶的着色 平板共培养:将在PDA平板上生长7 d的两种白腐真菌,各取直径10 mm的新鲜菌丝块接种至灭菌的PDA平板上,两菌种菌块之间间隔3 cm。为了确保菌丝在平板中间接触,混配中生长较慢的杂色云芝先于黄孢原毛平革菌提前2 d接种。单菌种自我配对作为对照。在恒温培养箱中30℃避光培养,定性观察以及定量测定两菌种菌丝接触后7 d内的漆酶活性变化。每个处理作3个平行。
漆酶的定性观察:在共培养5 d的混配菌种和自我配对菌种的平板中间,滴加0.5 mmol/L ABTS,1 h之后观察染色情况。
1.3.2 粗酶液的制备 平板共培养粗酶液的制备(图1):在菌丝相互作用区域和两侧单菌区域分别取4块直径10 mm的菌丝块,将菌丝块对半劈,放置10 mL比色管中,内装4 mL 10 mmol/L的醋酸-醋酸钠缓冲液(pH5.0),4℃隔夜浸提,4 000 r/min,4℃离心10 min,取上清液经0.22 μm滤膜过滤,过滤液即为粗酶液。
液体培养基中粗酶液的制备:在250 mL三角瓶中,装液量50 mL,1×105Pa灭菌30 min。杂色云芝先于黄孢原毛平革菌2 d接种,接种量各5 mL。在150 r/min,30℃下培养7 d,每天取样。10 000 r/min,4℃离心20 min,取上清液经0.22 μm滤膜过滤,获得粗酶液。单菌种作为对照。
1.3.3 SM2的酶解 在250 mL三角瓶中,加入10 mmol/L的醋酸-醋酸钠缓冲液(pH5.0),反应液总体积50 mL含一定浓度的SM2,5 mL粗酶液,加入ABTS的浓度为1 mmol/L(天然介导物为5 mL)。在150 r/min,30℃的条件下反应48 h后,用HPLC测定SM2的剩余浓度。

图1 共培养取样示意图
2 结果
2.1 两种白腐真菌共培养对酶活的影响
在平板中滴加0.5 mol/L的ABTS,通过无色化合物ABTS在平板上呈现的颜色变化来观察漆酶活性的大小。结果(图2)显示,在杂色云芝自配对的平板中菌丝边缘出现一圈蓝绿色,表明杂色云芝产生并分泌胞外漆酶。在黄孢原毛平革菌自配对的平板中,颜色未有任何变化,表明黄孢原毛平革菌未产漆酶。两个自配对菌株的接触区与各自的其他区相比,均未有颜色差异,而共培养菌种的菌丝接触区则呈现紫色,共培养的杂色云芝侧呈现蓝绿色,黄孢原毛平革菌侧未有任何颜色变化,表明两菌种间存在相互作用并对杂色云芝分泌漆酶产生影响。
杂色云芝和黄孢原毛平革菌在共培养3 d后菌丝开始接触并进入僵持状(图3)。通过检测漆酶酶活发现,在不同的僵持阶段,菌丝僵持区域的漆酶酶活始终高于其他区域,其漆酶酶活峰值出现在共培养的第5天,达到0.34 U/g。杂色云芝未接触侧的最高漆酶酶活出现在共培养第8天,酶活值为0.18 U/g。黄孢原毛平革菌未接触区域则始终未检测出漆酶酶活,表明黄孢原毛平革菌对杂色云芝产漆酶具有促进作用。
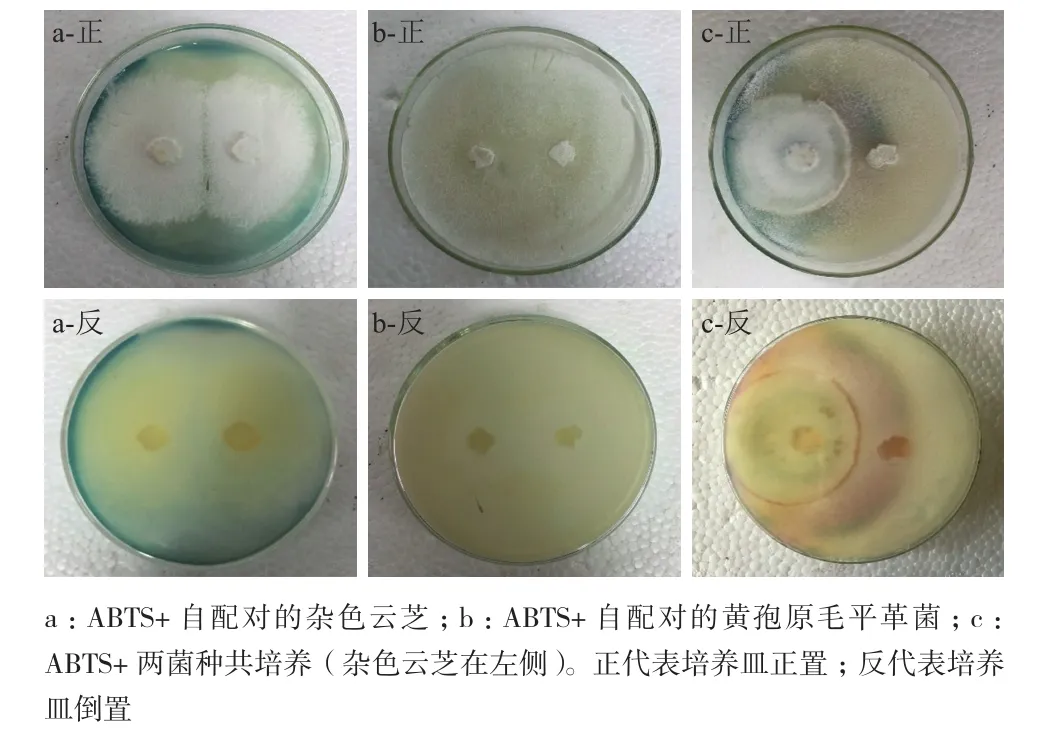
图2 菌种共培养5 d的漆酶着色情况

图3 共培养过程中平板不同区域漆酶活性的变化
将两种菌进行液体共培养,以期获得具有较高漆酶酶活的粗酶液。从图4-A可以看出在整个培养过程中,两菌种共培养的漆酶酶活始终高于杂色云芝单菌种的漆酶酶活,在共培养的第3天至第5天,漆酶酶活均处于较高范围,在第4天,漆酶酶活最大,达到95 U/L,而单菌株杂色云芝最大漆酶酶活出现在第5天,为44.6 U/L。对于漆酶酶活,液体共培养的效果明显好于平板共培养。对于锰过氧化物酶(图4-B),共培养与黄孢原毛平革菌单培养的酶活峰值相同,而杂色云芝单菌株也产生锰过氧化物酶,因此,共培养的酶活峰值未出现1+1≥2的效果,但共培养酶活下降幅度明显低于单菌株。而后,对液体培养基中锰含量进行检测,发现培养液中锰的含量很低,几乎为零。
在酶活检测过程中,发现在现有实验条件下单菌株及其共培养均未产生木质素过氧化物酶,表明菌株间的相互作用并不能增加各菌株的新酶活,只能影响各菌株现有酶活,并且酶的种类不同,其产生的影响效果也不相同,对于漆酶,有着明显增加作用,而对于锰过氧化物酶,未有明显促进作用。

图4 两菌株液体混配中酶活的变化
2.2 液体共培养产生的粗酶液对磺胺二甲基嘧啶的降解
在黄孢原毛平革菌的培养液中,未检测出漆酶和木质素过氧化物酶,而检测出锰过氧化物酶,不同培养时间产生的粗酶液对SM2均未有明显降解,表明锰过氧化物酶对SM2的去除无影响。结果如图5所示,在杂色云芝及其与黄孢原毛平革菌共培养的培养液中均检测出漆酶酶活,不同培养时间产生的粗酶液对SM2的降解率,与粗酶液中的漆酶活均呈现正相关性,随着漆酶活性的增大,SM2的降解率增大,在共培养第4天漆酶酶活最高,制备的粗酶液对SM2的降解率最大,在杂色云芝单培养第5天漆酶酶活最高,制备的粗酶液对SM2的降解率也最大,随着漆酶活性的降低,SM2的降解率也降低,表明漆酶参与了SM2的降解。
由混配菌种得到的粗酶液对SM2的降解能力高于单菌种,磺胺二甲基嘧啶为非酚类化合物,漆酶对它的降解需要介导物参与。种间相互作用下各菌种为了维持它们的生长状况,抵御其他菌丝体的侵入,可能会产生更多的天然介导物。

图5 不同培养时间产生的粗酶液对SM2的降解
为了验证以上推测,将两种菌共培养4 d时制备的粗酶液分成2份,其中1份作为粗酶液,另一份进行加热处理,以使其中的酶失活,作为天然介导物,与加入ABTS进行比较,探究天然介导物对SM2酶解的影响。
由图6可知,未加入介导物时,共培养和杂色云芝单培养的粗酶液对SM2的降解率分别为25.4%和9.6%,当加入天然介导物之后,两种粗酶液对SM2的降解率分别增至49%和24%,说明共培养中产生的某些代谢物可以作为漆酶的天然介导物。加入ABTS后,共培养和杂色云芝单培养的粗酶液对SM2的降解率显著增加,分别为93.1%和88.0%,推测ABTS介导物所涉及的氧化机制比天然介导物更适宜于SM2的酶解。黄孢原毛平革菌单培养的粗酶液对SM2的降解无显著作用影响。
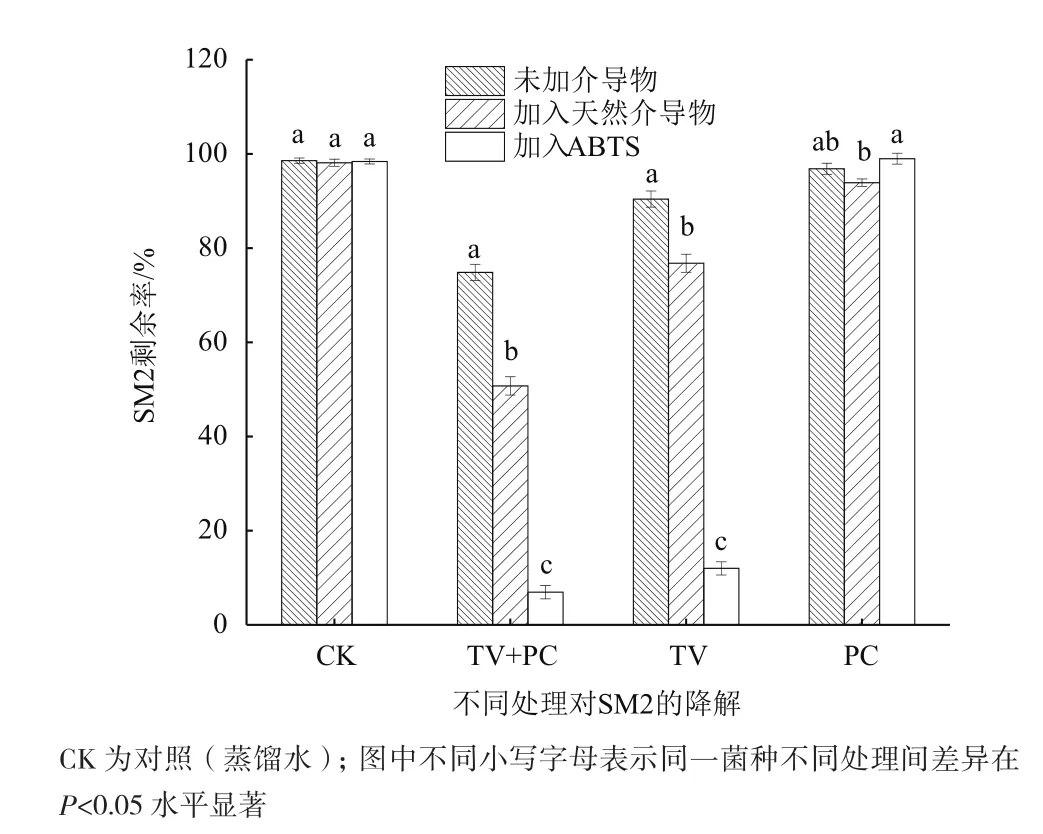
图6 不同介导物对粗酶液降解SM2的影响
3 讨论
种间的拮抗作用会导致两菌种相互作用区域受到胁迫,从而会积累大量的活性氧和过氧化氢,所以漆酶的产量会增加。白腐真菌能向胞外分泌降解木质素的酶,生境重叠或部分重叠的真菌间存在空间和营养的竞争[12]。从菌落形态看,共培养的杂色云芝边缘菌丝发生卷曲缠绕而紧密以对抗快速生长的黄孢原毛平革菌的空间竞争,而自配对的杂色云芝接触区菌丝未发生明显的形态变化;从生化角度看,共培养的漆酶酶活明显高于单菌株杂色云芝的漆酶酶活。表明杂色云芝菌丝内存在能够识别异己并排他的防御系统,而该防御系统被黄孢原毛平革菌的竞争所激活,其中漆酶酶活的增加可能是该防御系统发挥的部分作用[13]。
漆酶是多铜氧化酶中的一种含铜的糖蛋白氧化酶,能催化多元酚及其衍生物的氧化并同时还原氧分子为水。漆酶的氧化还原电势较低(300-800 mV)[14],一些低分子量化合物在漆酶作用下可形成活性高的中间体,这些活性中间体可以氧化非酚类化合物,使漆酶可氧化的底物进一步扩大[15],将这类在漆酶催化中起氧化助剂的低分子量化合物称为介导物。目前对漆酶介导物的研究大多针对于人工合成介导物,对于天然介导物研究较少。介导物的助氧化机制大致有3种:(1)ABTS介导物的传递电子机制;(2)含N-OH基团的介导物及紫尿酸的传递羟基自由基机制;(3)2,2,6,6-四甲基哌啶-1-氧(TEMPO)介导物的离子氧化机制。
锰过氧化物酶是一种含铁血红素的糖基化过氧化物酶,当H2O2和Mn2+都存在时,锰过氧化物酶可以氧化分解芳香环多聚体及异生物质[16]。有研究表明,当Mn2+浓度在适量的范围内,菌体生长较好,锰过氧化物酶酶活有明显增加,但Mn2+浓度过大时反而会减少其产量[17]。Bonnarrme等[18]发现,在不含Mn2+的培养液中能够检测到极低的锰过氧化物酶酶活,Mn2+在0.32-39.8 mg/L中锰过氧化物酶酶活会随之增加。因此当两菌种共培养后,由于Mn2+浓度过低,导致锰过氧化物酶酶活并未有增加,共培养的酶活峰值滞后于单菌株的酶活峰值的原因可能是因为种间真菌的相互作用。
对于人工介导物,一般是一些小分子化合物,如ABTS,1-羟基-苯并-三氮唑(1-hydroxybenzotriazole,HBT),它们可以提高漆酶对于难降解化合物的氧化能力[19]。但由于它们可能存在的毒性以及价格昂贵,所以还是需要寻求更加良性的自然介质[20]。已有的研究表明,白腐真菌产生和分泌的一些化合物可被用作天然介导物[21,22],两菌种间的相互作用可能导致菌种代谢产物发生了变化,从而生成天然介导物,在漆酶降解SM2中起到了促进作用[23]。
4 结论
在平板共培养中两菌种间的菌丝形态不仅发生了变化,而且菌丝产生的漆酶酶活增大;杂色云芝与黄孢原毛平革菌液体共培养得到的粗酶液中的漆酶酶活高于单菌种杂色云芝,同时对SM2的降解能力提高。经加热处理的共培养液,可以提高粗酶液对SM2的降解效果,表明该两种菌的共培养可以通过增加漆酶酶活以及产生天然介导物促进SM2的降解。
[1] Onesios KM, Jim TY, Bouwer EJ. Biodegradation and removal of pharmaceuticals and personal care products in treatment systems:A review[J]. Biodegradation, 2009, 20(4):441-466.
[2] Kong Q, Wang ZB, Shu L, et al. Characterization of the extracellular polymeric substances and microbial community of aerobic granulation sludge exposed to cefalexin[J]. International Biodeterioration & Biodegradation, 2015, 102:375-382.
[3] Ramaswamy J, Prasher SO, Patel RM, et al. The effect of composting on the degradation of a veterinary pharmaceutical[J]. Bioresource Technology, 2010, 101(7):2294-2299.
[4] Wei R, Ge F, Huang S, et al. Occurrence of veterinary antibiotics in animal wastewater and surface water around farms in Jiangsu Province, China[J]. Chemosphere, 2011, 82(10):1408-1414.
[5] Gros M, Petrović M, et al. Removal of pharmaceuticals during wastewater treatment and environmental risk assessment using hazard indexes[J]. Environment International, 2010, 36(1):15-26.
[6] 林刚, 文湘华, 钱易. 应用白腐真菌技术处理难降解有机物的研究进展[J]. 环境污染治理技术与设备, 2001, 2(4):1-8.
[7] Strong PJ, Claus H. Laccase:A review of its past and its future in bioremediation[J]. Critical Reviews in Environmental Science and Technology, 2011, 41(4):373-434.
[8] Hu HL, Van den Brink J, Gruben BS, et al Improved enzyme production by co-cultivation of Aspergillus niger and Aspergillus oryzae and with other fungi[J]. International Biodeterioration & Biodegradation, 2011, 65(1):248-252.
[9] Qian LB, Chen BL. Enhanced oxidation of benzo[a]pyrene by crude enzyme extracts produced during interspecific fungal interaction of Trametes versicolor and Phanerochaete chrysosporium[J]. Journal of Environmental Sciences, 2012, 24(9):1639-1646.
[10] Wolfenden BS, Willson RL. Radical-cations as reference chromogens in kinetic studies of ono-electron transfer reactions:Pulse radiolysis studies of 2, 2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate)[J]. Journal of the Chemical Society, Perkin Transactions 2, 1982, (7):805-812.
[11] Paszczyński A, Crawford RL, Huynh VB. Manganese peroxidase of Phanerochaete chrysosporium:Purification[J]. Methods in Enzymology, 1988, 161(1):264-270.
[12] Kennedy PG, Hortal S, Bergemann SE, et al. Competitive interactions among three ectomycorrhizal fungi and their relation to host plant performance[J]. Journal of Ecology, 2007, 95(6):1338-1345.
[13] Silar P. Peroxide accumulation and cell death in filamentous fungi induced by contact with a contestant[J]. Mycological research, 2005, 109(02):137-149.
[14] 高恩丽. 云芝漆酶的生产及其应用基础研究[D]. 杭州:浙江大学, 2007.
[15] Widsten P, Kandelbauer A. Laccase applications in the forest products industry:A review[J]. Enzyme & Microbial Technology, 2009, 42(4):293-307.
[16] 胡明, 卢雪梅, 高培基. 锰过氧化物酶的结构与功能[J]. 中国生物工程杂志, 2003, 23(3):30-34.
[17] Perez J, Jeffries TW. Role of organic acid chelators in manganese regulation of lignin degradation by Phanerochaete chrysosporium[J]. Applied Biochemistry & Biotechnology, 1993, 39-40(1):227-238.
[18] Bonnarme P, Jeffries TW. Mn(ii)regulation of lignin peroxidases and manganese-dependent peroxidases from lignin-degrading white rot fungi[J]. Applied & Environmental Microbiology, 1990, 56(1):210-217.
[19] Garcia HA, Hoffman CM, Kinney KA, et al. Laccase-catalyzed oxidation of oxybenzone in municipal wastewater primary effluent[J]. Water Research, 2011, 45(5):1921-1932.
[20] Cañas AI, Camarero S. Laccases and their natural mediators:Biotechnological tools for sustainable eco-friendly processes[J]. Biotechnology Advances, 2010, 28(6):694-705.
[21] Weng SS, Liu SM, Lai HT. Application parameters of laccasemediator systems for treatment of sulfonamide antibiotics[J]. Bioresource Technology, 2013, 141(7):152-159.
[22] Johannes C, Majcherczyk A. Natural mediators in the oxidation of polycyclic aromatic hydrocarbons by laccase mediator systems[J]. Applied & Environmental Microbiology, 2000, 66(2):524-528.
[23] Collins PJ, Kotterman M, Field JA, et al. Oxidation of anthracene and benzo[a]pyrene by laccases from Trametes versicolor[J]. Applied and Environmental Microbiology, 1996, 62(12):4563-4567.
(责任编辑 李楠)
Degradation of Sulfamethazine by Co-culturing of White-rot Fungi
GUO Xiaodanna GUO Xia-li
(College of Chemical Engineering and Energy,Zhengzhou University,Zhengzhou 450001)
Sulfonamides are a class of antimicrobial agents that have been detected in China at high-frequency. Biological method has the advantages of no secondary pollution and green environmental protection,but the researches on biodegradation of sulfonamides is still scarce. This experiment was to investigate degradation of sulfamethazine(SM2)by co-culturing Trametes versicolor and Phanerochaete chrysosporium. Antibiotic concentration and enzyme activity were determined using high performance liquid chromatography(HPLC)and UV spectrophotometer. A deadlock between the two mycelia was observed on plate confrontation method of an agar medium. The laccase activity at the interaction zone was higher than that at the other regions in the incubation of the two white-rot fungi on an agar plate. The crude enzyme preparation with high laccase concentration was obtained at the co-culturing time of 4 days in liquid medium. At 48 h after incubation,the degradation percentage of SM2 by crude enzyme solution from co-culturing was 25.4%,which was higher than that by crude enzyme preparations from Trametes versicolor(9.6%). When natural mediators and artificial mediator 2,2’-azinobis(3-ethylbenzthiazoline-6-sulfonic acid ammonium salt)(ABTS)were added to the reaction mixture,the degradation percentages of SM2 by the crude enzyme from mixed culture significantly increased to 49% and 93.1%,respectively. The results showed that the interspecific interactions involving P. chrysosporium and T. versicolor enhanced the SM2 oxidation through increasing laccase activity and producing potential mediators. Therefore,the co-culturing of different white-rot fungi has potential for application in antibiotic-contaminated soils and wastes.
white-rot fungi;co-culture;laccase activity;sulfamethazine;degradation
10.13560/j.cnki.biotech.bull.1985.2016-0905
2016-09-26
国家水体污染控制与治理科技重大专项(2015ZX07204-002)
郭晓丹娜,女,硕士研究生,研究方向:环境生物技术;E-mail:nazi224@163.com
郭夏丽,女,副教授,硕士生导师,研究方向:环境生物技术与固废资源化等;E-mail:guoxl@zzu.edu.cn

