生物转化能源草制取纤维素乙醇的研究进展
白龙 李春美 吕途 杜颖 杨玥 田沈
(首都师范大学生命科学学院 北京 100048)
生物转化能源草制取纤维素乙醇的研究进展
白龙 李春美 吕途 杜颖 杨玥 田沈
(首都师范大学生命科学学院 北京 100048)
随着化石燃料的日益枯竭和环境污染的日益加剧,寻找一种绿色能源以代替化石能源成为当今世界迫在眉睫的任务。清洁燃料当中的生物乙醇具有车用价值,可作为化石能源的替代品而受到研究学者的广泛关注。而草本能源植物的生物转化被认为是生物质能源产业化发展的最有效途径之一。能源草作为木质纤维素原料之一,由于其具有生长快,产量高,抗性强等优势而备受瞩目。详细论述了近期国内外以能源草为底物进行纤维素乙醇的生物转化研究进展,从纤维素原料预处理到乙醇发酵工艺等各方面的进展及存在的问题,并对木质纤维素制取生物质能源的生物转化效率,以及全纤维素组分的多级利用进行了简单阐述,以期找出一条产业化生产纤维素乙醇的最优生产模式。
生物质能源;能源草;生物转化;纤维素乙醇
近年来,随着能源需求的增加和石油资源的日渐枯竭,可再生生物质能源受到越来越多的关注,寻找化石燃料的替代能源成为人们的共识[1]。燃料乙醇作为一种替代能源得到了各国的重视和发展。最初利用生物转化制取燃料乙醇的原材料主要是玉米、甘蔗等富含淀粉和糖类可食用物质。为了不与人争粮、不与粮争地,逐渐发展出了以木质纤维素原料的第三代纤维素乙醇。而木质纤维素中的能源草由于抗逆性强和适应性广等特点,成为制取纤维素乙醇的焦点之一。20世纪80年代,美国能源部就已开始将能源草中的柳枝稷作为生物能源进行研究与尝试,以减少对外国石油的依赖[2]。目前,以能源草生产纤维素乙醇的研究很多,但都止步于实验室阶段。这是由于能源草复杂的结构导致乙醇生产工艺繁琐、原料利用率低、分离能耗大,致使生产成本高于采用糖和淀粉类原料[3]。充分利用木质纤维素原料、简化生产工艺、降低生产成本、减少废水和废渣的排放,是纤维素燃料乙醇研发面临的挑战。
本文论述了国内外生物转化能源草制取纤维素乙醇的主要研究近况,包括预处理工艺、乙醇发酵菌株、发酵工艺等各方面的进展及存在问题,并结合本实验室的最新研究成果,提出了一些较为可行的解决办法,以期找出一条产业化生产纤维素乙醇的最优生产模式,为推动我国纤维素乙醇产业化发展提供有价值的参考。
1 能源草特点
所谓“能源草”,是指生长迅速、生物质产量高的草本植物,一般为两年或多年生植物,是可直接作用于生产生物质能源的草本植物的统称[4]。能源草具有以下特点[2]:(1)多为耐旱、耐盐碱、耐瘠薄、适应性强的草种,对土质和气候要求不高,耐寒、抗冻、生长快,产量高;(2)具有高的热值,其碳原子含量占主要成分的64%;(3)为多年生禾本科C4植物,固定CO2的效率远远高于C3植物。因此,草本能源植物在很大程度上解决了生物质能源产业化的原料问题,其生物转化被认为是生物质能源产业化发展的最有效途径之一。
2 能源草预处理
2.1 能源草预处理的必要性
预处理是纤维素乙醇生产中的关键环节,且预处理过程所产生的费用约占纤维素乙醇生产成本的20%[5]。因此,世界各国都针对预处理开展了大量的研究。作为木质纤维素原料的能源草,其结构主要由纤维素、半纤维素和木质素组成。其中的木质素在纤维素周围形成保护层并与半纤维素通过共价键相连,使整个分子结构形成高度结晶聚合物。因此,高效的预处理工艺能有效改变植物细胞壁的结构和组成分布,去除细胞壁微纤维的半纤维素外鞘,暴露结晶纤维素内核,打开了酶分子进入的通道,从而显著地的提高其对酶作用的敏感性,同时预处理后的底物要具有高的糖回收率和低含量的降解产物。在众多预处理过程中,由于酸、碱预处理可以将半纤维素水解和溶解被认为是导致纤维素酶可及面积增大的主要机制[6],并且稀酸预处理由于其低的酶加量和较高的木糖回收率,碱性预处理可使木质素溶解,剩余纤维素与半纤维素,提高了成分利用率,使纤维素乙醇的经济性得到改善而被广泛采用,但酸碱预处理都面临着高温下设备腐蚀和后续污水处理的问题采用率逐渐减少。青贮也是近年来发展起来的一种针对能源草的预处理方式。根据植物生理学变化规律,草本植物在收割后,呼吸作用加强,通过微生物厌氧菌群的发酵作用将原料中部分纤维素、半纤维素转化为糖类。糖类经有机酸发酵转化为乳酸、乙酸和丙酸,并可抑制产丁酸菌和霉菌等有害微生物的繁殖,为后续的厌氧消化产甲烷提供可利用物质[7]。青贮操作简单,预处理周期长,受季节、温度的限制,并且随着易于消化的蛋白质、可溶性糖和维生素等营养成分的水解,粗纤维素比例增加,造成剩余组成结构复杂、坚韧,对后续的加工和利用造成困难[8]。因此,青贮并不能成为广泛应用于能源草预处理的科学方法。
2.2 蒸汽爆破预处理能源草
不同于以上预处理,蒸汽爆破由于其快捷,无污染、能耗低、不添加化学品及产物中抑制剂浓度低等优点而成为目前国内外首选的能源草预处理方式(表1)。蒸汽爆破预处理是将原料置于高温高压条件下,迫使高压水蒸汽渗入纤维内部并骤然降压,造成气体迅速膨胀而产生闪爆,从而破坏木质纤维素的大分子结晶度,实现其化学组成和微观结构的改变。
能源草种类繁多,构成木质纤维素结构的成分含量以及大分子结晶程度存在差异。因此近年来,很多学者都热衷于对汽爆预处理条件的优化。Juliana等[10]在优化蒸汽爆破条件处理芒草(Miscanthus)时,随着半纤维素的损失,汽爆产物中抑制剂的含量明显增加,乙酸含量达到了0.6 g/L。Scholl等[11]在200℃高温下汽爆芒草的纤维素百分含量以及糖回收率均无190℃时处理的高,但在200℃条件下糠醛与呋喃含量分别达到了0.47 g/L和0.55 g/L,明显高于190℃的0.21g/L和0.4 g/L。分析原因是,在高温条件下保留时间过长易造成纤维素糊化,并且使释放的糖进一步氧化为糠醛、呋喃等毒性化合物。此外木质纤维素原料中的半纤维素在汽爆条件为160-220℃之间损失率为47.6%-73.3%,葡萄糖回收率达到了60%-80%[12-14]。因此,蒸汽爆破预处理能源草的条件优化对后续的乙醇发酵性能及微生物菌种活性都十分必要。如何选择最优的汽爆强度系数,在降低纤维素结晶程度以保证葡萄糖得率的同时,还要尽量减少半纤维的损失及乙酸等发酵抑制剂的产生,这无疑值得国内外学者们去深入探讨和研究。
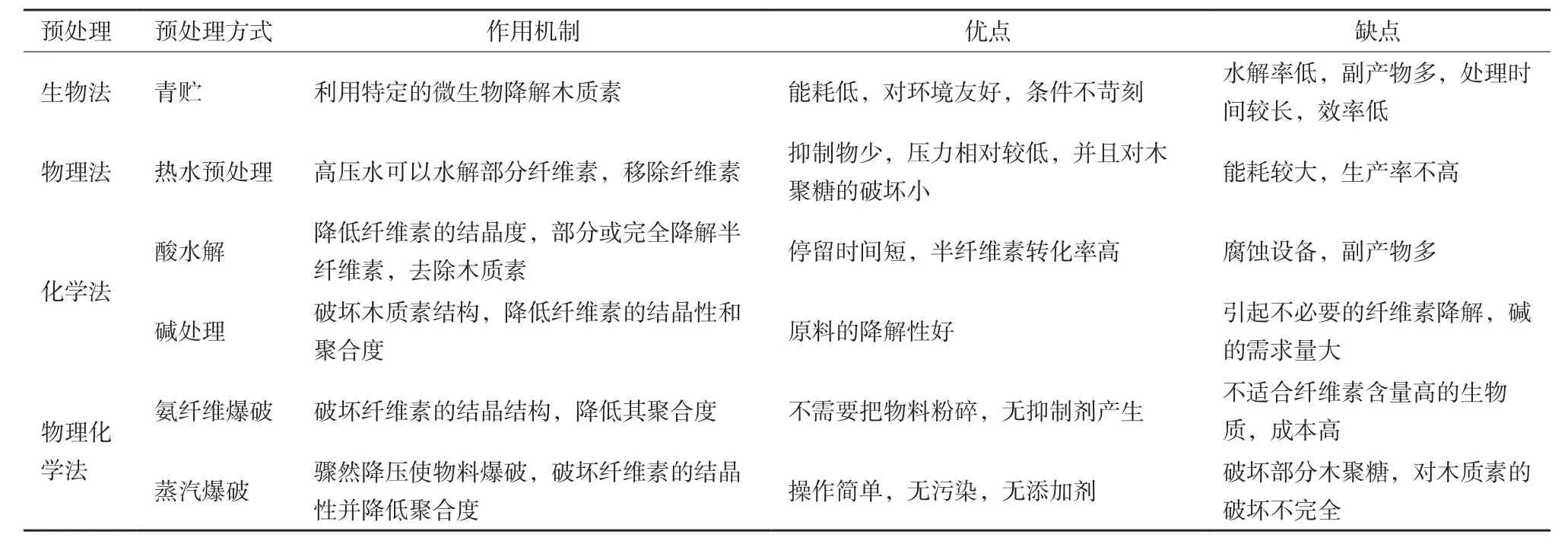
表1 不同能源草预处理方式的比较[9]
3 能源草制取纤维素乙醇的发酵工艺研究
3.1 同步糖化发酵工艺是制取纤维素乙醇的主流工艺
近几十年来对纤维素乙醇的研究不断深入,普遍认为纤维素乙醇的发酵工艺是突破纤维素乙醇产业化的关键技术。而同步糖化发酵工艺由于酶水解与发酵在同一发酵罐中进行,发酵罐内的纤维素水解速度远低于葡萄糖消耗速度,为糖转化成乙醇创造了有利条件,提高了纤维素酶的效率,并且发酵时间短、减少了外部微生物污染及反应介质中可以有乙醇存在和厌氧性条件等,是目前一种主流的生产纤维素乙醇的发酵策略。如Zhang等[15]以柳枝稷、芒草、大须芒草以及混合杂草进行了纤维素乙醇的生产,结果表明以4%(W/V)柳枝稷为底物,经同步糖化发酵,最终的乙醇产量达到了21.7g/g干物质,为4种草中乙醇含量达到最高。Laura等[16]通过烯酸-碱法二次预处理紫色狼尾草,以10%(W/V)底物浓度经同步糖化发酵,获得乙醇24 g/L,乙醇产率达到了52.9%,纤维素转化率达到了64.4%。此外还有很多利用能源草进行纤维素乙醇的生产,如表2所示。
3.2 高底物浓度是能源草制取纤维素乙醇的关键
综合评价这些研究,为了能够实现较为理想的纤维素转化率,许多研究小组通常会选择在反应体系中使用较低底物浓度(<15%(W/V),从而造成最终的乙醇发酵浓度低(5<%(W/V))而不能真正满足工业化的需求。为此,有研究学者提出“高底物浓度发酵”。但是,由于能源草在预处理过程中不可避免地会产生多种毒性化合物如糠醛、呋喃、酚等,随着底物浓度的提高,造成发酵体系中的抑制剂浓度增大。另外,高底物浓度还意味着反应体系的黏稠度增加,传质与传热性能下降等一系列问题,进而影响酶解效率以及菌种活力,造成纤维素乙醇产量的降低。为了解决这些问题,目前普遍认同将补料发酵工艺与同步糖化发酵相结合,根据操作方式不同,将其分为分批发酵(Batch fermentation)、连续发酵(Continuous fermentation)以及补料分批发酵(Fed-batch fermentation)3 种类型。在能源草生产纤维素乙醇过程中,完全封闭式的分批发酵或者纯粹的连续发酵较为少见,更多见的是补料批式发酵。如Kang等[17]利用芒草为底物,通过批式补料同步糖化策略,在底物浓度为30%(W/V),乙醇产量达到了64 g/L,乙醇产率在72 h时达到了76.5%。本实验室在前期工作中,经过反复的尝试和研究,采用批式补料的策略,将汽爆预处理木质纤维素的底物浓度从最初的15%(W/W),经过连续3次批式补料,在发酵36 h前提升到35%(W/W),发酵72 h的乙醇产量达到69.8 g/L,达到乙醇理论产率的72.5%,纤维素转化率达到了80%,完全达到了工业化乙醇生产的要求,居国内外先进水平[18]。

表2 不同能源草的乙醇产量[19-28]
4 生物转化能源草联产制取乙醇和甲烷研究
4.1 能源草制取乙醇和甲烷的可行性
为了提高能源草原料制取纤维素乙醇的利用率,尤其是全纤维素组分(纤维素+半纤维素)的生物转化率,进一步实现木质纤维素的多级利用,可以尝试将乙醇发酵与厌氧消化产甲烷这两个生物转化过程进行整合。能源草经过乙醇发酵及蒸馏后的发酵醪液被称为发酵残留物。发酵残留物含有较高的总固体含量(TS)和挥发性固体的含量(VS),这意味着发酵残留物有较高的可利用性和挑战性。可利用性是由于含有较高的VS含量,这是厌氧消化微生物所能利用的,而较高的TS含量,造成厌氧消化体系中黏稠度增加、机械搅拌困难、微生物分布不均衡等从而造成厌氧消化性能下降。因此,国内外学者一般将发酵残留物固液进行分离,液体部分用于厌氧消化。如Wahida等[29]利用芒草先进行乙醇发酵,发酵残留物的液体部分进行厌氧消化实验,有机负荷控制3.2-6 gVS/Ld,最大甲烷产率达到了300 mL/gVS。Kreuger等[30]也利用桑科多年生植物,进行乙醇发酵,获得乙醇171 g,发酵残留物上清液,进行了厌氧消化,获得甲烷93 g。由此可见,利用能源草将同步糖化发酵和厌氧消化结合起来的生物统和加工过程,可以实现木质纤维素的多级利用。
4.2 全组分乙醇发酵残留物的厌氧消化研究
以上例子均采用乙醇发酵残留物的上清液进行厌氧消化,这种利用发酵残留物上清液进行乙醇甲烷联产策略,虽然在一定程度上提高了生物转化效率,但是在乙醇发酵残留物的固体中也含有大量未被降解的纤维素。为了使能源草的纤维素组分的尽可能的全部利用,有研究学者提出将乙醇发酵全残留物进行厌氧消化,一方面简化了操作工艺;另一方面最大限度的实现能源草的全组分利用。乙醇发酵全残留物由于固体含量高,一般的厌氧消化反应器,如UASB等反应器并不适合这种高悬浮固体含量。因此,选择适用的厌氧消化器对于稳定厌氧菌群、提高厌氧消化效率、提高甲烷产率具有一定影响。一般常见的用于能源草固体消化的反应器,如表3[31-39]。良好的设备为能源草转化为清洁能源提供了反应环境和基础。如Luca等[28]利用CSTR反应器处理芦荻乙醇发酵全残留物,通过单相批示厌氧消化,有机负荷在2.8 gVS/L/d时,甲烷产率达到289 mL/gVS。Carvalho等[37]利用象草,将乙醇发酵后的全残留物,在CSTR反应器中进行了单相厌氧消化,在有机负荷为1.13 gVS/L/d时甲烷产率达到了310 mL/gVS,挥发性固体(VS)的去除率达到了66%。这种利用合适的反应器进行的全残留物厌氧消化,不仅实现能源草的多级利用,而且将纤维素的转化率提高了23%-38%。除此之外,本实验团队利用4种能源草(冰草、针茅草、披碱草和荻),经同步糖化发酵后分别获得乙醇7.5 g、6.5 g、8.0 g和7.5 g,用乙醇发酵完的全残留物,进行厌氧发酵。并分别获得甲烷17.44 g、16.21 g、16.8 g和13.3 g甲烷,最后再将木质素进行了提取,同样实现了能源草的多级利用。与国内外其他能源草产清洁能源相比,纤维素转化率提高了30%,最终整个纤维素转化率高达到85%以上[40],这在国内外鲜有文献报道。因此,这种生物转化能源草联产制取乙醇和甲烷是一种很有前景的制取清洁能源的策略。

表3 单相CSTR厌氧消化比较[29-37]
5 结语
本文综述了以能源草为原料,通过预处理方法,尤其是蒸汽爆破预处理方法,高效的破坏木质纤维素结晶程度,再将汽爆后的原料通过高底物批式补料同步糖化发酵和厌氧消化制取清洁能源乙醇和甲烷的方法,实现了木质纤维素原料组分的充分利用。但是,在生产过程中还存在一些问题,如目前预处理方法耗能多、化学药品用量较多对环境也有污染,并且木质素分离不完全、部分木糖被破坏后处理损失可溶性半纤维素组分使总糖化率降低。此外,在糖化发酵过程和厌氧消化过程中生物质能的转化效率不高,传质能力低,并且受多种营销因素的制约,技术单一、创新力量薄弱,均阻碍了生物能源的开发利用。本文提出的这种联产乙醇-甲烷的生物转化策略,偶联集成生物质联产液体与气体燃料技术,形成清洁高效的生物质能源转化工艺,为推动生物质能源的可持续发展提出了新的设想。
[1] 汪辉, 周禾, 高凤芹等. 能源草发酵产沼气的研究进展[J].山东农业科学, 2014, 46(3):135-139.
[2] Gallego L, Escobar A, Penuela M. King Grass:A promising material for the production of second-generation butanol[J]. Fuel, 2015, 143:399-403.
[3] 牛红志, 李连华, 孔晓英, 等. 三种能源草厌氧发酵制备生物燃气初步研究[J]. 新能源展, 2015(3):192-196.
[4] 高瑞芳, 张建国. 能源草研究进展[J]. 草原与草坪, 2013, 1(33):89-96.
[5] 闫莉, 吕惠生, 张敏华. 纤维素乙醇生产技术及产业化进展[J].酿酒科技, 2013(10):80-84.
[6] Ding SY, Himmel ME. The maize primary cell wall microfibril:a new model derived from direct visualization[J]. Agric Food Chem, 2006, 54(3):597-606.
[7] 贾晶霞, 梁宝忠, 王艳红, 等. 不同汽爆预处理对干玉米秸秆青贮效果的影响[J]. 农业工程学报2013, 29(20):192-198.
[8] Kaien R, Fumitaka S, Jun A, et al. Biomass yield and nitrogen use efficiency of cellulosic energy crops for ethanol production[J]. Biomass and Bioenergy, 2012, 37:330-334.
[9] 阎金龙, 王艳君, 马烽, 等. 木质纤维素原料预处理技术相关研究进展[J]. 中国酿造, 2013, 32(11):7-10.
[10] Vasco-correa J, Li YB. Solid-state anaerobic digestion of fungal pretreated Miscanthus sinensis harvested in two different seasons[J]. Bioresource Technology, 2015, 185:211-217.
[11] Scholl AL, Menegol D, Pitarelo AP, et al. Ethanol production from sugars obtained during enzymatic hydrolysis of elephant grass(Pennisetum purpureum, Schum. )pretreated by steamexplosion[J]. Bioresource Technology, 2015, 192:228-237.
[12] Alvira P, Tomás-Pejó E, Ballesteros M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J]. Bioresource Technology, 2010, 101(13):4851-4861.
[13] Conde MC, Jiménez GA, Halwagi EM. A comparison of pretreatment methods for bioethanol production from lignocellulosic materials[J]. Process Safety and Environmental Protection, 2012, 90(3):189-202.
[14] Limayem A, Ricke SC. Lignocellulosic biomass for bioethanol production:current perspectives, potential issues and future prospects[J]. Progress in Energy and Combustion Science, 2012, 38(4):449-467.
[15] Zhang K, Loretta J, Vara P, et al. Comparison of big bluestem with other native grasses:chemical composition and biofuel yield[J]. Energy, 2015, 83:358-365.
[16] Laura C, María BR, Mairan G, et al. Evaluation of dilute acid and alkaline pretreatments enzymatic hydrolysis and fermentation of napiergrass for fuel ethanol production[J]. Biomass and Bioenergy, 2015, 74:193-201.
[17]Kang KE, Chung DP, Kim Y, et al. High-titer ethanol production from simultaneous saccharification and fermentation using a continuous feeding system[J]. Fuel, 2015, 148:18-24.
[18] Wang Z, Lv Z, Du JL, et al. Combined process for ethanol fermentation at high-solids loading and biogas digestion from unwashed steam-exploded corn stover[J]. Bioresource Technology, 2014, 166:282-287.
[19] Camesasca L, María Belen R, Mairan G, et al. Evaluation of dilute acid and alkaline pretreatments, enzymatic hydrolysis and fermentation of napiergrass for fuel ethanol production[J]. ScienceDirect, 2015, 74:193- 201.
[20] Kallioinen A, Uusitalo J, Pahkala K, et al. Reed canary grass as a feedstock for 2nd generation bioethanol production[J]. Bioresource Technology, 2012, 123:669-672.
[21] Kaien R, Fumitaka S, Jun A, et al. Biomass yield and nitrogen use efficiency of cellulosic energy crops for ethanol production[J]. Biomass and Bioenergy, 2012, 37:330-334.
[22] Krzysztof JJ, Bogdan D, Wojciech SB, et al. Energy efficiency of crops grown for biogas production in a large-scale farm in Poland[J]. Energy, 2016, 109:277-286.
[23] Hamed M, Mashad E. Biomethane and ethanol production potential of spirulina platensis algae and enzymatically saccharified switchgrass[J]. Biochemical Engineering Journal, 2015, 93:119-127.
[24] Van Dyk JS, Pletschke BI. A review of lignocellulose bioconversion using enzymatic hydrolysis and synertistic cooperation between enzymes-factors affecing enzymes, conversion and synergy[J]. Biotechnol Adv, 2012, 30:1458-1480.
[25] Luis JG, Andrey E, Mariana P. King Grass:a promising material for the production of second-generation butanol[J]. Fuel, 2015, 4:399-403.
[26] Rashmi K, Rohit R, Ramesh B, et al. Saccharification of alkali treated biomass of kans grass contributes higher sugar in contrast to acid treated biomass[J]. Chemical Engineering Journal, 2013, 230:36-47.
[27] Suryawati L, Wilkins MR, Bellmer DD, et al. Effect of hydrothermolysis process conditions on pretreated switchgrass composition and ethanol yield by SSF with Kluyveromyces marxianus IMB4[J]. Process Biochemistry, 2009, 44(5):540-545.
[28] Luca C, Samuele L, Carlo R, et al. Giant cane(Arundo donax L.)can substitute traditional energy crops in producing energy by anaerobic digestion, reducing surface area and costs:A full-scale approach[J]. Bioresource Technology, 2016, 218:826-832.
[29] Wahida R, Susanne FN, Veronica MH,et al. Methane production potential from Miscanthus sp.:Effect of harvesting time, genotypes and plant fractions[J]. Biosystems Engineering, 2015, 133:71-80.
[30] Kreuger E, Sipos B, Zacchi G, et al. Bioconversion of industrial hemp to ethanol and methane:The benefits of steam pretreatment and co-production[J]. Bioresource Technology, 2011, 3(102):3457-3465.
[31] Simona M, Alexander Br, Franz T, et al. Biogas production from steam-exploded miscanthus and utilization of biogas energy and CO2in greenhouses[J]. Biomass and Bioenergy, 2013, 6:620-630.
[32] Castrillón L, Fernández NY, Ormaechea P, et al. Methane production from cattle manure supplemented with crude glycerin from the biodiesel industry in CSTR and IBR. [J]. Bioresource Technology 2013, 127:312-317.
[33] Wang F, Taira H, Jun T. Enhancement of anaerobic digestion of shredded grass by co-digestion with sewage sludge and hyperthermophilic pretreatment[J]. Bioresource Technology, 2014, 169:299-306.
[34]Dareioti MA, Kornaros M. Effect of hydraulic retention time(HRT)on the anaerobic co-digestion of agro-industrial wastes in a twostage CSTR system[J]. Bioresource Technology, 2014:407-415.
[35]Kaparaju P, Serrano M, Angelidaki I. Optimization of biogas production from wheat straw stillage in UASB reactor[J]. Applied Energy, 2010, 87(12):3779-3783.
[36]Lehtoma A, Nizami AS, Murphy JD, et al. Optimizing the thermophilic hydrolysis of grass silage in a two-phase anaerobic digestion system[J]. Bioresource Technology, 2013, 143:117-125.
[37]Carvalho AR, Fragosoa R, Gominho J. et al. Water-energy nexus:anaerobic co-digestion with elephant grass hydrolyzate[J]. Journal of Environmental Management, 2016, 181:48-53.
[38]Luo G. Anaerobic treatment of cassava stillage for hydrogen and methane production in continuously stirred tank reactor(CSTR)under high organic loading rate(OLR)[J]. Nrnaonal Jornal of Hydrogn Nrgy, 2010, (21):11733-11737.
[39]Westerholm M, Hansson M, Schnürer A. Improved biogas production from whole stillage by co-digestion with cattle manure[J]. Bioresource Technology, 2012, 114:314-319.
[40] Zuo Z, Tian S, Chen ZB, et al. Soaking pretreatment of corn stover for bioethanolproduction followed by anaerobic digestion process[J]. Appl Biochem Biotechnol, 2012, 167:2088-2102.
(责任编辑 狄艳红)
Research Progress on the Biological Conversion of Energy Grass to Cellulosic Ethanol
BAI Long LI Chun-mei LÜ Tu DU Ying YANG Yue TIAN Shen
(College of Life Sciences,Capital Normal University,Beijing 100048)
With the increasing depletion of fossil fuels and the deterioration of environmental pollution,seeking a green energy to replace fossil energy is an urgent task for the world. Bio-ethanol as a clean energy presents the value for vehicle,and can be used as a clean substitute of fossil energy,which is widely concerned by the researchers. And bio-conversion of grass energy is recognized as the most efficient measure for the industrialization of biomass energy. Energy grass as one of lignocellulose materials,because of its fast growth,high yield,strong resistance and other advantages,has been attracted much attention. This paper discusses the recent progresses on the bio-conversion of energy grass as substrate for cellulosic ethanol,i.e.,advances and existing problems in varied aspects from the pretreatment of raw cellulose to the fermentation process of ethanol,bioconversion efficiency in the bioenergy production from lignocellulose,and conprehensive utilizations of all components of lignocellulose are briefly discussed,aiming at finding out an optimal production mode for the industrial production of cellulosic ethanol.
biomass energy;energy grass;bio-conversion;cellulosic ethanol
10.13560/j.cnki.biotech.bull.1985.2017.05.007
2016-11-17
国家自然科学基金项目(31570790),国家科技支撑计划项目(2013BAD22B03)
白龙,男,硕士研究生,研究方向:探究纤维素乙醇与甲烷联产;E-mail:bailongjob@163.com
田沈,女,教授,研究方向:微生物清洁能源;E-mail:cnu_tianshen@sina.com

