水稻无花粉型核雄性不育突变体whf41的鉴定与基因定位
轩丹丹孙廉平张沛沛 张迎信 吴玮勋 杨正福 占小登 沈希宏 曹立勇程式华
(中国水稻研究所/水稻生物学国家重点实验室/浙江省超级稻研究重点实验室,杭州311401;#共同第一作者;*通讯联系人,E-mail:caoliyong@caas.cn,shcheng@mail.hz.zj.cn)
水稻无花粉型核雄性不育突变体whf41的鉴定与基因定位
轩丹丹#孙廉平#张沛沛 张迎信 吴玮勋 杨正福 占小登 沈希宏 曹立勇*程式华*
(中国水稻研究所/水稻生物学国家重点实验室/浙江省超级稻研究重点实验室,杭州311401;#共同第一作者;*通讯联系人,E-mail:caoliyong@caas.cn,shcheng@mail.hz.zj.cn)
【目的】水稻花药角质层和蜡质层是花粉囊发育重要的结构支撑和安全屏障。对花粉囊发育相关基因进行表型分析和遗传定位,为进一步克隆相关基因和分子机制研究提供基因资源和理论基础。【方法】从籼稻中恢8015辐射诱变(60Co-γ)突变体库中分离鉴定出了一个无花粉型雄性不育突变体whf41。对野生型和突变体不同发育时期的花药进行半薄切片观察;并对其成熟期的花药进行扫描电镜观察。将突变体分别与中恢8015和02428杂交,构建BC1F1、F1株系和BC1F2、F2群体,对该表型进行遗传分析,采用图位克隆的方法精细定位目的基因。【结果】表型分析结果显示,whf41突变体的花药瘦小且呈透明乳白色,花药中不包含花粉粒细胞;半薄切片结果显示,突变体的小孢子无法形成正常的花粉外壁,绒毡层细胞异常膨大而不进行程序性死亡,最终膨胀的绒毡层和花粉细胞碎片逐渐融合并充满药室;扫描电镜结果进一步发现突变体花药内外壁均呈平滑状而缺乏脂类物质,花粉细胞逐渐破碎并降解。遗传分析表明,whf41突变体的无花粉型雄性不育性状受一对隐性核基因控制,我们将该基因精细定位于第3染色体短臂XD-5和XD-11两个标记之间,物理距离45.6 kb,其中包含9个开放阅读框。序列分析显示该区间内细胞色素P450基因LOC_Os03g07250的第4个外显子处存在1个单碱基替换和3个碱基的缺失,导致其翻译序列发生一个氨基酸的替换(天冬氨酸→甲硫氨酸)和一个氨基酸(缬氨酸)的缺失,致使其功能改变进而出现该表型。qRT-PCR检测结果表明,whf41突变体中CYP704B2和一系列花药脂质合成与转运相关基因的表达水平均发生了显著下调。【结论】根据本研究结果可推断,OsWHF41是CYP704B2的新等位基因,相关结果进一步明确CYP704B2在水稻花药脂质合成与花粉壁形成过程中的重要作用。
水稻;whf41;隐性核雄性不育;基因定位
雄性不育是指雄蕊发育不正常、不能形成有功能的花粉细胞,但雌蕊发育正常,能接受正常花粉而受精结实的现象[1]。根据其遗传机制的不同,可将其分为细胞质雄性不育、细胞核雄性不育以及核质互作雄性不育三类。其中,核雄性不育一般属于功能性不育,由核基因突变造成,表现为小孢子在发育过程中出现异常,不能形成有活力的花粉粒甚至无花粉,其突变性状可通过雌配子或雄配子稳定遗传[2-6]。
水稻作为单子叶植物的模式植物,对其雄性生殖发育的过程及相关基因的功能研究就显得尤为重要。遗传分析表明,大多数雄性不育性状是由隐性核基因突变造成的,目前已有20个以上水稻隐型核不育基因陆续被克隆[7-8],但它们在调控水稻雄性生殖发育的时期和功能等方面存在很大差异,大致可分为控制小孢子母细胞发育时期、减数分裂时期、绒毡层发育时期、花粉囊和花粉外壁发育时期以及花药开裂时期等相关的基因。第1个被报道控制早期小孢子细胞发育的基因MSP1(multiple sporocyte 1),编码由1294个氨基酸组成的富亮氨酸重复受体蛋白激酶(LRR receptor-like protein kinase),该基因主要控制初生壁细胞(PPC,primary parietal cell)和初生造孢细胞(PSC,primary sporogenous cell)的发育,能抑制孢母细胞的周边细胞再度分化成孢母细胞,起到控制大、小孢子母细胞数目的作用,同时影响花粉囊壁的发育。MSP1缺失或变异将导致水稻花粉彻底败育而雌蕊发育正常,小穗完全不育[9]。调控水稻减数分裂的基因包括PAIR(pairing aberration in rice)系列基因PAIR1、PAIR2、PAIR3,主要控制同源染色体的联会与配对[10-12];而ZEP1(zeaxanthin epoxidase1)[13]和MEL1[14]主要参与小孢子早期减数分裂阶段染色体的正常浓缩;此外PSS1[15]也是调控水稻减数分裂的重要基因,对水稻花药减数分裂的染色体动力学、雄配子形成以及花粉囊开裂具有重要意义。水稻F-box基因MEIOTIC F-BOX(MOF),对于雄性减数分裂进程至关重要,主要活跃在有丝分裂前期Ⅰ的细线期到粗线期,对于双链DNA断裂的末端处理和修复至关重要[16]。已报道的与水稻花药绒毡层发育过程相关的基因主要包括TDR(tapetum degenerationretardation)[17]、UDT1(undeveloped tapetum1)[18]、GAMYB[19]、PTC1(persistent tapetal cell)[20]、API5(apoptosis inhibitor 5)[21]、EAT1(eternal tapetum 1)[22]、TIP2(TDR interacting protein2)[23],ABCG15[24]以及ABCG26[25]等,这些基因在花药绒毡层细胞程序性死亡、绒毡层细胞与花药室之间孢子花粉素的合成和转移以及花粉粒的形成过程中起重要调控作用。
花粉囊壁外的角质蜡质等物质既是小孢子发育过程中形成完整内部结构的基本保障,又是孢粉素等必需营养物质传递的结构基础;调控此类物质发育的OsC6[26]、WDA1(wax-defi-cient anther 1)[27]、DPW(defective pollen wall)[28]、DPW2(defective pollen wall 2)[29]等基因的突变都会导致花粉囊蜡质显著减少,花粉粒皱缩,花粉败育。此外,细胞色素P450基因家族的CYP704B2[30]、CYP703A3[31]通过调控脂肪酸的ω-羟基化在控制花粉外壁形成方面也起着至关重要的作用。最后,水稻花药开裂过程,大约55%的AID1(anther indehiscence1)[32]的隐性突变小穗虽可形成可育的花粉,但花药不能开裂,并且(或者)花药隔膜退化和花药裂口破损导致花药裂开时间同花期不一致,导致不育。在水稻花药发育过程中的各个时期,雄性不育相关基因功能的正常行使和有序分工保证了花药每个部分的发育和小孢子的形成等过程有条不紊地进行。其中,脂质代谢在花粉外壁和花粉囊蜡质生物合成过程中有重要作用。在内质网中,CYP704B2编码的细胞色素P450蛋白作用C16/C18脂肪酸在ω碳位置发生羟基化,这些羟基化后的脂肪酸一部分用于绒毡层发育中的脂质代谢/转运,一部分作为花药发育过程所需的孢粉素、角质的单体,蜡质前体物质通过后续一系列相关基因的调控最终参与形成花粉外壁和花药角质层。而另一个细胞色素P450蛋白CYP703A3则作为一种链式羟化酶,作用于特异底物月桂酸,使其形成七羟基月桂酸;其表达受TDR直接调控,在水稻花药表皮角质层和花粉外壁的发育过程中发挥重要作用;单碱基插入突变体cyp703a3-2花药中的角质单体和蜡质组分含量明显减少,表现为花药表面角质层和花粉外壁发育缺陷,花药变小,呈白黄色,无花粉,完全不育。
水稻雄配子体发育过程的调控机制广泛,内容复杂,目前对其并未了解透彻。本研究中,我们对一个无花粉型雄性不育突变体whf41进行了花药发育过程的初步探究,并对该雄性不育基因进行了定位与克隆,以期更详细全面地了解水稻雄配子体发育的分子机制,为未来利用制种技术[33-34]将隐性核雄性不育株系应用在杂交水稻育种生产中提供理论基础和基因资源。
1 材料与方法
1.1 试验材料及田间管理
籼型水稻恢复系中恢8015经60Co-γ辐射诱变,在其M1代中分离鉴定出一个无花粉型雄性不育突变体whf41,通过挖稻桩的方式进行材料保存。2013年春季,在海南陵水以whf41为母本,分别与野生型和粳稻品种02428配制杂交组合,获得BC1F1和F1种子;夏季在中国水稻研究所富阳实验基地种植BC1F1和F1并观察其表型,单株收获种子。2014年夏季在浙江富阳种植BC1F2和F2群体,统计突变型与野生型的分离比,用于遗传分析和基因定位。所有亲本材料于2014年夏季种植于中国水稻研究所富阳实验基地,种植管理与大田生产相同。
1.2 花粉育性调查
开花当日,田间取回野生型和突变体的颖花,在高级立体荧光显微镜(德国蔡司,型号为SteRED Lumar V12)下观察野生型和突变体的花药表型并拍照。参照Sun[35]的方法用1%I2-KI溶液进行花药和花粉染色,在普通光学显微镜下观察并拍照。
1.3 花药发育的半薄切片观察
取野生型和突变体不同发育时期的小花,于FAA固定液(V38%甲醛∶V冰乙酸∶V50%乙醇=90∶5∶5)中固定24 h后,梯度酒精脱水、饱和番红溶液中处理2~3 h,再采用Technovit 7100树脂渗透包埋,60℃恒温烘烤4~5 d。于半薄切片机(德国徕卡,微系统型号为RM2265)上横切花药,切片厚度为2 μm,甲苯胺蓝染色后用光学显微镜(德国徕卡,微系统型号为DM2000)观察拍照[28]。
1.4 扫描电镜观察
用镊子将突变体的花药从颖壳中剥出,迅速置于2.5%戊二醛中,4℃固定24 h。用0.2 mol/L磷酸缓冲液(pH=7.4)冲洗3次,每次10 min,经过30%、50%、70%、80%、90%乙醇分别脱水10~15 min后,再用无水乙醇脱水两次,每次20 min,乙酸异戊酯置换20~30 min后,CO2临界点干燥,真空镀膜后在扫描电镜(日立台式电镜TM-1000)上选择不同倍数视野下观察、拍照并记录结果。
1.5 DNA的提取和基因定位
用简易的CTAB法分单株提取野生型、whf41突变体以及F2群体中突变型单株的DNA[28]。检测本实验室保存的SSR标记和InDel标记[36-37]在中恢8015和02428之间的多态性,选取133对平均分布于水稻12条染色体上的多态引物对8株突变型单株进行染色体连锁分析,进一步利用78个突变性单株对突变为点进行初步定位。根据Gramene(http://www.gramene.org)中公布的日本晴和9311的全基因组序列,对初定位区间内的基因组序列进行对比,寻找插入/缺失位点,利用Primer premier 5.0软件设计新的InDel分子标记,对突变基因进行精细定位,所用引物由杭州擎科梓熙生物技术有限公司合成(表1)。
PCR扩增采用北京鼎国昌盛生物技术有限责任公司的10 μL反应体系:模板DNA 1 μL、引物(20 μmol/L)1 μL、2×Taq PCR无色混合液5 μL、ddH2O 3 μL;PCR程序如下:94℃下预变性5 min;94℃下变性30 s,58℃下退火30 s,72℃下延伸45 s,共计32个循环;最后72℃下延伸5 min。PCR产物经8.0%非变性聚丙烯酰胺凝胶电泳,0.1% AgNO3染色,甲醛和NaOH显色后拍照并统计带型。
1.6 候选基因分析
在水稻基因组注释计划数据库(http://rapdb. dna.affrc.go.jp)中查阅精细定位区间内的所有开放阅读框,并对可能的候选基因进行分析。根据候选基因的全长基因组序列,设计测序引物(由杭州擎科梓熙生物技术有限公司合成),采用高保真DNA聚合酶KOD-FX分别扩增突变体whf41和野生型的全部候选基因,PCR产物送往杭州擎科梓熙生物技术有限公司进行测序,测序结果通过Contig Express软件拼接,并用DNAStar-MegAlign进行序列比对,从而确定突变位点。
1.7 实时荧光定量PCR分析
采用TOYOBO公司的包含去基因组酶的逆转录试剂盒(First Strand cDNA Synthesis Kit),分别提取野生型和突变体处于花药发育第8、9、11和12期等4个时期的花药总RNA,以Oligo(dT)18为反应引物进行第1链cDNA合成。利用qPCR分析调控花药发育的关键基因CYP704B2、CYP703A3、GAMYB、WDA1、OsC4、OsC6以及CYP704家族的两个基因(LOC-Os04g48460和LOC-Os06g03930)在野生型和突变体中的表达量。实时荧光定量PCR体系(20 μL)包括蒸馏水6.4 μL、2×SYBR qPCR混合液10 μL、上下游引物(10 μmol/L)各0.8 μL、cDNA模板2 μL,每个样品3个重复。PCR扩增程序为95℃下30 s;95℃下5 s,58℃下30 s,72℃下15 s,共计35个循环。

表1 本研究所用引物Table 1.Primers used in the research.
2 结果与分析
2.1 突变体表型分析
突变体whf41的营养生长及其主要农艺性状与其野生型中恢8015基本无显著差异,而且突变体的花器官组成和幼穗发育进程也与野生型基本相同。唯一的差异在于,野生型的花药饱满呈金黄色,而突变体的花药瘦小呈透明乳白色(图1-A、B)。花粉镜检结果也显示,野生型中恢8015的花药内充满成熟的花粉粒,且为典型的饱满圆形、能被I2-KI完全染色成深黑色(图1-C、D),表明野生型花粉育性正常;而突变体whf41花药经过染色压片显示,其花药内室为空腔,并无花粉粒释放出来,花粉细胞I2-KI染色也并未发现花粉粒细胞,完全不育(图1-C、D)。
2.2 花药半薄切片分析
野生型和突变体在花药发育过程中的细胞学差异主要通过花药半薄横切来观察。张大兵等[4]将花药发育过程划分为14个时期,在whf41中,突变体花药发育形态在第1~8期与野生型均无显著差异,花粉母细胞进行正常的减数分裂并形成四分体(图2-A、F)。但在第9期,野生型小孢子细胞(花粉粒)从四分体中分离,绒毡层浓缩且染色加深,中间层逐渐消失不见(图2-B);然而在此时期的whf41突变体花药中,小孢子细胞(花粉粒)虽正常分离,但绒毡层皱缩不明显(图2-G)。到第10期,野生型小孢子细胞(花粉粒)逐渐由液泡化形态转变成去液泡化状态,花粉外壁形成,绒毡层继续降解(图2-C);而突变体whf41花药内小孢子细胞(花粉粒)并未发生液泡化,呈现的形态是花粉细胞破碎、发育中止,无花粉外壁结构,绒毡层开始膨胀,颜色变浅(图2-H)。至第11期,野生型小孢子经过一次不对称的有丝分裂形成一个生殖细胞和一个营养细胞(图2-D),但突变体whf41的花药膨胀、绒毡层和破碎的花粉细胞碎片混为一体(图2-I)。最终到了第12期,野生型的二胞花粉又经过一次有丝分裂形成两个精核,至此,形成了由两个精核和一个营养核组成的成熟花粉粒(图2-E);但在whf41突变体的花药中,膨胀的绒毡层和花粉细胞碎片逐渐充满药室,花药形状由原来的圆形变成椭圆形,并在后续发展阶段一直保持此种状态(图2-J)。
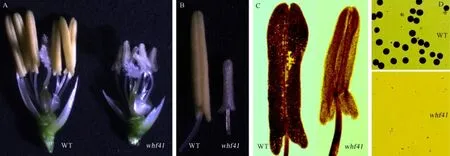
图1 野生型中恢8015(WT)与突变体whf41的表型分析Fig.1.Phenotypic comparison of wild type Zhonghui 8015(WT)and the whf41 mutant.
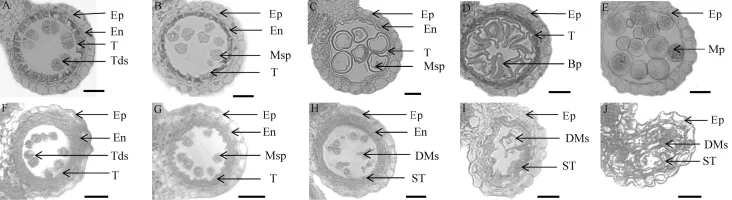
图2 野生型中恢8015和whf41突变体野生型不同发育时期花药半薄横切观察Fig.2.Transverse section of anthers of the wild type and whf41 at different developmental stages.
2.3 花药和花粉外壁的扫描电镜观察

图3 野生型和whf41花药和花粉结构的扫描电镜观察Fig.3.SEM observation of the anther and pollen grains in wild type and the whf41 mutant.

表2 whf41突变位点的遗传分析Table 2.Genetic analysis of the whf41 locus.
为更细致了解whf41花药和花粉发育畸形的特点,我们采用扫描电镜对野生型中恢8015和whf41突变体第13期的花药内外壁和花粉外表面进行了详细的观察、比较和分析。由图3可以看出,突变体whf41的花药较野生型明显短小,且从花药外表皮结构来看,野生型的成熟花药表面较为饱满,由线状物质组成;而突变体花药外表面呈光滑圆润状态,蜡质和角质等线状物质排列明显平滑(图3-A~D,G、H);更明显的是,野生型成熟花药的内壁的乌氏体单体等结构分布均匀且结构规则,表面光滑,前乌氏体结构暴露于药室,而突变体的内壁仍然是光滑平面状态,只存在极小的小孔,而未观察到乌氏体和孢粉素等物质(图3-E、F和I、J)。进一步对野生型和whf41的花粉结构观察发现,野生型的花粉粒呈饱满的圆球状,其外表皮质地均匀且孢粉素充分得以利用,并以相对规则的颗粒形式积累(图3-K、M、O),而whf41突变体的花粉明显小于野生型,且为皱缩的干瘪状,紧贴在平滑的花药内壁上(图3-L),进一步放大倍数对第13期花粉外壁进行观察发现,whf41花粉外壁存在显著地裂缝,而且越往后期越明显(图3-N、P),这很可能是因为突变体内的花粉粒细胞由于营养不足而最终逐渐断裂、破碎并消化,最终溶入花药内室,这与半薄切片观察结果一致。进一步证明,突变体的花药内壁的物质和花粉外壁的孢粉素、乌氏体合成与转运均产生了障碍。
2.4 突变体遗传分析
以whf41为母本,分别与02428和中恢8015配制杂交组合,得到F1和BC1F1家系,对其花药、花粉和小穗育性进行统计,发现其F1植株花粉育性和小穗育性均正常;经卡方检验,F2群体中的野生型与突变型植株数量的比值,符合3∶1的遗传分离比(表2)。同期,我们还统计了野生型中恢8015和02428杂交BC1F1代结实率及其F2群体内的所有单株,其中并未发现无花粉型雄性不育植株(表2)。以上情况表明whf41的突变性状受一对隐性核基因控制的,且与遗传背景无关。
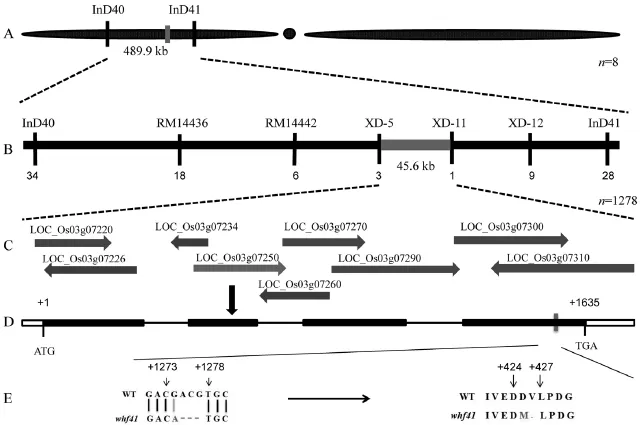
图4 突变基因的图位克隆Fig.4.Positional cloning of the whf41 mutated gene.
2.5 目的基因的定位与序列分析
为定位控制突变体whf41无花粉性状的雄性不育基因,选取了平均分布于12条染色体上的133对多态性引物,利用78株突变型单株将控制该性状的基因初步定位于第3染色体短臂上的InD40到InD41两个InDel标记之间,物理距离490 kb(图4-A)。进一步扩大定位群体后,并参考Gramene网站(http://www.gramene.org/)公布的日本晴和9311全基因组序列,在这两个标记之间设计了InDel标记,最终将目的基因定位于XD-5和XD-11标记之间,物理距离为45.6 kb(图4-B)。
根据NCBI(http://www.ncbi.nlm.nih.gov)和水稻基因组注释计划数据库(http://rapdb.dna.affrc.go. jp)提供的水稻基因组注释序列,在XD-5和XD-11两个标记之间的45.6 kb区间内包含9个注释基因(图4-C)。对突变体中此候选区域的ORF进行功能预测、扩增PCR产物直接回收测序并与野生型测序结果比对发现,其中LOC_Os03g07250基因的第4外显子区发生了1个碱基的替换和紧接着的3个碱基的缺失。该阅读框为一个细胞色素P450氧化还原酶基因,由4个外显子和3个内含子组成(图4-D),全长2.332 kb,编码区长度1.635 kb,编码一个由544个氨基酸组成、含有跨膜结构域的细胞色素P45家族蛋白。在whf41突变体中,该基因从ATG开始的第1273位置发生了一个由G到A的单碱基替换,紧接着从第1274个碱基开始发生了3个碱基的缺失,导致接下来翻译的多肽链中出现一个氨基酸的替换(天冬氨酸→甲硫氨酸)和一个氨基酸(缬氨酸)的缺失(图4-E),此突变可能导致其蛋白结构发生变化,进而失去原有的功能。因此,whf41的候选基因很有可能是LOC_Os03g07250。
2.6 花药发育相关基因的表达分析
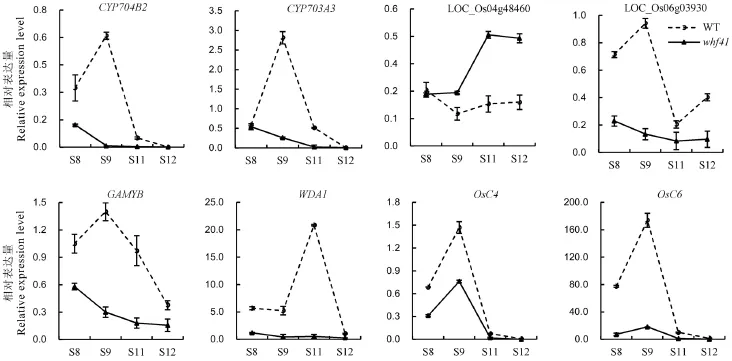
图5 野生型与whf41突变体中水稻花药发育相关基因的表达Fig.5.Expression profile of the genes involved in anther development in wild type and whf41 plants.
通过qPCR分析比较了whf41与野生型中已克隆的相关隐性核不育基因的相对表达量,包括细胞色素P450家族基因CYP704B2、CYP703A3及CYP704B2在水稻中的同源基因LOC_Os04g48460、LOC_Os06g03930、调控花药绒毡层PCD的GAMYB、调控花粉蜡质形成的WDA1、调控花药脂质转移的基因OsC4和OsC6。如图5所示,除了LOC-Os04g48460在whf41突变体中花药发育中后期的表达量有所提高以外,其他基因在突变体whf41的第9期之后其相对表达量均显著降低。与前文半薄切片和扫描电镜观察结果一致,这些表达模式的变化进一步证实了whf41突变体中LOC_Os03g07250的突变在花药内外壁和花粉发育过程中角质和蜡质等脂肪酸的合成与转运中的重要作用。但突变体中LOC-Os04g48460的表达量在花药发育后期却有略微的上调,推测其可能存在一定的反馈调节,但仍需进一步验证。
3 讨论
本研究对一个无花粉型雄性不育突变体whf41进行了表型分析和基因定位,结果表明,该突变体受一对隐性核基因控制,位于第3染色体短臂的XD-5和XD-11两个标记之间,物理距离45.6 kb。该区域中的细胞色素P450家族基因LOC-Os03g07250内第4外显子的1个单碱基替换和随后的3个碱基的缺失导致该基因蛋白序列发生1个氨基酸的替换和1个氨基酸缺失,导致该基因在突变体花药发育后期表达量显著下调,可能是引起whf41突变无花粉表型的原因。
本研究中的无花粉型雄性不育突变体whf41与之前报道的cyp704b2表型相似[30],但二者的表型和突变位点均存在明显差异。cyp704b2突变体,由粳稻9522辐射诱变得来,虽然也是由LOC-Os03g07250基因的突变导致,但该突变体中LOC-Os03g07250基因的第4外显子之前(1-1112 bp)及其外启动子部分和后一开放阅读框(LOC-Os03g07260)的258 bp全部缺失,共3.1 kb,导致其蛋白序列出现了大片段的氨基酸缺失。而本研究中的whf41突变体由籼稻恢复系辐射诱变而来,其突变位置仅发生在该基因的第4外显子(包含1个碱基和随后的3个碱基的缺失),导致蛋白序列出现1个氨基酸的替换和1个氨基酸的缺失。从表型上看,cyp704b2花药变小且呈淡黄色,表达分析结果显示该基因在花药发育的第8~10期的绒毡层和小孢子中特异表达[30],至花药发育的第10期,小孢子发育就终止并与绒毡层一起充满花药内腔。而本研究中whf41突变体内的花药则更加瘦小且呈透明的乳白色,可见其表型更加明显;花药半薄切片结果也表明,突变体whf41减数分裂正常,能形成正常的四分体和小孢子(图2-F),最明显的突变从花药发育的第9期开始,whf41中的小孢子液泡化不明显且表面不能形成花粉外壁,绒毡层细胞异常膨胀,中间层并未降解,后续过程中绒毡层未进行正常的PCD过程,而且小孢子细胞开始破裂,并未发生液泡化,退化的小孢子碎片(DM)与膨胀的绒毡层逐渐融合并充满整个花药腔室,该过程一直持续到第12期。扫描电镜结果也进一步显示,本文中无花粉型雄性不育突变体whf4中的花粉细胞外壁破碎及降解是发生在有丝分裂后期(第11期和第12期),且一直延续至花粉粒成熟期,甚至花药内壁也呈平滑状而缺乏孢粉素等成分,因此,其异常发育过程比cyp704b2更久且彻底,是该基因一个败育更加彻底的等位突变体。可见,LOC-Os03g07250不同位点发生突变对水稻花药和花粉发育过程的影响具有一定差异。
水稻中已发现的有功能的植物细胞色素P450家族基因有300多个,植物细胞色素P450具有广泛的催化活性,其催化作用的共同特点是在作用物分子中加入一个氧原子,其主要功能是参与生物合成和生物解毒途径[38]。CYP704B2属于植物Ⅰ型细胞色素P450家族蛋白基因,其蛋白酶主要催化代谢外源底物,具有E类基因功能,参与花药角质层、小孢子外壁形成所需脂肪酸的羟基化过程[38],whf41突变体花药内外壁以及花粉外壁破碎、降解和异化证实了此结论。qRT-PCR结果表明LOC-Os03g07250的突变对花药发育过程绒毡层发育和花药囊壁角质蜡质成分发育相关基因的表达量均显著下调。但突变体中的另一个CYP704A3基因(LOC-Os04g48460)的表达量在花药发育后期却有略微的上调,该基因主要参与调控幼穗发育,与粒长有关[39],推测该基因与CYP704B2可能存在一定的反馈调节,但仍需进一步验证。上述结果证明,植物细胞色素P450家族基因CYP704B2对于水稻花药囊壁角质层、花粉外壁以及绒毡层程序性死亡等过程具有重要意义。此外,依据最新报道的雄性不育杂交体系和种子生产技术[33-34],未来我们也可进行相关试验,将OsWHF41与特异的花粉致死基因和荧光蛋白基因串联,采用荧光标记筛选、批量生产而获得非转基因的雄性不育系,既避免光温影响,可靠性显著提高,有效解决水稻隐性核雄性不育材料的制繁种难题,又可扩大父本选择范围,增加未来水稻杂种优势利用的选择空间,而且该技术体系获得的雄性不育系不带有任何转基因成分、制种产量和纯度大大提高。因此,本研究可为未来利用该技术进行隐性核雄不育系的杂交水稻育种新途径提供理论基础和新的基因资源。
[1]朱英国.水稻雄性不育生物学.武汉:武汉大学出版社,2000:1-2. Zhu Y G.Biology of Male Sterility in Rice.Wuhan: Wuhan University Press,2000:1-2.(in Chinese)
[2]Raghavan V.Anther developmental biology in molecular embryology of flowering plants.Plant Physiol,1997: 17-60.
[3]Ma H.Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants.Annu Rev Plant Boil,2005,56:393-434.
[4]Zhang D B,Wilson Z A.Stamen specification and anther development in rice.Chin Sci Bull,2009,54:2342-2353.
[5]Zhang D B,Luo X,Zhu L.Cytological analysis and genetic control of rice anther development.J Gen Genom, 2011,38(9):379-390.
[6]Kinoshita T.Gene symbols and information on male sterility.Rice Genet Newsl,1997,14:13-22.
[7]Okamuro J K,Boer B G,Jofuku K D.Regulation of Arabidopsis flower development.Plant Cell,1993,5: 1183-1193.
[8]马西青,方才臣,邓联武,万向元.水稻隐性核雄性不育研究进展及育种应用探讨.中国水稻科学,2012, 25(5):511-520. Ma X Q,Fang C C,Deng L W,Wan X Y.Research progress and breeding application of recessive genic male sterility gene in rice.Chin J Rice Sci,2012,25(5): 511-520.(in Chinese with English abstract)
[9]Nonomura K I,Miyoshi K,Eiguchi M,Suzuki T,Miyao A,Hirochika H,Kurata N.The MSP1 gene is necessary to restrict the number of cells entering into male and female sporogenesis and to initiate anther wall formation in rice.Plant Cell,2003,15(8):1728-1739.
[10]Nonomura K I,Nakano M,Fukuda T,Eiguchi M,Miyao A,HirochikaH,KurataN.Thenovelgene HOMOLOGOUSPAIRINGABERRATIONINRICE MEIOSIS1 of rice encodes a putative coiled-coil protein required for homologous chromosome pairing in meiosis. Plant J,2004,16(4):1008-1020.
[11]Nonomura K I,Nakano M,Murata K,Miyoshi K, Eiguchi M,Miyao A,Hirochika H,Kurata N.An insertional mutation in the rice PAIR2 gene,the ortholog of Arabidopsis ASY1,results in a defect in homologous chromosome pairing during meiosis.Mol Gen Genom, 2004,271(2):121-129.
[12]Yuan W Y,Li X W,Chang Y X,Wen R Y,Chen G X, Zhang Q F,Wu C.Mutation of the rice gene PAIR3 results in lack of bivalent formation in meiosis.Plant J, 2009,59(2):303-315.
[13]Wang M,Wang K J,Tang D,Wei C X,Li M,Shen Y, Chi Z C,Gu M H,Cheng Z K.The central element protein ZEP1 of the synaptonemal complex regulates the number of crossovers during meiosis in rice.Plant Cell, 2010,22:417-430.
[14]Nonomura K,Morohoshi A,Nakano M,Eiguchi M, Miyao A,Hirochika H,Kurata N.A germ cell-specific gene of the ARGONAUTE family is essential for the progression of premeiotic mitosis and meiosis during sporogenesis in rice.Plant Cell,2007,19(8):2583-2594.
[15]Wang C,Yue W,Ying Y,Wang S,Secco D,Liu Y, Whelan J,Tyerman S D,Shou H.Rice SPX-Majorfacilitysuperfamily3,avacuolarphosphateefflux transporter,isinvolvedinmaintainingphosphate homeostasisinrice.PlantPhysiol,2015,169(4): 2822-2831.
[16]He Y,Wang C,Higgins J D,Yu J,Zong J,Lu P,Zhang D,Liang W.MEIOTIC F-BOX is essential for male meiotic DNA double-strand break repair in rice.Plant Cell,2016,28(8):1879-1893.
[17]Li L,Li Y,Song S,Deng H,Li N,Fu X,Chen G,Yuan L. An anther development F-box(ADF)protein regulated by tapetum degeneration retardation(TDR)controls rice anther development.Planta,2015,241(1):157-166.
[18]Jung K H,Han M J,Lee Y S,Kim Y W,Hwang I,Kim M J,Kim Y K,Nahm B H,An G.Rice Undeveloped Tapetum1isamajorregulatorofearlytapetum development.Plant Cell,2005,17(10):2705-2722.
[19]Liu Z,Bao W,Liang W,Yin J,Zhang D.Identification of gamyb-4 and analysis of the regulatory role of GAMYB in rice anther development.J Integr Plant Biol,2010,52(7): 670-678.
[20]Li H,Yuan Z,Vizcay-Barrena G,Yang C,Liang W, Zong J,Wilson Z A,Zhang D.PERSISTENT TAPETAL CELL1 encodes a PHD-Finger protein that is required for tapetal cell death and pollen development in rice.Plant Physiol,2011,156(2):615-630.
[21]Li X,Gao X,Wei Y,Deng L,Ouyang Y,Chen G,Li X, Zhang Q,Wu C.Rice APOPTOSIS INHIBITOR5 coupled withtwoDEAD-boxadenosine5′-triphosphatedependent RNA helicases regulates tapetum degeneration. Plant Cell,2011,23(4):1416-1434.
[22]Niu N,Liang W,Yang X,Jin W,Wilson Z A,Hu J, Zhang D.EAT1 promotes tapetal cell death by regulating aspartic proteases during male reproductive development in rice.Nat Comm,2013,4:1445.
[23]Fu Z,Yu J,Cheng X,Zong X,Xu J,Chen M,Li Z, Zhang D,Liang W.The rice basic Helix-Loop-Helix transcription factor TDR INTERACTING PROTEIN2 is a central switch in early anther development.Plant Cell, 2014,26(4):1512-1524.
[24]Niu B X,He F R,He M,Ren D,Chen L T,Liu Y G.The ATP-binding cassette transporter OsABCG15 is required for anther development and pollen fertility in rice.J Integr Plant Biol,2013,55(8):710-720.
[25]Zhao G,Shi J,Liang W,Xue F,Luo Q,Zhu L,Qu G, Chen M,Schreiber L,Zhang D.Two ATP binding cassette G transporters,rice ATP binding cassette G26 and ATP binding cassette G15,collaboratively regulate rice male reproduction.Plant Physiol,2015,169(3): 2064-2079.
[26]Zhang D,Liang W,Yin C,Zong J,Gu F,Zhang D.OsC6, encodingalipidtransferprotein,isrequiredfor postmeiotic anther development in rice.Plant Physiol, 2010,154(1):149-162.
[27]Jung K H,Han M J,Lee D Y,Lee Y S,Schreiber L, Franke R,Faust A,Yephremov A,Saedler H,Kim Y W, Hwang I,An G.Wax-Deficient Anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development.Plant Cell,2006,18(11): 3015-3032.
[28]Shi J,Tan H,Yu X H,Liu Y,Liang W,Ranathunge K, Franke R B,Schreiber L,Wang Y,Kai G,Shanklin J,Ma H,Zhang D.Defective Pollen Wall is required for anther and microspore development in rice and encodes a fatty acyl carrier protein reductase.Plant Cell,2011,23(6): 2225-2246.
[29]Xu D W,Shi J X,Rautengarten C,Yang L,Qian X L, Uzair M,Zhu L,Luo Q,An G,Waßmann F,Schreiber L, Heazlewood J L,Scheller H V,Hu J P,Zhang D B,Liang W Q.Defective Pollen Wall 2(DPW2)encodes an acyl transferase required for rice pollen development.Plant Physiol,2017,173(1):240-255.
[30]Li H,Pinot F,Sauveplane V,Werck-Reichhart D,Diehl P, Schreiber L,Franke R,Zhang P,Chen L,Gao Y,Liang W,ZhangD.CytochromeP450familymember CYP704B2 catalyzes the ω-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice.Plant Cell,2010,22(1):173-190.
[31]Yang X,Wu D,Shi J,He Y,Pinot F,Grausem B,Yin C, Zhu L,Chen M,Luo Z,Liang W,Zhang D.Rice CYP703A3,a cytochrome P450 hydroxylase,is essential for development of anther cuticle and pollen exine.J Integr Plant Biol,2014,56(10):979-994.
[32]Zhu Q H,Ramm K,Shivakkumar R,Dennis E S, Upadhyaya N M.The ANTHER INDEHISCENCE1 gene encoding a single MYB domain protein is involved in anther development in rice.Plant Physiol,2004,135(3): 1514-1525.
[33]Kent B,Erin C,Nina D,David H,Young J K,Zhong Cathy X Y.Plant genomic DNA flanking SPT event and methods for identifying SPT event.United States Patent, US008257930B2,20120904.
[34]Chang Z Y,Chen Z F,Wang N,Xie G,Lu J W,Yan W, Zhou J L,Tang X Y,Deng X W.Construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene.Proc Natl Acad Sci USA,2016,113(49):14145.
[35]Sun L P,Zhang Y X,Zhang P P,Yang Z F,Zhan X D, Shen X H,Zhang Z H,Hu X,Xuan D D,Wu W X,Li Z H,Cao L Y,Cheng S H.K-Domain splicing factor OsMADS1 regulates open hull male sterility in rice.Rice Sci,2015,22(5):207-216.
[36]Orjuela J,Garavito A,Bouniol M,Arbelaez J D,Moreno L,Kimball J,Wilson G,Rami J F,Tohme J,McCouch S R,Lorieux M.A universal core genetic map for rice. Theor Appl Genet,2010,120:563-572
[37]Wu D H,Wu H P,Wang C S,Tseng H Y,Hwu K K. Genome-wide InDel marker system for application in rice breeding and mapping studies.Euphytica,2013,192: 131-143
[38]Yamanaka S,Suzuki E,Tanaka M,Takeda Y,Watanabe J A,Watanabe K N.Assessment of cytochrome P450 sequences offers a useful tool for determining genetic diversity in higher plant species.Theor Appl Genet,2003, 108(1):1-9.
[39]Tang W,Wu T,Ye J,Sun J,Jiang Y,Yu J,Tang J,Chen G,Wang C,Wan J.SNP-based analysis of genetic diversity reveals important alleles associated with seed size in rice.BMC Plant Biol,2016,16(1):93.
Characterization and Gene Mapping of a No-pollen Genic Sterile Mutant whf41 in Rice
XUAN Dandan#,SUN Lianping#,ZHANG Peipei,ZHANG Yingxin,WU Weixun,YANG Zhengfu, ZHAN Xiaodeng,SHEN Xihong,CAO Liyong*,CHENG Shihua*
(China National Rice Research Institute/State Key Laboratory of Rice Biology/Key Laboratory for Zhejiang Super Rice Research,Hangzhou 311401;#These authors contributed equally to this work;*Corresponding author,E-mail:caolycgf@mail.hz.zj.cn,shcheng@mail.hz.zj.cn)
【Objective】The anther cuticle and wax layer act as structural support and protective barriers for the development of pollen sac in rice.Phenotypic analysis and genetic mapping of the related genes can provide genetic resources and lay theoretical basis for further cloning and molecular mechanism analysis.【Method】We identified a no-pollen male sterile mutant whf41 from the mutant progeny of60Co-γ-treated indica cultivar Zhonghui 8015.Anthers of the wild-type and whf41 mutant at different development stages were fixed for transverse section analysis and mature anthers of which were randomly selected for scanning electron microscopy analysis.BC1F1,F1lines and BC1F2,F2populations derived from whf41/Zhonghui 8015 and whf41/02428 were used for genetic analysis and fine-mapping of the mutation site.【Result】Comparing with wild type,the whf41 mutant exhibited thin and transparent milky anther without mature pollen grains.Transverse section analysis showed that the whf41 mutant displayed aborted pollen grains,none detectable exine and swollen tapetal layer without expected PCD(programmed cell death),finally resulting in fragments of tapetal layer and pollen grains in the chamber.Scanning electron microscopy analysis further revealed the mutant had smoother anther wall,fewer lipids both on the inner and outer sides and fragments of degragated pollens. Genetic analysis revealed that whf41 was controlled by a single recessive genic gene,which was fine-mapped to a 45.6-kb region that harbored nine Open Reading Frames(ORFs)on the short arm of chromosome 3 between markers XD-5 and XD-11.Sequence analysis revealed that the whf41 mutant carried a nucleotide substitution and three nucleotide deletion,which led a substitution of one amino acid(D to M)and a deletion of one amino acid(V)in the fourth exon of one Cytochrome P450 family gene,LOC_Os03g0725,which is named as OsWHF41 and probably responsible for the no-pollen male sterility phenotype.Furthermore,qPCR analysis showed that the expression level of CYP704B2 and seven anther lipid synthesis and transportation related regulators changed significantly in whf41.【Conclusion】Based on all these results,we deduced that the OsWHF41 gene was a new allelic to CYP704B2 gene and this further confirmed the important role of CYP704B2 in anther lipid synthesis and pollen exine formation.
rice;whf41;recessive genic male sterility;gene mapping
Q343.5;S511.01
:A
:1001-7216-(2017)03-0247-10
2016-12-01;修改稿收到日期:2017-02-06。
国家公益性农业科技研究专项(20140302,20150308);国家转基因重大专项(2014ZX08001-002);中国农业科学院创新工程超级稻育种创新团队、水稻杂种优势研究机理研究创新团队资助项目(CAAS-ASTIP-2013-CNRRI)。

