金属有机骨架材料对于氨基硼烷储放氢性能的改善研究①
寇雪莹 孙炜伟
(1.聊城大学东昌学院,山东聊城252000;2.上海大学环境与化学工程学院,上海200444)
金属有机骨架材料对于氨基硼烷储放氢性能的改善研究①
寇雪莹1孙炜伟2
(1.聊城大学东昌学院,山东聊城252000;2.上海大学环境与化学工程学院,上海200444)
选择金属铜为配位中心的金属有机骨架作为载体材料对于氨基硼烷在氨气氛下进行负载,得到的复合体系表现出明显改善的储氢热力学和动力学性能,同时该复合体系也可以有效抑制在氨基硼烷的分解过程中杂质气体的释放.
氨基硼烷,金属有机骨架,脱氢作用,动力学
0 引言
随着对新能源的需求日益增加,氢气逐渐成为可持续发展的能源载体[1,2], 这就需要我们设计合成出可以在常温常压下存储大量氢气、且具有快速充放氢性能的新型储氢材料[3-5].在用于氢气存储的各类材料(金属氢化物[6,7]、金属硼氢化物[8]等)中,氨基硼烷因具有高的理论储氢容量而备受关注.纯的氨基硼烷在较低的温度条件下可以通过两步放氢释放出其含氢量2/3的氢气[9].然而氨基硼烷在100℃以下的放氢动力学性能较差,这将严重制约其作为储氢材料的研究和应用[10-14].改善氨基硼烷放氢性能的常用方法是选择含有d电子的金属元素,如Cu,Ni,Co等作为催化剂用于改善氨基硼烷的放氢动力学性能.另一种有效的解决方法是在氨气氛条件下使氨基硼烷液化,该条件下氨气分子可以同氨基硼烷作用消耗B-H官能团从而有效抑制在氨基硼烷分解过程中挥发性副产物(硼烷高分子或双硼烷)的释放.另一方面,金属有机骨架结构因具有可控的孔道结构而在气体存储等领域受到广泛关注[15,16],特别是金属有机骨架对于氨气或气体毒性气体的吸附十分高效[17-19].因此,我们尝试选择金属铜盐与均苯三酸配体合成得到的金属有机骨架HKUST-1 [Cu3(BTC)2(H2O)3, BTC = 均苯三酸] 作为载体材料负载氨基硼烷,同时实现氨基硼烷和氨气在该金属有机骨架孔道中的反应.在除去骨架中配位的水分子后,金属有机骨架HKUST-1中的金属中心铜离子呈现不饱和状态,更加容易与氨气分子进行结合.而这种化学吸附氨气分子的金属有机骨架结构用于负载氨基硼烷后,对于氨基硼烷和氨气在其孔道中的反应十分有利.更为重要的是,通过上述负载方法实现的在金属有机骨架孔道中氨基硼烷和氨气分子的结合反应,可以大幅度提高氨基硼烷的放氢动力学并有效抑制在氨基硼烷的分解过程中硼烷高分子等副产物的释放.
1 实验部分
1.1 样品的制备
AB-NH3@Cu-MOFs:0.9 g脱水后的金属有机骨架Cu-MOFs 和0.3 g氨基硼烷 (NH3BH3, AB, 97%, Aldrich) 在反应瓶中混合后置于冰水浴中,在超声作用下将氨气通入反应瓶中,持续2 h.可以观察到白色的氨基硼烷晶体融化,得到灰蓝色固体.将反应产物室温下抽真空约3 h将其中多余的氨气去除即得到目标产品.
NH3-treated Cu-MOFs:在超声条件下将氨气直接通入无水的Cu-MOFs中直至样品质量不再增加,得到的产品在常温下抽真空3 h以去除多余的氨气后即得到目标产物.
所有的样品处理和保存都是在水氧浓度低于1 ppm的手套箱中进行的.加热反应是在充满氮气的密闭反应管中进行的,产生的氢气随着氩气流通过T型管进入存储器以保证反应管中的氩气氛.
1.2 样品的性能及表征
IR: 固体红外光谱测试是在Nicolet Nexus 470红外光谱仪上进行,KBr压片,波长范围为500-4 000 cm-1.
XRD: 固体X射线粉末衍射实验是在Bruke X’PERT 衍射仪 (Cu Ka radiation, 16 Kw).XRD测试过程中所有样品都是在手套箱中装样,样品台上覆盖一层非晶膜以保证材料不被氧化.
TPD: 氢气释放性能测试使用Sievert’s 方法从室温到220°进行测试,升温速率为2℃/min.
MS: 质谱测试在1 bar氩气条件下使用netzsch STA 409C质谱仪,从室温到200℃以5℃/min的升温速率升温.
2 结果与讨论
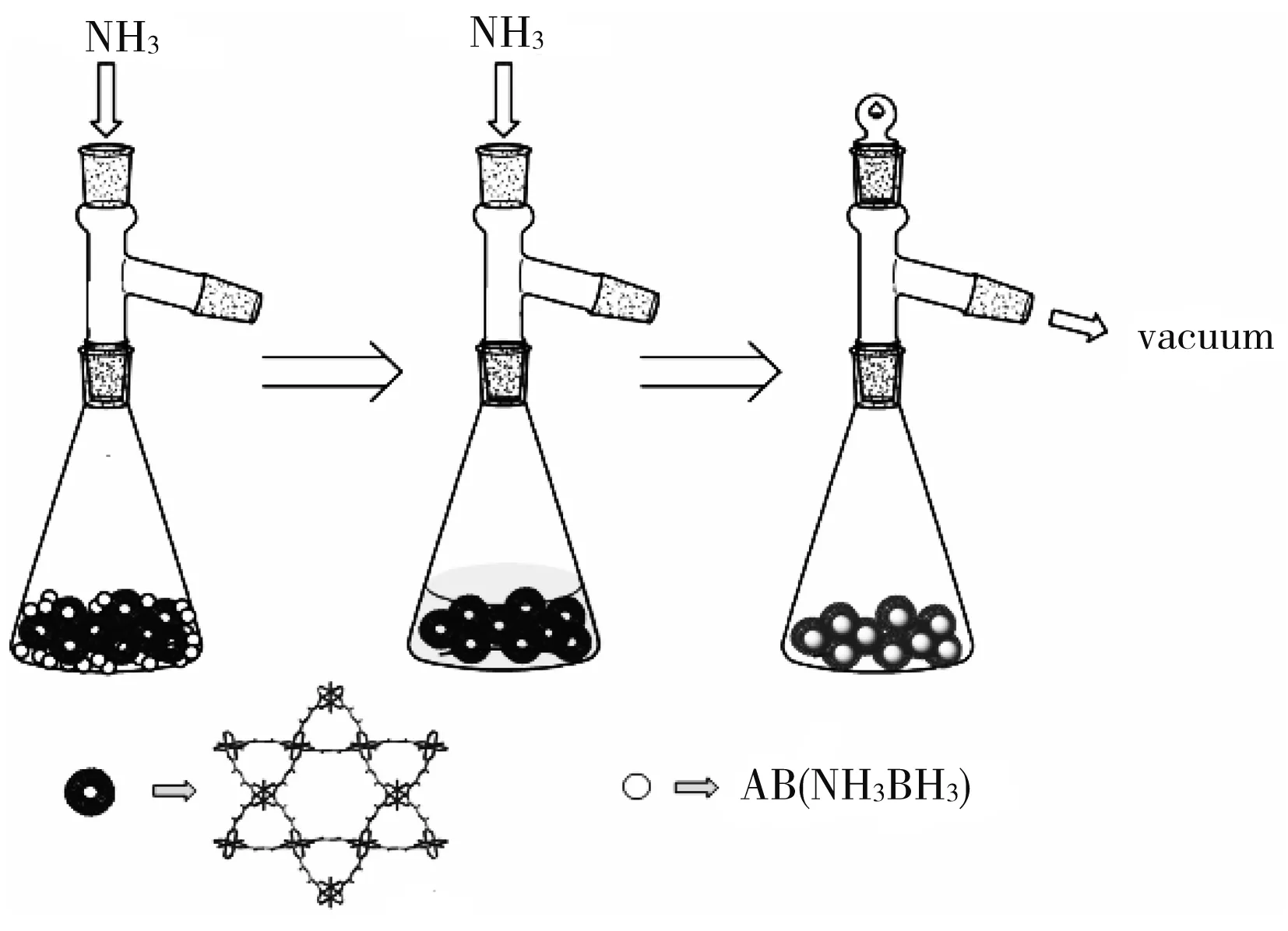
图1 液氨法制备AB-NH3@Cu-MOFs的示意图
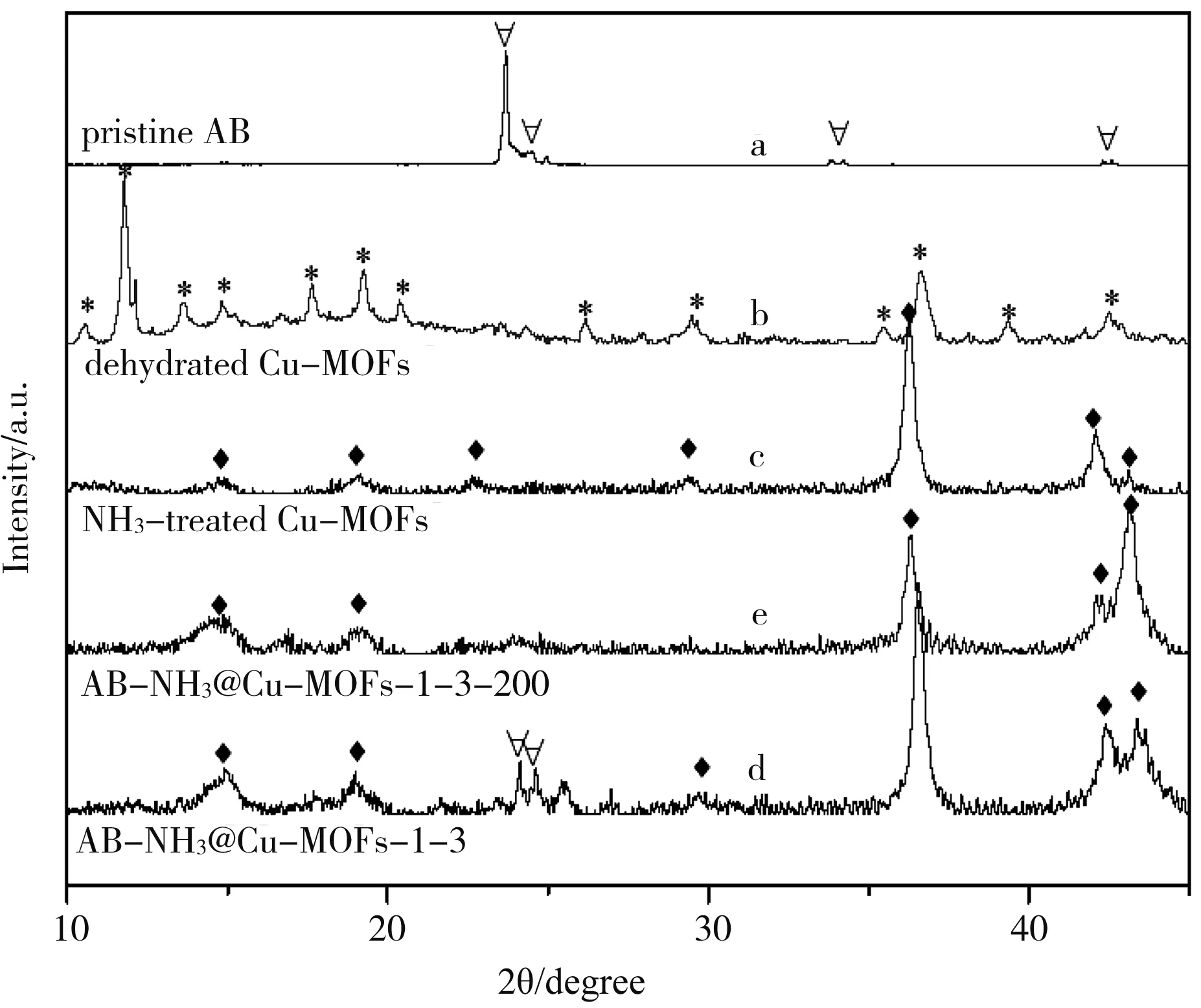
图2 200℃脱氢处理前后的AB-NH3@Cu-MOFs样品、NH3 treated Cu-MOFs样品与纯氨基硼烷(AB)和脱水后Cu-MOFs的XRD图谱对比
本论文中使用的纳米尺寸的金属有机骨架Cu-MOFs是参考相关文献[20,21]合成得到,该骨架结构真空条件下加热到100℃并保持6 h可以失去其中的配位水分子,从而得到脱水后的Cu-MOFs材料.
如图1所示,我们通过液氨合成法制备得到了目标产物 AB-NH3@Cu-MOFs: 氨基硼烷的白色粉末与脱水后的金属有机骨架Cu-MOFs 深蓝色粉末在反应瓶中混合(质量比1∶3),后将反应瓶置于0℃的冰水浴中并将氨气通入其中,会发现金属有机骨架Cu-MOFs的颜色逐渐变成浅蓝色并可以观测到氨基硼烷液化的现象.将上述混合物在超声条件下通入氨气反应2 h后,升温至室温,同时抽真空约3 h以去除在骨架结构中物理吸附的氨气分子.同样采用上述装置,通过类似的方法合成得到对比产物氨气处理的金属有机骨架材料(NH3-treated Cu-MOFs).
AB-NH3@Cu-MOFs以及在200℃脱氢后的AB-NH3@Cu-MOFs产品的XRD图谱如图2所示.通过对比 NH3treated Cu-MOFs和脱水后的金属有机骨架Cu-MOFs的XRD图谱发现,金属有机骨架Cu-MOFs在氨气处理后结构发生了变化.然后NH3treated Cu-MOFs的骨架结构在后续负载氨基硼烷以及氨基硼烷分解放氢的过程中,结构可以稳定保持.同时在AB-NH3@Cu-MOFs的XRD图谱中可以观测到氨基硼烷(在图2中用∀表示)的存在,而在该样品200℃的脱氢反应之后氨基硼烷的特征衍射峰消失.这说明该样品在加热到200℃后,其中负载的氨基硼烷已完全分解,而金属有机骨架结构依然可以很好的保持.
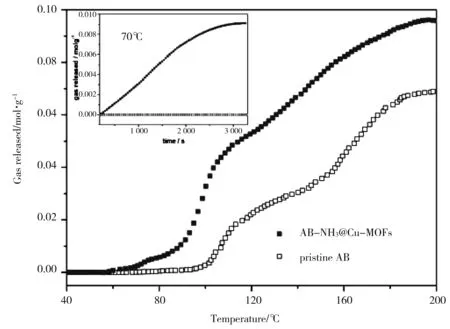
图3 AB-NH3@Cu-MOFs pristine AB样品和纯氨基硼烷的升温放氢性能(升温速率2℃/min),内插图是两者在70℃条件下的恒温放氢性能图
如图3所示的升温脱氢曲线(TPD),AB-NH3@Cu-MOFs样品的起始放氢温度为70℃,比纯氨基硼烷的起始放氢温度要低35℃左右.加热到200℃后,AB-NH3@Cu-MOFs的放氢量为0.096mol·g-1,明显高于纯氨基硼烷的放氢量0.069mol·g-1.纯氨基硼烷和AB-NH3@Cu-MOFs样品在70℃的恒温放氢曲线如图3内插图所示,其中可以清晰的观测到AB-NH3@Cu-MOFs样品在该温度下放氢剧烈,没有放氢诱导期,且40min后的放氢量达到0.009mol·g-1;而在该温度下纯氨基硼烷没有气体释放,这主要可以归因于氨基硼烷在该温度下具有较高的放氢动力学势垒.
对于AB-NH3@Cu-MOFs样品和纯氨基硼烷分解释放出的多种挥发性产物,如氢气、双硼烷、硼烷高分子等等,进行质谱分析,其结果如图4所示.AB-NH3@Cu-MOFs样品在103℃和140℃分别释放第一当量和第二当量的氢气,其放氢温度明显低于纯氨基硼烷[9].在质谱中的氢气释放出峰的峰值温度与TPD曲线中的放氢温度有一点差别,主要可以归因于两种测试是在不同的气氛条件下进行的.同时对比纯氨基硼烷在分解过程中双硼烷(m/e=27)和硼烷高分子(m/e=80)的释放,在AB-NH3@Cu-MOFs样品分解放氢的过程中挥发性杂质气体双硼烷和硼烷高分子得到完全的抑制,这将有效提高氢气释放的产率和纯度[10,11].
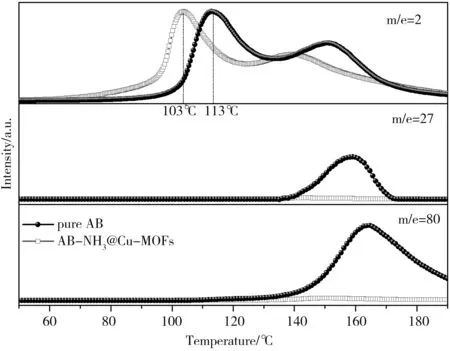
图4 AB-NH3@Cu-MOFs样品(红色线)和纯氨基硼烷(黑色线)热分解释放出气体的质谱图示
我们通过Kissinger的方法确定了AB-NH3@Cu-MOFs样品分解放氢的活化能从而定量计算其动力学能垒,具体计算方法如[22,23]
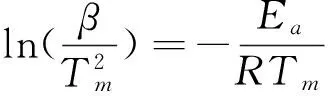
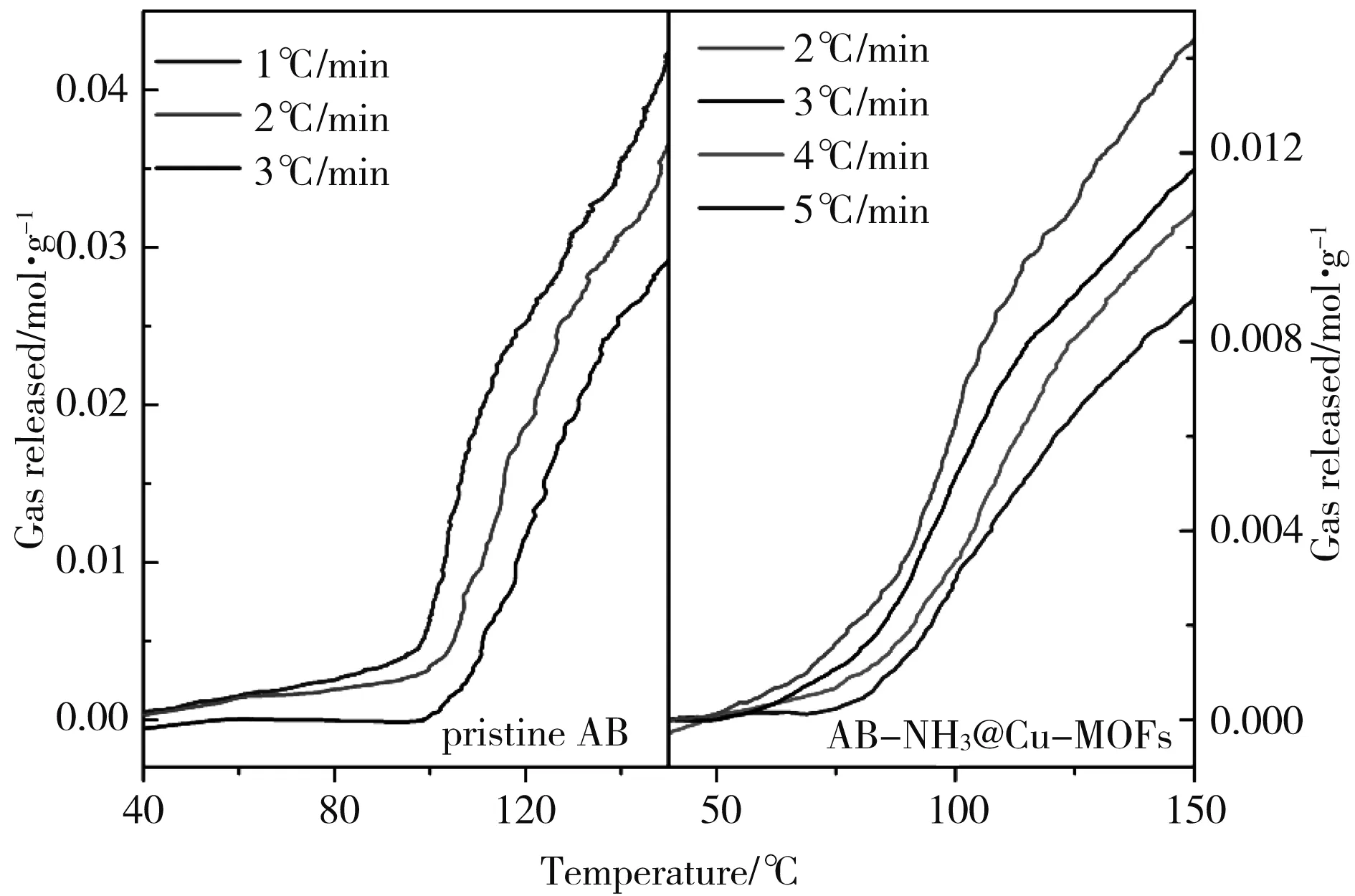
图5 纯氨基硼烷和AB-NH3@Cu-MOFs样品在不同升温速率下的第一步放氢曲线
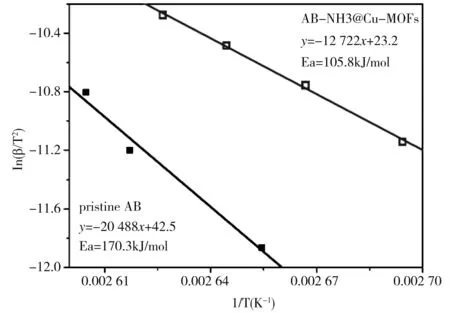
图6 AB-NH3@Cu-MOFs样品和纯氨基硼烷的Kissinger图
3 结论
本论文中,我们选择了一种高比表面积的金属有机骨架Cu-MOFs作为模板材料并探索了一种新型的液氨合成方法首次成功制备了金属有机骨架负载的氨基硼烷-氨气复合材料AB-NH3@Cu-MOFs.基于金属有机骨架Cu-MOFs对于氨气的吸附特性,氨基硼烷在氨气氛条件下实现液化并负载到金属有机骨架结构的孔道中.我们获得的复合材料AB-NH3@Cu-MOFs具有更高的氨基硼烷负载量、更低的放氢温度和明显改善的放氢动力学性能以及实现了分解过程中对于可挥发性杂质产物的抑制,从而有效提高了其放氢容量和放氢纯度.这种新型的负载方法将进一步推进金属有机骨架在储氢领域的应用.
[1] Grochala W, Edwards P P.Thermal Decomposition of the Non-Interstitial Hydrides for the Storage and Production of Hydrogen[J].Chem Rev,2004,104(3):1 283-1 316.
[2] Dresselhaus M S,Thomas I L.Alternative energy technologies[J].Nature,2001, 414(6 861):332-337.
[3] Orimo S I,Nakamori Y,Eliseo J R,et al. Complex hydrides for hydrogen storage-new perspectives[J].Chem Rev,2007,107(10):4 111-4 125.
[4] Stephens F H,Pons V,Baker R T.Ammonia-borane: the hydrogen source par excellence[J]. Dalton Trans,2007,25(25):2 613-2 624.
[5] Chen P, Zhu M, Recent progress in hydrogen storage[J].Mater Today, 2008, 11(12):36-43.
[6] Schlapbach L,Züttel A.Hydrogen-storage materials for mobile applications[J].Nature ,2001,414(6 861):353-367.
[7] Wagemans R W P, van Lenthe J H,e Jongh P E, et al.Hydrogen storage in magnesium clusters: quantum chemical study[J]. J Am Chem Soc,2005, 127(47):16 675-16 680.
[8] Zhang Y, Zhang W S,Wang A Q,et al.LiBH4 nanoparticles supported by disordered mesoporous carbon: Hydrogen storage performances and destabilization mechanisms[J].Int J Hydrogen Energy,2007,32(16):3 976-3 980.
[9] Li L,Yao X D,Sun C H,et al.Lithium‐Catalyzed Dehydrogenation of Ammonia Borane within Mesoporous Carbon Framework for Chemical Hydrogen Storage[J].Adv Funct Mater,2009,19(2):265-271.
[10] Himmelberger D W,Yoon C W,Bluhm M, et al.Base-promoted ammonia borane hydrogen-release[J]. J Am Chem Soc, 2009,131(39):14 101-14 110.
[11] Zimmerman P M,Paul A,Musgrave C B.Catalytic dehydrogenation of ammonia borane at Ni monocarbene and dicarbene catalysts[J]. Inorg Chem, 2009,48(12):5 418-5 433.
[12] Wolf G,Baumann J,Baitalow F,et al.ChemInform Abstract: Calorimetric Process Monitoring of Thermal Decomposition of B—N—H Compounds[J]. Thermochim Acta, 2000, 343(1-2):19-25.
[13] Kang X D,Fang Z Z,Kong L Y,et al.Ammonia borane destabilized by lithium hydride: an advanced on-board hydrogen storage material[J].Adv Mater,2008,20(14):2 756-2 759.
[14] Gutowska A, Li L Y, Shin Y,et al. Nanoscaffold mediates hydrogen release and the reactivity of ammonia borane[J].Angew Chem Int Ed,2005,44(23):3 578-3 582.
[15] Rowsell J L C,Yaghi O M.Strategies for Hydrogen Storage in Metal-Organic Frameworks[J].Angew Chem Int Ed,2005,44,4 670-4 679.
[16] Chen B,Ockwig N W,Millward A R,et al. Minireviews Strategies for Hydrogen Storage in Metal-Organic Frameworks[J].Angew Chem Int Ed,2005, 4,4 745-4 756.
[17] Peterson G W,Wagner G W,Balboa A,et al.Ammonia Vapor Removal by Cu3(BTC)2) and Its Characterization by MAS NMR[J].J Phys Chem C,2009, 113(31):13 906-13 917.
[18] Petit C,Mendoza B,Bandosz T J.Reactive adsorption of ammonia on Cu-based MOF/graphene composites[J]. Langmuir,2010,26(19):15 302-15 309.
[19] Britt D,Tranchemontagne D.Metal-organic frameworks with high capacity and selectivity for harmful gases[J]. Proc Natl Acad Sci U S A,2008,105(33):11 623-11 627.
[20] Chui S S Y,Samuel M F L,Charmant J P H,et al.A chemically functionalizable nanoporous material[J]. Science,1999, 283(5 405):1 148-1 152.
[21] Schlichte K, Kratzke T,Kaskel S.Improved synthesis, thermal stability and catalytic properties of the metal-organic framework compound Cu3(BTC)2[J].Microporous Mesoporous Mater,2004,73(1-2):81-88.
[22] Kissinger H E.Reaction Kinetics in Differential Thermal Analysis[J].Anal Chem,195,29(11):1 702-1 706.
[23] Wang F H, Liu Y F,Gao M X,et al.Formation Reactions and the Thermodynamics and Kinetics of Dehydrogenation Reaction of Mixed Alanate Na2LiAlH6[J].J Phys Chem C 2009, 113(18):7 978-7 984.
Metal-Organic Frameworks Loaded Ammonia Borane: Improvement on Its Dehydrogenation Properties
KOU Xue-ying1SUN Wei-wei2
(1. Dongchang College of Liaocheng Univercity, Liaocheng 252000, China; 2. School of Environmental and Chemical Engineering,Shanghai University, Shanghai 200444, China)
Successful synthesis and investigation of a new material that use high-surface-area Cu-MOFs as the template for loading ammonia borane (AB) were reported. This novel AB-NH3@Cu-MOFs system exhibited significantly improved hydrogen release thermodynamics/kinetics and effective prevention of borane and/or borazine formations during decomposition.
ammonia borane, metal-organic frameworks,dehydrogenation,kinetics
2016-11-24
国家自然科学基金项目(51201095);聊城大学东昌学院科研基金项目(2015LG014)资助
寇雪莹,E-mail:xueyingkou@163.com.
TB332
A
1672-6634(2017)01-0056-05

