不同TOAST分型急性脑梗死患者血清hs-CRP和LDL水平变化及临床意义
谷黎丽,田勇武,贺 丹
(1.河北医科大学第二医院神经内科,河北 石家庄 050000;2.河北省定州市第二医院神经内科,河北 定州 073000)
·论 著·
不同TOAST分型急性脑梗死患者血清hs-CRP和LDL水平变化及临床意义
谷黎丽1,2,田勇武2,贺 丹1*
(1.河北医科大学第二医院神经内科,河北 石家庄 050000;2.河北省定州市第二医院神经内科,河北 定州 073000)
目的检测不同TOAST分型急性脑梗死患者血清高敏C反应蛋白(high sensitive-C reactive protein,hs-CRP)和低密度脂蛋白(low density lipoprotein,LDL)水平,探讨hs-CRP和LDL在不同类型脑梗死急性期的作用及临床意义。方法选取脑梗死患者374例为病例组,健康志愿者60例为正常对照组。病例组患者按照TOAST分型分为大动脉粥样硬化组(large-artery atherosclerosis,LAA)158例、小动脉闭塞组(small-artery occlusion,SAO)171例和心源性栓塞组(cardioembolism,CE)45例。所有受试者于次日清晨空腹抽取肘静脉血3 mL,测定血清hs-CRP和LDL水平。结果LAA、SAO、CE组美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、收缩压、舒张压明显高于对照组,LAA组和CE组NIHSS评分高于SAO组,LAA、SAO组收缩压高于CE组。LAA、SAO组吸烟、糖尿病发生率高于对照组和CE组,SAO组饮酒发生率高于对照组,LAA、SAO、CE组高血压、高脂血症、心脏病发生率高于对照组,CE组心脏病发生率高于LAA组和SAO组。LAA、SAO、CE组血清hs-CRP水平高于对照组,CE组血清hs-CRP水平高于LAA、SAO组,LAA组血清hs-CRP水平高于SAO组。LAA、SAO组血清LDL水平高于对照组(P<0.05)。急性脑梗死患者血清hs-CRP水平与LDL、NIHSS评分呈正相关(rs=0.164、0.183,P<0.05)。二分类Logistic回归分析结果显示,收缩压、hs-CRP是心源性脑栓死的危险因素。结论在TOAST亚型中,血清hs-CRP可作为CE的危险因素,成为脑梗死发病早期判定病因学分类的指标。LDL有望成为LAA的特异性生化指标,对早期预测LAA有重要临床价值。
脑梗死;C反应蛋白质;脂蛋白类,LDL
脑梗死通常是指脑部的血液供应障碍或脑组织局部缺血缺氧而造成的局部脑组织坏死,又称缺血性脑卒中,其主要原因是脑血管出现了动脉粥样硬化和血栓形成,使脑部血管逐渐狭窄或者完全闭塞,最终导致血液供应障碍。对于缺血性卒中不同病因分型要采取针对性的治疗方法。现已证实急性脑梗死动脉硬化斑块中存在炎症反应,其中许多单核吞噬细胞和T淋巴细胞的浸润,可刺激斑块内生成高敏C反应蛋白(high sensitive-C reactive protein,hs-CRP),其通过结合部分降解的低密度脂蛋白(low density lipoprotein,LDL)和加强低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的氧化作用,加速炎性细胞浸润,引起斑块不稳定,甚至在最薄弱的血管处出现斑块破裂、脱落,最终造成栓塞和血栓形成。血清hs-CRP水平能反映脑血管动脉粥样硬化斑块破裂的可能性和易损能力。通常血清hs-CRP水平在脑梗死急性期明显升高,与脑梗死发病机制关系密切。血清hs-CRP增加可以间接激活纤溶凝血系统,导致凝血功能异常,加速脑梗死的发病。血清LDL和hs-CRP水平增高可能在脑梗死的急性期有协同作用,加速脑梗死病情发展,甚至恶化。目前国内已有急性脑梗死对LDL和hs-CRP水平变化的文献研究[1]。但是,尚未发现针对不同TOAST分型的急性脑梗死患者血清hs-CRP和LDL水平变化的报道。本研究检测不同TOAST分型急性脑梗死患者血清hs-CRP和LDL水平,分析二者与病情轻重程度的关系,探讨hs-CRP和LDL在不同TOAST分型急性脑梗死患者中的作用及其临床意义,旨在为临床评判不同TOAST分型急性脑梗死提供可靠的依据。现报告如下。
1 资料与方法
1.1 一般资料 选取2013年10月—2016年1月于河北医科大学第二医院神经内科住院的脑梗死患者374例为病例组。其中男性185例,女性189例,年龄18~80岁,平均(60.10±5.60)岁。根据入选患者临床、电生理(如心电图)、影像学(头颅CT/MRI、颈部血管超声和心脏超声)、生化(血常规、凝血、自身免疫等)检查结果,按照TOAST分型要求,由2名神经科医生结合病史及影像资料进一步进行TOAST病因分型,大动脉粥样硬化型(large-artery atherosclerosis,LAA)158例(42.3%),小动脉闭塞型(small-artery occlusion,SAO)171例(45.7%),心源性栓塞型(cardioembolism,CE)45例(12.0%)。另选取同期在河北医科大学第二医院体检中心健康体检者60例为对照组,男性31例,女性29例,年龄18~80岁,平均(60.63±6.21)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准 纳入标准:①符合1995年第四届全国脑血管病会议制定的脑梗死诊断标准;②首次发病的脑梗死患者;③发病时间<72 h;④年龄18~80岁;⑤CT/MRI证实为脑梗死;⑥有详细的人口学资料和血常规、生化常规、凝血常规、心电图、超声心动图和心脏影像学检查结果等;⑦签署患者知情同意书。排除标准:①严重意识障碍的脑梗死;②出血性脑梗死、短暂性脑缺血发作;③各种原因的脑出血和蛛网膜下腔出血;④明显肝肾功能不全或心力衰竭;⑤近2周内有严重感染、结核或恶性疾病、外科手术和外伤史;⑥近1个月内服用抗生素、环氧化酶2抑制剂等;⑦近期服用过血管紧张素转化酶抑制剂类降压药、抗凝药物、抗癫痫药、激素或类激素药物、免疫炎症抑制剂;⑧近期服用卡马西平、苯妥英钠、异烟肼等药物,或长期服用氯丙嗪、吩噻嗪类药物等;⑨既往有卒中病史者,住院期间并发感染;⑩排除其他可能影响血hs-CRP水平的因素,包括甲状腺疾病、胃病、及其他慢性消耗性疾病、自身免疫性疾病、急性心肌梗死及其他血栓栓塞性疾病等。
1.3 研究方法
1.3.1 临床调查表 收集纳入患者的人口学资料,包括性别、年龄、体质量,既往史、吸烟饮酒史、收缩压/舒张压、发病时间、临床症状、体格检查、美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分,以及血常规、凝血常规、血生化全项、自身免疫、病毒系列、心电图、心脏超声、颈动脉超声、CT/MRI、CT血管造影(CT angiography,CTA)/磁共振血管造影(magnetic resonance angiography,MRA)等辅助检查。
1.3.2 实验室检测指标 所有研究对象于次日清晨空腹抽取肘静脉血3 mL,加入肝素促凝试管,放入低温离心机内,在4 ℃的条件下,转速3 000 r/min,离心4 min,将血清分离,留取血浆。应用Cobas 80000全自动生化分析仪,采取乳胶比浊法测定hs-CRP水平,采用直接测定法测定LDL水平。试剂盒为日本和光纯药工业株式会社公司生产,严格按说明书操作。
1.4 统计学方法 应用SPSS 21.0统计学软件分析数据。计量资料为非正态分布变量,以M(QR)表示,比较采用秩和检验;计数资料比较采用χ2检验;相关性采用Spearman相关分析;采用Logistic回归分析筛选各型脑梗死发病的危险因素。P<0.05差异有统计学意义。
2 结 果
2.1 影像学表现 LAA型患者DWI显示:右颞叶大片状高信号,提示急性大面积脑梗死。MRA显示:右侧大脑中动脉M1近端明显狭窄,远端分支未显影。SAO型患者DWI显示:右侧基底节区小片状高信号,提示急性腔隙性梗死。MRA未见明显异常。CE型患者DWI显示:左额顶颞区斑大片状高信号,局部小片状低信号影,提示急性大面积脑梗死伴渗血。MRA显示:左侧大脑中动脉近端明显狭窄,M1中段以远信号缺失。
2.2 4组人口学特征和风险因素比较 4组间性别、年龄、纤维蛋白原水平差异无统计学意义(P>0.05)。LAA、SAO、CE组NIHSS评分、收缩压、舒张压明显高于对照组,LAA组和CE组NIHSS评分高于SAO组,LAA、SAO组收缩压高于CE组,差异有统计学意义(P<0.05)。LAA、SAO组吸烟、糖尿病发生率高于对照组和CE组,SAO组饮酒发生率高于对照组,LAA、SAO、CE组高血压、高脂血症、心脏病发生率高于对照组,CE组心脏病发生率高于LAA组和SAO组,差异有统计学意义(P<0.05)。见表1。
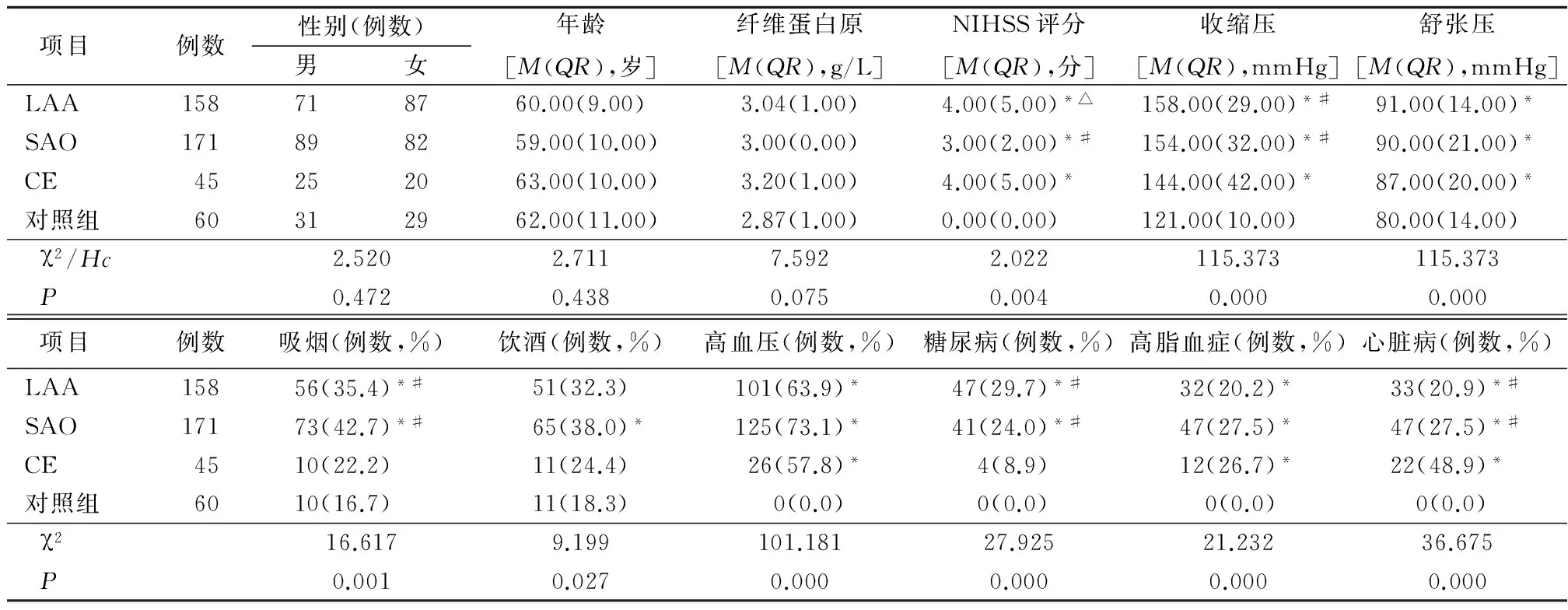
表1 LAA、SAO、CE组与对照组人口学特征和风险因素比较Table 1 Comparison of demographic characteristics and risk factors among LAA,SAO,CE and control groups
*P<0.05与对照组比较 #P<0.05与CE组比较 △P<0.05与SAO组比较(χ2检验、秩和检验)
2.3 4组血清hs-CRP和LDL水平比较 LAA、SAO、CE组血清hs-CRP水平高于对照组,CE组血清hs-CRP水平高于LAA、SAO组,LAA组血清hs-CRP水平高于SAO组,差异有统计学意义(P<0.05)。LAA、SAO组血清LDL水平高于对照组,差异有统计学意义(P<0.05)。见表2。
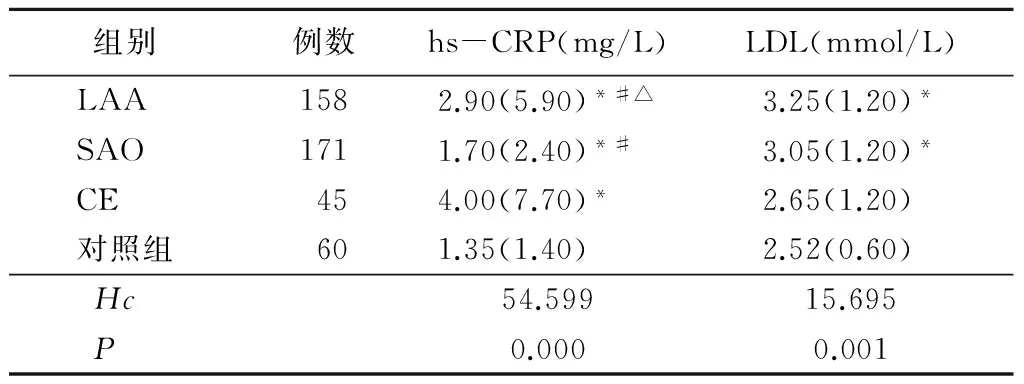
表2 4组hs-CRP和LDL水平比较Table 2 Comparion of hs-CRP and LDL levels among 4 groups [M(QR)]
*P<0.05与对照组比较 #P<0.05与CE组比较 △P<0.05与SAO组比较(秩和检验)
2.4 急性期脑梗死患者血清hs-CRP水平Spearman相关危险因素分析 急性脑梗死患者血清hs-CRP水平与LDL、NIHSS评分呈正相关(rs=0.164、0.183,P<0.05)。
2.5 二分类Logistic回归分析 以心源性脑栓死为因变量,以NIHSS评分、收缩压、舒张压、吸烟、饮酒、糖尿病、高脂血症、心脏病、hs-CRP、LDL为自变量,进行二分类Logistic回归分析,结果显示收缩压、hs-CRP是心源性脑栓死的危险因素。见表3,4。
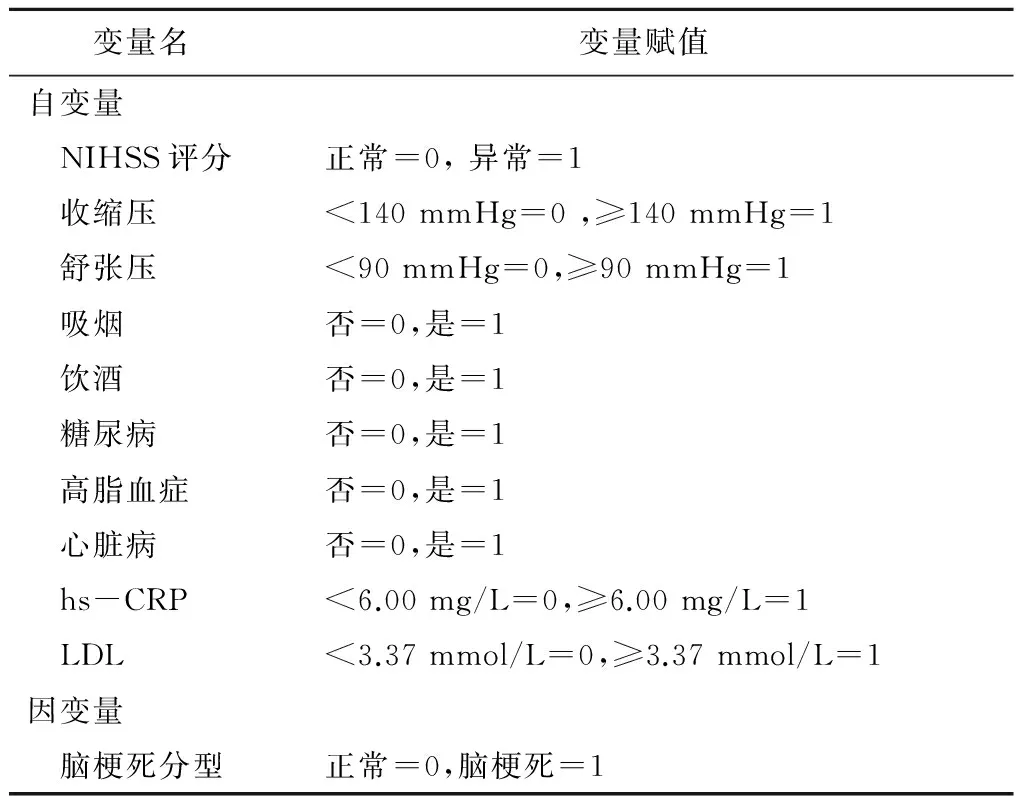
表3 Logistic回归变量含义及变量赋值说明Table 3 Variable and assignment of Logistic regression

表4 急性脑梗死患者危险因素的 Logistic回归分析Table 4 Logistic regression analysis of risk factors in patients with acute cerebral infarction
3 讨 论
在国际范围内,急性脑梗死是病死率最高的病因之一[2]。脑梗死可分为腔隙性脑梗死、脑血栓形成和脑栓死等,约占全部脑卒中的70%。急性脑梗死通常在发病24 h后,头颅CT可发现相应部位的缺血病灶。头颅DWI检查可发现脑梗死超急性期(<6 h)的新发病灶,表现为DWI呈高信号,ADC呈低信号。脑梗死的TOAST分型是根据急性脑梗死患者的临床症状和体征,结合医学影像学资料,临床中可以针对不同的病因进行不同的脑梗死病因学分型,使患者得到更加个体化的治疗,减少致死率和致残率,同时更有针对性地开展预防工作。急性脑梗死病因极其复杂,主要包括CE、SAO、LAA及其他少见原因(如高凝状态、血管炎、吸食毒品、血液系统疾病)等。而TOAST分型侧重于病因学分型,有助于脑梗死亚型的分类,进而指导临床诊断治疗。TOAST分型具有良好的信度和效度,作为急性脑梗死病因学分型的代表,已被广泛应用于临床及基础研究之中[3]。根据急性期脑梗死的辅助检查结果不同,TOAST分型共分为5型: LAA、SAO、CE,不明原因脑梗死和其他原因明确性脑梗死。因后2型病例数极少,本研究未纳入。本研究结果显示, 374例急性脑梗死患者依照TOAST分型标准分为SAO 171例(45.7%),LAA 158例(42.3%),CE 45例(12.0%)。本研究选取的病例均为首次发病于72 h内入院的脑梗死患者,占比例数最大的是SAO脑梗死类型。国外一项报道结果也表明,在急性脑梗死患者中,大多为SAO,其次是LAA和CE[4]。本研究TOAST分型构成比与国内外报道结果一致。脑梗死多见于中老年人,其常并发动脉硬化、高脂血症、高血压或糖尿病等,长期糖尿病、高血压可影响心、脑、肾功能。本研究结果显示,LAA、SAO、CE组收缩压、舒张压明显高于对照组,LAA、SAO组收缩压高于CE组,差异有统计学意义(P<0.05)。LAA、SAO组吸烟、糖尿病发生率高于对照组和CE组,SAO组饮酒发生率高于对照组,LAA、SAO、CE组高血压、高脂血症、心脏病发生率高于对照组,CE组心脏病发生率高于LAA组和SAO组,差异有统计学意义(P<0.05)。与以往研究报道结果一致[5-6]。急性脑梗死的病理改变是由于微动脉粥样硬化、小动脉的脂质透明样变性和(或)纤维蛋白样坏死[7],导致广泛的血管内皮损伤和血管阻力急剧增加,微血管的基膜增厚和退行性改变使管腔局部狭窄,形成微小的粥样斑块,基底动脉或大脑中动脉的主干或者是其远端分支的动脉粥样硬化等,最终局部管腔闭塞可造成小动脉闭塞性脑梗死,故笔者认为这是导致SAO患者居多的可能原因。因此,推断SAO与动脉硬化存在一定的相关性。
3.1 hs-CRP、LDL与动脉硬化 造成脑动脉血管狭窄的主要原因是动脉粥样硬化,而MRA是评估脑梗死动脉粥样硬化程度的首选影像学方法,能够清晰显示急性脑梗死患者病变血管的部位、数目、血管侧支循环建立和狭窄程度情况,亦能直观地显示脑内大血管的狭窄和闭塞情况。临床工作中,根据MRA血流信号的强弱对脑动脉血管的狭窄程度进行分析,从而对动脉粥样硬化的程度作出评判。本研究结果显示,LAA、SAO、CE组血清hs-CRP水平均高于对照组,CE组高于LAA、SAO组,LAA组高于SAO组。结合头颅MRA结果,LAA组MRA表现为大脑前循环、后循环主干血管管径狭窄程度≥50%,而CE组与LAA组MRA影像学表现相似。说明这2型脑梗死的动脉硬化程度较明显。本研究中CE组和LAA组血清hs-CRP水平相对较高,揭示血清hs-CRP水平与动脉粥样硬化严重程度密切相关。有研究报道,大量hs-CRP沉积在动脉粥样硬化斑块中,并且可以见到大脑的补体终末反应蛋白沉淀[8-10]。在动脉硬化形成过程中,炎性反应扮演着十分关键的角色[11]。动脉粥样硬化性脑梗死的发生机制与炎性反应密切相关。hs-CRP加速动脉粥样硬化的机制包括:①可以诱导血管的内皮细胞上的黏附分子产生高表达,启动脑梗死动脉粥样硬化的发生;②可以通过调节动脉壁中的脂质,参与形成泡沫细胞;③可由蛋白分解作用而产生的多肽,可以促使局部免疫炎性反应的发生,最终导致病灶的进行性加重及斑块破裂;④补体的激活作用;⑤可诱导单核细胞通过激活补体系统或者合成组织因子,加速血栓栓子的形成及脱落。故由此推断血清hs-CRP与动脉粥样硬化斑块密切相关。
本研究结果显示LAA组和SAO组血清LDL水平明显高于对照组,结合头颅MRA结果,说明脂质斑块沉积在动脉管壁的数量较多,间接判断患者颅内动脉粥样硬化的程度较重。血清LDL促使动脉粥样硬化形成的可能机制为,LDL可从血浆逐步进入动脉的血管壁内,又能重新返回到血浆当中。但当其血浆的浓度超过一定的阈值(LDL达到1.5 mmol/L)时,进入量即高于流出量,使之在血管壁内堆积。堆积在血管壁内的LDL随之被氧化、化学修饰[12],其中被氧化的磷脂启动了免疫炎性反应,在动脉血管壁内发生生化反应,最终造成动脉粥样硬化[13]。已有研究表明,LDL氧化后可以诱导体液免疫和细胞免疫,抗氧化型LDL抗体的滴度与颈动脉粥样硬化的进展相关[14],降低血浆LDL浓度可延缓动脉粥样硬化的进展[15]。
3.2 hs-CRP、LDL与脑梗死的不同TOAST分型 本研究结果显示,在TOAST亚型中,CE组患者中血清hs-CRP水平最高,其次是LAA组,SAO组水平最低。与以往的研究结果一致[16-19]。提示hs-CRP水平增高越明显,炎性反应则越剧烈,动脉粥样硬化程度相应也会明显加重,血管狭窄程度加剧,导致临床表现越严重,病死率越高。本研究采用二分类Logistic回归分析,结果显示收缩压、hs-CRP是心源性脑梗死的危险因素。与以往研究报道结果一致[20-21]。
分析脑梗死患者血清hs-CRP水平明显增高的原因;首先,hs-CRP水平在心脏疾病通常增加[22],尤其是在心房颤动和心力衰竭的患者中hs-CRP水平更高,是CE脑梗死最常见的来源;其次,hs-CRP水平增高的范围与脑卒中损伤的程度有关[23-24]。hs-CRP水平在发生脑梗死后的8 h内升高可增加一倍的脑血管事件,使病情加重[25]。这些生化指标在CE脑梗死的诊断中起着特殊的作用,能够在早期协助诊断缺血性卒中的病因学分类。
本研究结果显示LAA组和SAO组血清LDL水平明显高于对照组。说明LDL在LAA、SAO发病过程中发挥重要作用,可能是由于血清LDL所造成的脂质斑块大量沉积在血管的管壁上,造成血管的严重狭窄,甚至闭塞,导致脑梗死发生[26]。而CE组血清LDL水平与对照组差异无统计学意义,说明此类型脑梗死发病与血清LDL水平无明显相关性,考虑与心脏原发病有关。结合本研究结果,在脑梗死急性期,应及时检测血清LDL水平,此生化指标如有明显升高,可初步考虑LAA、SAO 2种类型,为早期诊断及治疗提供帮助。
3.3 hs-CRP、LDL与脑梗死的NIHSS评分 本研究结果显示,在急性脑梗死患者中,血清hs-CRP与LDL水平、NIHSS评分呈正相关(P<0.05)。脑梗死后NIHSS评分的高低代表着神经功能损伤的严重程度,NIHSS评分越高,神经损伤的程度越严重,病情也越严重,hs-CRP、LDL水平也相应明显升高。考虑有以下几方面原因:①LDL在生物学过程中是关键的因素之一,能引发和加速动脉粥样硬化病变的发展,而氧化LDL水平可反映脑缺血中的氧化应激程度;②炎症既是一个危险因素,又是卒中的结果,是在疾病发病过程的氧化应激的根源。hs-CRP是一个炎性标记物,与卒中的预后及未来发生血管事件紧密相关[27-29]。
综上所述,在急性脑梗死的病理机制中,血浆hs-CRP和LDL水平的作用不容忽视,血浆hs-CRP水平可作为心源性栓塞的特异性生化指标,而血清LDL水平可作为预测LAA脑梗死的指标,为临床诊疗提供帮助。本研究样本量较小,且未将所有类型急性脑梗死纳入其中,故存在一定的局限性,所得的结果可能存有偏差。在今后的研究中宜进一步扩大样本量,更深入地探讨实验室生化指标与各类型急性脑梗死之间的关系。
[1] 蒋福生,张平,张新华.急性脑梗死患者血清LDL-C及CRP的临床意义[J].中国民族民间医药,2013,22(7):38.
[2] 朱国燕,邵国富.近期炎症事件与缺血性脑卒中TOAST亚型的关系[J].神经疾病与精神卫生,2008,8(6):462-463.
[3] Hankey GJ,Anderson NE,Ting RD,et al. Rates and predictors of risk of stroke and its subtypes in diabetes:a prospective observational study[J]. J Neurol Neurosurg Psychiatry,2013,84(3):281-287.
[4] Silva-Pinto A,Costa A,Serrăo R,et al. Ischaemic stroke in HIV-infected patients:a case-controlstudy[J]. HIV Med,2016[Epub ahead of print].
[5] 孙海林,孙灵.高血压合并急性脑梗死患者的临床特征及对预后的影响[J].当代医学,2016,22(33):72-73.
[6] 赵秀欣,穆利春,马丽芳.rt-PA静脉溶栓治疗急性脑梗死临床分析[J].中国循证心血管医学杂志,2016,8(4):486-488.
[7] Lu X,Wood DK,Higgins JM. Deoxygenation reduces sickle cell blood flow at arterial oxygen tension[J]. Biophys J,2016,110(12):2751-2758.
[8] Di Napoli M,Schwaninger M,Cappelli R,et al.Evaluation of C-reactive protein measurement for assessing the risk and prognosis in ischemic stroke.A Statement for Health Care Professionels From the CRP Pooling Project Members[J]. Stroke,2005,36(6):1316-1329.
[9] Yasojima K,Schwab C,Mc Geer EG,et al. Generation of C-reactive protein and complement components to atherosclerotic plaques[J]. Am J Pathol,2001,158(3):1039-1051.
[10] Zhao L,Zhai Z,Hou W. Analysis of Carotid color ultrasonography and high sensitive C-reactive protein in patients with atherosclerotic cerebral infarction[J]. Pak J Med Sci,2016,32(4):931-934.
[11] 徐耕,金国栋,傅国强,等.急性冠脉综合征患者C-反应蛋白及其1059G/C基因多态性的研究[J].中华急诊医学杂志,2003,12(4):223-226.
[12] Torisu K,Zhang X,Nonaka M,et al. PKCη deficiency improves lipid metabolism and atherosclerosis in apolipoprotein E-deficient mice[J]. Genes Cells,2016,21(10):1030-1048.
[13] Santos RD,Gidding SS,Hegele RA,et al. Defining severe familial hypercholesterolaemia and the implications for clinical management:a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel[J]. Lancet Diabetes Endocrinol,2016,4(10):850-861.
[14] Zhao J,Zheng L,Fei Q,et al. Association of thromboxane A2 receptor gene polymorphisms with cerebral infarction in a Chinese population[J]. Neurol Sci,2013,34(10):1791-1796.
[15] Tuttolomondo A,Di Raimondo D,Pecoraro R,et al. Inflammation in ischemic stroke subtype[J]. Curr Pharm Des,2012,18(28):4289-4310.
[16] Eikelboom JW,Hankey GJ,Baker RI,et al. C-reactive protein in ischemic stroke and its etiologic subtypes[J]. J Stroke Cerebrovasc Dis,2003,12(2):74-81.
[17] Luo Y,Wang Z,Li J,et al. Serum CRP concentrations and severity of ischemic stroke subtypes[J]. Can J Neurol Sci,2012,39(1):69-73.
[18] Terruzzi A,Valente L,Mariani R,et al. C-reactive protein and aetiological subtypes of cerebral infarction[J]. Neurol Sci,2008,29(4):245-249.
[19] Ladenvall C,Jood K,Blomstrand C,et al. Serum C-reactive protein concentration and genotype in relation to ischemic stroke subtype[J]. Stroke,2006,37(8):2018-2023.
[20] Ashjazadeh N,Fathi M,Shariat A. Evaluation of homocysteine level as a risk factor among patients with ischemic stroke and its subtypes[J]. Iran J Med Sci,2013,38(3):233-239.
[21] Nagarakanti R,Wallentin L,Noack H,et al. Comparison of characteristics and outcomes of dabigatran versus warfarin in hypertensivepatients with atrial fibrillation (from the RE-LY Trial)[J]. Am J Cardiol,2015,116(8):1204-1209.
[22] Habib SS,A AIMasri A. Relationship of high sensitivity C-reactive protein with presence and severity of coronary artery disease[J]. Pak J Med Sci,2013,29(6):1425-1429.
[23] Kara H,Akinci M,Degirmenci S,et al. High-sensitivity C-reactive protein,lipoprotein-related phospholipase A2,and acute ischemic stroke[J]. Neuropsychiatr Dis Treat,2014,10(6):1451-1457.
[24] Beer C,Blacker D,Hankey GJ,et al. Association of clinical and aetiologic subtype of acute ischaemic stroke with inflammation,oxidative stress and vascular function:a cross-sectional.observational study[J]. Med Sci Monit,2011,17(9):CR467-473.
[25] Young B,Gleeson M,Cripps AW. C-reactive protein:a critical review[J]. Pathology,1991,23(2):118-124.
[26] 刘焕琥,潘旭东,马爱军,等.急性脑梗死患者血清氧化型低密度脂蛋白水平变化及其与TOAST分型的关系[J].中华脑血管病杂志,2008,2(6):331-333.
[27] Welsh P,Barber M,Langhorne P,et al. Associations of inflammatory and haemostatic biomarkers with poor outcome in acute ischaemic stroke[J]. Cerebrovasc Dis,2009,27(3):247-253.
[28] Shantikumar S,Grant PJ,Catto AJ,et al. Elevated C-reactive protein and long-term mortality after ischaemic stroke:relationship with markers of endothelial cell and platelet activation[J]. Stroke,2009,40(3):977-979.
[29] Ryu SR,Choi IS,Bian RX,et al. The effect of C-reactive protein on functional outcome in ischemic stroke patients[J]. Int J Neurosci,2009,119(3):336-344.
(本文编辑:赵丽洁)
The changes of serum hs-CRP and LDL Levels in patients with acute cerebral infarction of different TOAST types and its clinical significance
GU Li-li1,2, TIAN Yong-wu2, HE Dan1*
(1.DepartmentofNeurology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050017,China; 2.DepartmentofNeurology,theSecondHospitalofDingzhouCity,HebeiProvince,Dingzhou073000,China)
Objective To investigate the effects of high sensitive-C reactive protein(hs-CRP) and low density lipoprotein(LDL) levels in patients with acute cerebral infarction, and to investigate the effects of hs-CRP and LDL on the acute cerebral infarction and its clinical significance. Methods Three hundred and seventy-four cases of cerebral infarction were selected as the case group and 60 healthy volunteers were normal control group. In the case group, 158 patients with large-artery atherosclerosis(LAA), 171 patients with small artery occlusion(SAO) and 45 cases with cardioembolism(CE) were divided into three groups according to TOAST classification. All the subjects were given 3 mL of venous blood in the early morning of the next day, and the levels of serum hs-CRP and LDL were measured. Results National Institute of Health stroke scale(NIHSS) score, systolic blood pressure and diastolic blood pressure of LAA, SAO and CE group were significantly higher than those of control group. The NIHSS score of LAA group and CE group was higher than that of SAO group, and the systolic blood pressure of LAA group and SAO group was higher than that of CE group. LAA, SAO group were higher than the control group and CE group. SAO group was higher than the control group, LAA, SAO, CE group of hypertension, hyperlipidemia, heart disease rate was higher than the control group. The incidence of heart disease in CE group was higher than that in LAA group and SAO group. The levels of serum hs-CRP in LAA, SAO and CE group were higher than those in LAA group and SAO group, and the level of serum hs-CRP in LAA group was higher than that in SAO group. The level of serum LDL in LAA and SAO group was higher than that in control group(P<0.05). The levels of serum hs-CRP in patients with acute cerebral infarction were positively correlated with LDL and NIHSS scores(rs=0.164, 0.183,P<0.05). Logistic regression analysis showed that systolic blood pressure and hs-CRP were risk factors for cardioembolism. Conclusion In the TOAST subtype, serum hs-CRP can be used as a risk factor for CE, and it is an indicator of the etiology of early diagnosis of cerebral infarction. LDL is expected to become a specific biochemical index of LAA, which has important clinical value for early prediction of LAA.
brain infarction; C-reactive protein; lipoproteins, LDL
2017-02-08;
2017-03-03
谷黎丽(1983-),女,河北定州人,河北省定州市第二医院主治医师,医学硕士研究生,从事神经内科疾病诊治研究。
*通讯作者。E-mail:danhe@126.com
R743.33
A
1007-3205(2017)05-0514-07
10.3969/j.issn.1007-3205.2017.05.005

