芽胞漆酶的固定化方法对比研究与载体选择
周 稳, 管政兵, 蔡宇杰, 赵 宏, 廖祥儒*
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
芽胞漆酶的固定化方法对比研究与载体选择
周 稳1,2, 管政兵1,2, 蔡宇杰1,2, 赵 宏1,2, 廖祥儒*1,2
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
为了找到适合芽胞漆酶固定化的载体和方法,对12种载体共19种芽胞漆酶固定化方案进行了对比研究,并通过参考固定化芽胞漆酶的酶活力回收率、重复利用率、成本等因素,选定以DEAE-纤维素为载体通过离子结合法固定为最佳方案。结果表明,包埋法固定化芽胞漆酶存在严重的扩散限制作用,部分包埋法制备的微球还会伴有溶解、膨胀的现象。而多孔材料常因孔径过小难以固定芽胞。芽胞以碳二亚胺为交联剂与载体进行共价结合,具有良好的固定化性能,可作为备选方案。
芽胞漆酶;包埋法;吸附法;离子结合;共价结合
漆酶(EC 1.10.3.2)是一种含铜多酚氧化酶,能够利用O2作为电子受体催化多种酚类物质氧化,在存在介体辅助的情况下,它还能够催化非酚类物质氧化[1]。漆酶由于其广泛的底物谱和环境友好的特性,在废水处理、生物修复、食品加工、生物传感器、有机合成、木质素降解处理中都极具应用潜力。漆酶广泛存在于高等植物、真菌、细菌和昆虫之中。其中,真菌漆酶的研究报道最多,研究得最深入,然而因其漆酶活性对酸性环境的极度依赖而难以得到广泛的工业化应用[2]。细菌漆酶由于其极度耐高温和耐碱的特性而成为近十年新的漆酶研究热点。
芽胞漆酶(spore laccase),即固着在芽胞上的漆酶,是最具代表性的细菌漆酶,其活性来源于芽胞外衣蛋白[3]。芽胞除具漆酶活性外,其表面20余种外衣蛋白可能还具有过氧化氢酶、乙酰脱氢酶、核酮糖激酶等活性[4]。
固定化芽胞是一项极具意义的工作。其意义不仅在于芽胞漆酶的研究和应用,更为芽胞的其他应用提供了固定化的经验。作者通过包埋、吸附和共价结合以及其复合方法对来源于Bacillus pumilus W3的芽胞进行了固定化方法的对比研究,并从固定化芽胞的漆酶活力回收、形状、溶解性、膨胀性、机械强度等方面评价了各种方法对芽胞漆酶的固定化性能,为芽胞的固定化载体和方法选择提供了思路。此外,作者还首次提出了将PVA海绵作为载体应用于酶或细胞固定化的技术方案。
1 材料与方法
1.1 试剂
丁香醛连氮(SGZ)、聚乙烯亚胺(PEI)、2,2-联氮-二 (3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(AR):Sigma公司产品;3-氨丙基三乙氧基硅烷(APTES)、活性炭(颗粒状,C112235:催化剂载体专用);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC):阿拉丁试剂(上海)有限公司产品;PVA海绵(Saugwunder):宁波海天集团产品;树脂D 113:安徽三星树脂有限公司产品;树脂HPD 300、HPD 400:沧州宝恩化工有限公司产品;DEAE-纤维素、戊二醛(GA)、聚乙烯醇(PVA)、海藻酸钠(SA)、正硅酸四乙酯(TEOS)、硅藻土(celite 545)、聚乙二烯苯小球(GDX-101)、羟基磷灰石(HAP)等(AR):国药集团化学试剂有限公司产品。
1.2 方法
1.2.1 菌株培养与芽胞准备 将分离于五倍子蜂蜜样品的菌株B.pumilus W3[5]接种于LB培养基上进行活化,然后按质量分数1%的接种量接入装液量为100mL的三角瓶中,在30℃、200 r/min的条件下培养48 h,芽胞大量生成。生胞培养基(DSM培养基)含营养肉汤 8 g/L、KCl 1 g/L、MgSO4·7H2O 0.25 g/L、MnCl2·H2O 0.002 g/L。高压灭菌后加入过滤除菌的CuSO4、CaCl2和FeSO4溶液并使其终浓度分别为0.2、0.5、0.005 mmol/L。芽胞悬液按王贺报道的方法进行制备[6]。
1.2.2 酶活检测 漆酶活性利用分光光度法进行检测。将0.1mL游离芽胞或具相同芽胞量的固定化芽胞加入到3.4 mL柠檬酸磷酸盐缓冲液(pH 6.8,0.1 mol/L),在37℃条件下保温15 min,使酶的活性中心充分激活,然后加入SGZ(终浓度为 0.05 mmol/L)或ABTS(终浓度为0.5mmol/L),反应5 min之后将反应样品进行10min的冰水浴以终止反应。离心上述反应样品,取上清在λ=420 nm(ABTS)或λ=525 nm处(SGZ)检测吸光值。一个单位的酶活定义为每分钟氧化1μmol底物所需的酶量[7]。
1.2.3 包埋法固定芽胞 芽胞的固定化方法参考已有的报道[8]进行,并进行了适当地修改。操作步骤见图1。芽胞的添加量为0.5~10mg/mL。根据不同载体的性质,固定方案略有调整,见表1。
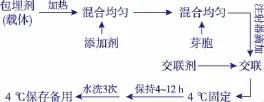
图1 包埋法固定芽胞的技术路线Fig.1 Technical route of immobilized spores by embeddingmethod
1.2.4 吸附法固定芽胞 称取1 g载体,根据需要进行预处理,DEAE-纤维素的预处理方式详见表中列出的参考文献。将处理好的载体投入20mL缓冲液中,添加适量芽胞,在37℃,200 r/min及一定pH条件下,吸附12 h,抽滤,收集滤出液(上清液)用于检测固定化率。用柠檬酸磷酸盐缓冲液洗涤沉淀3次,自然干燥备用。
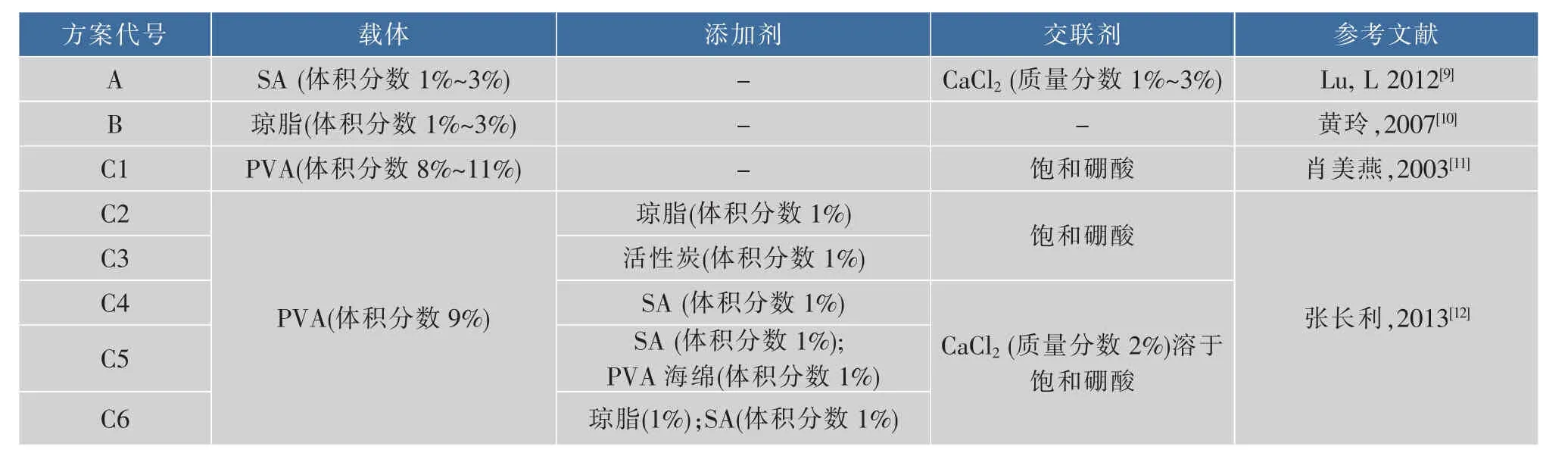
表1 包埋法所用载体及处理条件Table 1 Embedding carriers and treatment conditions

表2 吸附法所用载体及处理条件Table 2 Adsorption carriers and treatment conditions
1.2.5 结合法固定芽胞 载体合成及表面修饰:壳聚糖微球按王颖等[17]报道的方法进行。氨基功能化二氧化硅粒子(APS)按Ruan等[18]报道的方法进行合成。PEI涂敷的PVA海绵的制备:将成块的PVA海绵切成2 mm×2 mm×2 mm小块,用体积分数95%的乙醇浸泡过夜,以除去表面可能残留的甲醛。将经乙醇处理后的PVA海绵水洗,自然条件下干燥至恒重。将处理好的海绵按1 g∶20mL浸入水中,添加PEI到终质量浓度为1 mg/mL,在37℃、200 r/ min条件下振荡6 h。用缓冲液洗涤3次,过滤即得PEI涂敷的PVA海绵。硅藻土的表面氨基化采用常用的APTES偶联剂来进行[16]。
GA交联:将1 g制备所得的壳聚糖小球放入到含芽胞100 mg的20 mL柠檬酸磷酸盐缓冲液中,加入0.4~4%的GA交联8 h,抽滤上述混合物,收集上清液用于检测固定化率,滤出的固定化芽胞小球用柠檬酸磷酸盐缓冲液洗涤3次,保存备用。
EDC交联:称取1 g载体置于柠檬酸磷酸盐缓冲液中,混合均匀后加入2 mL EDC(4 mg/mL),超声处理10 min,接着加入1 mL芽胞悬液(100 mg/ mL)使最终混合液的体积为20 mL,同样条件下超声处理30 min,以使其充分分散结合。将上述超声处理的样品置于摇床,在37℃,200 r/min条件下继续固定12 h。固定完成后,用柠檬酸磷酸盐缓冲液洗涤固定化产物3次,分别收集上清和固定化产物,4℃保存备用。

表3 共价结合法所用载体及处理条件Table 3 Carriers for covalent bonding and treatment conditions
1.2.6 不同固定化方法和载体的性能检测与评价

式中,A1为初始酶活;A2为上清酶活;A3为固定化酶酶活。
粒径:粒径大于1 mm用直尺测量,小于1 mm并大于0.2mm用游标卡尺测量,小于0.2 mm用显微镜测量。
5次循环检测剩余酶活:取相同芽胞量的固定化芽胞,以SGZ来检测固定化芽胞漆酶的重复使用能力,每次测完酶活后,倾去反应液,用柠檬酸磷酸盐缓冲液振荡洗涤固定化芽胞,倾去洗涤液,然后加入反应体系再次测酶活,如此往复,检测5次循环反应后剩余酶活。
数据分析方法参考王政改等[21]的报道,所有数据均采用Origin 8、SPSS 19以及Excel 2003软件进行分析。
2 结果与讨论
2.1 芽胞漆酶固定化综合性能
2.1.1 包埋法固定芽胞漆酶的综合性能 表4为多种包埋方案固定化芽孢漆酶的综合性能。在这些方案中,所有微囊化获得的微球都具有极高的初始机械强度,不易被挤破或撕裂[22]。部分PVA微球有严重吸水膨胀现象,可能与PVA分子上未参与反应的羟基与水分子快速结合有关。
2.1.2 吸附法固定芽胞漆酶的综合性能 选择一个适合吸附的固定化载体,需要考虑载体的表面积、粒径、孔径、孔结构以及表面的功能基团[23]。其中,孔径以及孔结构可能是最重要的固定化理化参数。如表5所示,所有通过物理吸附的固定化芽胞漆酶活力回收率都极低,甚至多种树脂对芽胞几乎没有吸附能力。这可能是这些固定化材料的孔径以及孔结构造成的。芽胞的大小一般为1.2μm×0.8 μm,一般的树脂孔径要比其小得多[24-27]。
2.1.3 活性载体的制备与共价结合法固定芽胞漆酶的综合性能 表6考察了4种不同载体及其固定化芽胞漆酶的综合性能。
如表6所示,溶胶-凝胶法制备的带有氨基的二氧化硅粒子、PEI涂敷的PVA海绵以及氨基化的硅藻土都有较高的相对酶活,而壳聚糖不论以EDC还是GA为交联剂几乎都没有漆酶活性。
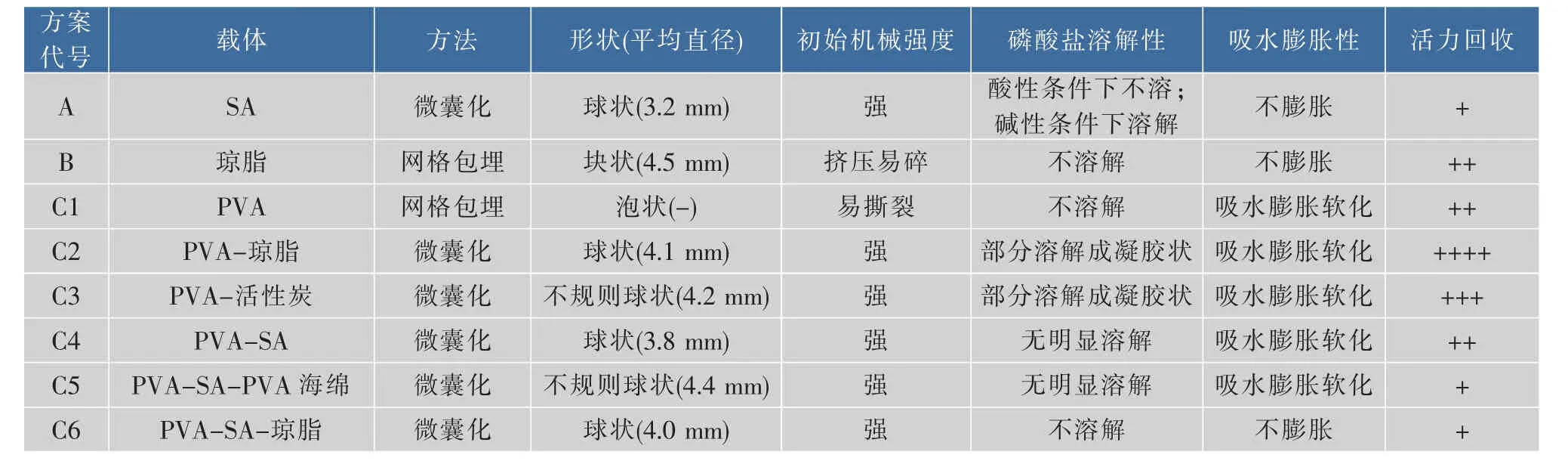
表4 包埋法固定芽胞漆酶的综合性能Table 4 Comprehensive performance of immobilized spore laccase by embeddingmethod

表5 吸附法固定芽胞漆酶的综合性能Table 5 Com prehensive performance of immobilized spore laccase by adsorption method
注:在平均直径检测与初始机械强度描述中,“-”代表未检测或未描述;在活力回收检测中,以本研究中DEAE-纤维素吸附芽胞的酶活回收率为“+++++”,无酶活为“-”。

表6 共价结合法固定芽胞漆酶的综合性能Table 6 Com prehensive performance of immobilized spore laccase by covalent bonding
2.2 包埋剂、pH和交联剂对芽胞漆酶固定化效率的影响
2.2.1 包埋剂添加量对包埋法固定化芽胞漆酶效率的影响 包埋剂添加量、交联剂添加量、芽胞量、添加剂添加量以及交联固定时间都会影响芽胞漆酶的活力回收和稳定性。其中,包埋剂的选择和添加量对此二者的影响作用尤为明显。当包埋剂含量较低时,固定化芽胞微球硬度较低,易被溶解。随着包埋剂含量的增加,固定化芽胞微球的硬度逐渐增加,利用注射器滴加的难度越大,也越容易出现拖尾现象。在本研究中,SA、PVA-琼脂和琼脂3种包埋方案其最适的包埋剂添加量分别为 2%、9%(PVA)和2%(数据未显示)。过低和过高浓度的包埋剂都不利于保留较高的酶活。包埋剂添加量的确定是包埋法固定化研究的基础,要在活力回收和稳定性中保持平衡,还需要进一步优化包埋剂添加量、芽胞量、添加剂添加量和交联固定时间。
2.2.2 pH对离子结合法固定化芽胞漆酶效率的影响DEAE-纤维素是一种弱碱性阴离子交换剂,其表面的二乙氨基乙基带正电,可以吸附带负电荷的蛋白质从而达到分离的目的。pH和离子强度是控制蛋白质离子交换行为、分辩率和回收率的重要参数,其中,pH决定了目标分子及离子交换剂带电荷的情况,因而是决定目的物是否发生吸附的最重要的参数。图2为DEAE-纤维素在不同pH条件下吸附芽胞对固定化效率的影响。芽胞漆酶在碱性条件下具有更高的相对酶活,在pH 10的条件下达到最大值,而在pH 5的条件下,芽胞漆酶的相对酶活不到pH 10的条件下酶活的40%。

标有不同小写字母表示差异显著(p<0.05),标有不同大写字母表示差异极显著(p<0.01)图2 pH对离子结合法固定化芽胞漆酶效率的影响Fig.2 Effect of pH on immobilization efficiency of spore laccase via ionic bonding
2.2.3 EDC与GA对共价结合法固定化芽胞漆酶效率的影响 EDC和GA都是常用的双功能交联剂,然而在添加相同芽胞量的情况下,通过不同的交联剂以及同种交联剂不同添加量处理得到的固定化酶活力回收差异较大。如图3所示,质量分数为2%的GA用作交联剂是合适的,过低浓度的GA不能提供足量的反应基团,而过高浓度的GA会破坏酶的活性中心。以壳聚糖为载体进行芽胞固定,几乎没有酶活回收。这可能是因为壳聚糖分子中含有丰富的羟基和氨基,GA在壳聚糖与芽胞同时存在的情况下,会优先使壳聚糖表面的氨基之间产生交联;而以EDC为交联剂时,EDC可能与残余的羧基发生反应,最终无法固定芽胞。EDC是一种异双功能交联剂,在交联过程中能够活化羧基和氨基,使之结合生成酰胺,其自身不参与连接臂的组成,对酶活的影响较小。在所有测试组中,以GA为交联剂的固定化芽胞的相对酶活回收率都要低于以0.4 mg/mL EDC为交联剂的固定化芽胞漆酶,这说明EDC比GA更适合用于芽胞的共价固定。此外,溶液的pH和离子强度都可能影响EDC的偶联效率,在含N-羟基琥珀酰亚胺(NHS)的情况下,EDC的偶联效率一般会更高。
2.3 载体与固定化方案的选择

标有不同小写字母表示差异显著(p<0.05),标有不同大写字母表示差异极显著(p<0.01)图3 EDC与GA对共价结合法固定化芽胞漆酶效率的影响Fig.3 Effects of EDC and GA on immobilization efficiency of spore laccase via covalent bonding
选择合适的固定化载体需要考虑到成本、酶活力回收、可重复利用率、适用的反应器以及固定化酶在特殊条件下的稳定性等多个方面。综合多种参考因素作者对最终选出的5种可供进一步研究的载体及固定化方案进行了对比分析。以PVA-琼脂为载体固定化芽胞漆酶的酶活力回收高、重复利用率好,但由于其在磷酸盐缓冲液中粘连成胶状物质,故可能只适用于具特殊要求的固定化应用。氨基化二氧化硅粒子作为载体,拥有较高的酶活力回收率,但制备过程略为繁琐,成本较高。氨基化的硅藻土成本一般,但粒径极小,且常沉降在反应池底部,对反应器有较高的要求。PVA海绵是一种新型的固定化材料,在分散性、分离容易度以及成本方面都有优势,但所得固定化酶的活力回收率是五种方案中最低的。相对而言,DEAE-纤维素通过离子键与芽胞结合,各方面都有良好的性能,是所有实验对象中最合适的载体。
3 结语
通过大量的对比研究,缩小了芽胞固定化载体的选择范围,比较全面地获得了芽胞固定化的经验,得到了一种适合固定化芽胞的材料——DEAE-纤维素。芽胞以EDC为交联剂,与氨基化的载体进行共价结合,具有良好的固定化性能,可作为芽胞固定化的备选方案。
[1]MADHAVIV,LELESS.Laccase:propertiesand applications[J].Bioresources,2009,4(4):1694-1717.
[2]SANTHANAM N,VIVANCO JM,DECKERSR,etal.Expression of industrially relevant laccases:prokaryotic style[J].Trends in Biotechnology,2011,29(10):480-489.
[3]ZHOUWen,GUAN Zhengbing,CAIYujie,etal.Progress in the Bacillus laccase[J].M icrobiology China,2015,42(7):1372-1383.(in chinese)
[4]MAO L,JIANG S,WANG B,etal.Protein profile of Bacillus subtilis spore[J].Current M icrobiology,2011,63(2):198-205.
[5]GUAN Z B,SONG C M,ZHANG N,et al.Overexpression,characterization,and dye-decolorizing ability of a thermostable,pH-stable,and organic solvent-tolerant laccase from Bacillus pumilus W 3[J].Journal of M olecular Catalysis B:Enzymatic,2014,101:1-6.
[6]王贺.乳果糖制备用酶枯草芽孢杆菌芽孢表面展示系统的构建[D].无锡:江南大学,2013.
[7]SUN Xiao,CAIYujie,LIAO Xiangru,et al.Laccase production under solid-state fermentation of rice straw by Pycnoporus sanguineus SYBC-L12 and itsdecolorization of synthetic dyes[J].Journal of Food Science and Biotechnology,2013,32(3):240-249.(in chinese)
[8]YU Meiyan.Study on the immobilizationmethods of Rhodotorulamucilaginosa[J].Journal of Zhongzhou University,29(3):123-125.(in chinese)
[9]LU L,ZHAO M,LIG F,et al.Decolorization of synthetic dyes by immobilized spore from Bacillus amyloliquefaciens[J]. Catalysis Communications,2012,26:58-62.
[10]HUANG Ling.Study on the characteristicsofα-amylase immobilized on agarby embedding[J].Chem istry&Bioengineering,2007,24(8):55-57.(in chinese)
[11]XIAOMeiyan,XU Erni,CHEN Zhiwen.Research progress in the immobilized cell technology by embedding[J].Food Science,2003,24(4):158-161.(in chinese)
[12]ZHANG Changli,YANG Hong,WANG Jingjing,et al.Effect of the co-composite matters on the immobilized manganese-oxidizing bacteria by PVA [J].Journal of Beijing University of Technology,2013,39 (11):1710-1715.(in Chinese)
[13]KHAN M R,BOKHARIH.Immobilization of the protease of Carica papaya on activated charcoal[J].Asian Journal of Chem istry,2008,20(8):6582-6588.
[14]CHAO H G,KIM Y O,LEE H Y,et al.Ethanol production from glycerol by the yeast Pachysolen tannophilus immobilized on celite during repeated-batch flask culture[J].M ycobiology,2014,42(3):305-309.
[15]LIU G Y,SUN L,WU X X,etal.Immobilization of puerarin glycosidase from Microbacterium oxydans CGMCC 1788 increases puerarin transformation efficiency[J].Brazilian Journal of Chem ical Engineering,2014,31(2):325-333.
[16]WANGM,SHIH,WU D,etal.Glutaraldehyde cross-linking of immobilized thermophilic esterase on hydrophobicmacroporous resin forapplication in poly(epsilon-caprolactone)synthesis[J].M olecules,2014,19(7):9838-9849.
[17]WANG Ying,ZHANG Di,RU Jia,etal.Enzymatic properties and catalytic capacity of immobilized laccase onmodified chitosan for2,4-Dichlorophenoldegradation[J].Environment Scicence,2013,32(10):1901-1908.(in Chinese)
[18]RUAN G H,WEI M P,CHEN Z Y,et al.Novel regenerative large-volume immobilized enzyme reactor:Preparation,characterization and application[J].Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2014,967:13-20.
[19]LONG J,JIAO A Q,WEIB X,et al.A novelmethod for pullulanase immobilized onto magnetic chitosan/Fe3O4composite nanoparticlesby in situ preparation and evaluation of the enzyme stability[J].Journal of M olecular Catalysis B-Enzymatic,2014,109:53-61.
[20]M INIGM,MAZZAFERRO L S,CAPECCEA,etal.Polyethyleneim ine coating ofmagnetic particles increased the stability of an immobilized diglycosidase[J].Biotechnology and App lied Biochem istry,2015,62(1):94-100.
[21]WANG Zhaogai,YANG Hui,CHEN Lijuan,etal.Effects of differentparts on quality and vitro antioxidation activity of extracts from Toona sinensis[J].Journal of Food Science and Biotechnology,2015,34(6):646-652.(in Chinese)
[22]LI Huazi,WANG Jianlong,WEN Xianghua et al.Improvement of PVA-H3BO3Immobilization Method[J].Research of Environmental Sciences,2002,15(5):25-27.(in Chinese)
[23]JESIONOWSKIT,ZDARTA J,KRAJEWSKA B.Enzyme immobilization by adsorption:a review[J].Adsorption-Journal of the International Adsorption Society,2014,20(5-6):801-821.
[24]CHADA V G,SANSTAD E A,WANG R,et al.Morphogenesis of Bacillus spore surfaces[J].Journal of Bacteriology,2003,185(21):6255-6261.
[25]WANG Yuesheng,WANG Yang.Research advances ofmacroporous resin[J].China Journal of Chinese M ateria M edica,2006,31(12):961-965.(in Chinese)
[26]XIE Qiang,ZHANG Xianglan,LI Lanting,et al.Porosity adjustment of activated carbon:theory,approaches and practice[J]. New Carbon M aterials,2005,20(2):183-190.(in Chinese)
[27]ZHU Jian,WANG Ping,LEIM ingjing,et al.Physicochem ical properties,modifi cation and research progress of diatom ite[J]. Journal of Central South University of Forestry&Technology,2012,32(12):61-66.(in Chinese)
Immobilization of Spore Laccase:Com parative Studies and Carriers Selection
ZHOUWen1,2, GUAN Zhengbing1,2, CAIYujie1,2, ZHAO Hong1,2, LIAO Xiangru*1,2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi214122,China)
The comparative studies for immobilization of spore laccasewere carried outusing 19 differentmethodsand 12 carriers.Theoptimalcarrierandmethodwere determ ined by theactivity yield,reusability,and costof the immobilized spore laccase.The ionic bondingmethod using DEAE-celluloseas the carrierwasselected as the bestmethod.The strong diffusion lim itationswere observed when the spore laccasewas immobilized by embeddingmethod.Them icrospheresm ight dissolve and swell if sem i-embeddingmethod wasused.The smallpore sizemade itdifficult for porousmaterials to immobilized spore laccase.Theexcellent immobilization propertieswere achieved when the sporeswere covalently bound to the carriersusing carbodiim ideas the crosslinker.Itwas thus recommended asan alternativemethod.
spore laccase,embedding,adsorption,ionic bonding,covalentbonding
Q 814.2
A
1673—1689(2017)04—0363—07
2015-06-05
国家自然科学基金项目(31101331);江南大学工业生物技术教育部重点实验室开放课题(KF201304);江苏高校优势学科建设工程资助项目;111引智计划(111-2-06);江苏省现代发酵工业协同创新中心项目。
*通信作者:廖祥儒(1964—),男,江西赣州人,理学博士,教授,博士研究生导师,主要从事微生物生物化学研究。
E-mail:liaoxiangru@163.com
周稳,管政兵,蔡宇杰,等.芽胞漆酶的固定化方法对比研究与载体选择[J].食品与生物技术学报,2017,36(04):364-370.

