火焰原子吸收光谱法测定黄山猕猴桃中金属元素的含量
兰艳素,张文峰,张猛,黄波 (黄山学院化学化工学院,安徽 黄山 245041)
火焰原子吸收光谱法测定黄山猕猴桃中金属元素的含量
兰艳素,张文峰,张猛,黄波
(黄山学院化学化工学院,安徽 黄山 245041)
采用火焰原子吸收光谱法对黄山猕猴桃(ActinidiachinensisPlanch)中Na、K、Cd、Ca、Cu、Fe、Mg、Mn、Pb、Zn的含量进行了测定。结果显示,含量较高的有K、Mg,其次是Na、Ca、Fe,含量较低的是重金属Cd、Pb,各元素回收率均介于97.50%~103.18%之间。该法高效、简单、准确。
火焰原子吸收光谱法;猕猴桃(ActinidiachinensisPlanch);金属元素;含量
猕猴桃(ActinidiachinensisPlanch)又叫猕猴梨,黄山地区又称之为杨桃,是猕猴桃属(Actinidia)植物的果实[1]。猕猴桃不仅营养价值较高,而且酸甜可口,被誉为“水果之王”[2]。研究发现,猕猴桃的化学成分中多糖[3]、维生素C的含量较高,还含有生物碱、黄酮类、三萜类、挥发油、氨基酸等成分[4~6]。猕猴桃不仅具有一定的降血脂、抗肿瘤、抗畸形、抗氧化等功效,而且能清热解毒、调节机体免疫力[7,8],若经常食用,可以有效治疗食欲不振、便秘、消化不良等症。
检测微量元素的方法较多,现阶段常用的有原子发射光谱法、原子吸收光谱法、X射线荧光光谱分析法等[9]。其中火焰原子吸收光谱法的检出极限非常低,而且方法成熟,仪器操作比较简单,准确度高,成为广泛应用于中草药及食品中微量元素含量测定方法之一。
到目前为止,对猕猴桃中的有效成分以及药理活性均已有研究,但对于黄山猕猴桃中微量元素的研究尚未见报道。本研究采用湿法消解-火焰原子吸收光谱法测定黄山猕猴桃中10种金属元素的含量,以期为黄山地区野生猕猴桃资源的进一步开发提供参考依据。
1 材料与方法
1.1 材料
样品:新鲜猕猴桃于2015年10月采自安徽省黄山风景区。
试剂:所用钠、钾、镁、铜、铅、锰、镉、锌、钙、铁标准溶液浓度均为1000μg/mL,HNO3、H2O2为优级纯,其他试剂为国产分析纯。
主要仪器:WFX-210型火焰原子吸收分光光度仪(北京瑞利分析仪器公司产品);空心阴极灯(北京有色金属研究总院产品);FST-YZ-40超纯水机(上海富诗特仪器设备有限公司产品);ECH-II微机控温电热板(上海新仪微波化学科技有限公司产品);电子分析天平(上海梅特勒-托利多仪器有限公司产品);GZX-9030MBE电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂产品);FW100型高速万能粉碎机(天津市泰斯特仪器有限公司产品)。
1.2 方法1.2.1 火焰原子吸收光谱仪测定条件
实验采用乙炔-空气火焰原子吸收光谱法测定各种金属元素的含量,通过预实验,对电流、燃烧高度等参数进行优化,得到仪器工作的最佳参数,详见表1。
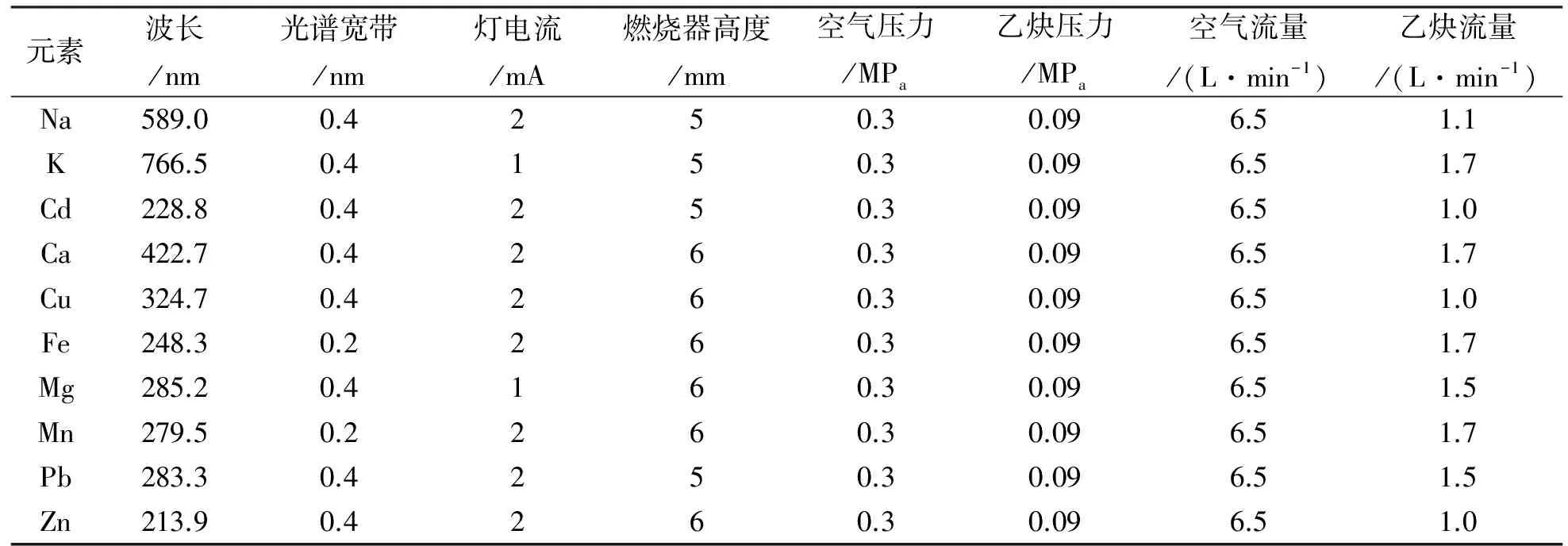
表1 火焰原子吸收光谱仪工作参数
1.2.2 材料前处理
将新采摘的黄山猕猴桃用重蒸水清洗干净,然后用小刀切成薄片,放到电热鼓风干燥箱内,设置温度为50℃,干燥24h至恒重,用粉碎机进行粉碎,过100目筛,阴凉处保存备用。所用玻璃仪器均采用6% HNO3浸泡24h,再用重蒸水冲洗2~3次,烘干后备用。
1.2.3 空白溶液、待测溶液的制备
取2个(编号为0号、1号)250mL三角瓶,精密称取1份黄山猕猴桃粉末0.5000g,放入1号瓶中,在通风橱中分别向2个三角瓶中加入 9mL浓硝酸,盖上表面皿,室温下浸泡24h后再往三角瓶中加入双氧水3mL后,一起置于电热板上进行加热,加热温度先设置为60℃,保持5min,逐步升高至160℃,溶液慢慢沸腾,保持微微沸腾状态10min,冒出棕色烟雾,继续加热,溶液不再冒白烟,约剩1mL无色透明溶液,小心取下三角烧瓶,在室温条件下放置冷却,最后将得到的样液吸出,并用1% HNO3多次洗涤三角瓶和表面皿,与样液合并后,定容于50mL容量瓶中,即得到空白溶液和样品待测溶液。
1.2.4 标准曲线的制作
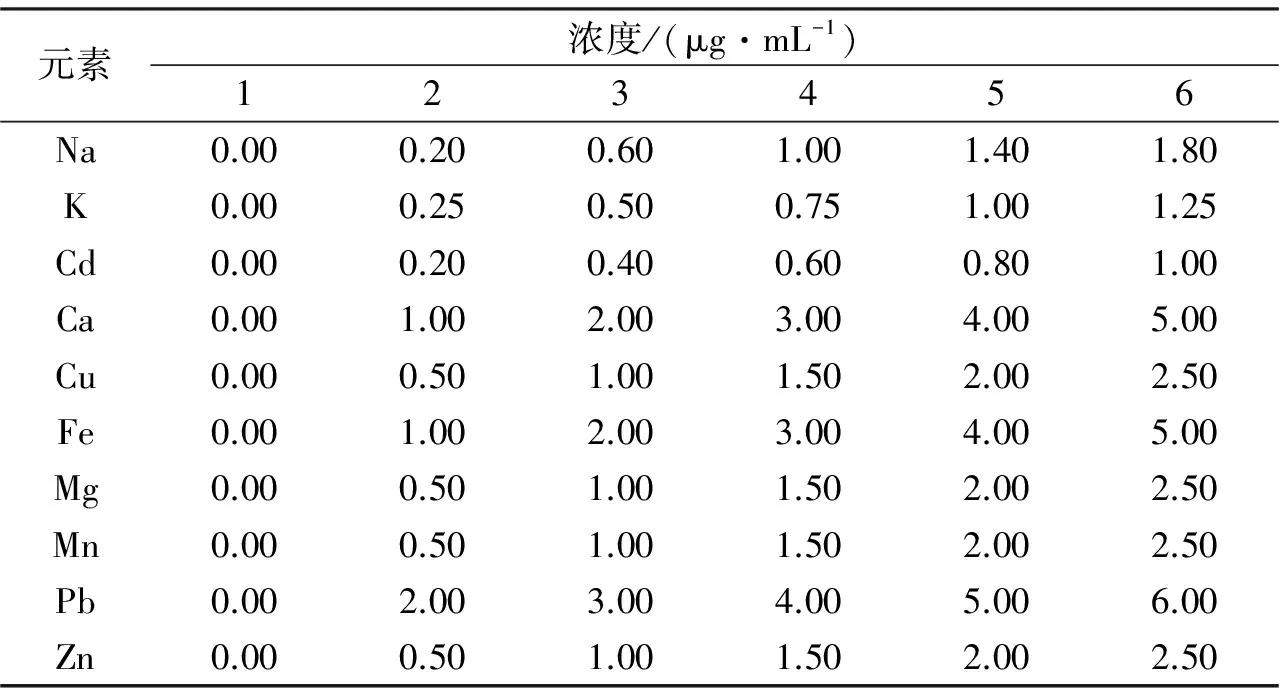
表2 各金属元素标准溶液质量浓度
从冰箱中取出10种元素的标准溶液(浓度1000μg/mL),先将各溶液稀释10倍,再移取一系列不同体积稀释后的标准溶液,用1% HNO3定容于50mL容量瓶中,得到用于制作标准曲线的溶液,各元素质量浓度系列见表2。开机预热,在已确定的仪器工作条件下,先用空白溶液调零,并从低到高质量浓度依次进样,测定各标准溶液的光密度,分别以金属元素的质量浓度为横坐标、光密度为纵坐标绘制10种金属元素的标准曲线。
1.2.5 样品测定
打开仪器,预热0.5h后,移取适量空白溶液、待测样品溶液,用1%硝酸将溶液进行稀释,再用稀释后的空白溶液进行调零,测定样品溶液的光密度。依次调换阴极灯,待光源稳定后,依次测定不同金属元素的含量。
1.2.6 精密度试验
移取2mL消解处理好的样品、空白溶液,用1%HNO3稀释,用空白溶液调零,光源稳定5min后,连续5次进样,计算RSD值。
1.2.7 重复性试验
称取5份等质量的黄山猕猴桃粗粉,以HNO3和H2O2作为消解液,经浸泡、消解制备待测、空白溶液,依次测定5份溶液中10种金属元素的含量。
1.2.8 加标回收率试验
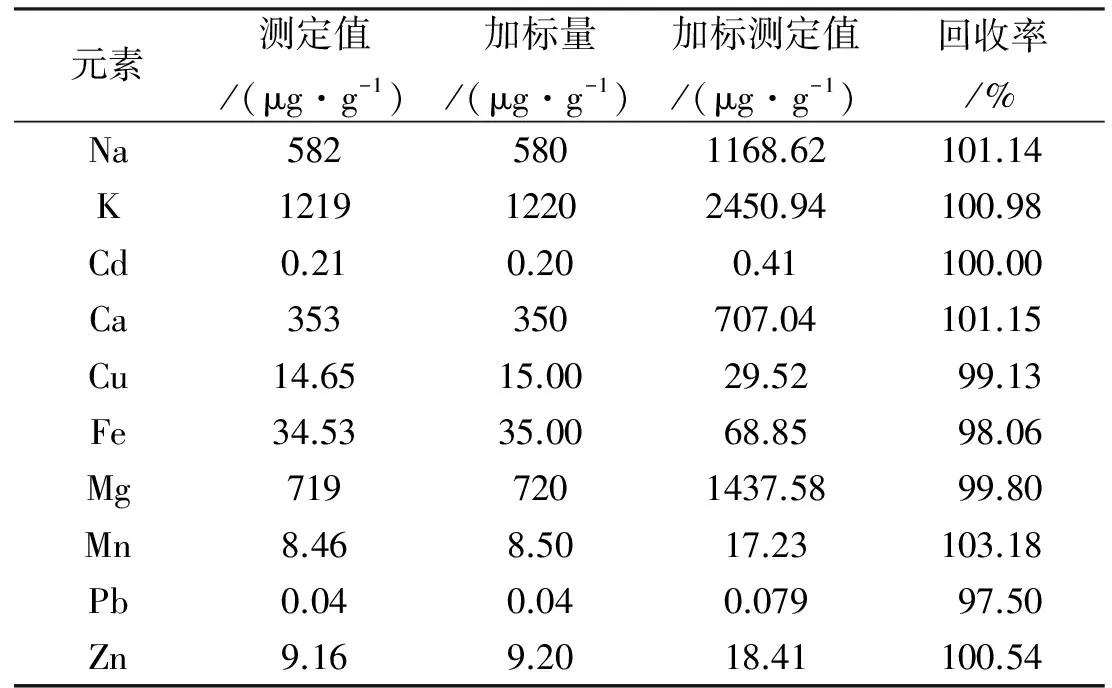
称取31份猕猴桃粗粉,每份0.5000g,每种金属元素的加标样量约等于样品中含有的量,然后加入等体积消解液,放在电热板上加热,消解至无白烟冒出,样品溶液转移、定容到容量瓶中,每种金属元素做3个平行试验,剩余的一份样品不加标准溶液,浸泡后同法消解,得到待测液以及10种元素的加标消解样液,稀释不同倍数,依次进样测定各溶液的光密度值。
2 结果与分析
2.1 消解试剂的确定
湿法消解常采用的消解液体系有浓HNO3、HNO3-HClO4、HNO3-H2O2、HF等,强酸性条件下,样品能被完全消解,但在强酸性条件下进行测定,会对原子吸收光谱仪有较大损伤,而且实验操作过程中存在不安全因素,因而选取HNO3-H2O2进行预实验。结果发现:HNO3-H2O2(3︰1)体系对黄山猕猴桃样品的消解效果最好,硝化后所得溶液澄清,消解比较彻底,并具有省时、安全、操作简单、损失少、污染小等优点。所以,选用体积比为3︰1的HNO3-H2O2溶液作为消解液进行后续实验。
2.2 各金属元素的标准曲线
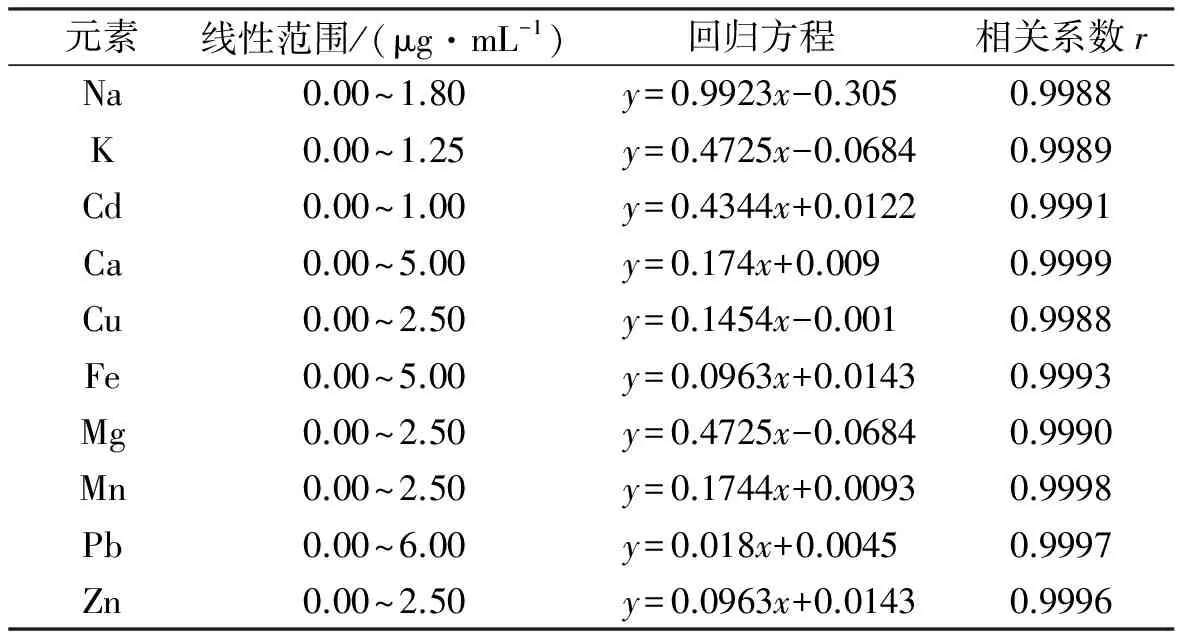
表3 各元素回归方程及相关系数
测定所得数据采用origin软件分别作图,得到各元素标准曲线的线性回归方程以及相关系数见表3。由表3可知,在设定的浓度范围内,各元素曲线的线性关系良好(0.9988~0.9999),满足实验需要。
2.3 样品含量测定结果
为了使测定的样品溶液中所含金属元素的质量浓度均位于标准曲线的线性范围之内,在对含量较高K、Mg、Na元素的光密度进行测定时,先将原待测液分别稀释20、10、10倍后,再进样,将所得数据代入标准曲线方程,计算得到样液中各金属元素的含量,重复操作3次,结果见表4。
由表4可见,黄山猕猴桃中均含有Na、K、Cd、Ca、Cu、Fe、Mg、Mn、Pb、Zn等金属元素,其中K的含量最高,大于1000μg/g,其次为Mg,含量相对较高的还有Na、Ca,重金属Cd、Pb的含量很少。各金属含量由低到高的顺序为:Pb 表4 黄山猕猴桃中各元素含量(n=3) 表5 回收率试验结果 2.4 方法学考察 按照1.2.6的方法进行精密度试验,每种金属元素均得到5个光密度值,结果表明10种元素的RSD较小(0.91%~1.76%),说明仪器的精密度较好,实验数据可靠。 按1.2.7的方法进行重复性试验,待光源稳定5min后,依次测定样品溶液中各金属元素的光密度值,结果RSD均小于2.36%(n=5),可见试验的重现性较好。 按照1.2.8的方法进行加标回收试验,得到10种元素的回收率结果见表5。 由试验数据可知,所测10种元素的回收率均介于97.50%~103.18%之间,加标回收率良好,说明试验所采用的方法具有较高的准确度,满足试验要求。 本研究采用火焰原子吸收光谱法对黄山猕猴桃中的 Na、K、Cd、Ca、Cu、Fe、Mg、Mn、Pb、Zn元素含量进行测定。结果表明,黄山猕猴桃中含有丰富的对人体有益的微量元素,其中K的含量最为丰富,其次是Mg、Na、Ca,含量均≥350μg/g,其中Ca、Mg元素具有很好的解毒效果[10],这与猕猴桃具有的清热解毒功效相呼应。Fe、Zn的含量也不低,可以不同程度增强人体的免疫力[11]。重金属Pb、Cd的含量远远低于国家食品安全标准,Cu的含量稍高,但也没有超出国家标准(小于20μg/g),可以放心食用。与黔东南州[12]、江西宜春[13]、浙江产猕猴桃[14]相比较,黄山猕猴桃中所含的金属元素含量偏高,可能是黄山特有气候以及植物所生长的土壤成分不同引起。可见,黄山猕猴桃不仅含有补充人体所需的各种微量元素,还具有一定的药用价值,值得进一步开发与利用。 [1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1984:261~263. [2]陈海峰,刘 晴,曾书琴.猕猴桃蒸汽热烫去皮工艺研究[J].食品科技,2016,41(6):117~120. [3]单云岗,陈锡林,傅跃青.野生猕猴桃多糖提取工艺研究[J].浙江中医杂志,2015,50(2):146~147. [4]杜彦影,刘长江,刘旸旸.响应面设计法优化软枣猕猴桃茎中总生物碱的提取工艺[J].食品工业科技,2015,36(13):220~224. [5]李然红,金志民,陈鑫,等.狗枣猕猴桃研究进展[J].中国林副特产,2015,135(2):84~85. [6]Takano F,Tanaka T,Tsukamoto W,etal.Isolation of (+)-catenin and (-)-epicatenin fromActinidiaargutaas bone marrow cell proliferation promoting compounds [J].Planta Med,2003,69:321~326. [7]Guan D,Zhang Z,Yang Y,etal.Antioxidant and antitumor activities of water extracts from the root ofActinidiakolomikta[J].Exp Ther Med,2011,2:33~39. [8]马凤爱.中华猕猴桃果实化学成分及生物活性研究[D].合肥:安徽中医药大学,2015. [9]杨柳,曹雪莹,孟东阳.煤中微量元素含量常用测定方法[J].中国矿业,2014,23(2):293~300. [10]乌兰其其格,宝力道,路洪波,等.蒙药阿嘎日中铁等10种微量元素初级形态研究[J].辽宁中医杂志,2016,43(7):1447~1449. [11]付金娥,滕红丽,郭力城.微波消解-ICP-OES分析白骨壤果实中微量元素[J].药物分析杂志,2015,35(1):41~45. [12]蒋天智,柴东方.野生猕猴桃的微量元素研究[J].凯里学院学报,2014,32(6):53~55. [13]王艳燕,刘 临.原子吸收分光光度法测定猕猴桃中微量元素[J].微量元素与健康研究,2008,25(6):42~43. [14]刘建军,陈卫红.中华猕猴桃微量元素测定分析[J].广东微量元素科学,2001,8(4):63~65. [编辑] 余文斌 2016-10-28 安徽省高校省级优秀青年人才基金重点项目(2013SQRL088ZD);安徽省黄山市科技计划项目(2015Z-02); 安徽省自然科学研究项目(KJ2015A259)。 兰艳素(1985-),女,硕士,助教,主要从事天然产物提取分离与活性研究,ls7536858@163.com。 O657.31;TS201.2 A 1673-1409(2017)06-0063-04 [引著格式]兰艳素,张文峰,张猛,等.火焰原子吸收光谱法测定黄山猕猴桃中金属元素的含量[J].长江大学学报(自科版),2017,14(6):63~66,84.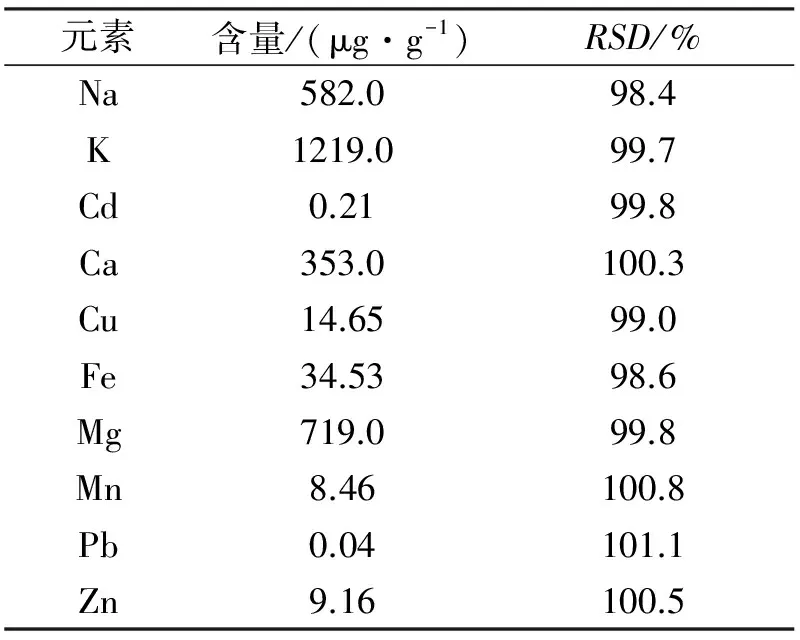
3 结论

