UTP23基因在A2780/Taxol细胞中表达及对紫杉醇化疗耐药的影响
章杰捷

[摘要] 目的 探讨上皮性卵巢癌紫杉醇耐药细胞(A2780/Taxol)中UTP23基因表达水平及其对紫杉醇化疗耐药的影响。 方法 利用Real-Time PCR与Western blot分别从基因与蛋白表达水平检测A2780/Taxol 细胞中UTP23的表达水平,通过脂质体在A2780/Taxol 细胞中特异性瞬时过表达UTP23基因,利用MTT细胞增殖法观察过表达UTP23基因对A2780/Taxol 细胞药物敏感性的影响;通过Real-Time PCR检测A2780/Taxol 细胞过表达UTP23后抗凋亡基因Bcl-2蛋白表达水平。 结果 A2780/Taxol中UTP23的mRNA表达水平降低,约为A2780细胞的50%,UTP23蛋白表达水平下降,约为A2780细胞的48%(P<0.01);相对于阴性转染组,UTP23基因过表达可显著提高A2780/Taxol 细胞中UTP23基因表达水平(P<0.05);相对于阴性转染组,UTP23基因过表达A2780/Taxol细胞对紫杉醇的敏感性显著提高(P<0.01);与阴性转染组相比,过表达UTP23基因后A2780/Taxol细胞Bcl-2基因表达水平显著下降(P<0.05)。 结论 UTP23基因在A2780/Taxol细胞中低表达,可能通过促进Bcl-2基因表达,从而参与A2780/Taxol细胞的耐藥作用。
[关键词] UTP23基因;紫杉醇;A2780/Taxol细胞;Bcl-2
[中图分类号] R737.31 [文献标识码] B [文章编号] 1673-9701(2017)08-0086-04
[Abstract] Objective To investigate the expression of UTP23 gene in paclitaxel-resistant epithelial ovarian cancer cells(A2780/Taxol) and its effect on drug resistance of paclitaxel chemotherapy. Methods Real-Time PCR and Western blot were used to detect the expression level of UTP23 in A2780/Taxol cells from the level of gene and protein expression. The UTP23 gene was transiently over-expressed in A2780/Taxol cells via liposomes. The effect of the over-expressed UTP23 gene on the drug sensitivity of A2780/Taxol cells was observed by MTT cell proliferation method. The expression of anti-apoptotic gene Bcl-2 protein after over-expression of UTP23 gene in A2780/Taxol cells was detected by Real-Time PCR. Results The expression level of UTP23 mRNA in A2780/Taxol decreased,which was about 50% of A2780 cells. And the UTP23 protein expression level decreased,which was 48% in A2780 cells(P<0.01). Compared with negative transfection group, UTP23 gene over-expression could significantly increase the expression level of UTP23 gene in A2780/Taxol cells(P<0.05). Compared with that in negative transfection group, the sensitivity of A2780/Taxol cells with over-expression of UTP23 gene to paclitaxel was significantly increased(P<0.01). The expression of Bcl-2 gene after the over-expression of UTP23 gene in A2780/Taxol cells was significantly lower than that in negative transfection group(P<0.05). Conclusion The expression of UTP23 gene is low in A2780/Taxol cells and may be involved in the drug resistance of A2780/Taxol cells by promoting the expression of Bcl-2 gene.
[Key words] UTP23 gene; Paclitaxel; A2780/Taxol cells; Bcl-2
上皮性卵巢癌是最常见的卵巢癌,位居女性生殖系统癌症死亡率榜首,由于缺乏早期临床症状及特异的早期诊断标志物,大部分患者确诊时已是肿瘤晚期阶段,严重威胁着女性患者的生存[1]。目前,临床手术及术后紫杉醇等化疗药物的联合治疗,一部分患者初步有效,然而,大部分患者往往由于化疗药物耐药性的产生,最终死亡[2]。大量研究表明,逆转化疗药物耐药将有助于改善患者预后[3]。UTP23是一种核仁蛋白,与90S前核糖体颗粒相互连接,参与18S rRNA的A0、A1及A2早期位点修饰,核糖体是蛋白质合成的重要组成部分,rRNA直接调控蛋白合成的过程[4]。近年来,研究发现UTP23在多重耐药的肿瘤中呈现异常表达,并且与肿瘤的耐药密切相关[5]。本研究旨在探讨UTP23在上皮性卵巢癌耐紫杉醇细胞中的表达及其与耐药的关系。
1 材料与方法
1.1 细胞株及培养
上皮性卵巢癌细胞株A2780与上皮性卵巢癌紫杉醇耐药细胞株A2780/Taxol均购于中国科学院细胞库,均使用含有10%胎牛血清的RPMI1640完全培养液,在37℃、5%CO2条件下恒温培养,取对数生长期细胞进行实验。
1.2 实验材料
胎牛血清购自Gibco公司,噻唑蓝(MTT)、RPMI1640培养液、紫杉醇均购自Sigma公司,BCA蛋白浓度测定盒购自碧云天生物技术公司,兔抗人UTP23抗体、兔抗人Bcl-2抗体、抗GAPDH抗体及相对应的二抗均购自美国Abcam公司,脂质体转染试剂、阴性对照转染试剂购自Santa Cruz公司,qRT-PCR试剂盒购自Takara公司。
1.3 RT-PCR测定UTP23基因表达
取对数生长期的A2780细胞与A2780/Taxol细胞,使用Trazol裂解液提取细胞总RNA,按照Takara公司提供的逆转录试剂盒说明书合成cDNA。以GAPDH作为内参,进行UTP23基因扩增。反应条件为:95℃预变性30 s,95℃ 5 s,60℃ 20 s 40个循环。应用2-ΔΔCt方法分别计算A2780细胞与A2780/Taxol细胞UTP23基因的相对表达量,重复3次实验。
1.4 Western blot蛋白印迹法测定UTP23蛋白表达水平
取对数生长期的A2780细胞与A2780/Taxol细胞,弃去细胞上清培养液,使用蛋白裂解液提取细胞蛋白后,BCA法进行蛋白定量检测蛋白浓度,以相同的作蛋白上样总量,进行凝胶蛋白电泳,电泳后将蛋白转移至预处理的硝酸纤维素膜,用5%浓度的脱脂牛奶封闭60 min,一抗孵育UTP23抗体(1∶100)、GAPDH抗体(1∶1000)4℃过夜。TBST溶液洗涤5次,每次3 min,加入相对应的二抗(1∶1000)室温孵育60 min。洗涤后加入化学发光液,进行曝光成像。
1.5 脂质体过表达UTP23基因与阴性对照
将A2780/Taxol细胞以3×105/孔接种于六孔板,含有10%胎牛血清完全培养液,在37℃、5%CO2恒温培养箱孵育至大约融合状态,参照脂质体转染试剂说明书,分别将阴性对照转染试剂及UTP23基因与脂质体混合后,加入A2780/Taxol细胞中,在37℃、5%CO2恒温箱继续孵育48 h。
1.6 MTT细胞增殖法观察UTP23基因对A2780/Taxol细胞耐药的影响
空白对照组(A2780/Taxol细胞)、阴性转染组(阴性转染A2780/Taxol细胞)与UTP23过表达组(过表达UTP23 基因A2780/Taxol细胞),以相同的细胞密度接种于96孔板,每组五个复孔,于37℃、5%CO2恒温培养24 h。分别加入紫杉醇(分别加入10、50、250、1250 nmol/L),继续培养48 h后,加入5 mg/mL的MTT培养液恒温孵育6 h,吸取上层细胞培养液弃去,加入100 μL DMSO完全溶解结晶,570 nm波长处测定吸光度值(A)。
1.7 RT-PCR法检测UTP23基因对A2780/Taxol细胞Bcl-2基因表达的影响
提取空白对照组、阴性转染组及过表达组细胞RNA,选取对数生长期A2780/Taxol细胞、阴性转染A2780/Taxol细胞与过表达UTP23 基因A2780/Taxol细胞,如方法1.3提取RNA、合成cDNA,进行Bcl-2基因扩增,以GAPDH作为内参,Bcl-2引物上游5-CATGTGTGTGGAGAGCGTCAA-3下游5- GCCGGTTCAGGTACTCAGTCA-3。实验条件为:95℃预变性30 s,95℃ 5 s,60℃ 1 min,进行40个循环。应用2-ΔΔCt方法分别计算三组细胞UTP23基因的相对表达量,重复3次实验。
1.8 统计学方法
应用SPSS 16.0统计学软件进行数据统计与分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 A2780/Taxol细胞中UTP23基因的mRNA表达水平
通过RT-PCR检测A2780/Taxol细胞与A2780细胞中UTP23基因的mRNA表达水平,结果显示,A2780/Taxol细胞中UTP23的mRNA表达水平显著减少,约为A2780细胞的50%,差异具有统计学意义(P<0.01)(图1)。
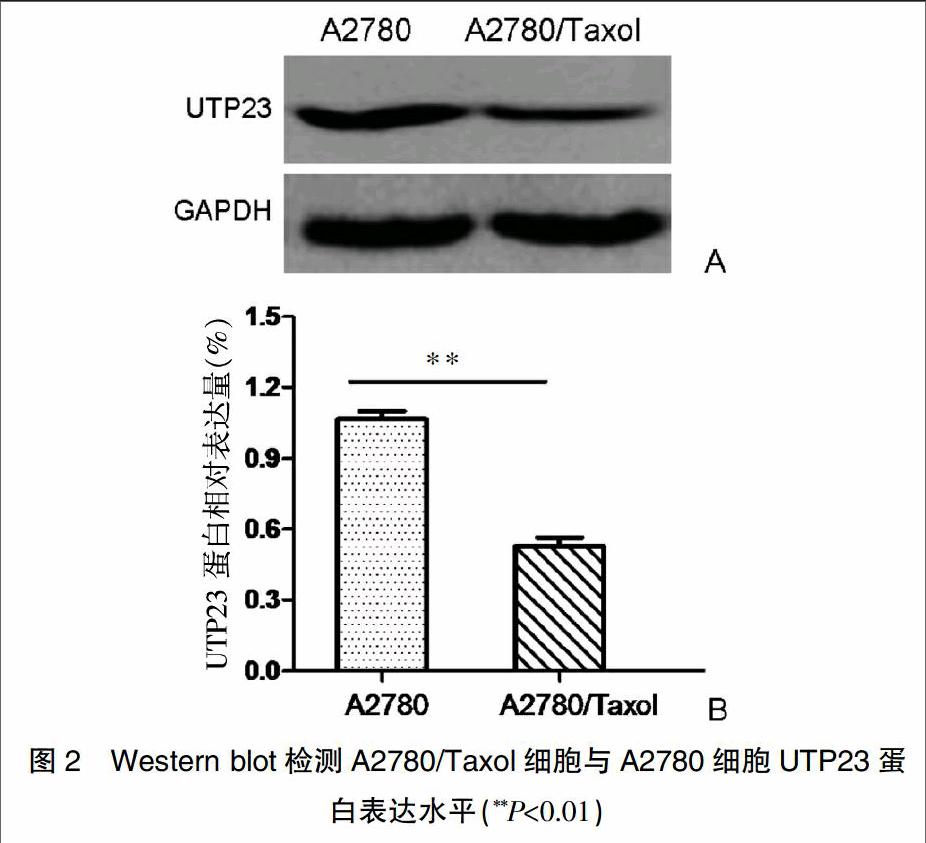
2.2 A2780/Taxol细胞中UTP23基因的蛋白表达水平
如图2所示,Western blot检测A2780/Taxol细胞与A2780细胞中UTP23基因的蛋白表达水平,如图2A所示,UTP23蛋白在A2780/Taxol细胞中表达水平显著下调,约为A2780细胞的48%,A2780/Taxol細胞与A2780细胞UTP23蛋白表达水平比较,差异具有统计学意义(P<0.01)(图2B)。
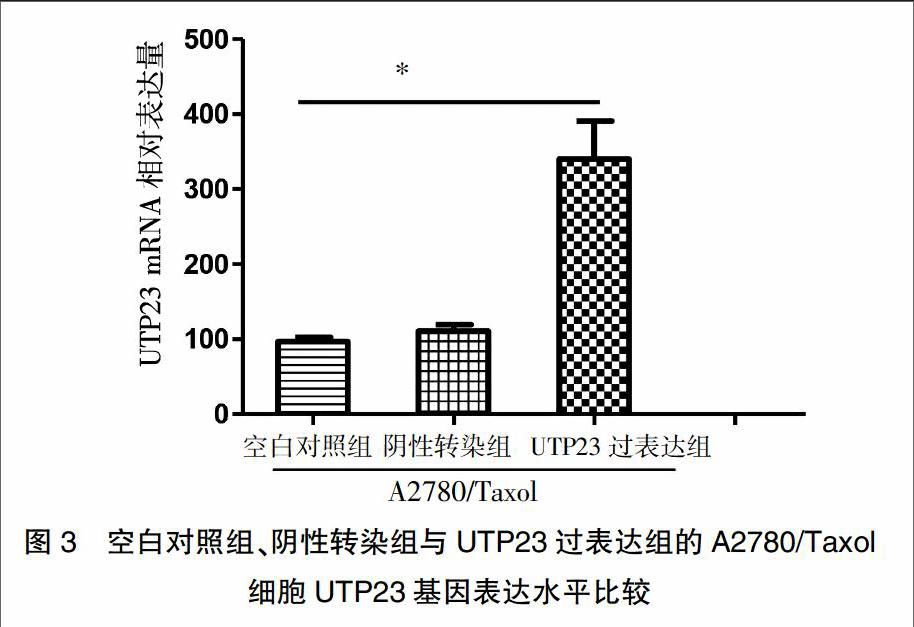
2.3 A2780/Taxol细胞过表达UTP23基因
通过RT-PCR分别检测空白对照组、阴性转染组与UTP23过表达组的A2780/Taxol细胞UTP23基因mRNA表达水平,如图3所示,UTP23过表达的A2780/Taxol细胞UTP23 mRNA表达水平显著提高,约为阴性转染组的3.5倍,差异具有统计学意义(P<0.05),而空白对照组与阴性转染组的A2780/Taxol细胞UTP23的mRNA表达水平相比较,差异无统计学意义(P>0.05),说明UTP23基因过表达转染有效。
2.4 UTP23基因对A2780/Taxol细胞耐药的影响
通过MTT实验结果发现,UTP23基因过表达的A2780/Taxol细胞对紫杉醇的敏感性显著增加,相对于阴性轉染A2780/Taxol细胞,当紫杉醇浓度为250 nmol/L时,UTP23基因过表达的A2780/Taxol细胞增殖受到抑制(P<0.05),当紫杉醇浓度达1250 nmol/L时,紫杉醇对UTP23基因过表达的A2780/Taxol细胞的杀伤最为显著(P<0.01),而空白对照组与阴性转染组A2780/Taxol细胞增殖比较,差异无统计学意义(P>0.05)(图4)。
2.5 UTP23基因对A2780/Taxol细胞Bcl-2基因表达的影响
通过RT-PCR检测UTP23基因对A2780/Taxol细胞Bcl-2基因表达水平的影响,如图5所示,与阴性转染组的A2780/Taxol细胞相比,UTP23基因过表达组的A2780/Taxol细胞Bcl-2基因的表达水平显著下降(P<0.05),而空白对照组与阴性转染组A2780/Taxol细胞Bcl-2基因的表达水平相比较,差异无统计学意义(P>0.05)。
3 讨论
上皮性卵巢癌是女性三大生殖系统恶性肿瘤之一,死亡率占女性生殖系统肿瘤的第1位,虽然手术联合化疗的治疗水平提高,但由于肿瘤对化疗药物耐药性的产生,患者往往出现肿瘤复发,肿瘤远端转移,患者的5年生存率仅25%左右[6-9]。目前,临床紫杉醇是杀伤上皮性卵巢癌细胞的一线化疗药物,长时间应用,上皮性卵巢癌耐受紫杉醇,药物敏感度大大降低,严重影响治疗效果,是患者治疗过程死亡的最常见原因。但上皮性卵巢癌对紫杉醇耐药的关键分子与具体机制仍然不清楚。因此,如何逆转细胞耐药成为治疗上皮性卵巢癌的难点,得到人们的广泛关注[10]。
UTP23基因是新发现的一种小亚基组成部分,参与核糖体的成熟。早期研究显示UTP23可能参与肿瘤的发生发展,在结直肠癌中通过基因与环境的数据统计分析表达发现,位于8q23.3染色体的易感基因与UTP23表达高度相同的基因,与结直肠癌的发生密切相关[11]。近来,研究发现UTP23在上皮性卵巢癌化疗耐受患者癌组织表达显著低于化疗敏感患者,此外,UTP23低表达与患者的不良预后呈相关性,提示UTP23可能在上皮性卵巢癌产生耐药中发挥重要的作用,然而,其具体分子机制仍不清楚[12,13]。因此,本文选取上皮性卵巢癌紫杉醇耐药细胞对UTP23基因表达及其在耐药中的作用进行探讨。
通过RT-PCR检测A2780细胞与A2780/Taxol细胞UTP23基因表达水平显示,A2780/Taxol细胞中UTP23基因呈现下调模式,Western blot从蛋白水平验证A2780/Taxol细胞中UTP23蛋白表达显著减少,分别从基因与蛋白水平验证UTP23在A2780/Taxol细胞表达减少,与早期报道一致,提示UTP23在上皮性卵巢癌紫杉醇耐药细胞中可能参与耐药的产生。利用脂质体过表达UTP23基因后发现A2780/Taxol细胞对紫杉醇的敏感性显著提高,提示UTP23基因可促进紫杉醇对A2780/Taxol细胞的杀伤作用,减少耐药性。
研究报道卵巢癌耐药性产生有多种机制,不同化疗药物产生耐药性的具体机制亦不同。临床传统药物顺铂、阿霉素等主要通过促进多药耐药基因表达,从而导致卵巢癌产生耐药治疗失败;卵巢癌细胞中谷胱甘肽及其转移酶的表达增多,促进环磷酰胺及紫杉醇耐药性的产生[14-17]。此外,早期的研究在卵巢癌患者组织发现Bcl-2抗凋亡基因表达上调,与卵巢癌患者化疗药物耐受显著相关;Bcl-2是凋亡调控家族中重要的抗凋亡基因,主要通过促进细胞增殖、抑制细胞凋亡,从而促进肿瘤细胞的不断生长,对药物产生耐药性[18-20]。本研究RT-PCR检测结果发现过表达UTP23基因后A2780/Taxol细胞Bcl-2基因表达水平显著下降,提示UTP23可能通过抑制A2780/Taxol细胞Bcl-2基因表达,从而抑制细胞增殖,增加A2780/Taxol细胞对紫杉醇的敏感性。
综上所述,本研究发现UTP23基因在A2780/Taxol细胞表达减少,过表达UTP23基因可下调Bcl-2抗凋亡基因表达,促进A2780/Taxol细胞对紫杉醇的敏感性,减少耐药性的产生,可部分逆转A2780/Taxol细胞对紫杉醇的耐药。UTP23基因调控A2780/Taxol细胞耐药的具体分子机制及胞内信号传导,有待更进一步研究。
[参考文献]
[1] Patel S,Kumar L,Singh N.Metformin and epithelial ovarian cancer therapeutics[J]. Cell Oncol(Dordr),2015,38(5):365-375.
[2] Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2013,63(2):11-30.
[3] Bookman MA,Brady MF,McGuire WP,et al.Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer:A Phase Ⅲ Trial of the Gynecologic Cancer Intergroup[J]. J Clin Oncol,2009,27(5):1419-1425.
[4] Li X,Pan QQ,Wan XY,et al.Methylation-associated Has-miR-9 deregulation in paclitaxel- resistant epithelial ovarian carcinoma[J].BMC Cancer,2015,15(1):509.
[5] Timofeeva MN,Kinnersley B,Farrington SM,et al. Recurrent coding sequence variation explains only a small fraction of the genetic architecture of colorectal cancer[J].Sci Rep,2015,10(5):16286.
[6] Piccart MJ,Bertelsen K,James K,et al.Randomized intergroup trial of cisplatin-paelitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer:Three-year results[J]. J Natl Cancer lnst,2000,92(5):699008.
[7] Webber K,Friedlander M.Chemotherapy for epithelial ovarian,fallopian tube and primary peritoneal cancer[J].Best Pract Res Clin Obstet Gynaecol,2016,23(16):30139-30140.
[8] Vallius T,Hynninen J,Auranen A,et al.Postoperative human epididymis protein 4 predicts primary therapy outcome in advanced epithelial ovarian cancer[J].Tumour Biol,2017,39(2):89.
[9] Li H,Xiao N,Li Z,et al.Expression of inorganic pyrophosphatase(PPA1) correlates with poor prognosis of epithelial ovarian cancer[J]. Tohoku J Exp Med,2017,241(2):165-173.
[10] Zhang SF,Wang XY,Fu ZQ,et al.TXNDC17 promotes paclitaxel resistance via inducing autophagy in ovarian cancer[J].Autophagy,2015,11(2):225-238.
[11] Hutter CM,Chang-Claude J,Slattery ML,et al.Characterization of gene-environment interactions for colorectalcancer susceptibility loci[J].Cancer Res,2012,72(8):2036-2044.
[12] Wang X,Wang SS,Zhou L,et al.A network-pathway based module identification for predicting the prognosis of ovarian cancer patients[J].J Ovarian Res,2016,9(1):73.
[13] Wang X,Teng F,Kong LA,et al.PD-L1 expression in human cancers and its association with clinical outcomes[J].Onco Targets Ther,2016,12(9):5023-5039.
[14] 李思瑾,張丙忠.紫杉醇联合铂类化疗在上皮性卵巢癌的耐药研究[J].中华临床医师杂志,2013,7(22):10231-10234.
[15] Januchowski R,Sterzyńska K,Zaorska K,et al.Analysis of MDR genes expression and cross-resistance in eight drug resistant ovarian cancer cell lines[J].J Ovarian Res,2016,9(1):65.
[16] Lopes-Coelho F,Gouveia-Fernandes S,Gonalves LG,et al.HNF1β drives glutathione (GSH) synthesis underlying intrinsic carboplatin resistance of ovarian clear cell carcinoma (OCCC)[J]. Tumour Biol,2016,37(4):4813-4829.
[17] Ribeiro JR,Schorl C,Yano N,et al.HE4 promotes collateral resistance to cisplatin and paclitaxel in ovarian cancer cells[J].J Ovarian Res,2016,9(1):28.
[18] Kim JH,Choi JS.Effect of ginsenoside Rh-2 via activation of caspase-3 and Bcl-2-insensitive pathway in ovarian cancer cells[J]. Physiol Res,2016,65(6):1031-1037.
[19] Liu J,Liu J,Guo SY,et al.HSP70 inhibitor combined with cisplatin suppresses the cervical cancer proliferation in vitro and transplanted tumor growth:An experimental study[J].Asian Pac J Trop Med,2017,10(2):184-188.
[20] Liang J,Yin K,Cao X,et al.Attenuation of Low Ambient Temperature-Induced Myocardial Hypertrophy by Atorvastatin via Promoting Bcl-2 Expression[J].Cell Physiol Biochem,2017,41(1):286-295.

