蛋氨酸水平对羔羊体况发育、消化道组织形态及血清抗氧化指标的影响
王 杰 崔 凯 王世琴 刁其玉 张乃锋(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京100081)
蛋氨酸水平对羔羊体况发育、消化道组织形态及血清抗氧化指标的影响
王 杰 崔 凯 王世琴 刁其玉 张乃锋*
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京100081)
本试验旨在研究蛋氨酸水平对羔羊体况发育、消化道组织形态及血清抗氧化指标的影响。试验选取12对7日龄断母乳的湖羊双胞胎公羔,采用配对试验设计,分为对照(CON)组和低蛋氨酸(LM)组,1对双胞胎羔羊分到不同的组中。试验分2个阶段进行,第1阶段(8~56日龄),CON组羔羊饲喂基础代乳粉和基础开食料;LM组羔羊饲喂的代乳粉和开食料在CON组基础上分别全部扣除(0.70%和0.40%)额外添加的蛋氨酸,其余营养水平保持一致。第2阶段(57~84日龄),2组羔羊停止饲喂代乳粉且饲粮均为基础开食料。在56和84日龄,各选取6对双胞胎羔羊进行屠宰,分离消化道组织,采集血清样品。结果表明:1)在采食量方面,LM组羔羊对蛋氨酸采食量在8~56日龄、8~84日龄阶段均极显著低于CON组(P<0.01),而干物质采食量却均显著高于CON组(P<0.05);在体尺指标方面,56日龄,LM组除体重、体斜长、胸围和体长指数显著低于CON组(P<0.05)外,其他体况发育指标2组间均无显著性差异(P>0.05);84日龄,2组间体况发育指标均无显著性差异(P>0.05)。2)56日龄,LM组羔羊的瘤胃乳头宽度显著低于CON组(P<0.05),2组羔羊的其他消化道形态发育指标差异不显著(P>0.05)。3)56日龄,LM组羔羊血清中超氧化物歧化酶活性极显著低于CON组(P<0.01);84日龄,LM组羔羊血清中除谷胱甘肽过氧化物酶活性显著低于CON组(P<0.05)外,2组羔羊的其他血清抗氧化指标差异均不显著(P>0.05)。结果提示,饲粮低蛋氨酸水平抑制了羔羊体况(体重、体斜长、胸围、体长指数)发育及瘤胃乳头宽度的增加,同时降低了机体血清中超氧化物歧化酶活性,然而却提高了干物质采食量;提高饲粮蛋氨酸水平后,羔羊体况发育及消化道组织形态发育也随之得到补偿,但机体抗氧化防御系统仍未得到完全改善。
蛋氨酸;羔羊;体况发育;消化道形态;抗氧化指标
羔羊出生前后的生长发育是确定其后期健康生长及育肥潜力的重要时期。新生羔羊由于其消化代谢系统的发育不成熟而具有极大的可塑性,也极易受到环境因素变化(营养调控)的影响而改变其后期育肥性能的发挥。研究发现,对于早期断奶的羔羊,易受到营养物质供给因素影响产生较大的应激反应[1-2],从而导致消化道功能紊乱[3-5],并能引起小肠形态结构的损伤性变化,绒毛长度降低,隐窝深度降低,肠道消化吸收面积减少[6-10]。另外,蛋氨酸作为必需氨基酸中唯一的含硫氨基酸,对动物体内蛋白质合成具有重要作用。Abdelrahman等[11]研究报道,饲粮中补充蛋氨酸不仅提高了羔羊对矿物质的生物利用率,还能提高羔羊的生长性能。因此,满足出生后羔羊机体蛋氨酸的营养需要,对于维持其生长发育和健康具有重要意义。
胃肠道是反刍动物主要的消化吸收场所,其黏膜结构的正常发育是营养物质被充分消化吸收的生理基础。研究表明,肠道组织重量仅占到体重的5%~7%,但却消耗机体所需营养物质的15%~20%[12]。在单胃动物上,Manzoor等[13]报道肉鸡饲喂低蛋氨酸水平饲粮可降低肉鸡的体重,同时抑制了胃肠道形态结构的发育。另外,Krutthai等[14]研究发现,断奶仔猪饲喂含低蛋氨酸水平的饲粮抑制了仔猪生长发育,同时显著降低了血清中尿素氮、白蛋白含量及胃肠道形态发育。在实际生产中,常因羔羊健康状况、饲粮原料及饲养管理等因素造成断奶前羔羊缺乏生长发育所必需的蛋氨酸,从而使哺乳期羔羊体况发育存在较大的个体差异,最终不利于集约化和规模化管理。目前,研究者多从饲粮中单一补充蛋氨酸方向研究对羔羊或育肥羊生长发育的影响[15],而研究饲粮中蛋氨酸缺乏与补充对羔羊断奶前后生长发育的影响尚未报到。因此,本试验通过人为调控羔羊断奶前后饲粮中蛋氨酸水平,研究羔羊前期缺乏蛋氨酸导致的生长发育受阻是否可以通过后期补充蛋氨酸使羔羊的生长状况得到补偿,为实际生产中健康养羊提供理论支持。
1 材料与方法
1.1 试验动物与试验时间
试验选取7日龄断母乳、体重为(4.93±0.20) kg、发育正常的12对湖羊双胞胎公羔羊。试验于2015年10月至2015年12月在山东省临清市润林牧业有限公司开展。
1.2 试验饲粮
试验用蛋氨酸规格:DL-蛋氨酸含量≥99%;干燥减重≤0.5%;砷≤0.002‰;重金属≤0.02‰;硫酸盐≤0.30%;氯化物≤0.20%;灼烧残渣≤0.5%;亚硝基铁氰化钠试验合格;硫酸铜试验合格。
基础开食料和基础代乳粉的营养水平分别参考我国《肉羊饲养标准》(NY/T 816—2004)[16]及发明专利ZL 02128844.5[17]所设定;蛋氨酸水平参考Patureau-Mirand等[18]和王波等[19]的试验结果设定的。基础代乳粉营养水平、基础开食料组成及营养水平见表1。

表1 基础代乳粉营养水平、基础开食料组成及营养水平(干物质基础)
1)基础代乳粉为专利产品,专利编号ZL 02128844.5[17]。Basal milk replacer was patent product, and the patent No. was ZL 02128844.5[17].
2)复合氨基酸是由赖氨酸、色氨酸、苏氨酸、缬氨酸、组氨酸等多种氨基酸组成。Compound amino acids were composed of lysine, tryptophane, threonine, valine, threonine and other amino acids.
3)每千克预混料含有One kg of premix contained the following:Fe 4~30 g,Mn 2~25 g,Cu 0.8~2.0 g,Zn 4~25 g,Se 0.04~0.30 g,I 0.04~0.50 g,Co 0.03~0.05 g,VA 800 000~2 500 000 IU,VD3200 000~400 000 IU,VE 3 000~4 000 IU。
4)营养水平除代谢能外均为实测值。ME was a calculated value, while others were measured values.
1.3 试验设计与饲养管理
采用配对试验设计,12对羔羊分为对照(control,CON)组和低蛋氨酸(low methionine,LM)组,1对双胞胎羔羊分到不同的组中。试验分2个阶段进行。第1阶段(8~56日龄),CON组羔羊饲喂基础代乳粉和基础开食料;LM组羔羊饲喂的代乳粉和开食料在CON组基础上分别全部扣除(0.70%和0.40%)额外添加的蛋氨酸,其余营养水平保持一致。第2阶段(57~84日龄),2组羔羊停止饲喂代乳粉且饲粮均为基础开食料。所有试验羔羊从8日龄开始人工饲喂代乳粉至56日龄结束;另外,从8日龄开始补饲开食料,直到84日龄试验结束。
试验开始之前,用强力消毒灵溶液对整个圈舍进行全面的消毒,之后每周对所有栏位重复消毒1次。同时,试验开始时所有试验羔羊均进行正常的免疫程序。另外,饲喂代乳粉时,8~14日龄每天饲喂4次,15~28日龄每天饲喂3次,29~56日龄每天饲喂2次。代乳粉的饲喂具体参照王波等[19]的方法进行。同时,饲喂量还根据试验过程中羔羊的健康状况进行适当的调整,以保证羔羊的正常生长。另外,除了每天按要求进行饲喂外,还需保证CON组和LM组羔羊补饲相近量的代乳粉和开食料。整个过程自由饮水。
1.4 测定指标和分析方法
1.4.1 代乳粉和开食料营养水平
氨基酸含量使用A300全自动氨基酸分析仪测定;总能使用Parr-6400氧弹量热仪测定,用于计算代谢能;干物质、粗蛋白质、粗脂肪、粗灰分、钙、磷含量参考《饲料分析及饲料质量检测技术》[20]测定。
1.4.2 羔羊的体重与体尺指标
分别于羔羊8、56和84日龄晨饲前准确称量体重并进行羔羊的体尺测定。测量用的仪器有测仗、卷尺、圆形测量器等。测量时,将被测羔羊牵引到平地并使之稳定,成自然站立状态。
羔羊体尺指标测定及方法如下。1)体高:肩胛骨最高点到地面的垂直距离。2)体斜长:肩端至坐骨结节末端的直线距离。3)胸围:肩胛骨后缘绕胸1周的长度。4)胸宽:肩胛骨后缘胸部最宽处的宽度。5)胸深:鬐甲至胸骨下缘的垂直距离。6)管围:管骨上1/3的周围长度。7)体长指数(%)=(体斜长/体高)×100;胸围指数(%)=(胸围/体高)×100;体躯指数(%)=(胸围/体斜长)×100。
1.4.3 羔羊胃肠道组织样的采集
分别在56和84日龄屠宰6对双胞胎羔羊,屠宰前16 h需要禁食、禁水[21],经颈静脉放血致死后,解剖,将各胃室分割,去食糜,分别称鲜重;在瘤胃背囊取样(1 cm×1 cm),置于10%的福尔马林溶液中固定,留待做石蜡切片;小肠各段分割后,先将内容物洗净,再称取各段肠道鲜重。取各3 cm左右的十二指肠、空肠、回肠中段,保存在10%的福尔马林溶液中固定,留待做石蜡切片。
1.4.4 羔羊胃肠道组织形态测定
瘤胃上皮形态观察测定指标包括乳头高度、乳头宽度和肌层厚度。小肠各段黏膜上皮形态观察测定指标包括绒毛高度、隐窝深度、黏膜厚度和肌层厚度。
在Olympus BX51显微镜下观察羔羊瘤胃上皮和小肠壁结构的组织形态,使用Olympus DP70图像采集系统取样,应用Image-Pro Plus 5.1 Chinese图像分析系统测量瘤胃乳头高度、乳头宽度和肌层厚度以及小肠各段绒毛高度、隐窝深度、黏膜厚度和肌层厚度。每个样本观察3张非连续切片,每张切片选取3个视野,每个视野分别测量5组数据,具体测量标准参考李辉[22]试验报道中的方法进行,其平均值作为1个测定数据。
1.4.5 血清抗氧化指标测定
分别于56和84日龄,每组随机选取3只试验羔羊于前腔静脉采血10 mL,3 000 r/min离心20 min,分离血清,并于-20 ℃保存。血清抗氧化指标包括:过氧化氢酶(CAT)、谷胱甘肽转硫酶(GST)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活性。GSH-Px和GST活性的测定方法为化学比色法;SOD活性的测定方法为邻苯三酚自氧化法;CAT活性的测定方法为可见光分光光度法。测定仪器为全自动生化分析仪。
1.5 数据处理
试验数据经过Excel 2010初步整理后,使用SAS 9.2统计软件Pairedt-test进行配对t检验,以P<0.05作为判断差异显著性的标准,以0.05≤P<0.10作为判断有变化趋势的标准。
2 结果与分析
2.1 蛋氨酸水平对羔羊采食量和体况发育的影响
蛋氨酸水平对羔羊采食量和体况发育的影响见表2。在采食量方面,LM组羔羊对蛋氨酸的采食量在8~56日龄、8~84日龄阶段均极显著低于CON组(P<0.01),而干物质采食量却均显著高于CON组(P<0.05)。在体尺指标方面,在8日龄,CON组和LM组羔羊体重和体尺指标均差异不显著(P>0.05),而56日龄LM组羔羊的体重、体斜长、胸围和体长指数均显著低于CON组(P<0.05),但84日龄时2组羔羊在体重和体尺指标上均差异不显著(P>0.05)。
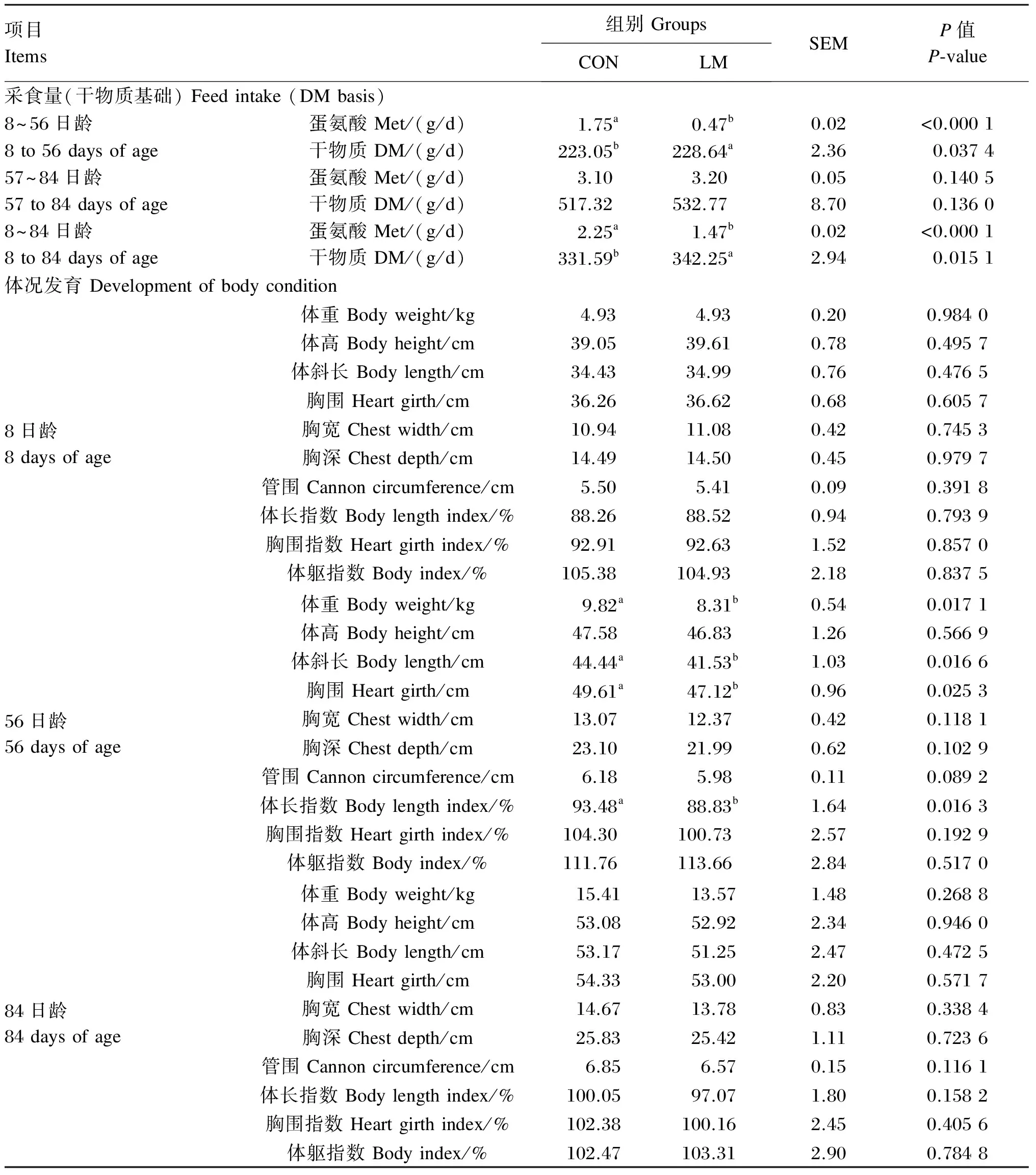
表2 蛋氨酸水平对羔羊采食量和体况发育的影响
同行数据肩标不同小写字母代表有显著性差异(P<0.05)。下表同。
In the same row,values with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 蛋氨酸水平对羔羊消化道组织形态的影响
蛋氨酸水平对羔羊消化道组织形态的影响见表3。在56日龄,与CON组相比,LM组羔羊瘤胃乳头宽度(P<0.05)和乳头高度(0.05≤P<0.10)较低;2组羔羊在其他消化道形态发育指标上差异不显著(P>0.05)。在84日龄,LM组羔羊的瘤胃乳头高度较CON组有降低的趋势(0.05≤P<0.10),2组在消化道形态发育方面均差异不显著(P>0.05)。
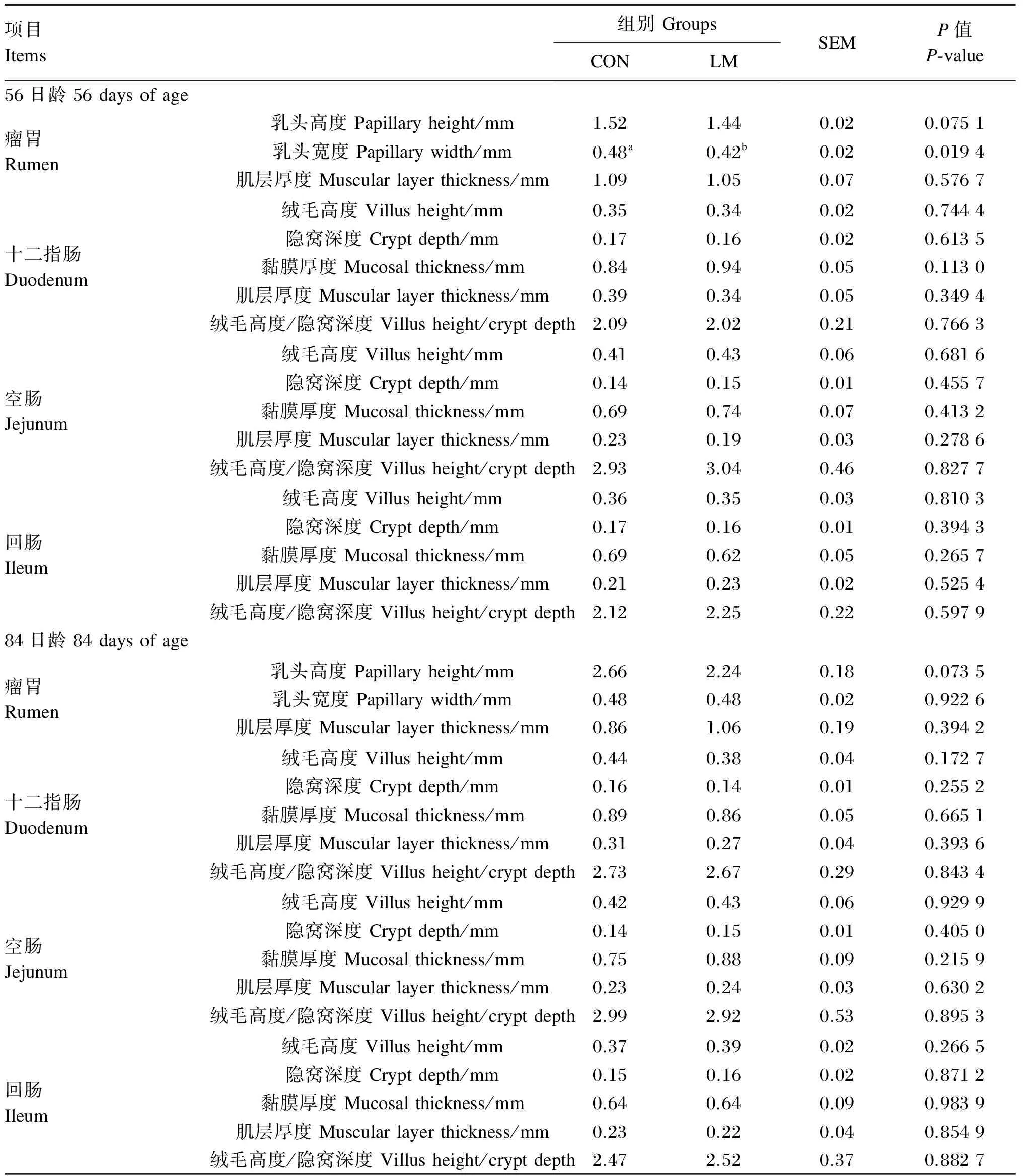
表3 蛋氨酸水平对羔羊消化道组织形态的影响
2.3 蛋氨酸水平对羔羊血清抗氧化指标的影响
蛋氨酸水平对羔羊血清抗氧化指标的影响见表4。在56日龄,LM组羔羊血清中SOD活性极显著低于CON组(P<0.01),2组羔羊在其他血清抗氧化指标上差异均不显著(P>0.05)。在84日龄,LM组羔羊血清中除GSH-Px活性显著低于CON组(P<0.05)外,2组羔羊在其他血清抗氧化指标上差异均不显著(P>0.05)。

表4 蛋氨酸水平对羔羊血清抗氧化指标的影响
3 讨 论
3.1 蛋氨酸水平对羔羊体况发育的影响
蛋氨酸作为唯一含硫必需氨基酸对于反刍动物生长发育具有重要意义[24]。另外,研究发现非反刍阶段羔羊每天蛋氨酸的最佳需要量为2 g,而对于育肥羊最适宜的蛋氨酸水平为0.64%左右[18,25]。本试验在8~56日龄阶段,LM组和CON组羔羊每天蛋氨酸的采食量分别为0.47和1.75 g,LM组较CON组降低了73.14%。另外,王杰等[23]研究还发现在8~56日龄阶段,LM组羔羊平均日增重和饲粮利用率显著低于CON组;57~84日龄,2组平均日增重和料重比均无显著差异。当动物机体受到营养限制而不能满足动物正常生长的基本营养需求时,动物机体将依据营养限制的时间和限制程度来动员体内贮存的能量以维持机体的生长发育,最终导致机体失重、体况下降[26]。Rooke等[27]研究报道,母羊妊娠前期(1~90 d)饲喂含75%能量的饲粮,在90日龄时限制组母羊的体重显著降低。Gao等[28]研究发现,母羊妊娠后期(91~150 d)通过饲喂限制能量的饲粮,在妊娠150 d时母羊体重损失的重量显著增高,并且出生羔羊的体重也显著降低。Puchala等[29]研究报道,限制育肥山羊采食量显著降低其平均日增重、内脏组织重及山羊体重,后期通过补充饲喂可对受限制山羊在体重上有补偿恢复效应。本试验中,低蛋氨酸水平显著抑制了羔羊的体重增加;而经过28 d蛋氨酸补偿后,2组羔羊体重差异不显著。结果提示,限制饲粮蛋氨酸水平后,通过后期提高饲粮蛋氨酸水平能一定程度上恢复羔羊生长,这也与刘小刚[30]研究结果相一致。
动物机体的体尺指标直接反映动物的体格大小和体躯的结构、发育等状况,也间接反映动物的组织器官发育情况,其与动物的繁殖机能、抗病力及对外界生活条件的适应能力等密切相关[31]。同时,体尺测量所得数值只能说明一个部位的生长发育情况,而不能说明动物的体态结构,因此还要进行体尺指数的计算,用来说明动物各部位发育的相互关系和比例[32]。马存寿等[33]通过对青海半细毛羊羔羊断奶体重与体尺性状进行了通径分析,结果发现:体尺中胸围对体重的表型相关和直接作用最大;体斜长对体重的表型相关和直接作用次之,其余各项体尺对体重的影响都较小。本试验56日龄时,低蛋氨酸水平显著降低了羔羊的胸围、体斜长和体长指数。而提高蛋氨酸水平后,2组羔羊在体尺指标上均差异不显著,此结果与羔羊体重相吻合。同样,陈碧红等[34]研究报道各体尺性状因素都在不同程度上影响戴云山羊的体重。陈月丽等[35]研究发现11~14月龄奶水牛的体重与体高、体斜长和胸围等体尺指标呈极显著正相关。
3.2 蛋氨酸水平对羔羊消化道组织形态的影响
蛋白质的营养价值实质上是氨基酸的营养价值。蛋氨酸作为含硫的必需氨基酸,饲粮中蛋氨酸水平将会影响胃肠道结构和功能的改变,最终影响胃肠道重量[36-37]。有研究发现,饲粮蛋氨酸水平高低将会调节肠道紧密连接蛋白表达量,从而改变肠道黏膜屏障功能,最终对动物预防疾病发生具有重要作用[38]。Riedijk等[39]研究发现蛋氨酸作为合成半胱氨酸和胱氨酸重要的前体物质,在仔猪胃肠道中蛋氨酸通过转甲基和转硫作用对胃肠道健康发育有着重要作用。Malik等[40]研究报道,饲粮中添加蛋氨酸和蛋氨酸羟基类似物有助于改善仔猪胃肠道形态结构,最终有利于对营养物质的消化利用。对羔羊来说,饲粮是影响复胃发育最主要因素,其组成、物理形态、营养水平等均可以影响羔羊复胃的发育,饲粮营养水平直接影响胃肠道的组织形态学发育,营养不合理会导致复胃的生长发育受限[41]。
通常瘤胃上皮乳头高度、乳头宽度及其肌层厚度等相关指标均可用来评定瘤胃的组织形态学发育[42]。Lesmeister等[43]认为试验不同处理手段首先对瘤胃乳头高度产生最大影响,其次是瘤胃乳头的宽度和肌层厚度等相关指标。研究发现,饲粮原料来源及饲粮精粗比例[44-45]均能影响羔羊瘤胃发育。同样,蔡健森[46]曾研究证实不同饲粮中蛋白质来源(植物性蛋白质和乳源性蛋白质)可显著增加断奶羔羊瘤胃乳头数量。另外,饲粮营养水平也会影响到瘤胃的发育。孙志洪[47]报道羔羊28日龄断奶后,限制营养水平的羔羊瘤胃乳头宽度、高度和绒毛表面积显著减少。本试验结果显示,低蛋氨酸除显著抑制羔羊瘤胃乳头宽度发育外,还使瘤胃乳头高度有降低的趋势;另外,经过28 d蛋氨酸补偿后,LM组羔羊的瘤胃乳头高度较CON组仍有降低的趋势,而2组在其他胃肠道形态发育方面均差异不显著。结果差异的出现,可能由于蛋氨酸限制时间、添加剂量或环境等因素造成的。
小肠是机体营养物质消化、吸收和转运的主要部位,良好的小肠黏膜结构对完善消化生理功能,促进机体生长发育尤为重要[48]。小肠绒毛高度、隐窝深度、黏膜厚度、肌层厚度和绒毛高度/隐窝深度等均是衡量小肠消化吸收功能的重要指标,代表了肠道的功能状况[49-50]。顾宪红[51]报道,仔猪能量、蛋白质营养不良,导致黏膜厚度、绒毛高度和宽度、绒毛表面积显著下降。本试验中,前期低蛋氨酸及后期蛋氨酸补偿均未对2组羔羊小肠形态发育产生显著影响。这可能由于小肠的形态发育受多种因素影响,仅通过49 d的低蛋氨酸处理并不能改变小肠的形态发育,同时蛋氨酸限制的水平也可能未达到抑制小肠形态发育的剂量。
3.3 蛋氨酸水平对羔羊血清抗氧化指标的影响
在羔羊的大豆饼粕等饲粮中,蛋氨酸作为一种限制性氨基酸,不仅参与体内的蛋白质合成,还具有抗氧化等多种作用。动物机体的氧化还原系统处于动态平衡状态,含硫氨基酸的调节功能能够使相关物质处于活性或者失活状态,进而调节机体多种生理反应[52]。GSH-Px活性可反映机体清除氧自由基的能力,是机体抗氧化防御系统的主要组成部分[53],在CAT活性或过氧化氢含量很低的组织中,可替代CAT清除过氧化氢。另外,GSH-Px活性高低能够决定清除脂类氢过氧化物速度的快慢[54]。SOD是细胞膜结构与功能完整性的保护酶之一,其活性的高低间接反映了机体清除自由基的能力,其活性升高有助于组织细胞抵御过氧化损伤[55]。蛋氨酸能够提高SOD的活性,增强机体的免疫应答反应,有助于减少病原以及自由基对机体组织的损害,促进脂肪分解代谢,可加快动物的生长[56]。GST为生物体内广泛存在的催化谷胱甘肽与某些疏水性化合物的亲电子基团相连接的胞质酶,可以消除体内自由基和达到解毒的功能[57]。因此,CAT、GST、SOD和GSH-Px活性是抗氧化性能的重要指标。
蛋氨酸对动物机体血清抗氧化指标的影响多见于禽类或大鼠中的报道。刘秀丽等[58]研究报道,低蛋氨酸饲粮能降低大鼠血清中GSH-Px活性,最终导致机体抗氧化防御系统减弱。麻丽坤等[59]研究报道,适量的蛋氨酸能够提高蛋鸡血清中SOD活性。林祯平等[60]研究发现,饲粮添加0.66%蛋氨酸能够显著提高28~70日龄狮头鹅的机体血清中SOD活性。本试验在56日龄,LM组羔羊血清中SOD活性极显著低于CON组,这与上述研究相一致;同时,蛋氨酸对羔羊其他血清抗氧化指标上无显著影响,可能是羔羊机体在蛋氨酸限制时期主要通过SOD活性这一指标反映清除自由基的能力,而其他抗氧化酶活性表现不明显。在84日龄时,LM组羔羊血清中除GSH-Px活性显著低于CON组外,2组羔羊在其他血清抗氧化指标上差异均不显著。造成这种现象的出现,作者推测前期饲粮中低蛋氨酸水平虽未对羔羊机体GSH-Px活性产生显著影响,但低蛋氨酸对机体抗氧化防御的抑制效应延伸到本试验结束时,通过GSH-Px活性这一指标来体现,其作用机理有待进一步探讨。目前为止,蛋氨酸水平对羔羊机体抗氧化防御系统的作用了解甚少,相关报道还很缺乏,需要更多的试验来研究。
4 结 论
① 饲粮低蛋氨酸水平抑制了羔羊体况(体重、体斜长、胸围、体长指数)发育及瘤胃乳头宽度的增加,同时降低了机体血清中SOD活性,然而却提高了干物质采食量。
② 提高饲粮蛋氨酸水平后,羔羊体况发育及消化道组织形态发育也随之得到补偿,但机体抗氧化防御系统仍未得到完全改善。
[1] NAPOLITANO F,CIFUNI G F,PACELLI C,et al.Effect of artificial rearing on lamb welfare and meat quality[J].Meat Science,2002,60(3):307-315.
[2] 范志影,刁其玉,蔡健森.不同蛋白质来源代乳粉对羔羊肌肉化学成分的影响[J].中国畜牧杂志,2008,44(7):29-30,48.
[3] ZHAO J,HARPER M J,ESTIENNE M J,et al.Growth performance and intestinal morphology responses in early weaned pigs to supplementation of antibiotic-free diets with an organic copper complex and spray-dried plasma protein in sanitary and nonsanitary environments[J].Journal of Animal Science,2007,85(5):1302-1310.
[4] CORL B A,HARRELL R J,MOON H K,et al.Effect of animal plasma proteins on intestinal damage and recovery of neonatal pigs infected with rotavirus[J].The Journal of Nutritional Biochemistry,2007,18(12):778-784.
[5] 张庆丽.早期能量与蛋白限制饲养对1月龄断奶羔羊胃肠道发育的影响[D].硕士学位论文.杨凌:西北农林科技大学,2010.
[6] YI G F,ALLEE G L,KNIGHT C D,et al.Impact of glutamine and oasis hatchling supplement on growth performance,small intestinal morphology,and immune response of broilers vaccinated and challenged withEimeriamaxima[J].Poultry Science,2005,84(2):283-293.
[7] UNI Z,GAL-GARBER O,GEYRA A,et al.Changes in growth and function of chick small intestine epithelium due to early thermal conditioning[J].Poultry Science,2001,80(4):438-445.
[8] LIU P,PIAO X S,KIM S W,et al.Effects of chito-oligosaccharide supplementation on the growth performance,nutrient digestibility,intestinal morphology,and fecal shedding ofEscherichiacoliandLactobacillusin weaning pigs[J].Journal of Animal Science,2008,86(10):2609-2618.
[9] PLUSKE J R.Morphological and functional changes in the small intestine of the newly-weaned pig[C]//PIVA A,BACH K K E,LINDBERG J E.Gut environment of pigs.Nottingham:Nottingham University Press,2001:1-27.
[11] ABDELRAHMAN M M,HUNAITI D A.The effect of dietary yeast and protected methionine on performance and trace minerals status of growing Awassi lambs[J].Livestock Science,2008,115(2/3):235-241.
[12] 祁敏丽,马铁伟,刁其玉,等.饲粮营养限制对断奶湖羊羔羊生长、屠宰性能以及器官发育的影响[J].畜牧兽医学报,2016,47(8):1601-1609.
[13] MANZOOR R,KAMAL T,KHWAJA D A,et al.Effects of feed accessing time after hatching on the methionine requirements,performances and digestive system development of broiler chicks[J].European Neuropsychopharmacology,2009,8(98):29-34.
[14] KRUTTHAI N,VAJRABUKKA C,MARKVICHITR K,et al.Effect of source of methionine in broken rice-soybean diet on production performance,blood chemistry,and fermentation characteristics in weaned pigs[J].Czech Journal of Animal Science,2015,60(3):123-131.
[15] EL-TAHAWY A S,ISMAEIL A M.Methionine-supplemented diet increases the general performance and value of rahmani lambs[J].Iranian Journal of Applied Animal Science,2013,3(3):513-520.
[16] 中华人民共和国农业部.NY/T 816—2004肉羊饲养标准[S].北京:中国农业出版社,2004.
[17] 刁其玉,屠焰.一种犊牛羔羊用代乳粉:中国,CN1494832A[P].2004-05-12.
[18] PATUREAU-MIRAND P,THERIEZ M.Amino acid requirements of preruminant lambs[J].Annales de Zootechnie,1977,26(2):287.
[19] 王波,柴建民,王海超,等.蛋白质水平对湖羊双胞胎公羔生长发育及肉品质的影响[J].动物营养学报,2015,27(9):2724-2735.
[20] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[21] 许贵善,刁其玉,纪守坤,等.不同饲喂水平对肉用绵羊生长性能、屠宰性能及器官指数的影响[J].动物营养学报,2012,24(5):953-960.
[22] 李辉.蛋白水平与来源对早期断奶犊牛消化代谢及胃肠道结构的影响[D].博士学位论文.北京:中国农业科学院,2008.
[23] 王杰,崔凯,毕研亮,等.蛋氨酸限制与补偿对羔羊生长性能及内脏器官发育的影响[J].动物营养学报,2016,28(11):3669-3678.
[24] CAROLINE B T,BARBARA S,BURRIN D G.Intestinal metabolism of sulfur amino acids[J].Nutrition Research Reviews,2009,22(2):175-187.
[25] ALBERT W W,GARRIGUS U S,FORBES R M,et al.The sulfur requirement of growing-fattening lambs in terms of methionine,sodium sulfate,and elemental sulfur[J].Journal of Animal Science,1956,15(2):559-569.
[27] ROOKE J A,HOUDIJK J G M,MCILVANEY K,et al.Differential effects of maternal undernutrition between days 1 and 90 of pregnancy on ewe and lamb performance and lamb parasitism in hill or lowland breeds[J].Journal of Animal Science,2010,88(12):3833-3842.
[28] GAO F,HOU X Z,LIU Y C,et al.Effect of maternal under-nutrition during late pregnancy on lamb birth weight[J].Asian-Australasian Journal of Animal Sciences,2008,21(3):371-375.
[29] PUCHALA R,PATRA A K,ANIMUT G,et al.Effects of feed restriction and realimentation on mohair fiber growth and tissue gain by growing Angora goats[J].Livestock Science,2011,138(1/2/3):180-186.
[30] 刘小刚.营养限制及补偿对羔羊内脏器官和血液中CD4+、CD8+T淋巴细胞的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2010.
[31] 刑振全,杨红,王春微.浅谈我国奶牛体型线性鉴定方法[J].黑龙江动物繁殖,2007,15(1):28-29.
[32] 赵恒波,田黛君,罗海玲,等.纤维素复合酶对羔羊早期生长发育的影响[J].中国畜牧杂志,2007,43(23):34-37.
[33] 马存寿,冯生青,周玉青.青海高原半细毛羊羔羊断奶体重与体尺的通径分析[J].中国草食动物,2008,28(5):44-45.
[34] 陈碧红,刘庆华.戴云山羊体尺与体重的回归分析[J].中国草食动物,2011,31(5):34-36.
[35] 陈月丽,任凤芸,梁辛,等.11~14月龄奶水牛体重与体尺指标的相关性分析[J].中国畜牧兽医,2016,43(3):662-667.
[36] FERRARIS R P,CAREY H V.Intestinal transport during fasting and malnutrition[J].Annual Review of Nutrition,2000,20:195-219.
[37] LONG N M,PRADO-COOPER M J,KREHBIEL C R,et al.Effects of nutrient restriction of bovine dams during early gestation on postnatal growth,carcass and organ characteristics,and gene expression in adipose tissue and muscle[J].Journal of Animal Science,2010,88(10):3251-3261.
[38] RAMALINGAM A,WANG X X,GABELLO M,et al.Dietary methionine restriction improves colon tight junction barrier function and alters claudin expression pattern[J].American Journal of Physiology:Cell Physiology,2010,299(5):C1028-C1035.
[39] RIEDIJK M A,STOLL B,CHACKO S,et al.Methionine transmethylation and transsulfuration in the piglet gastrointestinal tract[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(9):3408-3413.
[40] MALIK G,HOEHLER D,RADEMACHER M,et al.Apparent absorption of methionine and 2-hydroxy-4-methylthiobutanoic acid from gastrointestinal tract of conventional and gnotobiotic pigs[J].Animal,2009,3(10):1378-1386.
[41] 韩正康,陈杰.反刍动物瘤胃的消化和代谢[M].北京:科学出版社,1988.
[43] LESMEISTER K E,TOZER P R,HEINRICHS A J.Development and analysis of a rumen tissue sampling procedure[J].Journal of Dairy Science,2004,87(5):1336-1344.
[44] ZITNAN R,KUHLA S,NÜRNBERG K,et al.Influence of the diet on the morphology of ruminal and intestinal mucosa and on intestinal carbohydrase levels in cattle[J].Veterinarni Medicina,2003,48(7):177-182.
[45] GRAHAM C,SIMMONS N L.Functional organization of the bovine rumen epithelium[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2005,288(1):R173-R181.
[46] 蔡健森.蛋白来源对早期断奶羔羊生产性能和器官发育及血清生化指标的影响[D].硕士学位论文.北京:中国农业科学院,2007.
[47] 孙志洪.关键营养素限制对断奶羔羊胃肠道发育的程序化抑制及营养干预研究[D].硕士学位论文.北京:中国科学院研究生院,2010.
[48] 聂立欣,于博.猪不同肠段肠绒毛与肠腺形态的测量研究[J].畜牧兽医科技信息,2010(6):28-29.
[49] VAREL V H,ROBINSON I M,POND W G.Effect of dietary copper sulfate,Aureo SP250,or clinoptilolite on ureolytic bacteria found in the pig large intestine[J].Applied and Environment Microbiology,1987,53(9):2009-2012.
[50] HAMPSON D J,KIDDER D E.Influence of creep feeding and weaning on brush border enzyme activities in the piglet small intestine[J].Research in Veterinary Science,1986,40(1):24-31.
[51] 顾宪红.断奶仔猪日粮蛋白质需要量及低蛋白日粮对仔猪的影响[J].中国农业科技导报,2001,3(1):34-37.
[52] 霍湘,王安利,杨建梅.含硫氨基酸的抗氧化作用[J].生物学通报,2006,41(4):3-4.
[53] 刘文斐,刘伟龙,占秀安,等.不同形式蛋氨酸对肉种鸡生产性能、免疫指标及抗氧化功能的影响[J].动物营养学报,2013,25(9):2118-2125.
[54] 马森.谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J].动物医学进展,2008,29(10):53-56.
[55] SHOVELLER A K,STOLL B,BALL R O,et al.Nutritional and functional importance of intestinal sulfur amino acid metabolism[J].The Journal of Nutrition,2005,135(7):1609-1612.
[56] 王增敏,谭利伟,尹兆正.蛋氨酸对开产蛋鸡脂肪代谢性能的影响及机理研究[J].上海畜牧兽医通讯,2009(1):4-5.
[57] 张景飞,王晓蓉,沈骅.低浓度2,4-DCP对鲫鱼肝脏抗氧化防御系统的影响[J].中国环境科学,2003,23(5):531-534.
[58] 刘秀丽,许立庆,曾宪惠,等.低硒、低蛋氨酸对大鼠体内GSH-Px及TBA值的影响[J].哈尔滨医科大学学报,1993(1):31-33.
[59] 麻丽坤,谭利伟,卫振,等.日粮蛋氨酸水平对开产蛋鸡体组织生长和产蛋性能的影响[J].浙江农业科学,2006(5):586-589.
[60] 林祯平,冯凯玲,叶慧,等.饲粮蛋氨酸水平对28~70日龄狮头鹅血清生化指标及抗氧化功能的影响[J].动物营养学报,2012,24(11):2126-2132.
*Corresponding author, associate professor, E-mail: zhangnaifeng@caas.cn
(责任编辑 王智航)
Effects of Methionine Level on Development of Body Condition, Morphology of Digestive Tract and Serum Antioxidant Indexes in Lambs
WANG Jie CUI Kai WANG Shiqin DIAO Qiyu ZHANG Naifeng*
(FeedResearchInstituteofChineseAcademyofAgriculturalSciences,KeyLaboratoryofFeedBiotechnologyofMinistryofAgriculture,Beijing100081,China)
The aim of this study was to assess the effects of methionine level on development of body condition, morphology of digestive tract and serum antioxidant indexes in lambs. Twelve pairs of maleHutwin lambs weaned at 7 days of age were selected and divided into two groups [control (CON) group and low methionine level (LM) group] with a matched-pairs design, and one pair of lambs were assigned to the different groups. The experiment consisted of two stages. Stage 1 (8 to 56 days of age), lambs in the CON group were fed basal milk replacer and basal starter, while those in the LM group were fed basal milk replacer and basal starter deducting 0.70% and 0.40% methionine on the basis of CON group, respectively. Stage 2 (57 to 84 days of age), all lambs were stop feeding milk replacer and fed basal starter. Six twins at 56 and 84 days of age were slaughtered to collect gastrointestinal tract tissues and serum sample. The results showed as follows: 1) for feed intake of methionine, LM group was significantly lower than CON group at 8 to 56 days of age and 8 to 84 days of age (P<0.01), but dry matter intake in LM group was significantly higher than that in CON group (P<0.05); at 56 days of age, no significant differences were observed in development of body condition indexes between groups (P>0.05) except that body weight, body length, heart girth, body length index in LM group were significantly lower than those in CON group (P<0.05); at 84 days of age, no significant differences were observed in development of body condition indexes between groups (P>0.05). 2) At 56 days of age, ruminal papillary width in LM group was significantly lower than that in CON group (P<0.05), but no significant differences were observed in indexes of morphology of the digestive tract between groups (P>0.05). 3) At 56 days of age, serum superoxide dismutase activity in LM group was significantly lower than that in CON group (P<0.01); at 84 days of age, no significant differences were observed in serum antioxidant indexes between groups (P>0.05) except that glutathione peroxidase activity in LM group was significantly lower than that in CON group (P<0.05). In conclusion, low methionine level of diet not only results in inhibiting the growth of body weight, body length, heart girth, body length index and ruminal papillary width, but also decreases serum superoxide dismutase activity, however, increases dry matter intake; after the improvement of dietary methionine level, a subsequent recovery appear in development of body condition and morphology development of digestive tract, but body’s antioxidant system is not completely improved.[ChineseJournalofAnimalNutrition, 2017, 29(5):1792-1802]
methionine; lamb; development of body condition; morphology of digestive tract; antioxidant indexes
10.3969/j.issn.1006-267x.2017.05.040
2016-11-01
国家公益性行业(农业)科研专项(201303143);国家肉羊产业技术体系建设专项(CARS-39)
王 杰(1989—),男,山东临沂人,硕士研究生,研究方向为动物营养与饲料科学。E-mail: nkywangjie@163.com
*通信作者:张乃锋,副研究员,硕士生导师,E-mail: zhangnaifeng@caas.cn
S826
A
1006-267X(2017)05-1792-11

