饲粮添加功能性复合添加剂对生长猪生长性能和免疫功能的影响
巫丽娟 毛湘冰 余 冰 何 军 黄志清 虞 洁 郑 萍 罗钧秋 陈代文(四川农业大学动物营养研究所,成都611130)
饲粮添加功能性复合添加剂对生长猪生长性能和免疫功能的影响
巫丽娟 毛湘冰 余 冰 何 军 黄志清 虞 洁 郑 萍 罗钧秋 陈代文*
(四川农业大学动物营养研究所,成都611130)
本研究旨在考察饲粮中添加功能性复合添加剂对生长猪生长性能和免疫功能的影响。选取20头平均体重为(21.06±1.98) kg的健康“杜×长×大”三元杂交生长猪,按体重相近的原则,随机分为2个组,分别为基础饲粮组(对照组)和在基础饲粮中添加0.1%功能性复合添加剂的试验饲粮组(添加剂组),每个组10个重复,每个重复1头猪。试验期14 d。结果表明,与对照组相比,饲粮添加功能性复合添加剂显著提高了生长猪的平均日增重(ADG)(P<0.05),极显著提高了生长猪血清白细胞介素-10(IL-10)含量(P<0.01),显著或极显著降低了生长猪血清白细胞介素-1(IL-1)和尿素氮(UN)含量(P<0.05或P<0.01),并显著或极显著降低了生长猪血液白细胞内与Toll样受体(TLR)信号通路相关的核因子κB(NF-κB)、肿瘤坏死因子受体相关因子6(TRAF6)和白细胞介素-1受体相关激酶1(IRAK1)mRNA的相对表达量(P<0.05或P<0.01)。综上所述,饲粮中添加功能性复合添加剂可以改善生长猪的生长性能,而这可能与其可提高机体蛋白质利用和调节机体免疫功能有关。
生长猪;功能性复合添加剂;生长性能;免疫功能
在畜禽生产中,作为饲料添加剂,抗生素已经被用来抗应激、促生长和防疾病。但饲用抗生素的滥用带来了诸多社会问题,如耐药性的不断上升、在畜禽产品中的残留等。因此,寻求抗生素替代品成为目前研究的焦点。研究表明,在畜禽饲粮中添加维生素D、维生素C、维生素E和黄芪多糖均具有提高生长性能和免疫功能的作用[1-4]。不同添加剂的作用效果不同,而将其制成复合添加剂可以起到相互补充和促进的作用。Molina等[5]研究表明,复合添加剂具有更好的抗氧化和抗炎症作用。周显清等[6]研究表明,维生素C与维生素E两者作为添加剂共同添加到仔猪的饲粮中具有协同的作用。Zhu等[7]和Xu等[8]研究也表明,饲粮中添加由维生素C、维生素E、茶多酚、硫辛酸和乳酸菌等组成的复合添加剂能够有效改善肠道功能提高仔猪生长性能。本研究旨在揭示通过饲粮添加一种主要成分为维生素C、维生素E、维生素D、黄芪多糖和叶酸等的功能性复合添加剂,研究其对生长猪生长性能和免疫功能的影响,旨在为该自主研制的功能性复合添加剂在生产上的推广应用提供依据。
1 材料与方法
1.1 试验材料
本试验所使用的功能性复合添加剂成分及含量如下:维生素C 10.75%,叶酸0.21%,维生素A 0.67%,维生素D 3.77%,维生素E 6.00%,维生素B20.56%,黄芪多糖7.14%,碳酸氢钠10.10%,葡萄糖60.80%。
1.2 试验动物与试验设计
本试验选取20头初始体重为(21.06±1.98) kg的健康“杜×长×大”三元杂交生长猪,按体重相近的原则,随机分为2个组,分别为基础饲粮组(对照组)和在基础饲粮中添加0.1%功能性复合添加剂的试验饲粮组(添加剂组),每个组10个重复,每个重复1头猪。试验期14 d。
1.3 试验饲粮
基础饲粮为玉米-豆粕型,参考NRC(2012)25~50 kg生长猪营养需要量配制。基础饲粮组成及营养水平见表1。试验饲粮按照试验设计在基础饲粮中添加0.1%的功能性复合添加剂,添加剂量等量替代玉米。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 9 000 IU,VD33 000 IU,VE 20.0 IU,VK33.0 mg,VB11.5 mg,VB24.0 mg,VB63.0 mg,VB120.2 mg,烟酸 nicotinic acid 30.0 mg,泛酸 pantothenic acid 15.0 mg,叶酸 folic acid 0.75 mg,生物素 biotin 0.1 mg,Fe 96.0 mg,Cu 5.6 mg,Zn 93.0 mg,Mn 3.7 mg,I 0.13 mg,Se 0.28 mg。
2)营养水平为计算值。Nutrient levels were calculated values.
1.4 饲养管理
试验在四川农业大学动物营养研究所教学科研试验基地进行。试验时间为2016年5月21日至2016年6月4日,试验猪采用单笼饲养,自由饮水,每日饲喂3次(08:00、14:00、20:00),少喂勤添,喂量以料槽内略有剩余为度。猪舍温度控制在27~28 ℃,相对湿度控制在70%左右。定期冲洗圈舍,保持圈舍通风、清洁、干燥和卫生。
1.5 样品采集
血样采集:于试验第15天对所有生长猪进行空腹采血10 mL,在室温下放置45 min,3 000 r/min离心10 min,分离血清,-20 ℃保存。并采血3~5 mL缓慢注入含乙二胺四乙酸(EDTA)的抗凝管中,慢慢颠倒混匀,用于分离血液中的白细胞。
1.6 测定指标与方法
1.6.1 生长性能
试验期间每天计算采食量,计算试验全期平均日采食量(average daily feed intake,ADFI),并于试验第1和15天早上空腹称重,计算试验第1~14天的平均日增重(average daily gain,ADG),且由ADFI和ADG计算料重比(feed to gain ratio,F/G)。
1.6.2 血清指标
血清尿素氮(urea nitrogen,UN)含量采用南京建成生物工程研究所试剂盒测定,严格按照试剂盒说明操作;血清白细胞介素(interleukin,IL)-1和IL-10含量采用上海诺渊实业有限公司酶联免疫吸附试验(ELISA)试剂盒进行测定,严格按照试剂盒说明操作。
1.6.3 白细胞相关基因mRNA相对表达量
1.6.3.1 白细胞分离
白细胞分离按照天津灏洋生物制品科技有限公司动物外周血白细胞分离液试剂盒进行分离。具体操作如下:
1)取15 mL离心管,加入分离液3 mL。
2)将血液样本缓慢小心注入分离液的液面上,在18~20 ℃以内,400×g离心36 min。
3)最终液相分层,第1层淡黄色为稀释的血浆;第2层是以单核细胞为主的白色云雾层狭窄带;第3层无色透明为分离液层;第4层深红色沉淀物为红细胞层。
4)使用无菌的巴士吸管抽出分离液上层液体,弃去,用吸管小心吸取分离液层、单核细胞层和红细胞层置于另一新离心管内。
5)加入细胞洗涤液混匀,250×g离心10 min,弃去上清,用红细胞裂解液除去红细胞内容物和碎片,加入细胞洗涤液再反复清洗。
6)清洗好后,加入1 mL Trizol,反复吹打,标记, -80 ℃保存。
1.6.3.2 相关基因的相对表达量
采用荧光定量PCR检测白细胞中与Toll样受体(Toll-like receptor,TLR)信号通路相关基因[核因子κB(nuclear factor kappa B cells,NF-κB)、髓样分化因子(myeloid differentiation factor 88,MyD88)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)、白细胞介素-1受体相关激酶1(IL-1 receptor associated kinase 1,IRAK1)、白细胞介素-1受体相关激酶4(IL-1 receptor associated kinase 4,IRAK4)和IκB蛋白激酶α(IκB kinase α,IKK-α)]的相对表达量,用Primer Premier 5.0根据NCBI上提供的目的基因序列进行引物设计,设计好的引物序列(表2)送至成都康迪生物技术有限公司合成。按照试剂盒说明提取白细胞的总RNA,按照TaKaRa公司生产的Prime ScriptTMRT Reagents试剂盒上说明书严格操作,将RNA反转录为cDNA。以反转录出的cDNA为模板,用SYBR Green PCR Mix试剂盒检测目的基因相对表达量。采用10 μL反应体系,反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。目的基因相对表达量以β-肌动蛋白(β-actin)为内参基因,采用2-ΔΔCt方法计算。

表2 实时荧光定量PCR引物序列
1.7 数据处理与分析
所有数据用Excel 2007进行初步整理,并采用SPSS 17.0软件进行t检验,所有测定结果以每个重复为统计单位,以“平均值±标准误”表示,P<0.05时表示差异显著,P<0.01时表示差异极显著,0.05≤P<0.10时为有差异趋势。
2 结 果
2.1 饲粮添加功能性复合添加剂对生长猪生长性能的影响
由表3可知,与对照组相比,饲粮添加功能性复合添加剂显著提高了生长猪的ADG(P<0.05),有降低F/G的趋势(P=0.09)。

表3 饲粮添加功能性复合添加剂对生长猪生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 饲粮添加功能性复合添加剂对生长猪血清UN含量的影响
由表4可知,与对照组相比,饲粮添加功能性复合添加剂显著降低了生长猪血清UN含量(P<0.05)。
2.3 饲粮添加功能性复合添加剂对生长猪血清细胞因子含量的影响
由表5可知,与对照组相比,饲粮添加功能性复合添加剂极显著降低了生长猪血清IL-1含量(P<0.01),极显著提高了血清IL-10含量(P<0.01)。

表4 饲粮添加功能性复合添加剂对生长猪血清UN含量的影响

表5 饲粮添加功能性复合添加剂对生长猪血清中细胞因子含量的影响
2.4 饲粮添加功能性复合添加剂对生长猪白细胞内基因mRNA相对表达量的影响
由表6可知,与对照组相比,饲粮添加功能性复合添加剂显著或极显著降低了生长猪白细胞中NF-κB、TRAF6和IRAK1 mRNA的相对表达量(P<0.05或P<0.01),有降低白细胞中IRAK4(P=0.08)和IKKα(P=0.05)mRNA相对表达量的趋势。
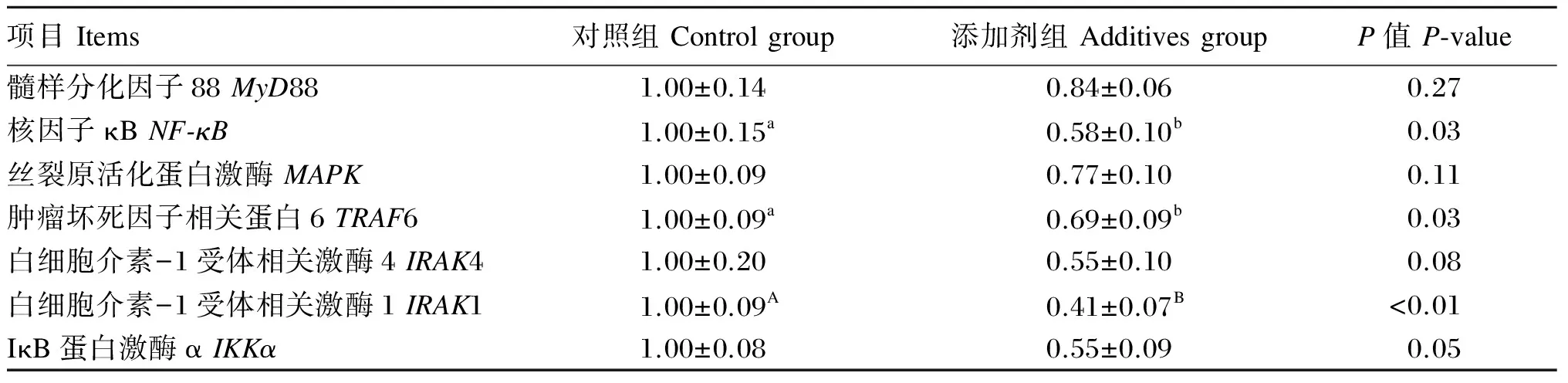
表6 饲粮添加功能性复合添加剂对生长猪白细胞内基因mRNA相对表达量的影响
3 讨 论
3.1 饲粮添加功能性复合添加剂对生长猪生长性能和血清UN含量的影响
本试验自主研制的功能性复合添加剂中维生素C、维生素E和黄芪多糖添加到饲粮中均具有提高仔猪生长性能及降低死亡率的作用[9-11];本研究也发现,功能性复合添加剂添加到饲粮中可以显著提高生长猪的ADG,并在一定程度上降低生长猪的F/G。血清UN含量可在一定程度上间接反映体内蛋白质代谢与氨基酸之间的平衡状况,当组织内氨基酸沉积利用率增高时,血清UN含量降低[12-13]。Harvey等[14]研究发现,在饲粮中添加维生素E和维生素C可以显著降低生长猪血清UN含量;彭宏刚等[15]报道,仔猪饲粮中添加黄芪多糖,可以显著降低血清UN含量,改善仔猪氮平衡。这与前人对本研究中功能性复合添加剂组成成分的试验结果一致,本研究发现,饲粮中添加功能性复合添加剂可以显著降低生长猪血清UN含量,表明该自主研发的功能性复合添加剂提高了生长猪对氨基酸的利用率,因此,我们可以推测功能性复合添加剂可以通过促进生长猪的蛋白质沉积,从而提高生长猪的生长性能。
3.2 饲粮添加功能性复合添加剂对生长猪血清细胞因子含量和白细胞内TLR信号通路相关基因mRNA相对表达量的影响
血清中细胞因子是机体全身免疫反应的指示器,表明机体的整个炎症反应[16]。IL-1主要由巨噬细胞产生,主要参与活化血管内皮、组织损伤、发热、淋巴细胞活化和诱导急性期蛋白质合成等;IL-10是一种潜在的抗炎因子,具有促进前B细胞增殖,抑制T细胞激活和诱导T细胞的免疫耐受等免疫调节功能,通过抑制促炎细胞因子的合成发挥作用。Cantorna等[17]研究表明,维生素D可以调节人和老鼠的T细胞分化,从而调节IL-10的分泌,抑制机体的炎症反应,起到抗炎作用。维生素C可以降低促炎性细胞因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量,提高抗炎性细胞因子IL-10的含量来缓解氧化应激对人体的炎性损伤[5]。廖波等[18]研究表明,饲粮中添加维生素D可以降低断奶仔猪血清和肠内容物的IL-2和IL-6含量。Fischer等[19]研究发现,维生素E和维生素C可以降低人血清中的IL-6含量。Zhao等[4]研究表明,黄芪多糖可以下调小鼠结肠炎组织中IL-1和IL-6含量。本研究使用功能性复合添加剂也得到和前人一致的结果,饲粮中添加功能性复合添加剂可以显著降低生长猪血清中促炎性细胞因子IL-1含量,显著提高血清中抗炎性细胞因子IL-10含量水平,表明功能性复合添加剂可以通过调节炎性细胞因子的分泌改善机体的免疫状态。
TLR信号通路能启动机体非特异性免疫应答,并继而激活特异性免疫反应。TLR信号通路主要是MyD88依赖性,激活的TLR募集MyD88,然后召集IRAK4,使其与IRAK1结合,诱导IRAK1磷酸化,作用于TRAF6,进而激活MAPK和NF-κB[20]。而NF-κB是一个激活炎症的经典的信号通路,可以诱导机体炎性细胞因子的分泌[21]。前人对本研究中功能性复合添加剂中相关有效成分的研究表明,维生素D、维生素C和维生素E可有效调节不同组织和器官中TLR信号通路。维生素D可以通过调控TLR信号通路,影响炎性细胞因子的释放[22-23]。在人白细胞中,维生素C可以通过调控MyD88信号通路来调节炎性细胞因子分泌来维持机体正常生理平衡[24]。维生素E在人的心脏中可以通过调节TLR信号通路调节NF-κB来改善心肌炎[25]。本研究检测仔猪外周血白细胞TLR信号通路相关基因的表达,发现功能性复合添加剂的使用趋于降低白细胞MyD88 mRNA相对表达量,显著或极显著降低NF-κB、TRAF6和IRAK1 mRNA相对表达量,并有降低IRAK4和IKKαmRNA相对表达量的趋势。由此可以推测,本研究中自主研制的功能性复合添加剂在饲粮中的添加调节机体免疫功能,可能是通过调控TLR信号通路完成的。
4 结 论
饲粮中添加功能性复合添加剂可以提高生长猪的生长性能,而这一作用可能与其可提高氨基酸利用率以及通过调节TLR信号通路来改善生长猪的免疫功能等有关。
[1] WILBURN E E,MAHAN D C,HILL D,et al.An evaluation of natural (RRR-α-tocopheryl acetate) and synthetic (all-rac-α-tocopheryl acetate) vitamin E fortification in the diet or drinking water of weanling[J].Journal of Animal Science,2008,86(3):584-591.
[2] KONOWALCHUK J D,RIEGER A M,KIEMELE M D,et al.Modulation of weanling pig cellular immunity in response to diet supplementation with 25-hydroxy vitamin D3[J].Veterinary Immunology and Immunopathology, 2013,155(1):57-66.
[3] ZHAO J,LI D,PIAO X,et al.Effects of vitamin C supplementation on performance,iron status and immune function of weaned piglets[J].Archiv Für Tierernährung,2002,56(1):33-40.
[4] ZHAO H-M,WANG Y,HUANG X-Y,et al.Astragalus polysaccharide attenuates rat experimental colitis by inducing regulatory T cells in intestinal Peyer’s patches[J].World Journal of Gastroenterology,2016,22(11): 3175
[5] MOLINA N,MORANDI A C,BOLIN A P,et al.Comparative effect of fucoxanthin and vitamin C on oxidative and functional parameters of human lymphocytes[J].International Immunopharmacology,2014,22(1):41-50.
[6] 周显青,牛翠娟,孙儒泳.维生素C和E混合饲喂对中华鳖幼鳖抗酸应激能力的影响[J].动物学研究,2004,25(1):37-42.
[7] ZHU L H,ZHAO K L,CHEN X L,et al.Impact of weaning and an antioxidant blend on intestinal barrier function and antioxidant status in pigs[J].Journal of Animal Science,2012,90(8):2581-2589.
[8] XU J,XU C,CHEN X,et al.Regulation of an antioxidant blend on intestinal redox status and major microbiota in early weaned piglets[J].Nutrition,2014,30(5):584-589.
[9] 叶文贵,林兆京.黄芪多糖预防断奶仔猪腹泻的效果试验[J].畜禽业,2007,(03):15-16.
[10] 王春华,何宇喜.维生素E及中草药对转群仔猪抗应激能力影响[J].饲料研究,2013,(3):83-84.
[11] DE RODAS B Z,MAXWELL C V,DAVIS M E,et al.L-ascorbyl-2-polyphosphate as a vitamin C source for segregated and conventionally weaned pigs[J].Journal of Animal Science,1998,76(6):1636-1643.
[12] WANG J P,YOO J S,KIM H J,et al.Nutrient digestibility, blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J].Livestock Science,2009,125(2/3):298-303.
[13] COMA J,CARRION D,ZIMMERMAN D R.Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J].Journal of Animal Science,1995,73(2):472-481.
[14] HARVEY R,KUBENA L,ELISSALDE M.Influence of vitamin E on aflatoxicosis in growing swine[J].American Journal of Veterinary Research,1994,55(4):572-577.
[15] 彭宏刚,郑伟,潘晓亮.黄芪多糖对断奶仔猪生长性能和血清生化指标的影响[J].农村科技,2015(9):68-69.
[16] YI H,YU C,ZHANG H,et al.Cathelicidin-BF suppresses intestinal inflammation by inhibiting the nuclear factor-κB signaling pathway and enhancing the phagocytosis of immune cells via STAT-1 in weanling piglets[J].International Immunopharmacology,2015,28(1):61-69.
[17] CANTORNA M T, SNYDER L, LIN Y D, et al. Vitamin D and 1,25(OH)2D regulation of T cells.[J].Nutrients,2015,7(4):3011-3021.
[18] 廖波,张克英,丁雪梅,等.饲粮添加25-羟基维生素D3对轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物抗体和细胞因子水平的影响[J].动物营养学报,2011,23(1):34-42.
[19] FISCHER C P,HISCOCK N J,PENKOWA M,et al.Supplementation with vitamins C and E inhibits the release of interleukin-6 from contracting human skeletal muscle[J].Journal of Physiology,2004,558(2):633-645.
[20] SHIZUO A,KIYOSHI T. Toll-like receptor signalling[J].Journal of Biological Chemistry,2003,278(40):499-511.
[21] SERVET K,AYGUL G,LATIF D,et al.Effects of leflunomide on inflamation and fibrosis in bleomycine induced pulmonary fibrosis in wistar albino rats[J].Journal of Thoracic Disease,2013,5(5):641-649.
[22] ADAMCZAK D M,NOWAK J K,FRYDRYCHOWICZ M,et al.The role of Toll-like receptors and vitamin D in diabetes mellitus type 1—a review[J].Scandinavian Journal of Immunology,2014,80(2):75-84.
[23] URRY Z,XYSTRAKIS E,RICHARDS D F,et al.Ligation of TLR9 induced on human IL-10-secreting Tregs by 1α, 25-dihydroxyvitamin D3abrogates regulatory function[J].The Journal of Clinical Investigation,2009,119(2):387-398.
[24] CANALI R,NATARELLI L,LEONI G,et al.Vitamin C supplementation modulates gene expression in peripheral blood mononuclear cells specifically upon an inflammatory stimulus:a pilot study in healthy subjects[J].Genes & Nutrition,2014,9(3):390-390.
[25] YAO X,CARLSON D,SUN Y,et al.Mitochondrial ROS induces cardiac inflammation via a pathway through mtDNA damage in a pneumonia-related sepsis model[J].PloS One,2015,10(10):e0139416.
*Corresponding author, professor, E-mail: dwchen@sicau.edu.cn
(责任编辑 武海龙)
Effects of Dietary Functional Compound Additive Supplementation on Growth Performance and Immune Function of Growing Pigs
WU Lijuan MAO Xiangbing YU Bing HE Jun HUANG Zhiqing YU Jie ZHENG Ping LUO Junqiu CHEN Daiwen*
(InstituteofAnimalNutritionofSichuanAgriculturalUniversity,Chengdu611130,China)
The aim of this experiment was to study the effects of dietary functional compound additive supplementation on growth performance and immune function of growing pigs. Twenty Duroc×Landrace×Large (DLY) healthy pigs with an initial body weight of (21.06±1.98) kg were randomly divided into two groups with 10 replicates per group and 1 pig per replicate. Pigs were fed the basal diet (control group) or the diet added 0.1% functional compound additive (additive group) for 14 days. The results showed that compared with the control group, dietary functional compound additive supplementation significantly increased the average daily gain (ADG) of growing pigs (P<0.05), significantly increased the serum interleukin-10 (IL-10) content of growing pigs (P<0.01), significantly reduced the serum urea nitrogen (UN) and interleukin-1 (IL-1) contents (P<0.05 orP<0.01), and significantly decreased the mRNA relative expressions of nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB), tumor necrosis factor receptor-associated factor 6 (TRAF6) and IL-1 receptor associated kinase 1 (IRAK1), which is the key genes of Toll-like receptor (TLR) pathway, in white blood cells of growing pigs (P<0.05 orP<0.01). Collectively, above results indicate that dietary functional compound additive supplementation can improve the growth performance via improving the utilization of protein and regulating the immune function of growing pigs.[ChineseJournalofAnimalNutrition, 2017, 29(5):1716-1722]
growing pigs; functional compound additive; growth performance; immune function
10.3969/j.issn.1006-267x.2017.05.031
2016-11-04
现代农业产业技术体系(CARS-36);四川省科技支撑项目(2013NZ005);四川省科技成果转换项目(2014NC0018)
巫丽娟(1989—),女,四川眉山人,硕士研究生,动物营养与饲料科学专业。E-mail: 646687600@qq.com
*通信作者:陈代文,教授,博士生导师,E-mail: dwchen@sicau.edu.cn
S828
A
1006-267X(2017)05-1716-07

