羟基自由基氧化对蛋清蛋白质结构的影响
牛思思,汪建明,贺雅欣,于景华
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
羟基自由基氧化对蛋清蛋白质结构的影响
牛思思,汪建明*,贺雅欣,于景华
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
研究蛋清蛋白质经过FeCl3/抗坏血酸(Asc)/H2O2产生的羟基自由基氧化体系氧化后化学结构的变化。用不同浓度的H2O2(0、1、5、10和20 mmol/L)对蛋清蛋白质氧化3 h,研究氧化前后蛋清蛋白质羰基、游离巯基、总巯基、游离氨基、粒径分布及二级结构的变化趋势。结果表明:氧化可使蛋清蛋白质羰基含量显著升高(p<0.05),游离巯基和总巯基含量显著下降(p<0.05),游离氨基显著下降(p<0.05),平均粒径逐渐增大。当H2O2浓度为20 mmol/L时,与对照组相比羰基含量增加2.01倍,游离氨基降低了29.1%,平均粒径增加到666 nm。在H2O2浓度低于5 mmol/L时,α-螺旋和β-折叠含量升高,β-转角降低;H2O2浓度高于5 mmol/L时蛋清蛋白质的肽链发生断裂,进一步导致蛋白质结构发生了变化。以上结果表明氧化能在一定程度上改变蛋清蛋白的结构特性。
蛋清蛋白,羟基自由基,蛋白质氧化,结构
蛋白质的氧化行为是使食品品质变差的重要原因,是导致蛋白质营养流失、风味变差以及功能特性下降的重要原因[1]。蛋白质在加工和贮藏阶段引入的氧化剂、催化剂、金属离子或不当的加工条件(如辐照)[2],都有可能引起蛋白质的氧化。蛋白质的氧化变性取决于其结构特点和特定的促氧化剂所固有的氧化机制,也可能受到pH、温度和系统组分的影响。氧化剂通过夺氢、加氧、断裂、交联等方式使蛋白质结构发生变化,失去生物活性,并引起其它不理想的变化[3]。
目前,在食品科学领域,对蛋白质氧化机理的解释大多集中于大豆分离蛋白、乳清分离蛋白以及肌肉纤维蛋白。研究表明,在模拟氧化体系中对蛋白质进行氧化处理,导致蛋白质的主链和氨基酸残基的侧链发生变化,如肽链的断裂、氨基酸残基侧链的氧化修饰以及蛋白质分子间交联物的形成等,进而会使得其营养品质及功能性质的降低,蛋白制品的品质及消费者的可接受性随之下降[4]。Davies[5]发现活性氧自由基会攻击几乎所有类型氨基酸侧链,而芳香族和含硫氨基酸酸侧链特别容易受到氧化。Kong等[6]在室温条件下将乳清分离蛋白暴露于H2O2/FeCl3羟基自由基体系中,研究不同氧化程度的乳清蛋白化学和结构变化,主要表现为羰基氧化产物的生成,总巯基含量的降低及蛋白质交联聚集等,并且蛋白质在羟基自由基体系下更容易发生氧化。章银良等[7]研究了羟基自由诱导牛血清蛋白的氧化发现总巯基及活性巯基的含量都有着不同程度的减少,随着氧化剂浓度的增加和氧化时间的延长,表面疏水性和羰基含量均呈增加趋势,蛋白质的二级结构也发生了改变。但是目前的研究中并没有涉及氧化对蛋清蛋白物理化学性质方面的研究。对于蛋清蛋白的氧化修饰及其氧化后理化性质的变化规律还需更多的实验研究来揭示。
本研究以蛋清蛋白为研究对象,采用羟自由基氧化体系(FeCl3/Asc/H2O2,pH6.0)对其进行氧化修饰,通过对羰基含量、游离巯基、总巯基及二级结构等结构指标的探讨,根据它们的变化规律及相互关系揭示羟基自由基对蛋清蛋白结构的氧化修饰。
1 材料与方法
1.1 材料与仪器
蛋清粉 郑州顶嘉食品科技有限公司;牛血清蛋白 美国Sigma公司;考马斯亮蓝 北京Solarbio科技有限公司;巯基乙醇 北京索莱宝科技有限公司;氯化铁(FeCl3)、过氧化氢(H2O2)、抗坏血酸(Asc)、乙二胺四乙酸(EDTA) 均为分析纯。
HH-S4型恒温水浴锅 郑州长城科工贸有限公司;H05-1型恒温磁力搅拌器 天津东南仪诚科技有限公司;AB204-N型电子分析天平 梅特勒-托利多仪器(上海)有限公司;FD-1型系列冷冻干燥机 北京德天佑科技发展有限公司;TDZ5-WS型低速离心机 湘仪离心机有限公司;756PC型紫外可见分光光度计 天津普瑞斯有限公司;BT-90型纳米粒度仪 丹东市百特仪器有限公司;IS50型傅里叶红外光谱仪 美国尼高利。
1.2 实验方法
1.2.1 蛋清蛋白的氧化 采用羟基自由基氧化体系主要由FeCl3、Asc和H2O2通过铁的氧化还原反应产生自由基[8]。FeCl3、Asc浓度均为0.1 mmol/L,H2O2浓度分别为0、1、5、10、20 mmol/L,反应体系均在50 mmol/L磷酸盐缓冲液中,在上述氧化体系中加入蛋清粉,使得蛋白质终质量浓度为20 mg/mL,80 ℃水浴3 h,研究不同氧化程度对蛋清蛋白结构及其功能特性的影响。氧化结束后,加入EDTA(终浓度为1 mmol/L)终止反应。为了减少氧化试剂对测定指标的影响,氧化产物要经过pH6.0磷酸盐缓冲溶液洗涤和离心处理去掉上清液,冷冻干燥得到氧化蛋白,用于测定氧化蛋白的羰基含量、巯基含量、二硫键含量、游离氨基含量、粒径、二级结构。
1.2.2 氧化蛋清蛋白羰基含量的测定 蛋白质羰基含量的测定参考文献[9]。将制备的氧化蛋清蛋白分散于去离子水中,磁力搅拌2 h,4000 r/min离心30 min。采用考马斯亮蓝法以牛血清白蛋白为标准品测定上清液中蛋白质量浓度。将10 mL上清液与2 mL含有10 mmol/L 2,4-二硝基苯肼(DNPH)的2 mol/L HCl混合,另取10 mL上清液与2 mL不含有2,4-二基苯肼的2 mol/L HCl混合作为对照,常温反应2 h。然后在每个离心管中加入40%的三氯乙酸0.50 mL,剧烈振摇均匀后静置20 min。4000 r/min 离心20 min后弃去上清液。用乙醇-乙酸乙酯混合溶液(体积比为1∶1)2.0 mL洗涤沉淀,4000 r/min离心10 min弃去上清液,重复洗涤3次。加入0.1 mol/L磷酸盐缓冲液(含6 mol/L盐酸胍,pH7.0)2.0 mL,37 ℃水浴20 min,每5 min剧烈振摇1次。以空白对照在370 nm处作校正,以 22000 cm-1消光系数计算每毫克蛋白质羰基衍生物的物质的量。

式中,A370:370 nm出的吸光值;D:为稀释倍数;C:为蛋白样品浓度,mg/mL。
1.2.3 氧化蛋清蛋白巯基与总巯基的测定 采用5,5′-二硫双(2-硝基苯甲酸)(DNTB)比色法[9]测定蛋白质的巯基含量(包括游离的和埋藏在蛋白质疏水基团内部的巯基)和总巯基基团(包括巯基和还原的二硫键)含量。
巯基含量的测定:取3 mL蛋白溶液,加入0.1 mol/L的磷酸盐缓冲液(1 mmol/L EDTA和1% SDS,pH8.0)3 mL、DNTB 0.1 mL,振荡均匀后在常温反应1 h。4000 r/min离心10 min。以不加DNTB为对照,取上清液在412 nm下测定吸光度,以13600 cm-1消光系数计算巯基含量。
总巯基基团含量的测定:取1 mL蛋白溶液,加入 0.05 mLβ-巯基乙醇和0.1 mol/L尿素-盐酸胍磷酸盐缓冲液(6 mol/L尿素和4 mol/L盐酸胍,pH8.0)4 mL,反应1 h后再加入12%三氯乙酸10 mL,反应1 h后,4000 r/min离心10 min。沉淀分散在20 mL 12%的三氯乙酸中,离心除去β-巯基乙醇,如此重复2次。最后将沉淀溶解于0.1 mol/L磷酸盐缓冲液(1 mmol/L EDTA和1% SDS,pH8.0)10 mL,再加入0.08 mL DNTB,剧烈振荡后反应1 h,4000 r/min离心 30 min。以不加 DNTB 为对照,取上清液在 412 nm 下测定吸光度,以13600 cm-1消光系数计算巯基含量。

式中,A412:412 nm出的吸光值;D:为稀释倍数;C:为蛋白样品浓度,mg/mL。
1.2.4 氧化蛋清蛋白游离氨基的测定 采用三硝基苯磺酸(TNBS)比色法[10]测定蛋清蛋白游离氨基含量。将一定量氧化后的蛋清蛋白分散于0.1 mol/L的四硼酸钠缓冲溶液(1% SDS,pH9.3)中,磁力搅拌2 h后,4000 r/min离心30 min,以牛血清白蛋白为标准蛋白,采用考马斯亮蓝法测定上清液中蛋白质量浓度,最后通过稀释使得上清液中蛋白质质量浓度达到0.1 mg/mL。取1 mL蛋白液与50 μL 0.03 mol/L TNBS混匀,37 ℃水浴1 h,加入0.24 mol/L HCl调节pH至 3.5~4.0,在 335 nm下测定吸光度。以亮氨酸为标准做标准曲线,计算游离氨基的含量(标准曲线方程y=0.0527x+0.0075,R2=0.9986)。
1.2.5 氧化蛋清蛋白粒径的测定 将氧化后的蛋清蛋白分散在0.01 mol/L 磷酸盐缓冲液(pH7.0)中,磁力搅拌 2 h,采用考马斯亮蓝法测定上清液中蛋白质质量浓度,通过稀释使得上清液蛋白质质量浓度为0.2 mg/mL,使用纳米粒度仪测定样品粒度分布。
1.2.6 氧化蛋清蛋白二级结构的测定 将真空冷冻干燥后的蛋白粉末2~6 mg与0.2 g溴化钾混合研磨均匀,用红外专用压片机进行压片,在恒温箱里平衡5 min,以空气为扫描背景,运用傅里叶变换红外光谱(FT-IR)测定。
扫描参数:光谱范围4000~400 cm-1,分辨率为4 cm-1,扫描累加64次,重复3次。选取1600~1700 cm-1波数的谱图,利用OMNIC 8.2数据处理软件进行分析处理。
1.2.7 数据处理 所有实验均进行3次重复实验,数据以“平均值±标准差”表示,采用Origin 8.0对数据进行分析处理。不同字母表示组间差异显著(p<0.05)。
2 结果与讨论
2.1 羰基含量的变化


图1 不同氧化程度的蛋清蛋白羰基含量的变化Fig.1 Changes in carbonyl content of different degree of oxidation egg white protein
2.2 游离巯基和总巯基的变化
巯基和二硫键是蛋白质中具有最高反应活性的基团,蛋白质发生氧化可使巯基(-SH)形成二硫键(-S-S-),因此在研究蛋白质氧化时,巯基和二硫键含量的测定是重要的测定指标。
不同氧化程度的蛋清蛋白游离巯基和总巯基含量的变化见表1。由表1可知,羟基自由基氧化体系对游离巯基和总巯基含量的影响同羰基变化趋势恰好相反。随着氧化剂浓度的增大,蛋清蛋白的游离巯基的含量显著下降。游离巯基含量的下降表明了氧化使得蛋白质发生了变性,或者形成了分子间二硫键[14]。

表1 不同氧化程度的蛋清蛋白二级结构游离巯基和总巯基的变化Table 1 Changes in free sulphydryl and total sulfhydryl(SH) content of different degree of oxidation egg white protein
注:不同字母表示组间差异显著p<0.05。
由表1同样可以发现,随着氧化剂浓度的增大,蛋清蛋白的总巯基含量也是显著下降的,总巯基含量与对照相比分别减少了1.5%、7.9%、17.8%、33.5%和35.7%。
游离巯基和总巯基含量会随着氧化程度的增加而呈现不同程度的损失。蛋清蛋白总巯基下降的绝对值大于游离巯基下降的绝对值,表明蛋白质氧化使得蛋清蛋白二硫键含量下降。蛋白质巯基可被氧化成多种状态,包括可逆氧化形式,主要形成蛋白质二硫键和次磺酸;与不可逆氧化形式,主要形成亚磺酸和磺酸[14]。而实验结果为二硫键含量下降,说明蛋清蛋白巯基被氧化成为不可逆氧化状态,形成了非二硫键的含硫化合物。
2.3 游离氨基酸含量的变化

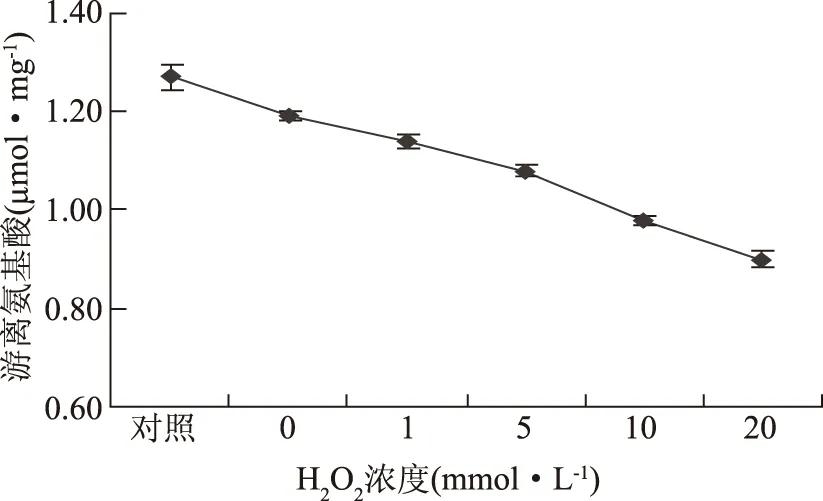
图2 不同氧化程度的蛋清蛋白游离氨基酸的变化Fig.2 Changes in free amine content of different degree of oxidation egg white protein
2.4 蛋清蛋白粒径的变化
激光纳米粒度测定仪是对可溶性蛋白质的粒度分布进行测定,一定程度上可以解释氧化蛋清蛋白的聚集程度。在羟基自由基氧化体系中蛋清蛋白的粒径分布情况如图3所示,与对照样相比,当H2O2浓度为0和1 mmol/L时,蛋清蛋白的粒径分布偏向粒径小的方向;H2O2浓度达到5 mmol/L以上时,蛋清蛋白的粒径分布偏向于粒径大的反向。实验结果表明氧化使得蛋清蛋白的粒径发生变化,分为大粒度(约1000 nm)和小粒度(约100 nm)两个部分。蛋清蛋白的平均粒径随着氧化剂浓度的增加呈现先降低后升高的趋势,氧化剂浓度达到20 mmol/L时平均粒径达到666 nm,比表面积达到最低,对照组的蛋清蛋白PDI(polydiseperse index,PDI)值最低,为0.139,粒度分布的均匀性较高,氧化剂浓度为20 mmol/L时,PDI值最大,说明粒度差异最大。
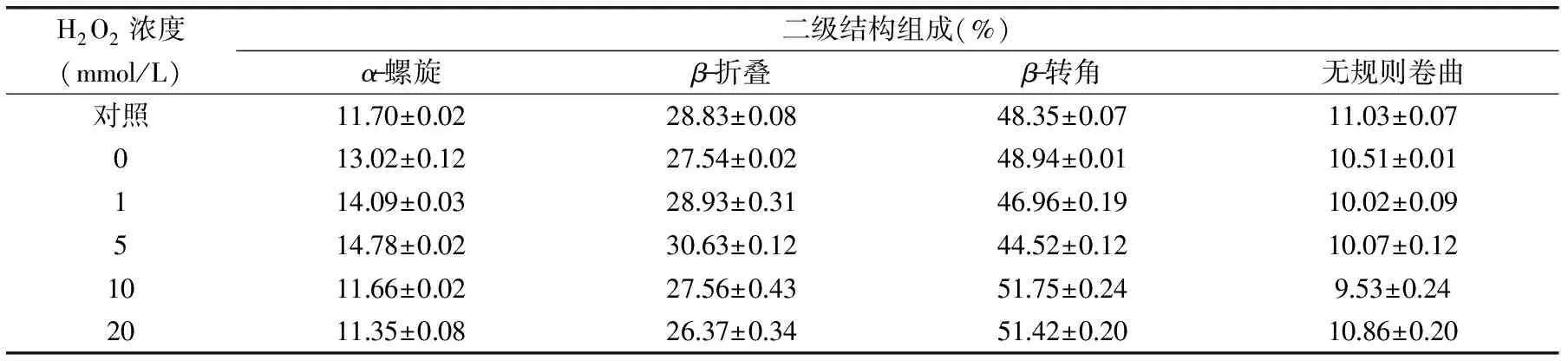
表4 氧化对蛋清蛋白二级结构相对含量的影响Table 4 Changes in secondary structural comparative content of different degree of oxidation egg white protein

图3 氧化对蛋清蛋白粒径的影响Fig.3 Influence of egg white protein particle diameter on oxidation
这说明羟自由基氧化使得蛋清蛋白发生变性和聚集,使得蛋白质粒径增大,从而导致蛋白质功能性质改变。吴伟[4]在对大豆蛋白进行氧化的研究中也发现了蛋白质的聚集,与本实验结果相符。黄友如等[16]研究报道蛋白质氧化引起蛋白质分子或亚基间共价的交联和疏水基团的暴露,反应后的蛋白质通过范德华力、氢键、疏水相互作用和静电作用等分子间作用力重新折叠与组装,从而形成较大的蛋白质聚集体。

表2 蛋清蛋白粒径分布的测定结果Table 2 Results of particle size distribution of egg white protein
2.5 蛋清蛋白二级结构的变化
红外光谱图中的酰胺I带(1600~1700 cm-1)对蛋白质中的二级结构变化非常敏感,常用来测定蛋白质的二级结构变化[17]。根据表3去卷积酰胺I带各个波数及结构指认表[18],计算出蛋清蛋白二级结构相对含量。

表3 去卷积酰胺I带各个波数及其结构指认Table 3 Deconvoluted amide I band frequencies and assignments to secondary structure for protein
表4所示是羟基自由基氧化的蛋清蛋白发生不同程度氧化的二级结构相对含量,发现氧化对蛋清蛋白α-螺旋、β-折叠、β-转角和无规则卷曲的相对含量有不同程度的影响。随着氧化剂浓度的增加,α-螺旋的相对含量先升高到5 mmol/L时达到最大,随后呈现降低趋势。无规则卷曲不明显。β-转角先下降后升高,而β-折叠的相对含量的变化是低浓度时升高,表明氧化可使蛋清蛋白形成聚集体,而当浓度达到10、20 mmol/L时,相对含量降低,可能是高浓度条件下,蛋清蛋白的肽链发生断裂,进一步导致蛋白质结构发生了变化。吴伟[4]和Lund等[19]认为高氧化条件会致使蛋白质肽链断裂。
3 结论
通过FeCl3/Asc/H2O2产生的羟基自由基氧化体系对蛋清蛋白进行氧化,能够显著改变其结构特性,随着H2O2的浓度逐渐增加,蛋清蛋白的羰基含量显著增加,游离巯基和总巯基含量显著降低,二硫键含量降低,蛋白质巯基发生不可逆氧化,形成了非二硫键的含硫化合物。随着氧化程度的加深,蛋清蛋白的游离氨基含量逐渐降低,平均粒径呈现增大趋势,在氧化浓度低于5 mmol/L时,α-螺旋和β-折叠含量升高,伴随着β-转角降低,而氧化浓度高于5 mmol/L时蛋清蛋白的多肽链发生断裂,从而导致了蛋白质结构发生变化。氧化还会导致蛋白质其他结构特性的改变,进一步影响蛋白质宏观上的功能特性,这些内容会在今后的研究中进行探索。
[1]Xiong Y L. Protein oxidation and implications for muscle food quality[M]. In Antioxiants in Muscle Foods;Decker E A,Faustman C L,Lopez-Bote C J,Eds.,John Wiley & Sons Inc.,New York,2000:85-111.
[2]Schaich K M. Free Radical Initiation in Proteins and Amino Acids by Ionizing and Ultraviolet Radiations and Lipid Oxidation(Ⅲ)[J]CRC Crit Rev Food Sci Nutr,1980,13:189-244.
[3]崔旭海,孔保华. 蛋白质氧化及其对乳蛋白结构与功能性的影响[J]. 中国乳品工业,2008,36(1):44-47.
[4]吴伟.蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D]. 无锡:江南大学,2010.
[5]Davies M J.The oxidative environment and protein damage[J]. Biochimica et Biophysica Acta,2005,1703(2):93-109.
[6]Cui X H,Xiong Y L,Kong B H,et al.Hydroxyl radical-stressed whey rrotein isolate:Chemical and structural properties[J].Food & Bioprocess Technology,2011,5(6):2454-2461.
[7]章银良,杨慧,安巧云.羟自由基诱导蛋白质氧化损伤的研究[J].食品与生物技术学报,2012,31(3):313-318.
[8]Kong B,Xiong YL,Cui X,et al. Hydroxyl Radical-Stressed Whey Protein Isolate:Functional and Rheological Properties[J]. Food and Bioprocess Technology,2011,6(1):169-176.
[9]Huang Y R,Hua Y F,Qiu A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International,2006,39(2):240-249.
[10]Habeeb A F S A.Determination of free amino groups in proteins by trinitrobenzenesulfonic acid[J].Analytical Biochemistry,1966,14(3):328-336.
[11]Stadtman E R.Oxidation of free amino acids and amino acid residues in proteins by radiolysis and by metal-catalyzed reactions[J].Annual Review of Biochemistry,1993,62(1):797-821.
[12]Santelhoutellier V,Aubry L,Gatellier P.Effect of oxidation on in vitrodigestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural and Food Chemistry,2007,55(13):5343-5348.
[13]Park D,Xiong Y L,Alderton A L,et al.Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J].Journal of Agricultural and Food Chemistry,2006,54(12):4445-4451.
[14]Thomas J A,Mallis R J.Aging and oxidation of reactive protein sulphydryls[J].Experimental Gerontology,2001,36(9):1519-1526.
[15]崔旭海,孔保华.羟基自由基氧化对乳清蛋白氨基酸含量的影响[J].食品工业科技,2010,31(10):85-89.
[16]黄友如,华欲飞,裘爱泳.脂质氧化诱导的大豆蛋白质聚集机理的研究[J].中国粮油学报,2006,21(6):80-87.
[17]Liu Y,Zhao G,Zhao M,et al.Effects of moist heat treatments to peanut kernels on the structure and functional properties of peanut protein isolated[J].Modern Food Science and Technology,2011,27(5):506-510.
[18]Byler D M,Brouillette J N,Susi H.Quantitative studies of protein structure by FTIR spectra deconvolution and curve-fitting[J].Spectroscopy,1986,1(3):29-32.
[19]Lund M N,Heinonen M,Baron C P,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition & Food Research,2011,55(1):83-95.
Effect of hydroxyl radical oxidation system on structure of egg white protein
NIU Si-si,WANG Jian-ming*,HE Ya-xin,YU Jing-hua
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
The objective of this study was to determine structural changes,including carbonyls,sulfhydryls,free amino,particle size distribution,secondary structure in egg white protein exposed to FeCl3/Asc/H2O2hydroxyl radical-generating systems. Protein carbonyl content in EWP increased(p<0.05)with increasing concentrations of H2O2,free SH,total SH groups and free amino decreased(p<0.05)in a similar fashion. EWP average particle size increased. When the H2O2concentration was increased to 20 mmol/L,there was 2.01-fold increase in carbonyl group,29.1% decrease in free amino acid,compared with control group. The average particle size reached 666 nm. The results showed that there were increases inα-helix andβ-fold of relative content,decrease inβ-turn of relative content with the increase of oxidizing agent(H2O2<5 mmol/L). Higher level oxidation(H2O2>5 mmol/L)would induce fragmentation through direct breakage of peptide bonds,resulted in changes in the secondary structures. These oxidation-induced changed demonstrate high susceptibility of EWP to oxidative stress.
egg white protein;hydroxyl radical;protein oxidation;structure
2016-08-16
牛思思(1991-),女,硕士研究生,研究方向:食品营养,E-mail:nss_bae@163.com。
*通讯作者:汪建明(1972-),女,教授,研究方向:动物资源开发与功能食品,E-mail:wangjianming@tust.edu.cn。
国家自然科学基金面上项目(31271904)。
TS253.1
A
1002-0306(2017)08-0113-05
10.13386/j.issn1002-0306.2017.08.014

