复合中性蛋白酶水解乳清蛋白中β-乳球蛋白的工艺条件优化
韩仁娇,王彩云,罗述博,程 英,云战友
(1.内蒙古乳业技术研究院有限责任公司,内蒙古呼和浩特 010110; 2.内蒙古伊利实业集团股份有限公司,内蒙古呼和浩特 010110)
复合中性蛋白酶水解乳清蛋白中β-乳球蛋白的工艺条件优化
韩仁娇1,2,王彩云1,2,罗述博1,2,程 英1,2,云战友1,2
(1.内蒙古乳业技术研究院有限责任公司,内蒙古呼和浩特 010110; 2.内蒙古伊利实业集团股份有限公司,内蒙古呼和浩特 010110)
为优化双酶水解技术生产水解乳清蛋白工艺,探寻适度水解条件下最优的β-乳球蛋白水解工艺,本研究以Neutral protease F(以下简称F酶)添加量、Neutral protease G酶(以下简称G酶)添加量、酶解温度为主要影响因素,结合实际生产中的其他水解条件,在单因素实验基础上,运用Box-Behnken实验设计原理,探讨F酶与G酶添加量、酶解温度的最佳组合。结果表明:F酶与G酶同时添加,F酶添加量0.44%(相当于2672.32 U/g)、G酶添加量0.08%(相当于362.24 U/g)、酶解温度55.2 ℃时生产乳清水解蛋白的β-乳球蛋白水解率高达58.99%±0.02%,与市售品牌水解乳清蛋白相比,过敏原β-乳球蛋白水解率最高,分子量分布在1000~180 u之间的肽段占51.76%,游离氨基酸含量为2.34%,明显优于市售同类产品。
乳清蛋白,复合中性蛋白酶,β-乳球蛋白水解率,分子质量分布,响应面法
乳清蛋白作为一种重要的乳源食品蛋白,经过生物酶解可制备易于人体消化吸收的肽段[1-2],还能产生一些具有特殊生理功能的生物活性肽,如具有降血压功能的降血压肽、具有促进钙铁吸收的酪蛋白磷酸肽,具有抗菌功能的抑菌肽等[3-5]。但是牛乳乳清蛋白中所含有的β-乳球蛋白(β-Lg),是导致婴幼儿过敏的主要过敏原,人乳中并不含有这一蛋白组分,但它在牛乳乳清蛋白中所占的比例高达56%~60%[6-8],所以,要生产母乳化、舒适或是低致敏性的婴幼儿配方奶粉,降低或去除乳清蛋白中的β-乳球蛋白是十分必要的。
生物酶解法是一种降低β-乳球蛋白含量的新手段,该方法工艺简单、生产成本低,在水解β-乳球蛋白的同时可获得大量的生物活性肽,提高乳清蛋白的生物效价,拓宽乳清蛋白的应用领域。研究表明,在相同浓度以及相同氨基酸组成的条件下,人体对肽的吸收速度要比游离氨基酸快,尤其是小肽(二肽、三肽)[9-10]。但是,在水解乳清蛋白的过程中势必会产生不同比例的游离氨基酸组分,而游离氨基酸含量过高食用后会导致婴儿体内渗透压的升高,进而产生不适感。因此,提高水解产物中小肽质量分数、降低或控制游离氨基酸比例,对制备优质的水解乳清蛋白是十分必要的。
本研究采用生物酶解技术,使用前期筛选后获得的两种中性蛋白酶(Neutral protease F,F酶和Neutral protease G,G酶)复合酶解乳清蛋白,以β-乳球蛋白水解率为主要考察指标,对两种蛋白酶的最适添加量和最适酶解温度进行了响应面优化实验分析,进而获得乳清蛋白达到适度水解(水解度在10%左右)状态下的最佳水解工艺,对水解产物的分子质量分布和β-乳球蛋白水解率进行了检测,同时与市售同类产品进行了β-乳球蛋白水解率和分子质量分布情况的对比。
1 材料和方法
1.1 材料与仪器
Neutral protease F 酶活607345.5 U/g,市售商业蛋白酶;Neutral protease G 酶活452800 U/g,市售商业蛋白酶;浓缩乳清蛋白 WPC80蛋白质含量80.2%,新西兰恒天然公司;水解乳清蛋白1、2、3 为3种市售水解乳清蛋白粉;β-Lg(色谱纯)、低分子量标准蛋白(Marker)、Tris-Base、细胞色素C(MW12384)、杆菌酶(MW1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451)、乙氨酸-乙氨酸-乙氨酸(MW189)等 均为分析纯,Sigma公司。
T6紫外-可见分光光度仪 北京普析通用仪器有限责任公司;ML1602型电子天平 梅特勒公司;LSHZ-300型冷冻水浴恒温振荡器 太仓培英;BUCHI B-370型凯氏定氮仪 瑞士BUCHI公司;1200高效液相色谱仪 安捷伦;iMark酶标仪、Mini-PROTEAN垂直电泳仪 美国伯乐。
1.2 实验方法
1.2.1 乳清蛋白水解工艺 将WPC80与水按照1∶9的比例配制成蛋白溶液,按比例加入蛋白酶,在搅拌转速为450 r/min的条件下进行水解,该过程保持温度恒定,水解2 h后加入1 mol/L的NaOH溶液调节pH为6.8~7.0,取出溶液置于85 ℃水浴中保温10 min,冷却至50 ℃后进行喷雾干燥。
1.2.2 单因素实验设计方法
1.2.2.1 F酶添加量对β-乳球蛋白水解率及分子质量分布的影响 将WPC80与水按照1∶9的比例配制成蛋白溶液,在G酶添加量为底物蛋白添加量的0.08%的条件下,分别按[E]/[S]比例为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%加入蛋白酶F,该过程始终保持温度为55 ℃,其他条件及操作按1.2.1,考察不同F酶添加比例对β-乳球蛋白水解率及分子质量分布的影响,确定最佳的F酶添加量。
1.2.2.2 G酶添加量对β-乳球蛋白水解率及分子质量分布的影响 将WPC80与水按照1∶9的比例配制成蛋白溶液,在F酶添加量为底物蛋白添加量的0.4%的条件下,分别按[E]/[S]比例为0.03%、0.05%、0.07%、0.09%、0.11%加入蛋白酶G,该过程始终保持温度为55 ℃,其他条件及操作按1.2.1,考察不同G酶添加比例对β-乳球蛋白水解率及分子质量分布的影响,确定最佳的G酶添加量。
1.2.2.3 酶解温度对β-乳球蛋白水解率及分子质量分布的影响 将WPC80与水按照1∶9的比例配制成蛋白溶液,按以上确定的最适F酶和G酶添加量分别为底物蛋白添加量的0.4%和0.07%的比例添加两种蛋白酶,在搅拌转速为450 r/min、水解温度分别为40、45、50、55、60 ℃的条件下进行水解,其他条件及操作按1.2.1,考察不同酶解温度对β-乳球蛋白水解率及分子质量分布的影响,确定最佳的酶解温度。
1.2.3 F酶单独酶解样品的制备 将WPC80与水按照1∶9的比例配制成蛋白溶液,按[E]/[S]为0.4%的比例加入蛋白酶F,在搅拌转速为450 r/min的条件下进行水解,该过程保持温度恒定55 ℃,水解2 h后加入1 mol/L的NaOH溶液调节pH为6.8~7.0,取出溶液置于85 ℃水浴中保温10 min,冷却至50 ℃后进行喷雾干燥。
1.2.4 水解度测定 采用三硝基苯磺酸钠(TNBS)法[11-12]。
1.2.5β-乳球蛋白水解率的测定 采用SDS-PAGE法测定[13],β-乳球蛋白水解率的计算公式如下:
β-乳球蛋白水解率(%)=(水解前β-乳球蛋白含量-水解后β-乳球蛋白含量)/水解前β-乳球蛋白含量×100。
1.2.6 分子质量分布测定 采用高效液相色谱法测定,具体检测条件如下。
色谱条件:色谱柱:TSKgel 2000 SWXL 300 mm×7.8 mm,流动相:乙腈∶水∶三氟乙酸为45∶55∶0.1(V/V),在UV220 nm下检测,流速为0.5 mL/min,柱温为30 ℃。
样品制备:将样品配制成1 mg/mL的溶液,吸取2 mL于10 mL容量瓶中,用流动相稀释至刻度,用微孔过滤膜过滤后供进样。
相对分子质量校正曲线:以相对分子质量的对数(lg Mr)对保留时间作图得到相对分子质量校正曲线方程。
1.2.7 Box-Behnken实验设计 根据单因素实验结果,采用响应面设计,运用Box-Behnken实验设计原理,以β-乳球蛋白水解率为响应值,选定F酶添加量、G酶添加量和酶解温度,设计三因素三水平响应面分析实验,其中蛋白酶添加量以占蛋白干基质量分数计,实验因素水平见表1。

表1 响应面实验因素和水平设计Table 1 Coded values and corresponding real values of the optimization parameters tested in response surface analysis
1.3 数据处理
采用Design-Expert7.0软件(Static Made Easy,Minneapolis,MN,USA)进行数据处理。
2 结果与分析
2.1 单因素实验
2.1.1 F酶添加量对β-乳球蛋白水解率及分子质量分布的影响 F酶与G酶同时添加,确定G酶添加量不变,改变F酶的添加量,考察其对β-乳球蛋白水解率的影响,实验结果见图1。

图1 F酶添加量对β-乳球蛋白水解率及分子质量分布的影响Fig.1 Effect of F-protease concentration on β-Lg hydrolysis rate
由图1可知,β-乳球蛋白水解率随着F酶添加量的增加不断上升,当添加量超过底物蛋白的0.4%时,β-乳球蛋白水解率上升趋缓;另外,当F酶添加量低于底物蛋白的0.4%时,随着蛋白酶添加量的增加水解产物中分子量处于1000~180 u之间的肽段的质量分数明显增加;当添加量超过底物蛋白的0.4%时,水解产物游离氨基酸(分子量<180 u的组分)含量明显增加;考虑到添加过多的蛋白酶对β-乳球蛋白水解率影响不大,反而使水解产物中产生较多的游离氨基酸组分,又增加生产成本,破坏水解产物的风味,所以选择F酶添加量为底物蛋白的0.4%左右较为合适。
2.1.2 G酶添加量对β-乳球蛋白水解率及分子质量分布的影响 F酶与G酶同时添加,确定F酶添加量不变,考察在此基础上G酶添加量对β-乳球蛋白水解率及分子量分布的影响,具体实验结果见图2。
由图2可知,β-乳球蛋白水解率随着G酶添加量的增加呈增加趋势,但变化幅度不明显,但分子质量分布受G酶添加量影响较明显。随着添加量的增加水解产物中处于1000~180 u之间的肽段比例逐渐增加,游离氨基酸组分逐渐减少,当添加量超过0.07%时,分子质量变化趋势趋缓,考虑到添加过多的G酶对β-乳球蛋白水解率和分子量分布影响不大,还会引起生产成本的提高,所以选择G酶添加量为0.07%左右较为合适。
2.1.3 酶解温度对β-乳球蛋白水解率及分子质量分布的影响 由图3可知,在两种蛋白酶同时水解且添加量不变的情况下,β-乳球蛋白水解率随着酶解温度的升高先升高后降低,当酶解温度为55 ℃时,β-乳球蛋白水解率达到最高值,当酶解温度达到60 ℃时,有部分蛋白酶已经失活,所以其β-乳球蛋白水解率明显下降,综合考虑β-乳球蛋白水解率和水解产物分子质量分布,选择酶解温度为55 ℃左右较为合适。

图3 酶解温度对β-乳球蛋白水解率及分子质量分布的影响Fig.3 Effect of hydrolysis temperature on β-Lg hydrolysis rate
2.2 响应面法优化水解乳清蛋白生产工艺
2.2.1 模型建立及显著性分析 根据表1方案进行响应面实验,在17个实验中,1~12是析因实验,13~17是中心实验,用来估算实验误差。响应面分析实验结果见表2,方差分析见表3。

表2 响应面分析实验设计及结果Table 2 Box-Behnken experimental design and results for response surface analysis
经回归拟合后,实验因素对响应值的影响可用回归方程表示。
Y=58.75+1.39A+0.17B+0.33C+0.12AB-0.21AC+0.07BC-1.89A2-0.04B2-4.02C2

由表3可以看出,A、A2、C2为极显著性影响因素,C和B2影响显著。在各影响因素中,F酶添加量对β-乳球蛋白水解率影响最大,其次是酶解温度和G酶添加量。
2.2.2 响应面优化与分析 根据模型方程绘制β-乳球蛋白水解率响应面图,结果如图4~图6所示。从图中可以直观地看出各因素对β-乳球蛋白水解率的影响。
由图4、图5可以看出,当G酶添加量和酶解温度不变时,β-乳球蛋白水解率随F酶添加量的增加而升高,当达到一定值以后略有降低;当F酶添加量和酶解温度不变时,β-乳球蛋白含量随G酶添加量的增加变化趋势不大,说明G酶的加入对于β-乳球蛋白的水解效果影响不大。F酶添加量对β-乳球蛋白含量影响较G酶添加量显著,表现为曲线变化趋势较大。
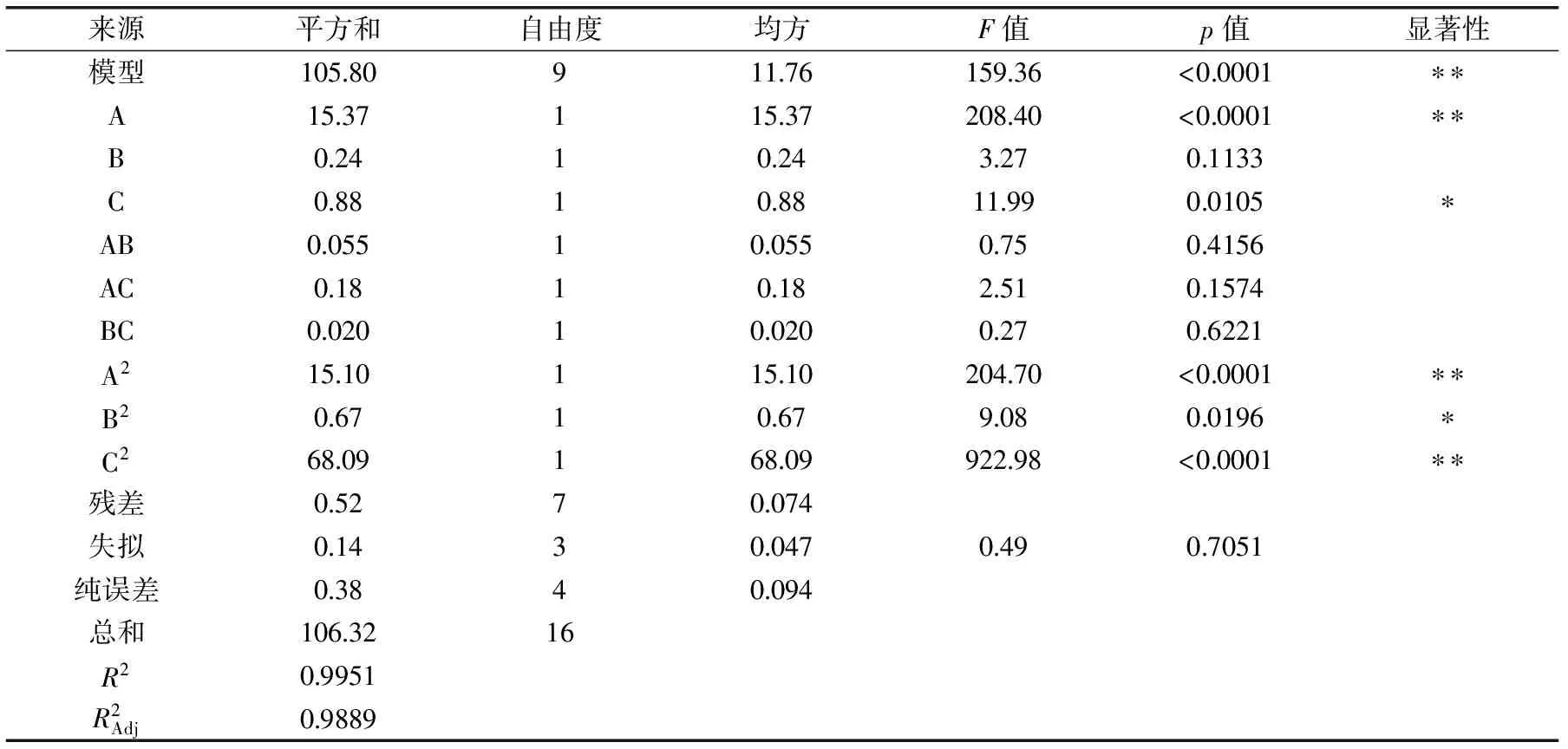
表3 响应面实验方差分析Table 3 Analysis of variance for the fitted regression model

图4 F酶添加量和G酶添加量对β-乳球蛋白水解率影响的响应面图Fig.4 Response surface plot for the effect of cross-interaction between F-protease concentration and G-protease concentration on β-Lg hydrolysis rate
注:*表示差异显著(p<0.05);**表示差异极显著(p<0.01)。
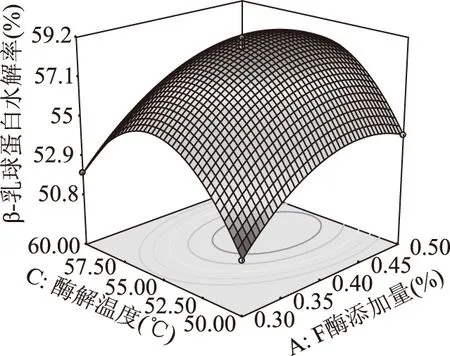
图5 F酶添加量和酶解温度对β-乳球蛋白水解率影响的响应面图Fig.5 Response surface plot for the effect of cross-interaction between F-protease concentration and hydrolysis temperature on β-Lg hydrolysis rate

图6 G酶添加量和酶解温度对β-乳球蛋白水解率影响的响应面图Fig.6 Response surface plot for the effect of cross-interaction between G-protease concentration and hydrolysis temperature on β-Lg hydrolysis rate
由图5、图6可以看出,当F酶和G酶添加量不变时,β-乳球蛋白水解率随着温度的升高呈现先升高后降低的趋势,说明当酶解温度超过蛋白酶的最适温度以后,随着酶活力的逐渐降低其水解底物蛋白中β-乳球蛋白的能力也逐渐下降。
通过对模型方程求导计算,得到β-乳球蛋白水解率最高的酶解工艺参数为F酶添加量0.44%(相当于2672.32 U/g)、G酶添加量0.08%(相当于362.24 U/g)、酶解温度55.17 ℃,由模型方程预测得到此时的β-乳球蛋白水解率是59.04%。根据响应面优化结果,以F酶添加量0.44%、G酶添加量0.08%、酶解温度55.2 ℃酶解生产水解乳清蛋白,通过验证实验,所得水解乳清蛋白的β-乳球蛋白水解率为58.99%±0.02%,与模型方程预测值基本一致。
2.3 酶解产物分子质量分布情况
采用高效液相色谱法对以上工艺制备的水解乳清蛋白的分子质量分布情况进行了检测,测定结果见图7。

图7 酶解产物高效液相检测图谱Fig.7 HPLC diagram of whey protein hydrolyzate 注:1为水解前样品的HPLC谱图,2为F酶酶解产物HPLC谱图,3为F酶与G酶共同酶解后产物HPLC谱图。

分子量范围(u)水解前浓缩乳清蛋白(WPC80,%)F酶单独酶解后(%)F酶与G酶共同酶解后(%)>1000055192888196110000~30008997615983000~200019095526402000~10001033126213911000~50027513671888500~18016325163288<180203654235
以相对分子质量的对数(lg Mr)对保留时间作图得到相对分子质量校正曲线方程:lg Mr=6.62-0.259T,所以出峰时间在14 min之前的为分子量分布在10000 u以上的片段,β-乳球蛋白的分子量为18.4 ku,主要分布在10000 u以上的组分中,通过图7与表4分子量分布检测结果可以看出,水解前浓缩乳清蛋白的HPLC谱图共有7个峰,但是由于个别峰出现叠加,导致直观很难辨别,通过谱图可以看出水解前浓缩乳清蛋白以分子量分布在10000 u以上的组分占主要比例,单独加入F酶时,对10000 u以上的组分有明显的水解效果,>10000 u以上的组分比例由55.19%下降到28.88%,F酶与G酶共同作用时底物蛋白中>10000 u的组分有更进一步的水解,这说明F酶与G酶都具备水解底物蛋白大分子的作用,但是F酶的作用效果更加明显,即F酶是导致β-乳球蛋白水解的主要因素;单独加入F酶以后分子量<1000 u组分所占的比例较水解前增加了38.96%,而加入G酶后该比例仅在单独加入F酶的基础上提高了不到10%,这说明F酶的加入是提高小肽比例的决定性因素;添加G酶以后游离氨基酸组分(<180 u)的比例明显降低,说明G酶除了能使原本大分子量的肽段进一步水解成小肽以外,还能使部分游离氨基酸再度交联形成小肽,这对平衡乳清水解蛋白产品摄入人体以后的渗透压以及改善水解产物的风味起到一定作用。
分析以上分子量变化的原因可能是由于F酶是内肽酶,主要作用于肽链内部,可以使大分子蛋白断裂成分子量相对较少的片断,加之其酶活力较G酶更高一些,所以其对β-乳球蛋白这样的大分子片段的水解效果更强;而G酶虽然也有内肽酶的成分,但是其酶活力相对较低,所以对大分子肽片段的水解能力相对弱一些;至于G酶能使部分游离氨基酸再度交联形成小肽的原因主要是受蛋白酶固有特性的影响,其深层次机理还需要进一步研究。
2.4 水解产物的凝胶电泳分析
采用上述复合中性蛋白酶对浓缩乳清蛋白进行水解,水解前后的SDS-PAGE电泳图如图8所示,WHP1、WHP2、WHP3是采用相同方法三次实验制备的水解产物,其水解度分别为9.75%、10.40%、9.53%。

图8 浓缩乳清蛋白水解前后的电泳结果Fig.8 Electrophoresis results of whey protein concentrate before and after hydrolysis

表5 不同品牌乳清水解蛋白关键指标比较Table 5 Comparison of key indicators among different brands of whey protein hydrolyzate
由图8可以看出,经过复合中性蛋白酶水解以后,10000 u以上的组分含量明显降低,经计算WHP1、WHP2、WHP3三个样品的β-乳球蛋白水解率分别为60%、73%、55%,平均水解率为62.6%,说明当水解产物的水解度控制在10%左右时,采用上述优化的复合中性蛋白酶酶解工艺对乳清蛋白中β-乳球蛋白具有较好的水解效果。
2.5 与市售同类产品关键指标对比
按照上述确定的工艺制备乳清水解蛋白,并与三款市售同类竞品进行对比,主要对比指标为水解度、β-乳球蛋白水解率、1000~180 u肽段比例和游离氨基酸(<180 u)比例,测定结果如表5所示。
从表5可以看出,在水解度相近的情况下,本研究使用的复合中性蛋白酶酶解工艺生产的乳清水解蛋白的β-乳球蛋白水解率最高,达到60%以上,与其他市售同类产品相比,酶解产物分子量分布在1000~180 u之间的肽段比例最大,而游离氨基酸组分(分子量<180 u)所占的比例明显低于市售同类产品,这说明在适度水解条件下,由F酶和G酶组成的复合中性蛋白酶体系对底物乳清蛋白中β-乳球蛋白有较好的水解效果,同时可以有效控制水解产物中游离氨基酸的形成,采用该复合中性蛋白酶酶解工艺生产的乳清水解蛋白在抗原水解率和消化吸收率上更有优势。
3 结论
利用Box-Behnken实验设计和响应面分析,探讨提高β-乳球蛋白水解率的最佳酶解工艺参数,所建立的实验模型能够反映响应值的变化,对实验的拟合较好。优化结果显示,在F酶与G酶同时添加,F酶添加量0.44%、G酶添加量0.08%、酶解温度55.2 ℃条件下生产的水解乳清蛋白β-乳球蛋白水解率为58.99%±0.02%。以此条件为基础生产的水解乳清蛋白与市售三款同类产品相比较抗原β-乳球蛋白水解率最高,分子质量处于1000~180 u的肽段所占比例明显高于市售同类产品,且产品中游离氨基酸组分所占比例得到明显的控制。按照生产婴幼儿配方奶粉对乳清水解蛋白的要求,在该条件下制备的水解乳清蛋白更适合添加到婴幼儿配方奶粉中,同时,本研究中确定的复合中性蛋白酶酶解工艺及研究思路为后续提高婴幼儿配方粉母乳化和舒适化程度的研究奠定了基础。
[1]Guo H,Kong BH. Health and Function Food[M]. Harbin:Heilongjiang science and technology press,1996.
[2]Adler-Nissen J. Enzymic hydrolysis of food proteins[M]. London,UK:Elsevier Applied Science Publishers,1986.
[3]Renate Jonker,Nicolaas EP,Deutz,et al. Hydrolyzed casein and whey protein meals comparably stimulate net whole-body protein synthesis in COPD patients with nutritional depletion without an additional effect of leucine co-ingestion[J]. Clinical Nutrition,2014,33(2):211-220.
[4]Argyri K,Theophanidi A,Kapna A,et al. Iron or zinc dialyzability obtained from a modified in vitro digestion procedure compare well with iron or zinc absorption from meals[J]. Food Chemistry,2011,127(2):716-721.
[5]Caroline Mellinger-Silva,Luisa OL,Rosa,et al. Dual function peptides from pepsin hydrolysates of whey protein isolate[J]. International Dairy Journal,2015,48:73-79.
[6]Tavares,Tania,Contreras,et al. Novel whey-derived peptides with inhibitory effect against angiotensin-converting enzyme:In vitro effect and stability to gastrointestinal enzymes[J]. Peptides,2011,32:1013-1019.
[7]DERECK E W C,GEOFFREY S,PETER R,et al. Bioactivity ofβ-Lactoglobulin andα-lactalbumin-Technological Implications for Processing[J]. International Dairy Journal,2006 16(11):1229-1240.
[8]Barros RM,Malcata FX. Molecular characterization of peptides released fromβ-lactoglobulin andα-lactalbumin via cardosins A and B[J]. Dairy Sci,2006,89(2):483-494.
[9]Lucia de la Hoz,Vera S,Nunes da Silva,et al. Small peptides from enzymatic whey hydrolyzates increase dialyzable iron[J]. International Dairy Journal,2014,38(2):145-147.
[10]WEBB K E. The Developments in Gastrointestinal Absorption Tissue Utilization of Peptides[J].Dairy Science,1993,76(1):351-361.
[11]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,15(11):65-67.
[12]张俊英,王彩云,靳烨,等.酶水解乳清蛋白工艺条件的研究[J].农产品加工,2009(6):35-37.
[13]杨章昀,冯郑珂,潘家荣.脱盐牛乳乳清粉中β-乳球蛋白的分离纯化[J].中国乳品工业,2015,43(4):10-12.
Optimization of compound neutral enzymatic hydrolysis ofβ-lactoglobulin in whey protein
HAN Ren-jiao1,2,WANG Cai-yun1,2,LUO Shu-bo1,2,CHENG Ying1,2,YUN Zhan-you1,2
(1.Inner Mongolia Research Center of Diary Technology Co.,Ltd.,Hohhot 010110,China; 2.Inner Mongolia Yili Industrial Group Co.,Ltd.,Hohhot 010110,China)
The purpose was to optimize the production of hydrolyzed whey protein by double enzyme hydrolysis technology,and to explore the optimal process ofβ-lactoglobul hydrolysis under moderate hydrolysis conditions. The enzymatic hydrolysis of whey protein with F-Neutral protease and G-Neutral protease was optimized using a Box-Behnken design with response surface methodology. Theβ-lactoglobulin hydrolysis rate of whey protein hydrolysate was 58.99%±0.02% when the optimal hydrolysis conditions were established as follows:0.44%(equivalent to 2672.32 U/g)F-protease,0.08%(equivalent to 362.24 U/g)G-protease,and hydrolysis at 55.2 ℃,which represented a maximum value over that reported for commercial whey protein hydrolyzate. Mass fraction of molecular weight 1000~180 u was 51.76%,and the free amino acid was 2.34%,significantly lower than the market similar products.
whey protein;complex neutral protease;β-lactoglobulin hydrolysis rate;molecular weight distribution;response surface methodology
2016-10-14
韩仁娇(1986-),女,硕士研究生,研究方向:乳品加工,E-mail:hanrenjiao@yili.com。
TS201.1
A
1002-0306(2017)08-0203-06
10.13386/j.issn1002-0306.2017.08.031

