利拉鲁肽对胰岛素抵抗大鼠肾脏8-羟基脱氧鸟苷、丙二醛及超氧化物歧化酶表达的影响
吴明昊 刘剑 胡桂才 高宇 张宝红 周瑾 赵亚娟
·实验研究·
利拉鲁肽对胰岛素抵抗大鼠肾脏8-羟基脱氧鸟苷、丙二醛及超氧化物歧化酶表达的影响
吴明昊 刘剑 胡桂才 高宇 张宝红 周瑾 赵亚娟
目的 研究利拉鲁肽对胰岛素抵抗(insulin resistance,IR)大鼠肾脏8-羟基脱氧鸟苷(8- hydroxydeoxyguanosine,8-OHdG)、丙二醛(malonaldehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)含量的影响。方法 54只雄性Wistar大鼠随机分成对照组(普通饮食)16只、模型组(高脂饮食)38只。喂养8周末各组取5只行高胰岛素-正葡萄糖钳夹实验评价各组IR状态,判定IR造模成功后再将高脂喂养组随机分为IR组、干预组1(利拉鲁肽100 μg·kg-1·d-1)、干预组2(利拉鲁肽200 μg·kg-1·d-1)。药物干预2周后,测定各组大鼠血肌酐(serum creatinine,SCr)、尿素氮(blood urea nitrogen,BUN)、24 h尿蛋白量以及肾组织中8-OHdG、MDA和SOD含量,并应用电镜观察各组肾组织形态结构。结果 IR组的SCr、BUN、24 h尿蛋白定量、8-OHdG、MDA分别为(26.31±0.60) μmol/L、(10.43±0.50) mmol/L、(7.13±0.60) mg、(32.81±2.96) ng/L和(7.7±1.0) nmol/mg,与对照组[(15.55±0.42) μmol/L、(5.34±1.33) mmol/L、(2.18±0.29) mg、(13.30±1.72) ng/L、(3.3±0.4) nmol/mg]比较均明显升高(均P<0.05),而SOD表达下降[(175.0±7.7) U/mg比(237.1±12.4) U/mg,P<0.05)];与IR组比较,干预组1的24 h尿蛋白定量[(6.46±0.44) mg]、8-OHdG[(28.54±2.71) ng/L]、MDA[(6.6±1.0) nmol/mg]表达均减少(均P<0.05);与IR组比较,干预组2的SCr[(24.07±1.05) μmol/L]、BUN[(9.53±0.53) mmol/L]、24 h尿蛋白定量[(4.60±0.40) mg]、MDA[(5.7±0.5) nmol/mg]、8-OHdG[(20.06±1.65) ng/L]表达均降低(均P<0.05),而SOD[(216.1±10.6) U/mg]表达升高(P<0.05);与干预组1比较,干预组2的SCr、BUN、24 h尿蛋白量、MDA、8-OHdG均降低(均P<0.05),而SOD表达升高(P<0.05)。结论 利拉鲁肽可呈浓度依赖性降低肾脏氧化应激水平,可能是阻断IR所致肾损伤的原因之一。
利拉鲁肽;胰岛素抵抗;8-羟基脱氧鸟苷;丙二醛;超氧化物歧化酶
胰岛素抵抗(insulin resistance,IR)是发生肾损害、导致肾衰竭的独立危险因素,其中机体氧化与抗氧化系统失衡在IR所致肾损伤的发病机制中起到重要作用[1-2]。利拉鲁肽是临床应用的新型降糖药物,有研究发现利拉鲁肽可改善IR大鼠所致的肾损伤,但具体作用机制尚不明确。本研究应用利拉鲁肽干预IR大鼠,观察药物对大鼠肾脏8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)、丙二醛(malonaldehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)含量的影响以及电镜下组织学改变,旨在探讨利拉鲁肽对肾脏保护作用的可能机制。
材料与方法
一、动物模型的建立与分组
雄性Wistar大鼠54只(4周,230~260 g,购自维通利华)。按随机数字表法随机分为2组:对照组16只,高脂组38只。54只大鼠喂养8周后各组取5只行清醒状态高胰岛素-正葡萄糖钳夹实验技术,准确评价实验大鼠IR状态。IR大鼠造模成功后,再随机分为3组,分别为IR组、干预组1、干预组2,各11只。第9周开始干预组继续高脂饮食喂养,同时给予不同浓度利拉鲁肽皮下注射(干预组1:利拉鲁肽100 μg·kg-1·d-1、干预组2:利拉鲁肽200 μg·kg-1·d-1)。对照组和IR组以等量生理盐水皮下注射。药物干预2周后,各组取5只大鼠行高胰岛素-正葡萄糖钳夹实验,其余6只大鼠腹主动脉取血测定血清各项指标,剪取肾脏组织-80 ℃冰箱冻存,留取部分肾脏标本行透射电镜。
二、相关检测指标测定
1.高胰岛素-正葡萄糖钳夹实验 喂养第8周末和药物干预2周后,各取5只大鼠,10%水合氯醛麻醉,右侧颈动、静脉插管,注射肝素封管。3 d后,禁食、水1 d,在大鼠清醒状态下,以4 mU·kg-1·min-1速度向颈静脉输注胰岛素和30%葡萄糖(5 mg·kg-1·min-1起始)。每15 min从颈动脉抽血测血糖,根据血糖情况调整葡萄糖输注率,使血糖维持在4.5~5.5 mmol/L,连续3次即为稳态,计算稳态下的平均葡萄糖输注率(glucose infusion rate,GIR)。
2. 相关指标的测定 ①于第10周末,用代谢笼收集各组大鼠24 h尿液(禁食,不禁水),记总尿液量,3 000 r/min,离心10 min,取上清。用免疫比浊法测24 h尿蛋白定量。②相关血液指标的测定:大鼠腹主动脉取血,室温放置2 h,离心机1 200 r/min,离心20 min,取上清分装至EP管中,-80 ℃冰箱保存。应用全自动生化分析仪测定大鼠血肌酐(serum creatinine,SCr)、尿素氮(blood urea nitrogen,BUN)。
3.剪取肾脏组织测定肾组织中的8-OHdG、MDA和SOD含量 取肾组织0.5 g加0.9%氯化钠溶液4.5 ml(重量/体积比1∶9)制成匀浆液,4 000 r/min,离心约10 min,取上清液。按试剂盒说明书:双抗体两步夹心酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测大鼠肾组织8-OHdG的水平、水溶性四氮唑(water soluble tetrazolium,WST-1)法测定SOD活性、硫代巴比妥酸(thibabituric acid,TBA)法测定MDA含量(试剂盒均购于南京建成生物工程研究所)。
4.肾脏组织电镜观察 取肾组织,眼科剪将肾组织剪成体积约为1 mm×1 mm×1 mm的组织方块,于3.1%戊二醛浸泡,再于1%锇酸固定,经脱水、渗透、包埋、切片等处理,透射电镜下观察肾脏组织超微结构。
三、统计学处理
采用SPSS 19.0统计软件进行处理,实验数据以均数±标准差表示,两均数比较用两独立样本t检验,多个样本均数比较采用完全随机设计单因素方差分析,以P<0.05为差异有统计学意义。
结 果
一、高胰岛素-葡萄糖钳夹实验结果
对照组GIR为(30.21±2.51) mg·kg-1·min-1,高脂组GIR为(20.41±3.64) mg·kg-1·min-1,与对照组比较,高脂组GIR明显下降,差异有统计学意义(P<0.05),提示高脂诱导IR大鼠模型造模成功。利拉鲁肽干预2周后各组GIR:与对照组比较,高脂组GIR降低更明显(P<0.05);经利拉鲁肽治疗后,干预组1、干预组2的GIR与高脂组比较,GIR均升高,干预组2升高更明显,差异有统计学意义(P<0.05)。(表1)

表1 4组大鼠各项指标检测比较±s)
注:与对照组相比:aP<0.05;与IR组相比:bP<0.05;与干预组1相比:cP<0.05
二、相关指标检测结果
与对照组比较,IR组的SCr、BUN、24 h尿蛋白定量、8-OHdG、MDA明显升高(P<0.05),而SOD表达下降(P<0.05);与IR组相比,干预组1仅24 h尿蛋白定量、MDA、8-OHdG减少(P<0.05);而干预组2的SCr、BUN、24 h尿蛋白定量、MDA、8-OHdG均降低(P<0.05),SOD表达升高(P<0.05);与干预组1相比,干预组2的SCr、BUN、24 h尿蛋白定量、MDA、8-OHdG均降低(P<0.05),SOD表达升高(P<0.05)。(表1)
三、肾脏电镜结果
与对照组相比,IR组肾小球基底膜明显增厚、厚薄不均、部分足突肿胀、融合或消失。与IR组相比,利拉鲁肽干预组肾小球基底膜增厚均有所减轻,足突肿胀缓解,且干预组2改善肾组织病理变化更为明显。(图1)
讨 论
既往研究表明,机体IR状态是导致肾损伤的始动因素之一,IR可通过胰岛素样生长因子-1、转化生长因子-β、肾素-血管紧张素-醛固酮系统、内皮素-1、高胰岛素血症等途径导致肾损害[3-4],其中氧化应激因素日益受到关注。本研究发现高脂诱导IR大鼠出现24 h尿蛋白定量增加、肾功能的改变,肾小球基底膜明显增厚、足突肿胀、融合或消失,证实IR可致肾脏损害。
氧化应激(oxidative stress, OS)是指体内活性氧簇和活性氮簇的产生增多,引起细胞生物膜脂质过氧化,胞内蛋白激酶变性以及DNA损伤[5]。氧化应激可减少使血管内皮舒张因子(NO)的生成以及生物利用度,引发肾小球血管内皮功能受损,加速肾小球硬化,此外还可促进糖化产物的生成,造成肾小球结节性病变[6]。体内氧化应激水平升高可促进肾脏炎症状态加重,促使机体IR状态进一步加重。羟自由基和单线态氧可以攻击DNA链上的鸟嘌呤碱基使C-8位发生羟化而生成加合物8-OHdG,8-OHdG是DNA氧化损伤的特异产物。研究认为,组织或体液中的8-OHdG是一种反映DNA氧化损伤的敏感指标[7]。MDA为脂质过氧化物裂解产物,可引起蛋白质分子间的交联,亦可与核酸等发生反应,导致细胞代谢广泛性障碍。组织中MDA的含量可反映机体内脂质过氧化的程度,进而间接反映细胞损伤程度[8];SOD为抗氧化系统中重要一员,可清除氧自由基阻断其对机体造成的损害[9]。本研究结果发现IR组大鼠肾组织8-OHdG、MDA含量升高、SOD活性降低,提示IR所致肾损伤与肾脏氧化应激水平有关。
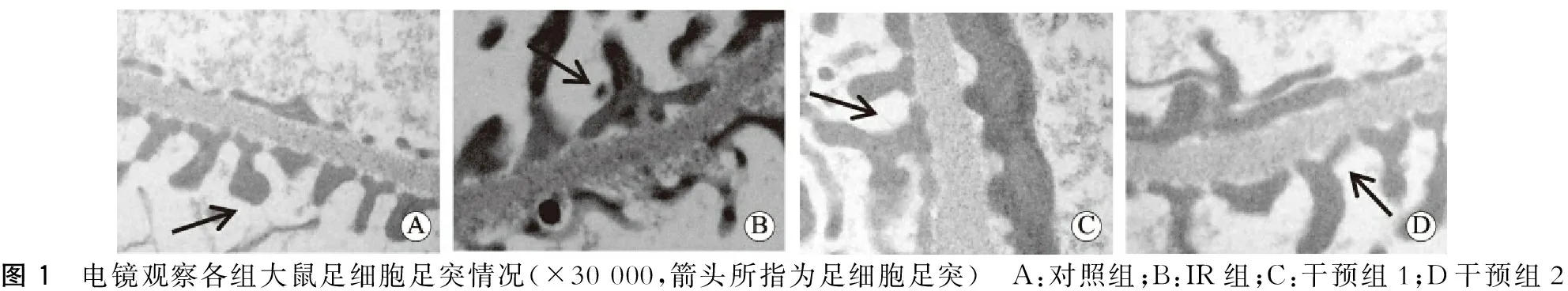
图1 电镜观察各组大鼠足细胞足突情况(×30000,箭头所指为足细胞足突) A:对照组;B:IR组;C:干预组1;D干预组2
GLP-1受体激动剂利拉鲁肽是一种新型降糖药物,药理浓度作用体内GLP-1受体,呈葡萄糖依赖模式刺激胰岛素的分泌,因其独特降糖机制和广泛的胰腺外效应备受关注[10]。近几年基础及临床研究证实,利拉鲁肽对肾脏的保护作用,如增加尿钠排出、减少尿蛋白等,但具体机制尚不明确[11-12]。本实验通过高脂饮食诱导IR大鼠模型,并给予利拉鲁肽药物进行干预,结果发现大鼠GIR下降、IR减轻,肾脏组织学改变得到改善,肾功能有所恢复,尿蛋白明显减少,证实利拉鲁肽对IR大鼠肾脏具有保护作用。而利拉鲁肽干预组大鼠肾组织SOD表达升高,8-OHdG、MDA表达减少,证实了利拉鲁肽明显降低肾脏氧化应激水平且效应呈一定浓度依赖性。
Shiraki等[13]在体外细胞实验中发现,利拉鲁肽通过促进SOD、过氧化氢酶、谷胱甘肽过氧化物酶的表达从而减轻肿瘤坏死因子α导致的氧化应激及炎症反应。Hendrato等[14]利用利拉鲁肽干预1型糖尿病大鼠,结果发现大鼠体内氧化应激水平明显减轻,尿蛋白水平也明显减少,因此推测利拉鲁肽可能具有改善糖尿病大鼠氧化应激的直接效应,且该效应不依赖于血糖浓度。Shimoda等[15]在糖尿病大鼠模型中发现利拉鲁肽通过抑制体内氧化应激水平而减少β细胞的凋亡。此研究和上述研究结果一致,具体机制有待进一步研究。
综上所述,IR可导致肾脏损伤且氧化应激参与此过程。利拉鲁肽具有抗氧化作用,可能通过降低肾脏部位氧化应激水平,即降低肾组织8-OHdG、MDA表达水平,上调肾组织SOD表达水平,从而起到对肾脏的保护作用。然而利拉鲁肽又是通过何种路径调控肾脏氧化应激水平,相关机制仍需我们进一步研究。
[1] Liao MT1, Sung CC, Hung KC. Insulin resistance in patients with chronic kidney disease[J]. J Biomed Biotechnol, 2012, 8(7): 691369.
[2] Sahoo S, Meijles DN, Pagano PJ. NADPH oxidases: key modulators in aging and age-related cardiovascular diseases?[J]. Clin Sci (Lond), 2016, 130(5): 317-335.
[3] Nistala R, Whaley-Connell A. Resistance to insulin and kidney disease in the cardiorenal metabolic syndrome;role for angiotensin II[J]. Mol Cell Endocrinol, 2013, 378(1-2): 53-58.
[4] Nagaraj M,Mandakini Pl,Jeffrey L,et al.RhoA/Rho kinase mediates TGF-β1-induced kidney myofibroblast activation through Poldip2/Nox4-derived reactive oxygen species[J]. Am J Physiol Renal Physiol, 2014, 307(2): F159-F171.
[5] Nikooyeh B, Neyestani TR.Oxidative stress, type 2 diabetes and vitamin D: past, present and future[J]. Diabetes Metab Res Rev, 2016, 32(3): 260-267.
[6] Faria AM, Papadimitriou A, silva KC, et al. Uncoupling endo-thelial nitric oxide synthase is ameliorated by green tea in ex-perimental diabetes by re-establishing tetrahydrobiopterin lev-els[J].Diabetes, 2012, 61: 1838-1847.
[7] Ock CY, Kim EH, Choi DJ, et al. 8-Hydroxydeoxyguanosine: Not mere biomarker for oxidative stress, but remedy for oxidative stress-implicated gastrointestinal diseases[J]. World J Gastroenterol, 2012, 18(4): 302-308.
[8] Poljsak B, Suput D, Milisav I. Achieving the Balance between ROS and Antioxidants: When to Use the Synthetic Antioxidants[J]. Oxid Med Cell Longev, 2013, 4(29): 956792.
[9] Batinic-Haberle I, Tovmasyan A, Roberts ER, et al. SOD Therapeutics: Latest Insights into Their Structure-Activity Relationships and Impact on the Cellular Redox-Based Signaling Pathways [J]. Antioxid Redox Signal, 2014, 20(15): 2372-2415.
[10]刘剑, 吴明昊, 高宇. 肠促胰素分泌分子机制的研究进展[J]. 世界华人消化杂志, 2015, 23(16): 2582-2587.
[11]Skov J. Effects of GLP-1 in the Kidney[J].Rev Endocr Metab Disord, 2014, 15(3): 197-207.
[12]von Scholten BJ, Hansen TW, Goetze JP, et al. Glucagon-like peptide 1 receptor agonist (GLP-1 RA):long-term effect on kidney function in patients with type 2 diabetes[J]. J Diabetes Complications, 2015, 29(5): 670-674.
[13]Shiraki A, Oyama J, Komoda H, et al. The glucagon-like peptide analog liraglutide reduces TNF-alpha-induced oxidative stress and inflammation in endothelial cells[J]. Atherosclerosis, 2012, 221(2): 375-382.
[14]Hendarto H, Inoguchi T, Maeda Y, et al. GLP-1 analog liraglutide protects against oxidative stress and albuminuria in streptozotocin-induced diabetic rats via protein kinase A-mediated inhibition of renal NAD(P)H oxidases[J]. Metabolism, 2012, 61(10): 1422-1434.
[15]Shimoda M, Kanda Y, Hamamoto S, et al. The human glucagon-like peptide-1 analogue liraglutide preserves pancreatic beta cells via regulation of cell kineticsand suppression of oxidative and endoplasmic reticulum stress in a mouse model of diabetes[J]. Diabetologia, 2011, 54(5): 1098-1108.
Effects of liraglutide on 8-OHdG, MDA and SOD of kidney in insulin resistance rats
WUMing-hao*,LIUJian,HUGui-cai,GAOYu,ZHANGBao-hong,ZHOUJin,ZHAOYa-juan.
*ChengdeMedicalCollege,Chengde067000,China
HUGui-cai,E-mail:cdguicaihu@126.com
Objective To observe the effects of liraglutide on 8-OHdG, MDA and SOD of kidney in insulin resistance (IR) rats.Methods According to random number table method, 54 Wistar male rats were divided into normal control group (normal diet) and IR model group (high fat diet). IR was evaluated by hyperinsulinemic euglycemic clamp technique after 8 weeks. After IR rat models were successfully established, the animals in high fat diet group were randomly divided into IR group, intervention group 1 (liraglutide: 100 μg·kg-1·day-1), and intervention group 2 (liraglutide: 200 μg·kg-1·day-1). After treatment for 2 weeks with liraglutide, SCr, BUN, 24-h urine protein, and 8-OHdG, MDA and SOD in the renal tissues were determined. The morphology and structure in the renal tissues were observed by electron microscope.Results As compared with control group, the levels of SCr, BUN, 24-h urine protein, 8-OHdG, and MDA were significantly increased in IR group (8-OHdG: 32.81±2.96 ng/L vs. 13.30±1.72 ng/L; MDA: 7.7±1.0 nmol/mg vs. 3.3±0.4 nmol/mg, allP<0.05) and the expression of SOD was decreased (175.0±7.7 U/mg vs. 237.1±12.4 U/mg,P<0.05). As compared with the IR group, 24-h urine protein, 8-OHdG and MDA were decreased in intervention group 1 (8-OHdG: 28.54±2.71 ng/L vs. 32.81±2.96 ng/L; MDA: 6.6±1.0 nmol/mg vs. 7.7±1.0 nmol/mg,P<0.05); SCr, BUN, 24-h urine protein, MDA and 8-OHdG were decreased (8-OHdG: 20.06±1.65 ng/L vs. 32.81±2.96 ng/L; MDA: 5.7±0.5 nmol/mg vs 7.7±1.0 nmol/mg, allP<0.05) and SOD was increased in intervention group 2 (216.1±10.6 U/mg vs. 175.0±7.7 U/mg,P<0.05). As compared with the intervention group 1, SCr, BUN, 24-h urine protein, MDA and 8-OHdG were decreased (allP<0.05) and SOD was increased in intervention group 2 (P<0.05).Conclusions Liraglutide could decrease the kidney oxidative stress in a concentration-dependent manner, which may be one of the reasons for the renal injury induced by IR.
Liraglutide; Insulin resistance; 8-hydroxydeoxyguanosine; Malonaldehyde; Superoxide dismutase
10.3969/j.issn.1671-2390.2017.03.010
067000 河北承德,承德医学院研究生学院(吴明昊,刘剑);067000 河北承德,承德医学院附属医院肾脏内科(胡桂才,张宝红,周瑾,赵亚娟),内分泌科(高宇)
胡桂才,E-mail:cdguicaihu@126.com
2016-04-10
2016-11-07)

