紫外诱变选育大肠杆菌营养缺陷型菌株的研究
宁祎 李基丽 道吉吉 王春台 刘新琼
摘要:营养缺陷型是一种生化突变株,它的出现是由基因突变引起的。营养缺陷型菌株在遗传学、食品生物技术、微生物代谢等领域的研究中均具有重要作用,另外它还是研究基因的结构与功能的常用材料。该研究以大肠杆菌(Escherichia coli)菌株DH5a为实验材料,利用紫外线(uv)对其进行诱变,并且采用青霉素法浓缩营养缺陷型细菌,采用逐个测定法检出营养缺陷型,利用生长谱法对缺陷型菌株进行鉴定、分析,得到了4株稳定的营养缺陷型突变株,分别为赖氨酸、组氨酸、精氨酸和嘧啶营养缺陷型菌株。
关键词:大肠杆菌;营养缺陷型;紫外诱变
微生物是遗传学研究中常用的材料,常用多种方法诱发其基因突变进行遗传育种,并且突变频率远远超过自发突变。诱变剂主要包括物理诱变剂和化学诱变剂两大类,物理诱变剂有紫外线、X-射线、γ射线、a射线,微生物诱变中常用紫外线(uv)进行物理诱变。DNA对紫外线有强烈的吸收作用,尤其是碱基中的嘧啶,紫外线能使同链DNA分子的相邻嘧啶间形成胸腺嘧啶二聚体,结构发生改变,阻碍碱基正常配对,阻碍DNA的复制或引起碱基排列顺序的变化,导致遗传基因发生变异,从而产生突变或死亡。
大肠杆菌由于其结构简单,遗传背景已研究清楚,是遗传学和分子生物学研究的极好材料。大肠杆菌紫外诱变和营养缺陷型菌株的选育,是遗传学实验中的一个重要实验,通常情况下在本科生课堂开设该实验,按照传统的方法,很难得到理想的实验结果。为此,笔者在多年教学的实践基础上,摸索出了一套成熟的实验方法,能够得到稳定的营养缺陷型菌株。
1.材料与方法
1.1出发菌种 大肠杆菌(Escherichia coli)菌株:DH5a。
1.2培养基 肉汤液体培养基:牛肉膏5g,蛋白胨10g,NaCl 5g,超纯水1 000mL,pH7.2,0.103 5mPa高压灭菌15min。加倍肉汤液体培养基:牛肉膏6g,蛋白胨20g,Nacl 30g,超純水1 000mL,0.103 5mPa高压灭菌15min。基本固体培养基(g/L):七水硫酸镁0.2g,柠檬酸钠2g,四水磷酸氢铵钠3.5g,磷酸氢二钾10g,葡萄糖20g,琼脂20g,超纯水1 000mL,pH7.0,0.055mPa高压灭菌30min。基本液体培养基:七水硫酸镁0.2g,柠檬酸钠2g,四水磷酸氢铵钠3.5g,磷酸氢二钾10g,葡萄糖20g,超纯水1 000mL,pH 7.0,0.055mPa高压灭菌30min。无氮基本液体培养基(g/L):七水硫酸镁0.2g,柠檬酸钠2g,磷酸氢二钾10g,葡萄糖20g,超纯水1000mL,pH 7.0,0.055mPa高压灭菌30rain。2倍氮基本液体培养基:七水硫酸镁0.2g,柠檬酸钠2g,磷酸氢二钾10g,硫酸铵2g,蛋氨酸0.2g,葡萄糖20g,超纯水1 000mL,pH 7.0,0.055mPa高压灭菌30min。固体完全培养基:牛肉膏5g,蛋白胨10g,NaCI 5g,超纯水1 000mL,琼脂20g,0.103 5 mPa高压灭菌15min。
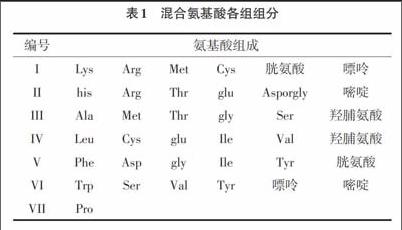
1.3主要试剂 20种基本氨基酸、7种维生素(硫胺素、核黄素、吡哆醇、泛酸、对氨基苯甲酸、烟酰胺、生物素)、嘌呤、嘧啶、青霉素钠盐、冰醋酸、乙酸钠、氢氧化钠、硫酸镁、蔗糖、生理盐水、0.1mol/L醋酸缓冲液(pH4.0)、0.1tool/L NaOH。混合氨基酸(包括核苷酸)共分7组,其中第1组到第VI组各有6种氨基酸(包括核苷酸),每种氨基酸(包括核苷酸)等量充分混合,第VII组为脯氨酸,因容易潮解,故单独组成。各组具体组成如表1所示。混合维生素:把硫胺素、核黄素、吡哆醇、泛酸、对氨基苯甲酸、烟氨酸及生物素等研细.充分混合即可。
1.4菌液制备
1.4.1菌体的活化与培养 实验前14-16h,挑取少量DH5a菌体,接种于盛有5mL肉汤培养液的三角瓶中,37℃培养过夜。第2天添加5mL新鲜的肉汤培养液,充分混匀后继续培养3-5h。
1.4.2收集菌体 将活化的菌体菌液取5mL倒入离心管中,3 500r离心10min,弃去上清液,吸入5mL生理盐水,打匀沉淀形成悬液。
1.5紫外线诱变处理 处理前先开紫外灯(15W)稳定30min,然后吸取菌液3mL均匀的涂布于培养皿内,置于紫外灯下,距灯管28.5cm处;先连盖在紫外灯下灭菌1min,然后开盖处理1min(处理时间依70%的杀菌率而定);照射后先盖上皿盖,再关紫外灯并注意避光。吸取3mL加倍肉汤培养液,注入处理后的培养皿中,37℃恒温箱内避光培养18h。
1.6突变型的筛选与检出
1.6.1青霉素法淘汰野生型 吸取5mL处理菌液于灭菌离心管中,3 500r离心10min。弃上清液,加人生理盐水,打匀沉淀,离心洗涤3次,加生理盐水至原体积。吸取菌液0.1mL于5mL无氮基本培养液中,37℃培养12h。加入等体积2倍氮基本培养液,并加入青霉素钠盐使最终浓度约为1 000单位/mL,达到杀死野生型,浓缩缺陷型的目的。培养12、16、24h时分别取菌液0.1mL,涂布基本及完全培养基,置37℃恒温箱中培养。
1.6.2逐个测定法检出营养缺陷型 以上平板培养36-48h后,进行菌落计数。选用完全培养基上长出的菌落数大大超过基本培养基的那一组,用牙签挑取完全培养基上长出的菌落100个,分别先点种基本培养基,后点种完全培养基,置于37℃恒温箱中培养。培养12h后,选择在基本培养基上不生长,而在完全培养基上生长的菌落,再在基本培养基的平板上划线,置于37℃恒温箱培养。24h后不生长的可能是营养缺陷型。
1.7生长谱鉴定
1.7.1突变菌株的培养与收集 将可能是缺陷型的菌落接种于盛有5mL肉汤培养液的离心管中,37%培养14-16h。培养后,3 500r离心10min,倒去上清液,加生理盐水,打匀沉淀,然后离心洗涤3次,最后加生理盐水到原体积。
1.7.2营养缺陷型的鉴定 吸取经离心洗涤的菌液150uL涂布于基本固体培养基中。将培养皿底等分8格并标记,依次取5uL各组混合氨基酸(包括核苷酸)、混合维生素和脯氨酸分别滴于平板每格的中央。然后置于37℃恒温箱培养24-48h,观察生长圈,当某一格内出现圆形混浊的生长圈时,即说明是某一氨基酸、维生素或核苷酸的缺陷型。
2.结果与分析
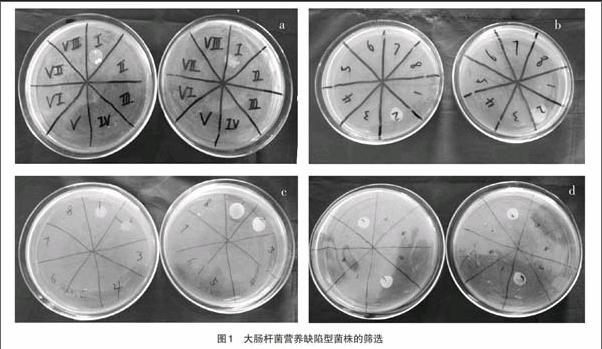
大肠杆菌菌株DH5a经紫外诱变处理,通过青霉素法淘汰野生型,进行生长谱测定,分别用8组不同的混合氨基酸和维生素等进行筛选,得到了4株不同营养缺陷型的突变菌株(图1)。如图1-a,在2个重复的补充培养基上,分别在I号区域长出了菌落,根据营养成分的比较,发现该菌株为赖氨酸营养缺陷型菌株。如图1-b,在2个重复的补充培养基上,分别在Ⅱ号区域长出了菌落,通过营养成分的比较,推定该菌株为组氨酸营养缺陷型菌株。如图1-c,在2个重复的补充培养基上,分别在I号和Ⅱ号区域同时长出了菌落,通过营养成分的比较,推定该菌株为精氨酸营养缺陷型菌株。如图1-d,在2个重复的补充培养基上,分别在II号和VI号区域同时长出了菌落,通过营养成分的比较,推定该菌株为嘧啶营养缺陷型菌株。
3.讨论
大肠杆菌诱变处理与营养缺陷型筛选是普通遗传学实验中的一个重要实验,大肠杆菌诱变处理的方法很多,但常用物理方法诱变处理,由于诱变之后的菌株所占的比例相当小,必须淘汰野生型的大肠杆菌菌株而筛选突变的菌株。细菌中常用的筛选方法是青霉素法,青霉素是一种杀菌剂,能够抑制细胞壁的合成,从而可以杀死正在生长的大肠杆菌,而对不生长的大肠杆菌则没有致死作用,因此,在含有青霉素的基本培养基中,野生型大肠杆菌能生长而被杀死,突变之后的菌株不能生长可被保存。随后采用逐个测定法检出营养缺陷型,并用生长谱法鉴定被初步确定为营养缺陷型的菌株,最终筛选营养缺陷型菌株。本研究利用紫外诱变处理,诱变处理的过程中防止光修复的产生,并且对辐射的距离和时间进行了优化,其间经过严格的筛选,获得了4种不同的营养缺陷型菌株,结果通过进一步验证,表现稳定。

