溶胶-凝胶法制备Eu3+-Ce3+共掺杂TiO2及光催化性能
徐晓虹,叶 芬,吴建锋,宋 佳,张乾坤,王东斌
(武汉理工大学材料科学与工程学院,湖北 武汉 430070)
溶胶-凝胶法制备Eu3+-Ce3+共掺杂TiO2及光催化性能
徐晓虹,叶 芬,吴建锋,宋 佳,张乾坤,王东斌
(武汉理工大学材料科学与工程学院,湖北 武汉 430070)
采用溶胶-凝胶法制备了Eu3+-Ce3+共掺杂TiO2纳米粉体,以亚甲基蓝溶液为目标降解物、用正交试验方法考察了内部因素和外部因素对掺杂样品的光吸收和光催化性能的影响,同时采用XRD、FE-SEM、UV-Vis吸收谱等表征了样品结构与性能。结果表明,最佳的实验方案是热处理温度为550 ℃、Ce3+的掺杂量为0.02mol%、Eu3+的掺杂量为0.2mol%,最佳的外部环境是共掺杂TiO2纳米粉体光催化剂加入量为0.15 g/50 mL、亚甲基蓝溶液的初始pH值及浓度分别为6.5和10 mg/L。样品的晶粒尺寸在20 nm左右,共掺样品的光催化率明显比单掺和未掺样品的高,且吸收边向可见光红移了53nm左右。共掺样品对亚甲基蓝降解反应符合一级动力学模式。共掺样品光催化率的提高归因于Eu3+和Ce3+的协同作用,一方面增加有效的空穴电子数;另一方面可使样品吸收更低能量的波长而被激发。
溶胶-凝胶法;Eu3+-Ce3+共掺;光催化性;TiO2纳米粉体;亚甲基蓝;正交试验
0 引 言
随着现代印染工业和化学工业的快速发展,水环境的污染日益严重,已引起了高度关注[1]。目前,处理废水的方法很多,其中光催化氧化法在处理水体污染方面有着巨大的应用潜力[2]。光催化氧化法就是利用半导体的特性,在光的照射下吸附光子起催化剂的作用,生成反应基氧化有害化合物,并使之矿化,把有害化合物分解为二氧化碳、水和无机盐。作为半导体光催化剂中的TiO2纳米光催化剂最具有应用前景,但由于TiO2是宽禁带半导体[3],光能利用率低,只能吸收利用占地球表面太阳光的3-4%的紫外光。而占太阳光谱中绝大多数的可见光部分(能量约占45%)未得到有效利用,从而阻碍了其实际应用。
对光催化材料进行改性是提高光催化活性和光催化效率的有效途径之一[4]。研究发现,稀土共掺是提高TiO2的光催化活性的一种有效途径。稀土元素因为具有f电子,易产生多电子组态,其氧化物也具有多晶型、强吸附选择性、热稳定性好和电子型导电性等特点[5]。本实验采用Eu3+和Ce3+共掺对纳米TiO2进行改性,Ce3+的主要吸收光谱在252.0 nm以下。而Eu3+的主要吸收光谱为375.5、391.1 nm,本实验拟以Eu3+为敏化粒子、Ce3+为激发粒子,协同提高纳米TiO2光催化活性。正交试验的优点是可根据选出少数几个具有代表性的试验方案的结果分析,推断出最优的实验方案,并作进一步分析,提取出更丰富的信息[6]。本研究中分别就内部因素和外部因素对样品的光催化性能的影响设计了两个正交实验。
1 实 验
1.1 掺杂纳米TiO2的制备
利用正交表L9(33)从27个试验点中挑选出9个试验点进行试验,具体试验方案如表1和表2所示。依据表3和表4所示试验方案制备各样品,制备方法为取10 mL钛酸丁酯与20 mL的无水乙醇混合均匀,制成溶液a;将10 mL无水乙醇、5 mL冰醋酸、1.6 mL去离子水和1 mL PEG400混合均匀,并取一定量的硝酸铕和硝酸铈晶体加入其中,完全溶解后将其转移至磁力搅拌器上搅拌30 min,制得溶液b。边搅拌边将a溶液逐滴加入到溶液b中,滴加完毕后继续搅拌2 h形成均匀的掺杂TiO2溶胶。室温下在密封的烧杯中置放陈化3d形成湿凝胶;将湿凝胶置于100 ℃恒温干燥箱中24 h,烘干后得到干凝胶,充分研磨成细粉;将干凝胶粉置于程序控温炉以3 ℃/min热处理至550 ℃(2 h),即得掺杂TiO2样品。采用同样的方法改变b溶液,不加入掺杂离子,制备纯的TiO2纳米粉体。实验所用化学药品均为分析纯试剂(国药集团)。

表1 内部因素的正交试验因素水平表Tab.1 Factors and levels of internal factors

表2 外部因素的正交试验因素水平表Tab.2 Factors and levels of external factors
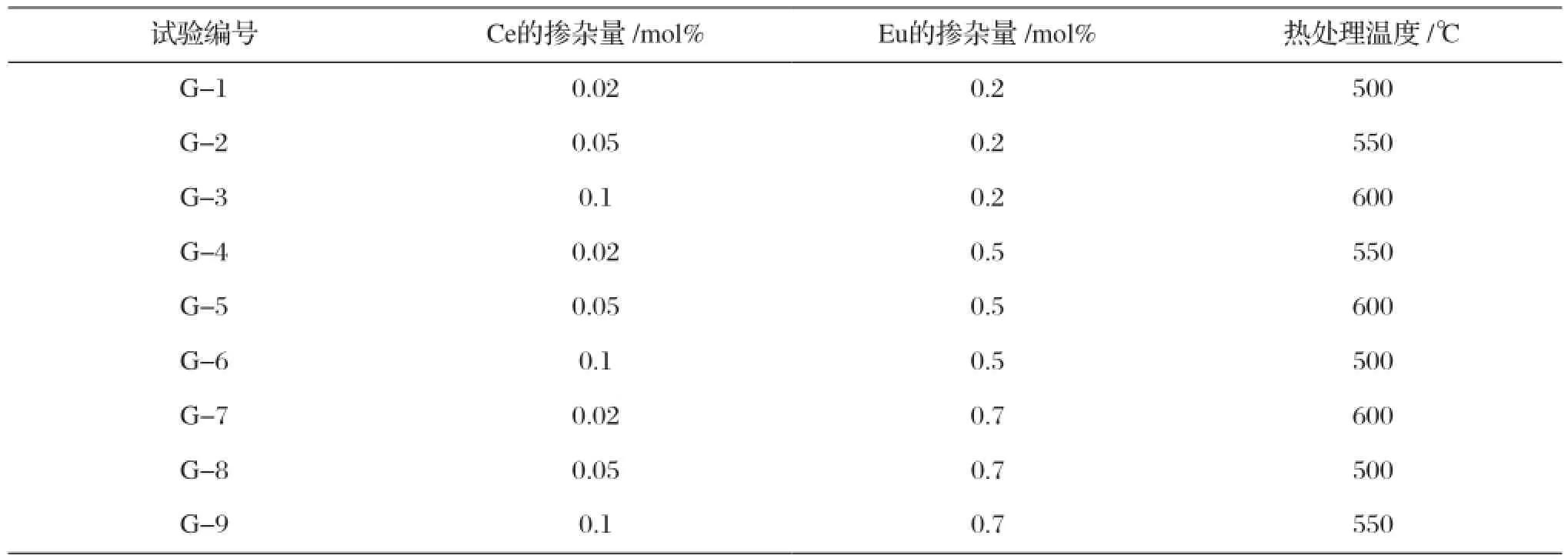
表3 内部因素正交试验的试验方案Tab.3 The orthogonal experiment scheme of internal factors
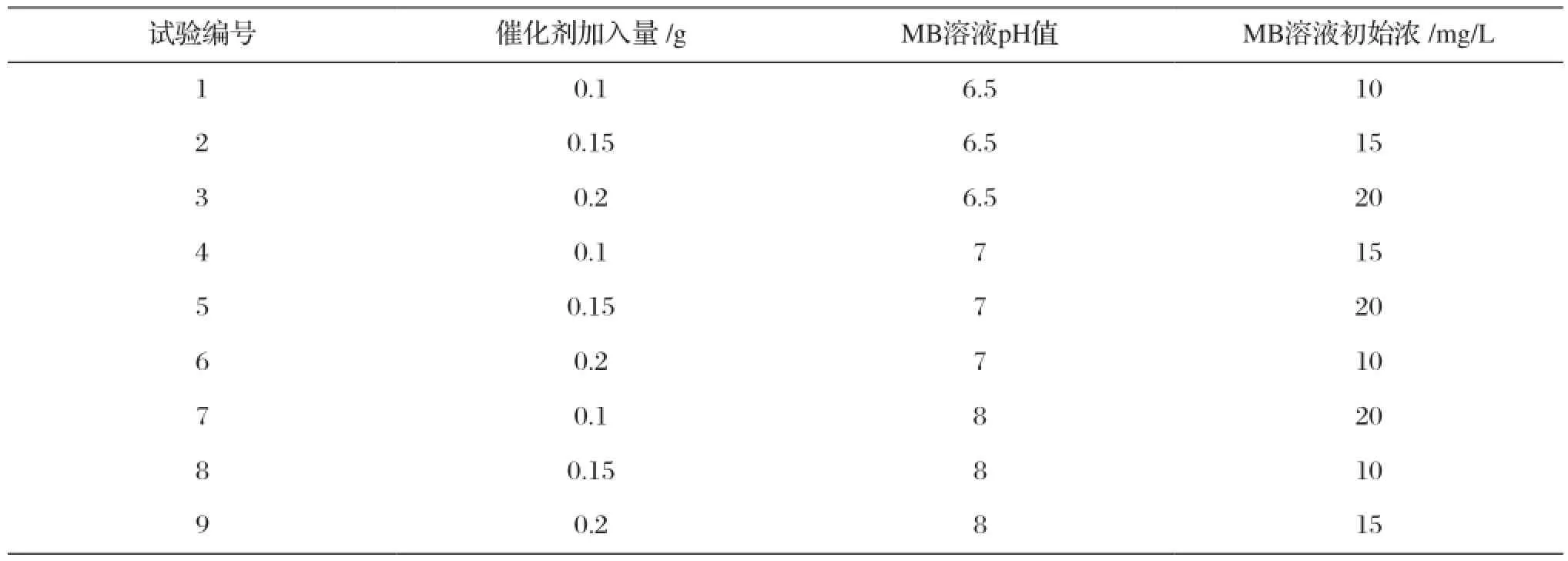
表4 外部因素正交试验的试验方案Tab.4 The orthogonal experiment scheme of external factors
1.2 光催化试验
光催化降解试验是在武汉理工大学制造的反应器中进行,配制的亚甲基蓝溶液初始浓度为10 mg/l,溶液pH值控制在6.5左右,将纯TiO2和掺杂TiO2粉末分别加入到亚甲基蓝溶液,避光环境下超声波分散20 min,达到吸附平衡,采用15 w紫外灯照射,紫外灯离液面的距离固定在15 cm。每隔20 min进行取样,用北京瑞利UV-1601型紫外分光光度计测定溶液在200-800 nm波长范围内的吸收谱,并选取吸收谱中最大吸收峰664 nm处的吸光度计算TiO2光催化剂对亚甲基蓝溶液的降解率:
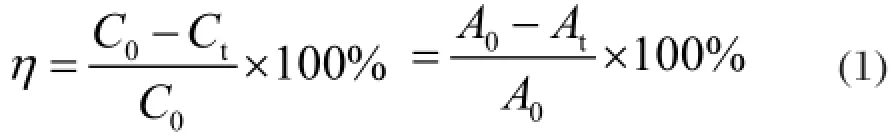
根据朗伯-比耳定律,在低浓度时溶液浓度与吸光度呈良好的线性关系。因此,可用相对吸光度值的变化来表征降解过程中亚甲基蓝浓度的变化,即降解率。式(1)中,Ct、At分别为t时刻亚甲基蓝溶液的浓度(mg/L)和吸光度(%);C0、A0分别为亚甲基蓝溶液的初始浓度(mg/L)和吸光度(%)。由于亚甲基蓝溶液在紫外灯照射下会分解,因此在做实验的同时作了相应的空白试验,以减少对实验结果的影响。
1.3 结构与性能表征
差热-热重分析(TG-DTA)采用武汉理工大学制造的综合热分析仪(参比为A12O3,升温速率为10 ℃/min)及热重仪测定;XRD采用荷兰帕纳科日本理学(Rigaku)公司生产的D-MAX/ⅢA型X射线衍射仪;FE-SEM研究采用的是日本Hitachi公司生产的S-4800型场发射扫描电镜分析;UV-Vis吸收谱采用日本岛津(SHIMADZU)公司生产的UV-2550型紫外-可见光谱仪来测量样品的紫外-可见光吸收光谱,以BaSO4作为曲线的校正标准来测试。
2 结果分析与讨论
2.1 正交试验结果分析
2.1.1 内部因素的正交试验分析
按表3所示实验方案制备各样品,并在亚甲基蓝溶液浓度为15 mg/L,用量为50 mL,pH=6.5,催化剂加入量为0.15 g/50mL的条件下进行光催化降解率的测试,记录数据并进行分析如表5。
由表4的极差分析可知,上述3种内部因素对TiO2光催化活性影响力的大小依次为热处理温度>Ce的掺杂量>Eu的掺杂量。其中,热处理温度对样品光催化效率影响最大,表明样品相组成对光催化率影响最大。
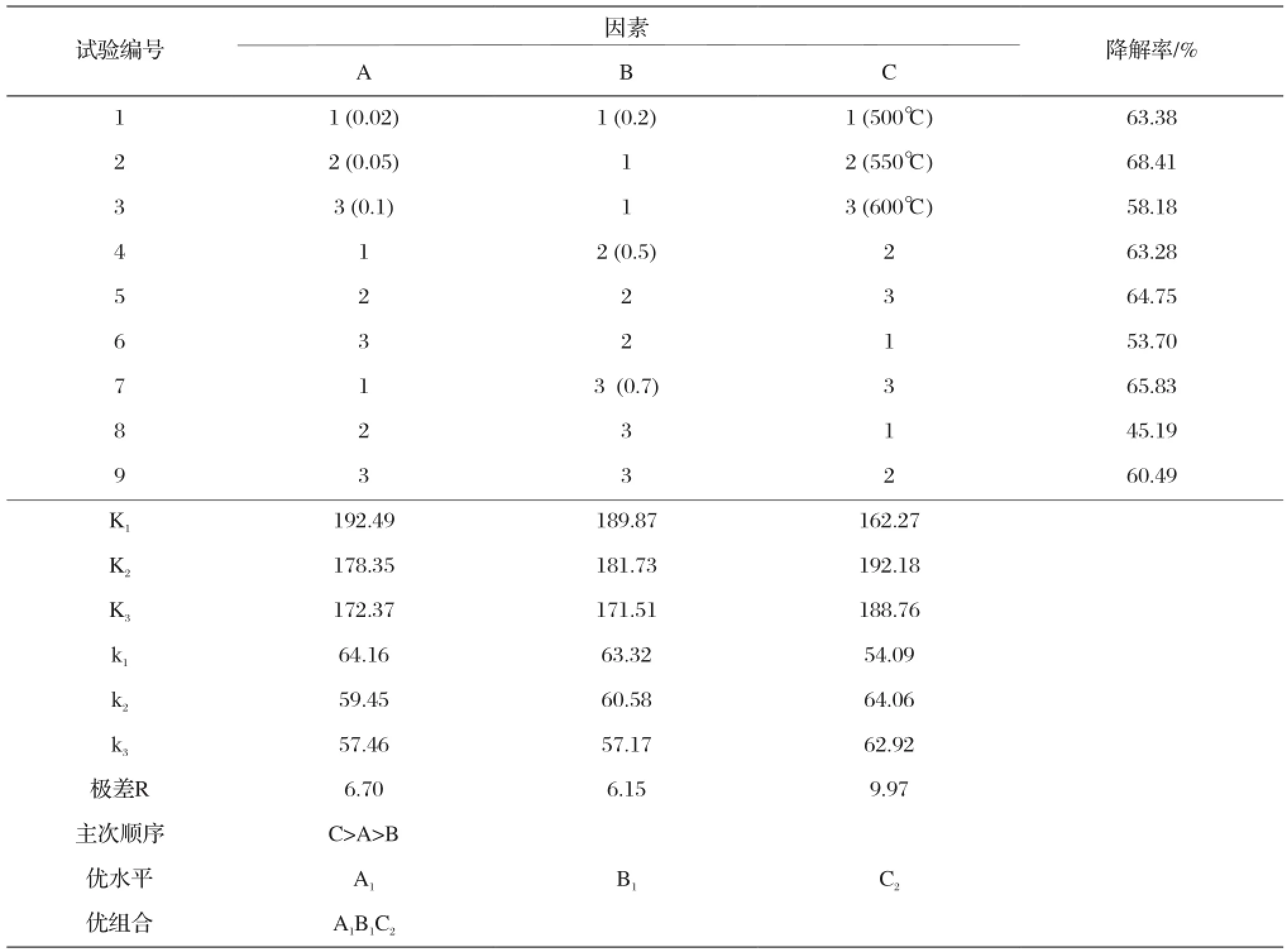
表5 正交试验的试验结果分析 (内部因素)Tab.5 Results analysis of orthogonal experiment (internal factors)
正交试验设计的极差分析简便易行,但精度较差,判断因素的作用时缺乏一个定量的标准,因此需要进一步进行方差分析。方差分析是通过对试验数据的分析,研究因素对试验结果的影响是否显著[7-8]。本试验中没有设置空白列,没有误差的平方和及自由度,原则上难以对试验数据进行方差分析。因此,本试验中可以取各因素中偏差平方和最小值作为误差的偏差平方和Se(如表6中选取因素B作为误差的偏差平方和)。具体分析结果如表6所示。
由于F0.25(2,4)=2.00[9],故因素C作用显著,与前面极差分析的结果一致。由分析可知,各因素作用的主次顺序为:C>A >B。综合极差分析和方差分析的结果优化样品的制备配方为:热处理温度为550 ℃、Ce的掺杂量为0.02mol%、Eu的掺杂量为0. 2mol%。2.1.2 外因素的正交试验分析
依据2.1.1节中得出的优化配方制备样品(标记为G-10:热处理温度为550 ℃、Ce的掺杂量为0.02mol%、Eu的掺杂量为0. 2mol%),进行如表7所示的外部因素对样品光催化活性影响的正交试验,并对其进行极差分析,如表7。
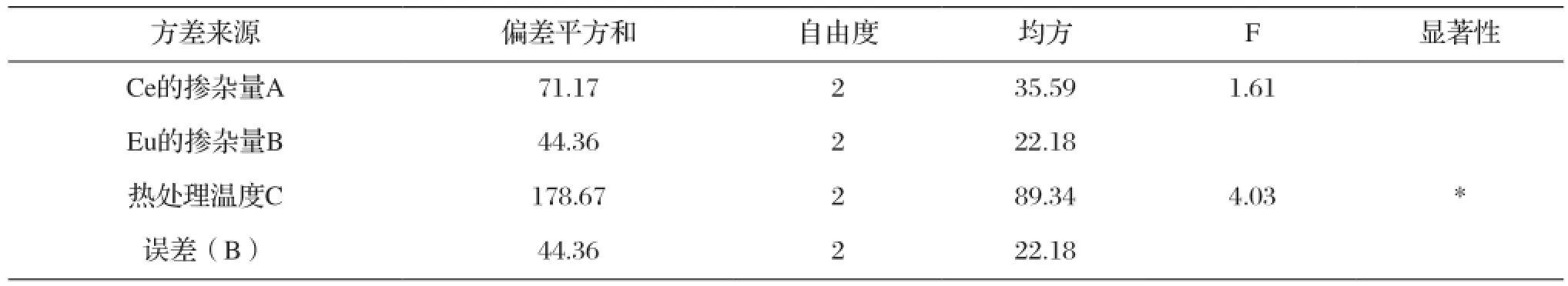
表6 内部因素正交试验的方差分析Tab.6 Variance analysis for orthogonal experiment with internal factors
由表7可知,上述3种外部因素对TiO2光催化活性影响力的大小依次为亚甲基蓝溶液的初始浓度>催化剂的加入量>溶液的pH值。其中,亚甲基蓝溶液的浓度对样品光催化效率影响最大。
表8为对试验数据进行方差分析的结果。由于FA=4.94 >F0.10(2,4)=4.32,FC=13.75 >F0.05(2,4)=6.94,因此,因素C对光催化活性作用显著,A因素对光催化活性有影响,这与前面极差分析的结果一致。
综上分析,本实验条件下,亚甲基蓝溶液的初始浓度和催化剂加入量是影响光催化活性的主要因素。其中亚甲基蓝溶液初始浓度的影响最为显著。对照表7分别比较C、A因素的各水平k值,可确定C和A的优水平分别为C1、A2;B因素影响不明显,为减小试验误差并方便实验操作,选择亚甲基蓝溶液的初始pH值6.5,即水平B1。因此,优化光催化条件为A2B1C1,即:光催化剂加入量为0.15 g/ 50 mL、亚甲基蓝溶液的初始pH值及浓度分别为6.5和10 mg/L。
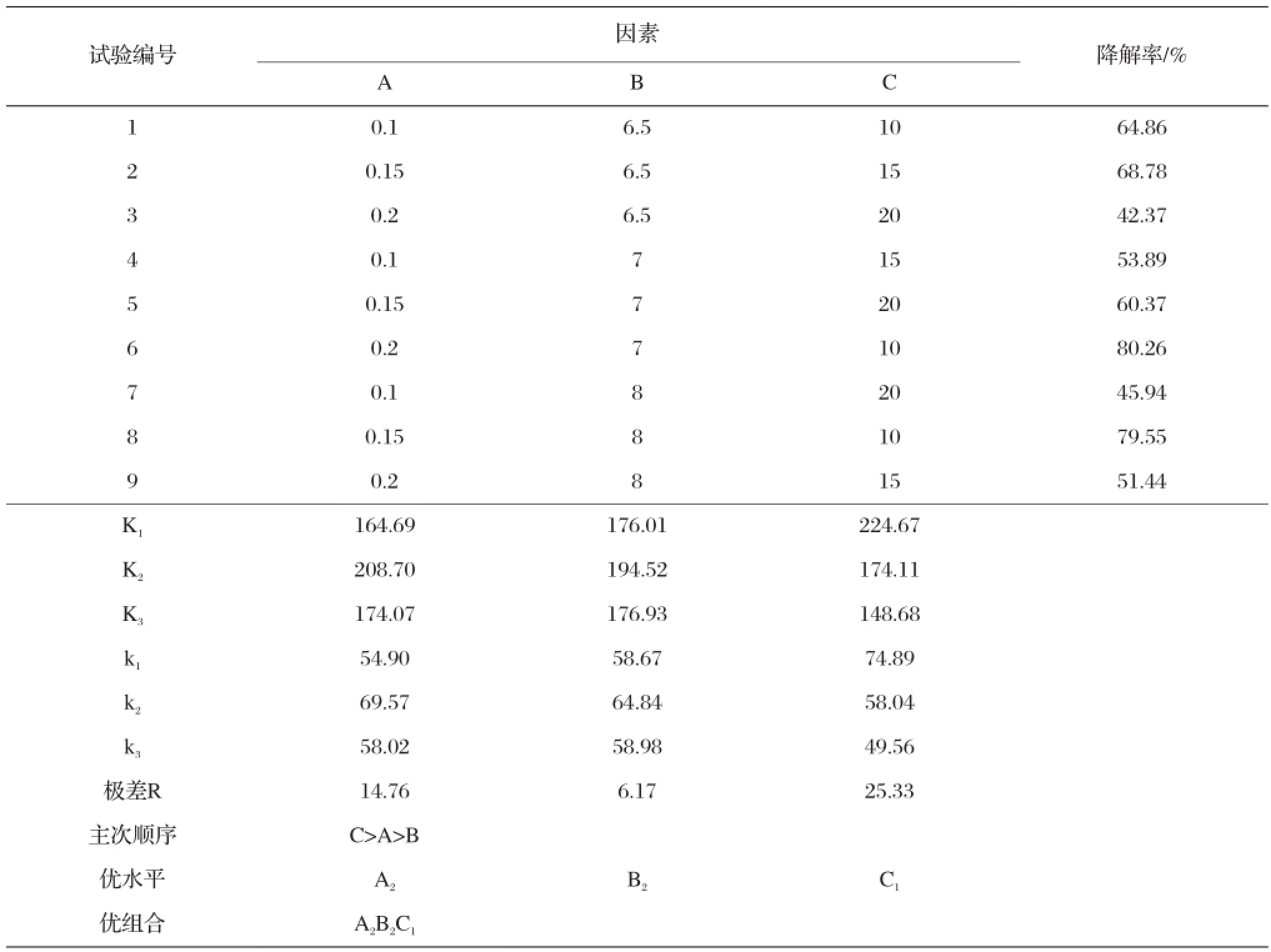
表7 正交试验的试验结果分析 (外部因素)Tab.7 Results analysis of orthogonal experiment (external factors)
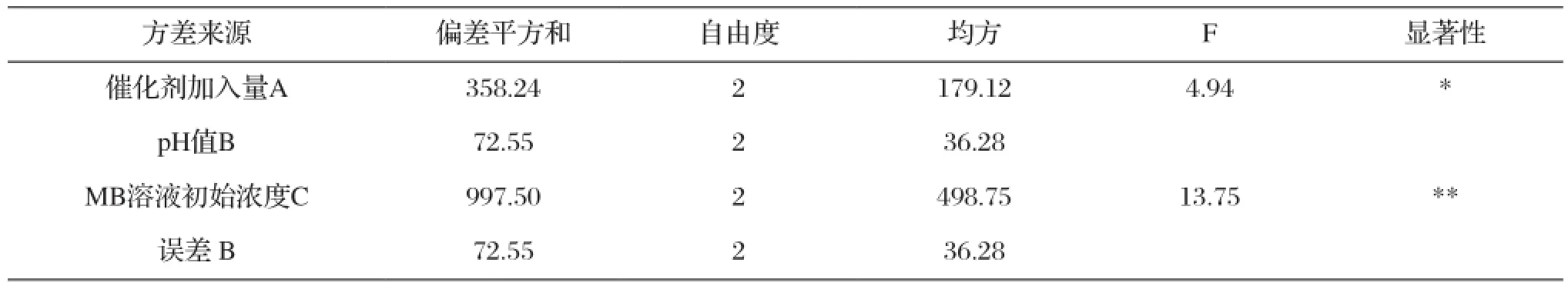
表8 外部因素正交试验的方差分析Tab.8 Variance analysis for orthogonal experiment with external factors
2.2 Ce-Eu共掺杂TiO2的XRD分析
图1是对样品E0/C0、E3、C2以及共掺杂样品G-10进行了XRD分析。根据谢乐公式以及样品的XRD衍射数据计算各样品的晶体学数据,所得结果如表9所示。
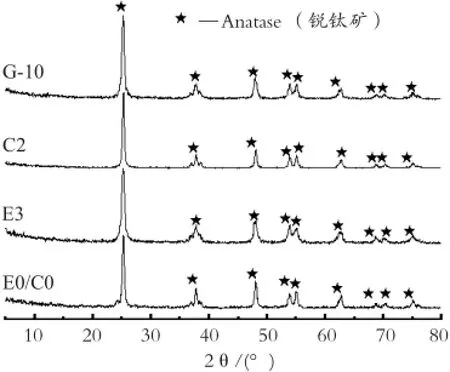
图1 不同样品的XRD图谱Fig.1 XRD patterns of different samples
由图1和表9可知,各掺杂样品经550 ℃热处理2 h后主晶相均为锐钛矿,掺杂样品没有出现与Ce3+、Eu3+相应的氧化物或其它化合物的衍射峰(可能因为Ce3+、Eu3+含量较小不在XRD检测范围),且掺杂后样品的衍射峰强度增大。如表9所示,E0/C0样品的晶粒尺寸为21.5 nm,Eu3+掺杂样品E3及 Ce-Eu共掺杂样品G-10的晶粒尺寸减小分别为18.5 nm和19.7nm,分析原因为掺杂离子均匀分散在TiO2晶格中,引起晶格畸变而降低了TiO2的平均晶粒尺寸。样品C2的晶粒尺寸24.9 nm大于其它几个样品,可能因为Ce3+的掺杂引起溶胶-凝胶的性能变化,进而影响了掺杂TiO2的烧结性能,使得晶粒更容易长大。掺杂后,各样品的晶胞体积均大于E0/C0样品的135.52×10-3nm3。因为Eu3+和Ce3+的半径都大于Ti4+,少数的离子会进入TiO2晶格中,引起不同程度的晶格畸变和晶胞体积的增大。晶格畸变随着晶粒尺寸的减小而增大,这与样品颗粒表面的原子数目及表面能有关。
2.3 Ce-Eu共掺杂TiO2的FE-SEM研究
对经550 ℃热处理2 h的样品G-10进行了FESEM分析,结果如图2所示。由图2可见,样品G-10颗粒呈球形。(d)图中样品颗粒分布比较均匀,由图(b)和(c)可以看出,样品的晶粒尺寸在20 nm左右,与表4-8计算所得的晶粒尺寸19.7 nm基本吻合。另外,在图(a)中可看出有团聚现象,可能因为:①样品颗粒尺寸较小,比表面积较大,表面活性高,颗粒之间自发聚集降低表面能;②少量水分子的存在,使相邻颗粒间的氢键在烧结过程中转化成强度较高的桥氧键而产生团聚。
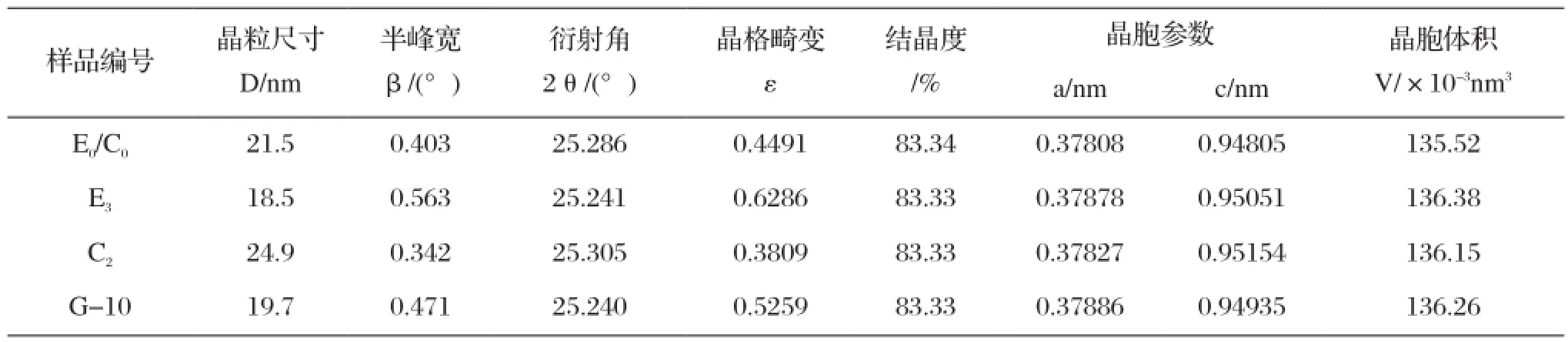
表9 样品的晶体学数据Tab.9 XRD crystallographic data of samples

图2 经550 ℃热处理2h的样品G-10的场发射扫描图像Fig.2 FE-SEM micrographs of sample G-10 fi red at 550°C for 2h
2.4 Ce-Eu共掺杂TiO2的UV-Vis吸收谱分析
对样品E0/C0、E3、C2以及共掺杂样品G-10在200~800nm范围内进行UV-Vis吸收谱分析,结果如图3所示。如图4(a)、(b)所示,用切线法估算掺杂样品的λg和Eg,结果见表10。
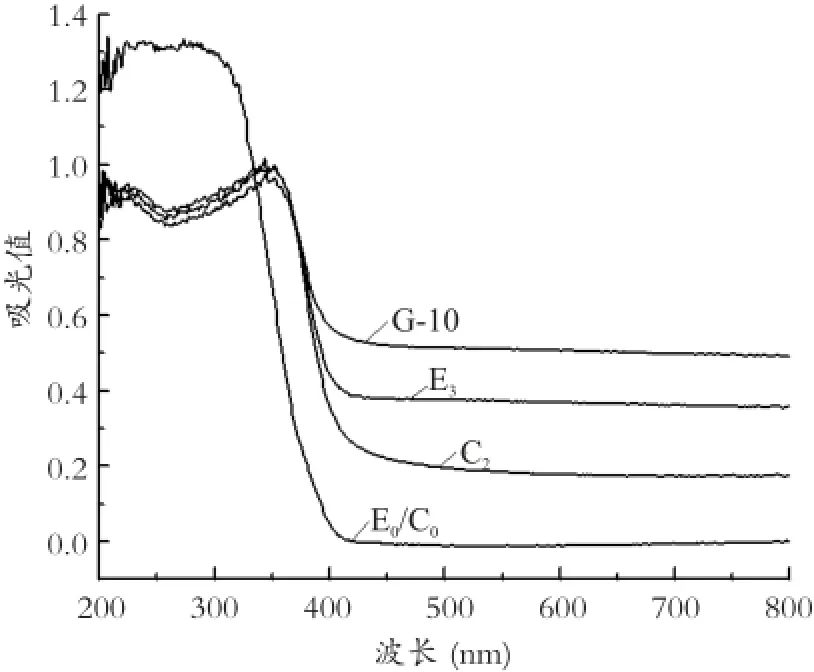
图3 不同样品的吸收曲线Fig.3 Ultraviolet-visible light absorption curves of different samples
结合图3、图4和表10分析,各掺杂样品在200-350 nm附近的近紫外光区吸收强度降低,而在400-750 nm附近的可见光区吸收强度有所增加,与Eu3+和Ce3+与TiO2等作用形成的有机络合物有关。样品E0/C0的吸收阈值λg为392 nm、禁带宽度值Eg 约为3.30 eV,Ce3+、Eu3+掺杂后,样品的吸收边明显向可见光区偏移。E3、C2、G-10样品的λg值分别达到430 nm、434 nm、445 nm。分析其原因,Eu3+掺杂样品E3主要由空位附加能级的作用而使 λg、Eg值分别达到430 nm、2.95 eV;Ce3+掺杂样品C2的λg、Eg值分别达到434 nm、2.97 eV,主要与Ce3+沉积在TiO2表面形成的对TiO2的光敏化结构有关;Ce-Eu共掺杂样品G-10的吸收阈值可达445 nm左右,远远大于纯TiO2样品的392 nm,禁带宽度也由3.3 eV减小至2.87 eV左右,与稀土元素具有丰富的能级和电子跃迁特性有关,魏亚光等[10]学者研究认为Ce3+的5d→4f(2F7/2,2F5/2)与Eu3+的5D0→7F1,2,3,4之间存在能量传递,受激发的Ce3+将一部分电子转移到Eu3+的激发态或是通过无辐射传输将部分能量传递给Eu3+。这就使得掺杂TiO2样品可以吸收更低能量的波长而被激发。另一方面,稀土离子的引入会引起TiO2的配位场的改变从而增强斯塔克效应使禁带变窄[11],扩大了TiO2的光谱响应范围。而赵斯琴等学者研究了Eu3+和Y3+共掺杂的纳米TiO2,发现其吸收曲线出现蓝移现象。
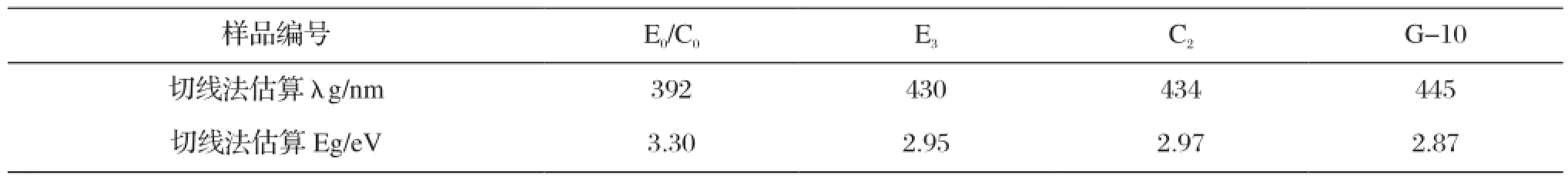
表10 样品的吸收阈值(λg)和禁带宽度值(Eg)Tab.10 Absorption threshold (λg ) and band gap (Eg) of samples

图4 切线法估算样品吸收阈值(λg)和禁带宽度(Eg)Fig.4 Estimation of absorption threshold (λg ) and band gap (Eg) of samples
2.5 Ce-Eu共掺杂TiO2的光催化活性分析
在优化的光催化条件下,光催化剂加入量为0.15 g/50 mL、亚甲基蓝溶液的初始pH值及浓度分别为6.5和10 mg/L,分别对未掺杂样品C0/E0、Eu3+和Ce3+单掺杂样品E3、C2,以及共掺G-10进行光催化活性测试,结果如表11所示。
由表11可知,样品C0/E0的光催化降解率为63.28%,稀土元素Eu3+、Ce3+掺杂后样品E3、C2、G-10的光催化活性明显提高,分别为85.36%、85.15%、86.23%。分析原因,Eu3+和Ce3+的半径分别为0.095 nm、0.103 nm,大于Ti4+半径0.075 nm,会引起TiO2晶格的畸变,这种畸变会对晶粒表面性能产生影响并产生氧空位,使得光生电子-空穴对能够有效分离,提高光催化活性。Ce3+掺杂样品C2的光催化降解率为85.15%,相对E3和G-10较低,可能为Ce3+的半径较大,难以进入晶格,会在表面沉积,减小TiO2的有效表面积;样品G-10的光催化效率最高,可达到86.23%,这是因为Ce3+和Eu3+是一对电子组态具有共轭特性的稀土离子,可能会发生下列反应[12]:
Ce3+(4f1)+Eu3+(4f6)=Ce4+(4f0)+Eu2+(4f7) (2)
即在样品中Ce3+、Ce4+共存,且Ce3+、Ce4+会不断地与陷阱中逃逸出的空穴和电子分别复合,减少了空穴和电子的直接复合从而提高光催化降解率。
2.6 Ce-Eu共掺杂TiO2的光催化反应动力学研究
对未掺杂样品E0/C0、Eu3+和Ce3+单掺杂样品E3、C2,以及共掺G-10进行光催化反应动力学研究。以光催化反应时间t(min)为横轴,以ln(A0/At)为纵轴作图,进行线性拟合,斜率即为各反应的动力学常数。
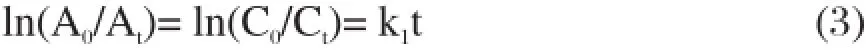
式中,Ct、At分别为t时刻亚甲基蓝溶液的浓度(mg/L)和吸光度(%);C0、A0分别为亚甲基蓝溶液的初始浓度(mg/L)和吸光度(%)。
实验结果如图5和表12所示。
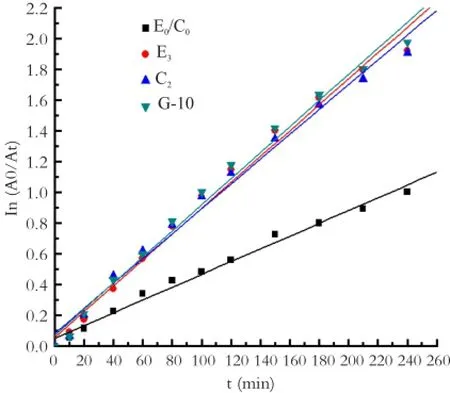
图5 不同稀土掺杂TiO2粉体降解过程ln(Ao/At)~t线性拟合曲线Fig.5 Linear fi t curves (ln(Ao/At)~t) of TiO2powders with different ER-doping
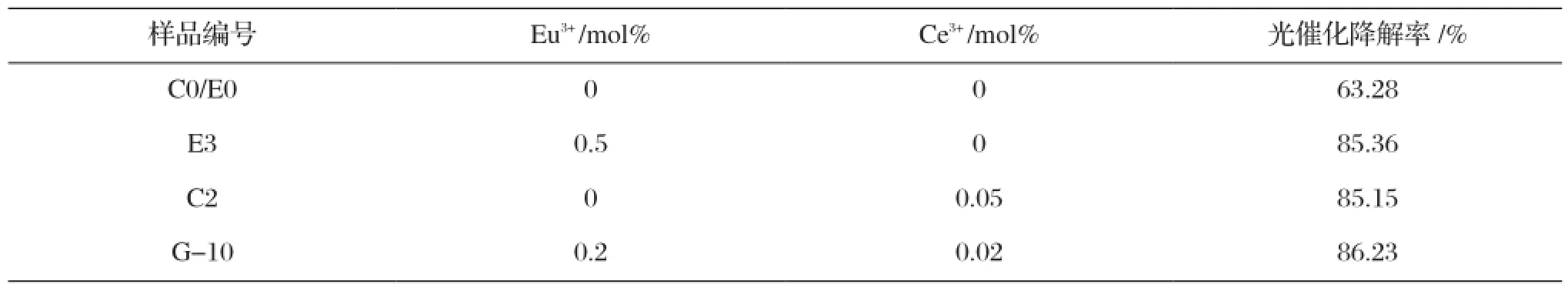
表11 不同样品的光催化活性比较Tab.11 Photocatalytic activity comparison of different samples

表12 不同稀土掺杂TiO2粉体一级动力学常数k1Tab.12 First-order kinetic rate constant k1 of TiO2with different ER-doping
由图5及表12可知,各样品的光催化降解过程均符合一级动力学方程,且线性相关系数较高,大致为0.994。稀土元素Eu3+、Ce3+掺杂后样品E3、C2、G-10的反应动力学常数有显著的提高。结合表11可知,E0/C0样品的光催化降解率为63.28%,其反应动力学常数为3.811×10-3。样品的光催化降解性能与反应的动力学常数相关,降解率越高,反应动力学常数越大,反之亦然。由表12可见,反应动力学常数k1的大小为E0/C0<C2<E3<G-10,表明光催化率Ce-Eu共掺杂>Eu3+单掺杂>Ce3+单掺杂>纯TiO2,Ce-Eu共掺杂样品G-10光催化降解率最高,可达86.23%,其反应动力学常数增大为7.766×10-3。
3 结 论
(1)热处理温度及亚甲基蓝溶液初始浓度对样品光催化效率影响显著,最优的样品制备实验方案为:热处理温度为550 ℃、Ce的掺杂量为0.02mol%、Eu的掺杂量为0.2mol%、光催化剂加入量为0.15 g/50 mL、亚甲基蓝溶液的初始pH值及浓度分别为6.5和10 mg/L。
(2)Ce-Eu共掺杂纳米TiO2样品的主晶相为锐钛矿型,掺杂后样品的衍射峰强度增大。晶粒尺寸为19.7 nm,晶格畸变为0.5259,晶胞体积为136.26×10-3nm3。光催化效率可达到86.23%,比同等条件下制备的未掺杂TiO2提高了22.95%。
(3)样品的光催化反应动力学常数随着降解率的增加而增大,Ce-Eu共掺杂的纳米TiO2样品的动力学常数为7.766×10-3,降解率为86.23%最高,而Eu3+单掺杂纳米TiO2样品的动力学常数为7.583×10-3,Ce3+单掺杂纳米TiO2样品的动力学常数为7.563×10-3,纯纳米TiO2的则为3.811×10-3。
(4)Ce-Eu共掺杂的样品的吸收边向可见光区移动,吸收阈值可达到445 nm左右,禁带宽度减小至2.87 eV左右。与纯TiO2相比,红移了53 nm左右,高出Eu3+单掺杂样品的430 nm,Ce3+单掺杂样品的434 nm。
[1] 吕英英, 顾晓天, 周家宏, 等. N、S共掺杂型二氧化钛光催化降解有机污染物的性能研究[J].南京师范大学学报(自然科学版),2008, 31(4): 69-73.
[2] 杨国营. 光催化氧化法处理污水的研究[J]. 河北化工, 2002(1): 11-12.
[3] CHO Y M, KYUNG H S, CHOI W Y. Visible light activity of TiO2for the photoreduction of CCl4and Cr(Ⅵ) in the presence of nonionic surfactant. Applied Catalysis B: Environmental, 2004, 52: 23-32.
[4] 徐晓虹, 田越, 吴建锋, 等. 稀土复合掺杂纳米TiO2薄膜光催化活性的研究[J]. 武汉理工大学, 2009, 31(11): 36-40.
[5] 李振宏, 伍虹. 我国稀土应用的现状与前景[J]. 稀土, 1996, 17(6): 48.
[6] 北京大学数学力学概率统计组[M]. 正交设计法. 北京: 石油化学工业出版社, 1976: 3-10.
[7] 彭海滨. 正交试验设计与数据分析方法[J]. 计量与测试技术, 2009, 36(12): 38-40.
[8] 李雁, 易永胜, 高全, 等. 高性能化海砂混凝土配合比设计的正交试验研究[J]. 建筑技术, 2010, 41(2): 162-164.
[9] 吴翊, 李永乐, 胡庆军, 等. 应用数理统计[M]. 长沙: 国防科技大学出版社, 2005: 405-414.
[10] 魏亚光, 施朝淑, 戚泽明, 等. Gd2O3: (Ce3+,Eu3+)微晶中稀土离子间的级联能量传递[J]. 发光学报, 2001, 22(3): 243-247.
[11] 陈俊涛, 李新军, 杨莹, 等. 稀土元素掺杂对TiO2薄膜光催化性能的影响[J]. 中国稀土学报, 2003, 21(12): 67-71.
[12] 张献明, 苏海全, 叶泽人, 等. BaY2F8: Ce,Eu中Ce3+→Eu2+的能量传递和Ce3+→Eu3+的电子转移[J].高等学校化学学报, 2001, 22(3): 358-361.
Photocatalytic Properties of Eu3+-Ce3+Co-doped TiO2Nanoparticles by Sol-gel Method
XU Xiaohong, YE Fen, WU Jianfeng, SONG Jia, ZHANG Qiankun, WANG Dongbin
(School of Materials Science and Engineering, Wuhan University of Technology, Wuhan 430070, Hubei, China)
Eu3+-Ce3+co-doped Nano-TiO2was prepared by sol-gel method and the photocatalytic activity under ultra-violet light was evaluated by photocatalytic degradation of methyl blue. The microstructure and performance were characterized by testing techniques such as XRD, FE-SEM, and UV-Vis. The inf l uence of internal and external factors on the photoabsorption and photocatalytic properties of the codoped samples was tested by orthogonal experiments. The results show the optimal conditions are as follows: the doping amounts of Ce3+and Eu3+are 0.02mol% and 0.02mol% respectively; the heating temperature is 550 ℃; the average size is 20nm; the optimal addition amount is 0.15 g/50 mL, the initial concentration is 10mg/L and the pH value is 6.5. The resulted photocatalysis rate of the co-doped samples was better than that of the samples without doping. The co-doped samples cause the red-shift (53 nm) of the optical absorption edge and increase the UV-Vis light absorption. The methyl blue degradation of the co-doped photocatalyst coincides with the fi rst order dynamic equation. The reason for the photocatalysis rate rise was the increase of effective electron and hole, which also excited the sample by helping it absorb lower energy light.
sol-gel method; Eu3+-Ce3+co-doped; photocatalytic degradation; TiO2nanapaticles; methyl blue degradation; orthogonal test
TQ174.75
A
1006-2874(2017)02-0001-09
10.13958/j.cnki.ztcg.2017.02.001
2016-11-05。
2016-11-08。
徐晓虹,女,博士,教授。
Received date:2016-11-05. Revised date: 2016-11-08.
Correspondent author:XU Xiaohong, female, Ph.D., Professor.
E-mail:xuxhf@whut.edu.cn

