凤尾菇(Pleurotussajor-caju)漆酶Lac4基因在黑曲霉中表达研究
李杰,李双,于盛竹,刘欢欢,张会
(1.东北农业大学生命科学学院,哈尔滨150030;2.东北农业大学资源与环境学院,哈尔滨150030)
凤尾菇(Pleurotussajor-caju)漆酶Lac4基因在黑曲霉中表达研究
李杰1,李双1,于盛竹2,刘欢欢1,张会1
(1.东北农业大学生命科学学院,哈尔滨150030;2.东北农业大学资源与环境学院,哈尔滨150030)
研究将凤尾菇漆酶基因Lac4(GeneBank登录号AJ507327.1)cDNA克隆到表达载体pSZHG10-6-2上,通过农杆菌介导法导入黑曲霉CICC2462中,筛选得到糖化酶基因glaA位点发生同源重组的黑曲霉转化子。摇瓶发酵后取上清液作SDS-PAGE检测、酶活测定及酶学性质和酶稳定性分析,研究重组漆酶对染料脱色影响。结果表明,成功分泌表达重组漆酶rLac4,其活性在第9天时达酶活最高峰1 211U·L-1;酶学性质研究发现,其最适反应温度为60℃、pH为4.5,且在10~30℃及pH 5.0~6.0稳定性较好。最适反应条件下,重组漆酶对ABTS的Km为0.142mmol·L-1,最大反应速率Vm为0.693mmol·L-1·m in-1·mg-1;通过重组漆酶研究4大类染料脱色能力,发现ABTS为介体时该漆酶对三苯基甲烷类孔雀绿脱色可达44%,杂环类中性红、偶氮类甲基橙脱色率分别13%和11%,而对蒽醌类活性亮蓝(RBBR)降解作用不明显,重组漆酶对孔雀绿的脱色效率具有较大应用价值潜力,对含三苯基甲烷染料废水处理应用前景良好。
漆酶;黑曲霉;异源表达;酶学性质;脱色
李杰,李双,于盛竹,等.凤尾菇(Pleurotus sajor-caju)漆酶Lac4基因在黑曲霉中表达研究[J].东北农业大学学报,2017,48(4): 7-14.
Li Jie,Li Shuang,Yu Shengzhu,et a l.Expression of Pleuro tus sajor-caju laccase Lac4 in Aspergillus n iger[J].Journa l of NortheastAgricultura lUniversity,2017,48(4):7-14.(in Chinese w ith English abstract)
漆酶(Laccase EC.1.10.3.2)是含铜多酚氧化酶,属于蓝色多铜氧化酶(Bluemulticopper oxi⁃dase,BMCOs)家族,最早在日本漆树(Rhusvernic⁃ifera)汁液中发现[1]。广泛分布于自然界昆虫、高等植物、真菌和细菌中,其中白腐真菌是重要漆酶生产菌[2],但天然漆酶产量低、稳定性差、培养周期长,且需要外加酚类化合物诱导产酶,限制漆酶工业化生产[3-5]。漆酶可降解木质素和多种有机毒物,在食品、纺织、纸浆造纸、木材加工、生物合成、能源等方面应用前景广泛。因此,生产优质、价廉的漆酶成为研究热点[6]。
目前,不同漆酶基因已成功异源表达于多个原核和真核表达系统中[7]。宿主体系包括酿酒酵母(Saccharomyces cerevisiae)[8-9]、甲醇毕赤酵母(Pich⁃iamethanolica)[10]、黑曲霉(Aspergillusniger)[11]、构巢曲霉(Aspergillusnidulans)[12]、灰盖鬼伞菌(Copri⁃nopsis cinerea)[13]、米曲霉(Aspergillussoryzae)[14]等。漆酶来源不同其结构与功能不同,表达效果存在差异[15]。
优化不同漆酶基因表达方法,如选择合适启动子与信号肽、表达宿主、优化发酵温度、培养条件等,可建立高效异源表达系统[16]。但目前漆酶基因异源表达仍不理想,常用的大肠杆菌、酿酒酵母、毕赤酵母仍无法高效表达漆酶[17]。与其他真核表达系统相比,黑曲霉(Aspergillusniger)作为丝状真菌中重要蛋白生产宿主[18],凭借强大蛋白分泌能力和优秀生物安全性,具有类似高等生物糖基化系统,成为重要的重组蛋白表达宿主和酶制剂生产菌。
本试验在分析凤尾菇漆酶基因Lac4(GeneBank No.AJ507327.1)编码的蛋白质序列基础上,通过基因工程手段构建自带信号肽的Lac4基因黑曲霉表达载体pSZHG10-6-2-lac4,将重组表达载体转化于黑曲霉CICC2462,旨在构建一株可分泌表达漆酶黑曲霉重组菌株。对表达产物作酶学性质和染料脱色效率研究,为进一步改造和应用漆酶提供参考[19]。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
黑曲霉CICC2462、大肠杆菌DH5α、农杆菌AGL1,基因Lac4,质粒pSZHG10-6-2由由东北农业大学丝状真菌遗传工程教研室保存。PCR引物设计:根据凤尾菇基因组中漆酶基因Lac4序列,利用primer5.0设计引物,引物序列见表1。
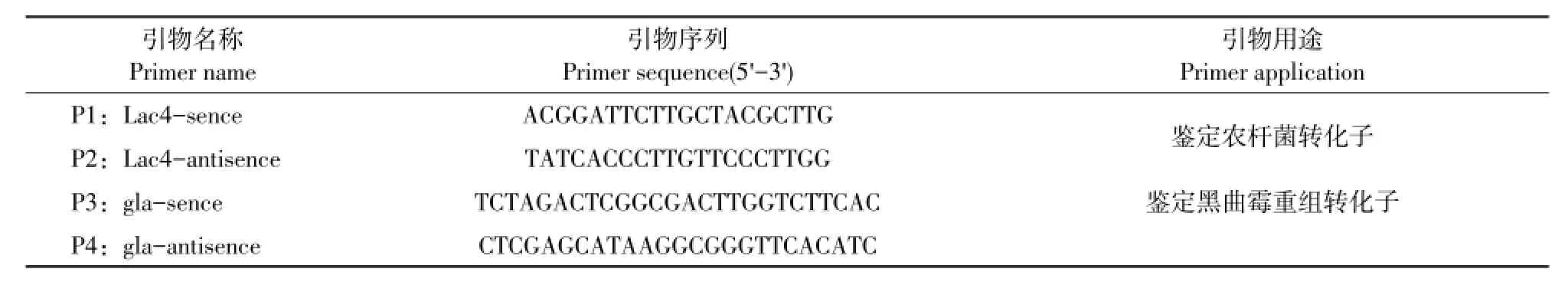
表1 引物序列Table1 Sequencesof prim er
1.1.2 主要试剂
试验中限制性内切酶购自TaKaRa公司,快速质粒小提取试剂盒、凝胶回收试剂盒、SDS-PAGE凝胶制备试剂盒、植物DNA基因组提取试剂盒均购自康为世纪生物科技有限公司;抗生素:利福平(Rif)、卡那霉素(Kan)、氨苄霉素(Amp)、乙酰丁香酮(As)均购自Sangon公司;2,2'-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)购自Amresco公司;孔雀绿、中性红、甲基橙、活性亮蓝(RBBR)均购自Biotopped公司。其他试剂均为分析纯。
1.2 方法
1.2.1 构建黑曲霉重组表达载体
用限制性内切酶XbaⅠ、HindⅢ酶切合成漆酶基因Lac4,将其基因片段切胶回收。用限制性内切酶NheⅠ、HindⅢ酶切载体pSZHG10-6-2,将载体片段切胶回收。将回收目的片段和载体片段按一定比例混合,加入T4 DNA Ligase(DNA连接酶),16℃连接1 h,转化大肠杆菌DH5α,在卡那霉素(Kan)抗性筛选下双酶切鉴定,得到重组表达载体pSZHG10-6-2-Lac4(见图1)。
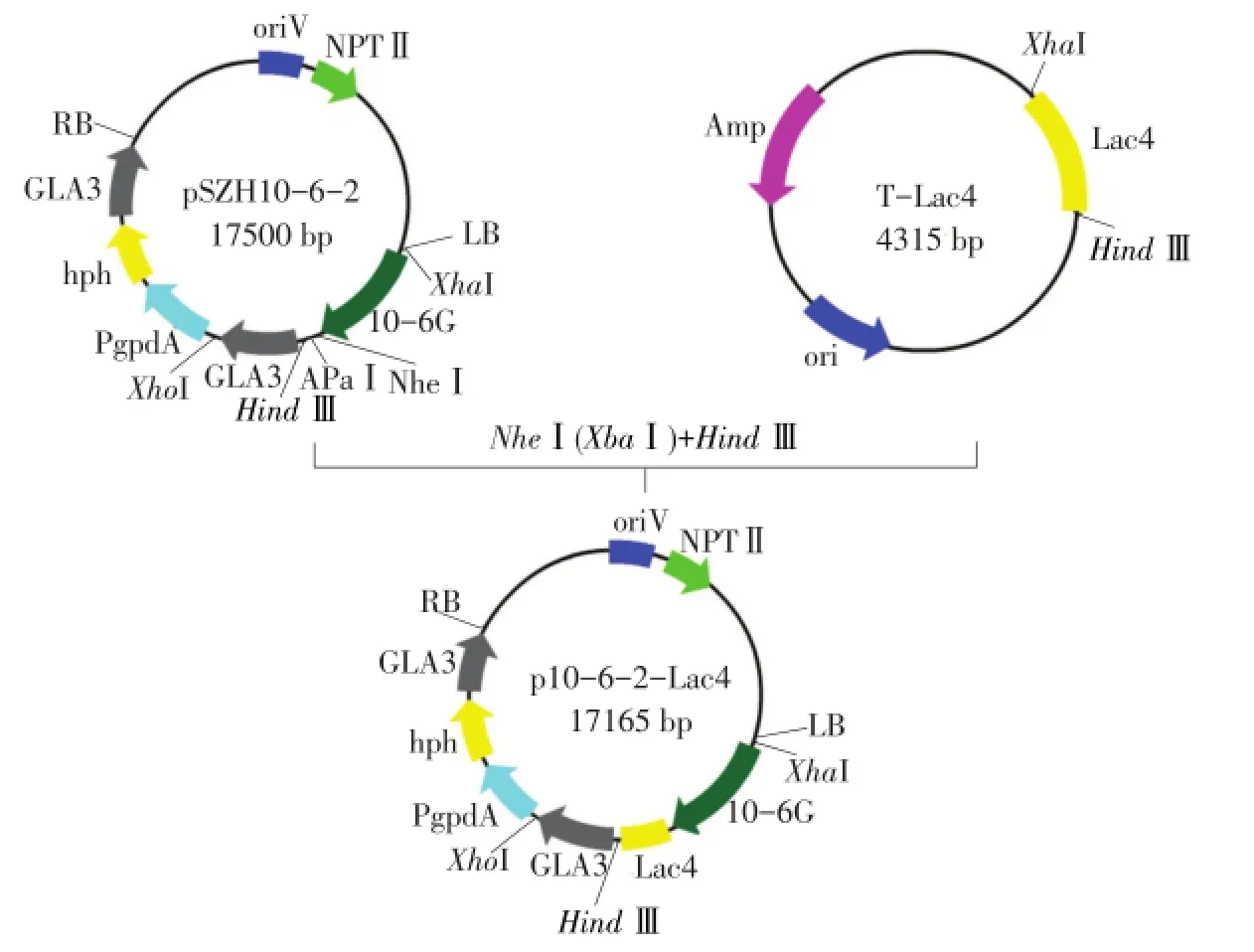
图1 重组表达载体pSZHG10-6-2-Lac4构建Fig.1 Construction of theexp ression vector pSZHG10-6-2-Lac4
1.2.2 农杆菌介导法转化黑曲霉
将鉴定正确重组质粒pSZHG10-6-2-Lac4加到农杆菌感受态中,利用基因引物P1、P2作PCR验证,水为阴性对照,重组质粒pSZHG10-6-2-Lac4为阳性对照,得到pSZHG10-6-2-Lac4农杆菌重组转化子。再利用农杆菌介导法将其转化到黑曲霉CICC2462中,培养3~5 d,观察培养基上单菌落。
1.2.3 筛选及鉴定阳性转化子
将筛选培养基上黑曲霉单菌落接种于PDA液体培养基中培养24 h,取适量菌丝,打碎,涂到含ABTS的PDA平板上作初次筛选,阳性菌株周围出现浅绿色透明圈,经PCR验证,获得重组漆酶的黑曲霉表达菌株。
1.2.4 黑曲霉重组菌株表达
将鉴定正确的黑曲霉重组转化子接种于发酵培养基中,30℃,250 r·min-1条件下震荡培养4 d后吸取发酵上清,于13 000 r·min-1下离心10min,取上清液,作蛋白和酶活等检测。
1.2.5 酶活测定
用0.5mmol·L-1的2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)为反应底物,在反应体系为4mL醋酸-醋酸钠缓冲液(pH 4.5)中反应3min,加入适量稀释倍数粗酶液,反应温度为30℃,420 nm下测定吸光值。定义每分钟转化1μmoL底物所需酶量为1个酶活力单位(U)。运用以下公式计算漆酶的酶活。测定结果重复3次。
其中,V1—反应液总体积(mL);V2—酶液体积(mL);ΔOD—单位时间(1min)内吸光度OD变化值;Δt—单位反应时间(1min);ε420(ABTS)(摩尔消光系数)=3.6×104moL·cm-1。
1.2.6 重组漆酶酶学性质研究
①重组漆酶最适温度和pH测定
取一定量漆酶发酵液,以ABTS为底物,在pH 4.5缓冲液中,分别在20~80℃(每隔10℃为一个梯度)下,反应3min,检测该酶相对酶活力,测得重组漆酶rLac最适反应温度。并在不同pH(3.0~7.5)醋酸-醋酸钠缓冲液中,以最适温度检测该酶酶活力,确定重组漆酶最适pH[20]。具体方法参见1.2.5酶活力检测,测定结果重复3次。
②重组漆酶温度稳定性和pH稳定性测定
温度稳定性测定:将漆酶发酵液在10~80℃(每隔10℃为一个梯度)下孵育2 h后,在最适温度及pH下测定漆酶酶活力,以最大酶活为100%。pH稳定性测定:重组漆酶粗酶液液置于在50mmol·L-1不同pH醋酸盐缓冲液(pH 4.0~7.0,每隔0.5一个梯度)中,4℃保温24 h,在最适条件下测定漆酶残余活性确定pH稳定性。测定结果重复3次。
1.2.7 动力学参数Km和Vm测定
将底物ABTS配置不同浓度,浓度范围0.25~2mmol·L-1,采用ABTS法,在最适pH和温度下测定酶活力,利用双倒数作图法(Linewear-Bank)作非线性拟合,得到重组漆酶对ABTS米氏常数Km值和最大反应速率Vm值[21]。
1.2.8 粗酶液对合成染料脱色研究
利用紫外-可见分光光度计在300~800 nm区间扫描,探讨重组漆酶Lac4对4种工业染料降解作用。得到几种染料最大吸收波长:孔雀绿为558 nm;中性红为527 nm;甲基橙为486 nm,;活性亮蓝(BRBB)为591 nm[6]。脱色体系中加入50mmol·L-1(pH 4.5)醋酸-醋酸钠缓冲溶液8.5m L、待降解染料0.5mL,0.01mmoL·L-1的ABTS作介体,最后加入重组漆酶酶液1mL启动反应,在30℃摇床过夜(24 h),检测4种染料吸光度值为A1;以未加Lac4漆酶反应体系为空白对照,测其吸光度值A0。所有测量均重复3次取平均值。脱色率计算公

2 结果与分析
2.1 黑曲霉表达载体pSZHG10-6-2-lac4构建
将酶切回收后Lac4基因片段和表达载体pS⁃ZHG10-6-2片段用T4DNA Ligase连接,转化大肠杆菌DH5α后,经卡那抗性筛选出大肠杆菌转化子,对重组质粒经XbaⅠ和HindⅢ双酶切后得到4 300 bp的含目的基因片段,证明为阳性克隆,成功构建表达载体pSZHG10-6-2-lac4(见图2)。
2.2 农杆菌介导法转化黑曲霉
将已构建的表达载体pSZHG10-6-2-Lac4通过冻融法转化到农杆菌感受态AGL1中,将其涂布在含有抗性可筛选出农杆菌转化子的YEB固体培养基上,28℃恒温培养2~3 d直至长出单菌落(见图3)。
PCR鉴定抗性菌落,以水为阴性对照,重组质粒为阳性对照,引物P1和P2荧光定量引物作PCR验证(见图4)。通过琼脂糖凝胶电泳检测,得到215 bp目的条带,与预期一致,表明目的片段成功转入到农杆菌AGL1中。

图2 表达载体pSZHG10-6-2-Lac4转入大肠杆菌中双酶切结果Fig.2 Doubleenzymesdigestion resu ltof exp ression vector pSZHG10-6-2-Lac4 transferred into E.coli
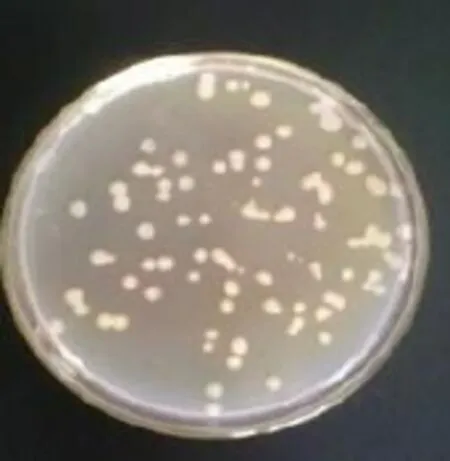
图3 表达载体pSZHG10-6-2-Lac4农杆菌转化结果Fig.3 Resu ltof pSZHG10-6-2-Lac4 transformants into AGL1
2.3 筛选黑曲霉转化子
将农杆菌和黑曲霉共培养,涂布于于含有乙酰丁香酮(AS)PDA固体培养基,2 d后在加有ABTS平板上作初次筛选,黑曲霉阳性转化子菌株周围出现绿色透明圈(见图5)。
2.4 黑曲霉重组转化子鉴定
挑取绿色透明圈菌株,于液体PDA培养基中培养约5 d,提取重组菌株基因组,经糖化酶引物P3、P4作PCR扩增,对PCR产物用Xba I和HindⅢ作双酶切,以水为阴性对照,出发菌株和pSZHG10-6-2-Lac4重组质粒为阳性对照,得出2 500 bp和1 400 bp条带,鉴定结果为黑曲霉重组转化子(见图6)。

图4 pSZHG 10-6-2-Lac4农杆菌转化子PCR鉴定结果Fig.4 Resultsof PCR identification of Agrobacterium tumefacien tranformantsofpSZHG10-6-2-Lac4
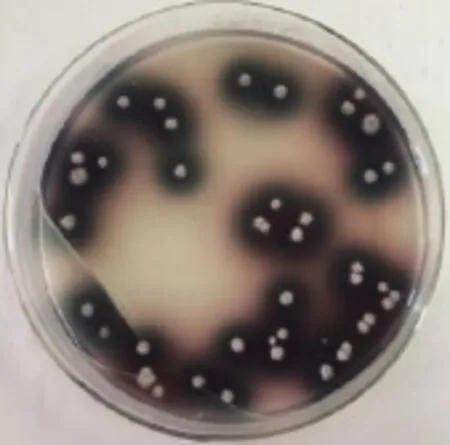
图5 pSZHG10-6-2-Lac4重组转化子初次筛选结果Fig.5 Initialscreening resultsof iden tification pSZHG 10-6-2-Lac4 recombination
2.5 重组漆酶的SDS-PAGE检测
将菌量足够出发菌株与pSZHG10-6-2-lac4同源重组菌株分别接种于发酵培养基中,取上清作SDS-PAGE检测,未见明显目的蛋白条带(见图7)。
2.6 重组菌株漆酶Lac4酶活检测
取发酵4~10 d上清液,按1.2.5方法检测酶活力。结果如图8所示,pSZHG10-6-2-Lac4重组菌株酶活力在第9天高达1 211 U·L-1,从第10天开始呈下降趋势。而出发菌株Asp中未检测到漆酶活性,说明凤尾菇漆酶Lac4基因在黑曲霉CICC2642中分泌表达。

图6 pSZHG10-6-2-Lac4重组转化子PCR酶切鉴定结果Fig.6 Doubleenzymesdigestion resu ltsof identification pSZHG10-6-2-Lac4 recombination positive transformantsby PCR

图7 重组漆酶SDS-PAGE电泳图谱Fig.7 SDS-PAGE of recombinant laccase

图8 重组菌株pSZHG 10-6-2-Lac4诱导表达漆酶活性Fig.8 Enzymeactivity of laccaseof recombinantstrain pSZHG10-6-2-Lac4
2.7 重组菌株中重组漆酶学性质分析
温度和pH对酶活力影响见1.2.5,分别在不同温度(20~80℃)和pH(3.0~7.5)下作酶活力检测,探究重组菌株所产漆酶最适温度(结果见图9,10)。结果发现,60℃酶活值最高,为该漆酶最适温度。30~70℃酶活均较高,说明其适合温度范围较大;pH 4.5时酶活力最高,为重组漆酶最适pH。重组漆酶在pH 4.0~5.0酶活较高。

图9 温度对酶活影响Fig.9 Effectof the tem peratureon enzymeactivity

图10 pH对酶活影响Fig.10 Effect of pH on enzym eactivity
2.8 pSZHG10-6-2-Lac4重组菌株中重组漆酶稳定性分析
重组漆酶热稳定性如图11所示。10~30℃孵育2 h后,重组漆酶活性保持在80%以上,40℃处理2 h后,仍保留70%以上残余酶活力,50℃时重组漆酶酶活损失较快,>60℃无法检测到漆酶活性。pH稳定性如图12所示。将发酵粗酶液置于不同pH(4.0~7.0)缓冲液中4℃环境下,24 h后检测酶活变化。结果显示,该重组漆酶在pH 5.0~6.0范围内稳定性较好且相对酶活均在80%以上,酶活损失较慢,其中pH为6时酶活最高、最稳定。一般来说,漆酶在pH>4、温度在20~40℃范围内相对较稳定;在酸性条件[22]及>50℃[23]时相对不稳定,与相关研究报道结果一致[24]。

图11 温度对漆酶稳定性影响Fig.11 Effectof temperatureon enzymeactivity

图12 pH对漆酶稳定性影响Fig.12 EffectofpH on enzymeactivity
2.9 重组漆酶的动力学参数
重组漆酶Lac4氧化不同浓度ABTS(0.25~2 mmol·L-1),测定酶活力与底物浓度用利用Linewear-Bank作图法[25]作非线性拟合,计算60℃时重组漆酶Lac4对ABTS米氏常数Km为0.142mmol·L-1,最大反应速率Vm为0.693mmol·L-1·min-1·mg-1。Km值越小,表明该漆酶对ABTS亲和能力越强。
2.10 粗酶液对合成染料脱色
4种染料蒽醌类活性亮蓝(RBBR)、杂环类中性红、偶氮类甲基橙和三苯基甲烷类孔雀绿染料浓度为1mmol·L-1,加入等量漆酶1 mL,发现该漆酶单独作用于染料降解时,脱色效果无明显变化;当ABTS为介体时,漆酶对孔雀绿脱色程度较高,反应24 h后脱色率达44%,对中性红和甲基橙脱色率为13%和11%,而对蒽醌类活性亮蓝(RBBR)脱色不明显。说明重组漆酶对孔雀绿脱色效率较高,对含三苯基甲烷染料废水处理应用前景良好。
3 讨论与结论
本研究建立的黑曲霉表达系统具有分泌蛋白能力强、翻译后加工机制完善、诱导条件简单、安全性高、适合于液态发酵等优点。利用该系统成功表达来源于凤尾菇Lac4漆酶基因,摇瓶发酵最高酶活为1 211 U·L-1,与张银波等[26-27]研究结果不同。出发菌株在相同条件下无法检测漆酶活性,重组菌株在筛选平板上显色清晰,说明重组菌株成功分泌表达重组漆酶Lac4。SDS-PAGE未检测到明显蛋白条带,一方面是重组漆酶表达量较低;另一方面可能是该酶糖基化位点较多,重组蛋白糖基化程度不同,形成弥散条带,或被糖化酶背景蛋白带掩盖。综上所述,该重组菌株表达重组漆酶蛋白量较低,但具有较高比酶活力。未来将进一步优化基因作密码子和信号肽、重组菌株摇瓶培养条件,提高重组蛋白表达量,实现漆酶高效异源表达[28]。
重组漆酶Lac4酶学性质及稳定性分析发现,虽然该酶最适温度为60℃,>60℃2 h后,无法检测活性,可能是长时间处于较高温度使蛋白结构发生变化。与裴佐蒂研究中大多数真菌漆酶最适温度为25~50℃结果相符[29]。
通过4种染料降解试验表明,该重组漆酶无法独自降解这4类染料,需ABTS作为介体发挥降解作用。漆酶脱色效果受酶活性、染料性质及染料吸附状态影响[30]。后期可从脱色体系中添加染料吸附剂或不同脱色介体等角度,对不同染料漆酶脱色,深入探索漆酶染料脱色应用[31]。
[1]刘英丽,刘骏明,王静,等.栓菌漆酶的异源表达及重组酶碳端和氮端组氨酸标签修饰对酶学特性的影响[J].食品科学, 2014,35(21):143-148.
[2]许颖,兰进.真菌漆酶研究进展[J].食用菌学报,2005,12(1): 57-64.
[3]Xiao Y Z,Tu X M,Wang J,etal.Purification,molecular charac⁃terization and reactivity with aromatic compounds of a laccase from basidiomycete Trametes sp.strain AH28-2[J].Applied Micro⁃ biology and Biotechnology,2003,60(6):700-707.
[4]Soden D M,Dobson A D.Differential regulation of laccase gene expression in Pleurotussajor-caju[J].Microbiology(Reading,Eng⁃land),2001,147(7):1755-63.
[5]郑苗苗,伊洪伟,邵淑丽,等.灰树花漆酶基因异源高效表达及对茜素红染料的脱色[J].中国食品学报,2015,15(12):31-38.
[6]郑苗苗,邵淑丽,张东向,等.红平菇漆酶基因异源表达及对染料脱色的研究[J].纺织学报,2014,35(12):84-90.
[7]宁娜,谭慧军,孙新新,等.真核生物来源漆酶的异源表达研究进展[J].生物工程学报,2017,33(4):1-13.
[8]Kojima Y,Tsukuda Y,Kawai Y,et al.Cloning,sequence analy⁃sis,and expression of ligninolytic phenoloxidase genes of the white-rot basidiomycete Coriolushirsutus[J].The Journalofbiolog⁃ical chemistry,1990,265(25):15224.
[9]Klonowska A,Gaudin C,AssoM,etal.LAC3,a new low redox po⁃tential laccase from Trametes,sp.strain C30 obtained asa recom⁃binantprotein in yeast[J].Enzyme&Microbial Technology,2005, 36(1):34-41.
[10]Guo M,Lu F,Pu J,etal.Molecular cloning of the cDNA encoding laccase from Trametes versicolor and heterologous expression in Pichia methanolica[J].Applied Microbiology and Biotechnology, 2005,69(2):178-83.
[11]Record E,PuntP J,ChamkhaM,etal.Expression of the Pycnopo⁃rus cinnabarinus laccase gene in Aspergillus niger and character⁃ization of the recombinant enzyme[J].Eur JBiochem.2002,269 (2):602-609.
[12]Larrondo L F,Avila M,Salas L,et al.Heterologous expression of laccase cDNA from Ceriporiopsis subvermispora yields copper-ac⁃tivated apoprotein and complex isoform patterns[J].Microbiology, 2003,149(5):1177-1182.
[13]Kilaru S,Hoegger P J,Majcherczyk A,et al.Expression of lac⁃case gene lcc1 in Coprinopsis cinerea under control of various ba⁃sidiomycetous promoters[J].App lied Microbiology and Biotechnol⁃ogy,2006,71(2):200-210.
[14]SkálováT,Dohnálek J,Østergaard LH,et al.The structure of the small laccase from Streptomyces coelicolor reveals a link between laccases and nitrite reductases[J].Journal of Molecular Biology, 2009,385(4):1165-78.
[15]贺立燕.杂色云芝漆酶同工酶基因的克隆及高效表达[D].南京:南京林业大学,2011.
[16]吴林,阳经慧,陈明杰,等.草菇漆酶基因vv-lac1和vv-lac6的克隆及异源表达[J].微生物学报,2014,54(7):828-835.
[17]董欣睿,秦丽娜,陶勇,等.糙皮侧耳(Pleurotus ostreatus)漆酶POXA1在里氏木霉中的高效表达及酶学性质[J].微生物学报, 2012,52(7):850-856.
[18]李杰,吴婷,马南,等.白曲霉酸性蛋白酶在黑曲霉中表达[J].东北农业大学学报,2016,47(5):29-35.
[19]高键.黑木耳漆酶基因克隆及其在毕赤酵母中的表达[D].哈尔滨:东北农业大学,2009.
[20]余小霞,刘晓青,田健,等.来源于枯草芽孢杆菌的漆酶cotA基因克隆与表达及其酶学性质研究[J].中国农业科技导报, 2015,17(1):102-108.
[21]胡斌斌,吴萍,刘晓青,等.来源于土壤宏基因组中漆酶Lac13H9基因克隆及其酶学性质分析[J].中国农业科技导报, 2015(2):64-71.
[22]Li JF,Hong Y Z,Xiao Y Z,etal.High production of laccase B from Trametes sp.in Pichia pastoris[J].World Journal ofMicrobi⁃ologyand Biotechnology,2007,23(5):741-745.
[23]Wang H X,Ng T B.Purification of a laccase from fruiting bodies of the mushroom Pleurotus eryngii[J].App lied Microbiology and Biotechnology,2006,69(5):521-525.
[24]郑邦晓,余湘萍,叶秀云,等.齿毛菌漆酶的基因克隆、异源表达及脱色研究[J].福州大学学报,2015,43(2):285-292.
[25]李琦.变色栓菌漆酶同工酶基因克隆表达及其在染料脱色中的应用[D].南京:南京林业大学,2013.
[26]张银波,姜琼,江木兰,等.金针菇漆酶基因的克隆及其在毕赤酵母中的表达研究[J].微生物学报,2004,44(6):775-779.
[27]张银波,江木兰,胡小加,等.平菇漆酶基因在毕赤酵母中的分泌表达及酶学性质研究[J].微生物学报,2005,45(4):625-629.
[28]刘晓庆,那日,郭九峰.漆酶基因异源表达及其酶活性的研究进展[J].安徽农业科学,2016(1):18-21.
[29]裴佐蒂.灰盖鬼伞漆酶在毕赤酵母中的异源表达及其酶学特性分析[D].上海:上海海洋大学,2013.
[30]张晓昱,颜克亮,王宏勋.稻草秆粉基质中白腐菌对三苯甲烷类染料的降解特性[J].应用与环境生物学报,2006,12(2):255-258.
[31]朱海潇,黄桂英,王霖,等.凤尾菇漆酶性质及应用的研究[J].福建农业学报,2008,23(1):48-52.
Expression of Pleurotus sajor-caju laccase Lac4 in Aspergillus niger/LI
Jie1,LIShuang1,YU Shengzhu2,LIU Huanhuan1,ZHANG Hui1(1.Schoo l of Life Sciences,Northeast Agricu ltural University,Harbin 150030,China;2.Schoo l of Resources and Environment,Northeast Agricu ltural University,Harbin 150030,China)
In the study,the laccase Lac4 gene(GeneBank login AJ507327.1)cDNA from Pleurotus sajor-caju had be cloned to expression vector pSZHG10-6-2,and through the method of agrobacterium mediated im port Aspergillus niger CICC2462,screening by homologous recombination in g laA loci homozygous transformation.After the fermentation was carried out,the supernatantwas subjected to SDSPAGE,enzymatic activity and enzymatic properties and enzym e stability.The effects of recombinant laccase on the decolorization of the dye were investigated.The results showed that the recombinant laccase rLac4 was successfu lly secreted and its activity reached the highest peak o f 1 211 U·L-1on the 9th day.The optim al temperature was 60℃,the optimum pH was 4.5,and the enzyme had good stability at10-30℃ and pH 5.0-6.0.Under the optimum reaction conditions,the Kmand Vmof recombinantprotein laccase w ith ABTS as the substrate were 0.142mmol·L-1and 0.693mm ol·L-1·m in-1·mg-1;In addition,the decolorization ability offour kinds of dyes by recombinant laccase was studied.Itwas found thatwhen the ABTS wasmediator,the lignase could decolorize 44%of the triphenylmethane peach green,the neutral red and azo methylOrange decolorization rates ofmethyl orange were 13%and 11%,respectively.The degradation effect of anthraquinone active b lue(RBBR)was notobvious,indicating that the recombinant laccase had great potentia l for the decolorization efficiency ofmalachite green.The wastewater treatment ofmethane dyes has a good app lication prospect.
laccase;Aspergillus niger;hetero logous exp ression;enzymatic properties;decolorization
Q815
A
1005-9369(2017)04-0007-08
时间2017-4-24 6:19:33[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170424.0619.002.html
2017-03-14
黑龙江省应用技术研究与开发计划重大项目(GA15B203)
李杰(1972-),男,副教授,博士,研究方向为微生物工程。E-mail:lijie_neau@126.com

