干旱胁迫对13个杜鹃品种生理特性的影响
胡肖肖++唐宇力++贾梅++金荷仙

摘要:以13个品种杜鹃(Rhododendron)2年生苗为材料,研究不同程度干旱胁迫对杜鹃叶片形态、相对含水量、水分饱和亏缺、细胞膜透性(相对电导率)、最大光化学效率(Fv/Fm)、潜在光化学效率(Fv/Fo)的影响,评价杜鹃品种的抗旱性。研究结果表明,叶片形态、水分饱和亏缺、相对电导率值随干旱胁迫程度增加而升高;相对含水量随胁迫程度增加而降低;最大光化学效率及潜在光化学效率在重度胁迫下显著下降。根据模糊隶属函数综合评价13个杜鹃品种的抗旱性,其抗旱性排序为国旗红>玉蝴蝶>大青莲>胭脂蜜>大鸳鸯锦>蓝樱>状元红>红月>新天地>紫萼>琉球红>粉珊瑚>红珊瑚。各杜鹃品种均可以通过其形态、生理特性来适应干旱胁迫环境。
关键词:杜鹃;干旱胁迫;抗旱性;生理特性;隶属函数
中图分类号: S685.210.1文献标志码: A文章编号:1002-1302(2017)06-0101-04
杜鹃花属(Rhododendron)为杜鹃花科(Ericaceae)中最大的属,全世界有1 000余种,中国约有562种,为世界杜鹃分布中心之一[1]。杜鹃花是中国十大名花之一,其种类繁多,花色艳丽,具有较高的观赏价值、经济价值和药用价值,在园林中应用广泛。根据杜鹃的产地来源、亲缘关系、形态习性和观赏特征,把栽培的杜鹃属品种分成东鹃、毛鹃、西鹃、夏鹃4个类型[2],由于起源与地理环境的不同,各杜鹃品种对环境的适应性上表现出较大差异[3],因此对于不同类型的杜鹃品种,在栽培管理上需要采取相应的管理措施。
杜鹃在园林绿化及室内观赏栽培中,最易受到水分的影响[4-5],尤其对干旱胁迫比较敏感,缺水会导致其生长受阻而死亡[6]。杜鹃园艺品种经过引种驯化适应新的环境,但是往往在实地应用中存在诸如高温、土壤供给水分不足等因素影响而导致杜鹃生长不良的现象。目前,针对杜鹃园艺品种的耐旱性研究较少,主要集中在土壤水分胁迫对杜鹃生理生化指标特性及抗旱性评价方面[4-5,7],对杜鹃在干旱胁迫下叶片形态以及荧光特性变化的研究甚少。本研究选取13个观赏价值较高的杜鹃品种,通过设置不同干旱梯度的处理,研究不同品种杜鹃对土壤水分胁迫的生理、形态、荧光参数变化,以期筛选出耐旱的杜鹃品种,为西湖景区杜鹃花的水肥管理和栽培养护,提供理论依据。
1材料与方法
1.1试验材料
供试杜鹃品种13个——大青莲、红珊瑚、粉珊瑚、大鸳鸯锦、胭脂蜜、红月、蓝樱、新天地、琉球红、状元红、国旗红、玉蝴蝶和紫萼,购于嘉兴嘉善魏塘杜鹃盆景园,上述品种在西湖景区灵隐路段及灵隐胜境广场应用表现较好。2015年4月将长势一致的2年生苗木定植于高25 cm、直径30 cm的普通塑料花盆内,盆土为普通园土,每盆盛土量一致,放置于杭州植物园科研中心温室大棚(30°15′N,120°07′E)进行试验。
1.2处理方法
于2015年10月7日给苗木浇水到饱和,随后连续干旱处理。处理0 d,测得当天土壤含水量为28.8%,并以此设置为对照组(CK);在干旱胁迫的15、35、55 d,测得其土壤含水量范围依次为10%~20%、5%~9%、0~4%。按照Hsiao等对干旱胁迫程度的划分方法[8-9],干旱15、35、55 d分别达到轻度干旱(LD)、中度干旱(MD)、重度干旱(SD)。在干旱处理的0、15、35、55 d分别观察记录植物叶片形态,并测定叶片相对含水量、水分饱和亏缺以及细胞膜透性,并用Li-6400便携式光合仪在温室大棚内活体测最大光化学效率(Fv/Fm)以及潜在光化学效率(Fv/Fo)。其中叶片形态评价参照文献[10]进行;采用烘干和饱和称重法测定叶片含水量;采用电导法[11]测定叶片细胞膜透性。
1.3抗旱性综合评价
根据干旱胁迫后测定的各项指标,采用模糊数学中的隶属函数值法进行抗旱性综合评价。如果某一指标与抗旱性呈正相关,则采用隶属函数计算,公式为:
X(μ)=(X-Xmin)/(Xmax-Xmin)。
如果某一指标与抗旱性呈负相关,则采用反隶属函数计算,公式为:
X(μ)=1-(X-Xmin)/(Xmax-Xmin)。
式中:X(μ)为隶属函数值,X为干旱胁迫下某一指标的测定值,Xmin和Xmax为所有参试指标中某一指标的最大值和最小值。将参试材料所有指标的隶属函数值加起来求其平均值,用平均值大小综合评价抗旱性强弱。
1.3数据分析
采用SPSS 16.0统计软件进行方差分析,同类数据显著性差异运用Duncans检验法进行多重比较。
2结果与分析
2.1干旱胁迫对叶片形态的影响
13个杜鹃花品种随着干旱胁迫时间的延长,胁迫程度加重,土壤水分含量由饱和到轻度干旱(LD)、中度干旱(MD)、重度干旱(SD),叶片萎蔫指数也逐渐加重(表1)。不同时段处理下叶片萎蔫平均级别分别为0.00、0.87、2.31、3.41级,显然随着干旱级别的增加,植物的萎蔫级别升高,叶片萎蔫程度加重。控水15 d(轻度干旱),红珊瑚、粉珊瑚、红月、新天地、状元红萎蔫级别达到1.33以上,其中新天地达到 1.67,显著高于大青蓮、大鸳鸯锦、胭脂蜜、蓝樱、琉球红、国旗红、玉蝴蝶、紫萼;控水35 d(中度干旱),红珊瑚、粉珊瑚、红月、状元红这4个品种的叶片萎蔫指数达到3.00,国旗红最低,仅有1.00;控水55 d(重度干旱),粉珊瑚与琉球红的平均萎蔫级别增加至4.5级,红珊瑚叶片平均萎蔫级别增加至4级,而国旗红叶片平均萎蔫级别只有1.67级,显著低于其他各品种。
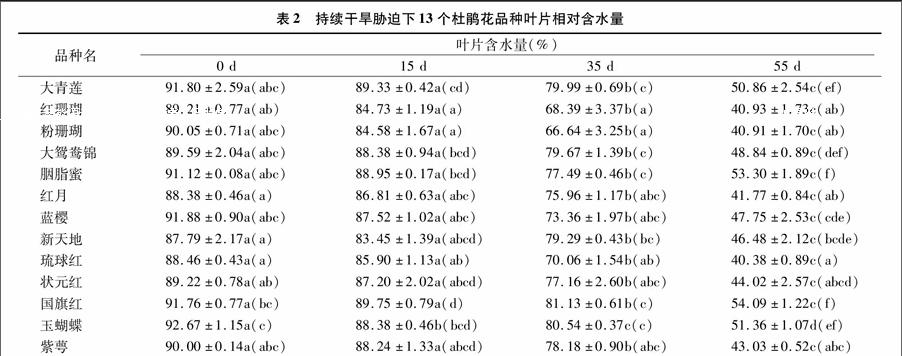
2.2干旱胁迫对叶片相对含水量的影响
叶片相对含水量能直观地反映植物体内水分生理的变化情况。植物在受到干旱胁迫时,叶片相对含水量会随着干旱胁迫程度的加深而下降,抗旱性越强降幅越小。由表2可见,13个杜鹃品种的叶片相对含水量,不同时段干旱处理下存在
较大差异。处理0 d,叶片含水量在87.79%~92.67%,新天地含水量最低;控水15 d,玉蝴蝶下降幅度最大,其余12个品种下降幅度较小;控水35~55 d,叶片含水量大幅降低,其中重度干旱胁迫(55 d)下,叶片含水量只有40.38%~54.09%,琉球红最低,只有40.38%,表现差异显著(P<005)。
2.3干旱胁迫对叶片相对电导率的影响
电导率反映了在胁迫下细胞膜透性情况,外渗电导率低的种质抵御干旱能力较强,有利于维持细胞膜的稳定性,保持细胞的正常生命代谢[12]。由表3可知,在轻度胁迫条件下,蓝樱和琉球红的相对电导率较CK略有降低,其余杜鹃花品种叶片相对电导率都不同程度上升,且红珊瑚、红月、蓝缨、新天地相对电导率与对照差异显著,其余品种与对照差异不显著;比较LD处理与MD处理下相对电导率值,除大鸳鸯锦、胭脂蜜、新天地、国旗红、玉蝴蝶差异不显著外,其他品种差异显著(P<0.05),且国旗红和玉蝴蝶2个品种在CK、LD和MD条件下,相对电导率值差异不显著;比较MD处理与SD处理下相对电导率值,除红月和状元红表现差异不显著外,其余品种差异均显著(P<0.05)。
2.4干旱胁迫对叶绿素荧光参数的影响
叶绿素可变荧光(Fv)反映光合作用中的光系统Ⅱ(PSⅡ)原初电子受体QA的还原情况,最大荧光产量(Fm)是PSⅡ反应中心处于完全关闭时的量子产量,可反映通过PSⅡ的电子传递情况[13]。Fv/Fm是叶绿体PSⅡ最大光化学量子产量,它反映PSⅡ反应中心内的光能转换效率。表4可见,与CK相比,持续控水15~35 d,13个杜鹃品种的Fv/Fm值均无差异性;持续控水55 d,13个杜鹃品种的Fv/Fm下降明显,但各品种下降幅度不一,国旗红的Fv/Fm值最高(0.771),琉球红最低,仅有0.209。
Fv/Fo为潜在光化学效率,可以反映光反应中心PSⅡ的潜在活性。由表5可知,控水15 d,13个杜鹃品种的Fv/Fo与对照差异均不显著;控水35 d,除大青莲、红珊瑚、粉珊瑚、
新天地、琉球红外,其余杜鹃品种的Fv/Fo值与对照差异不显著;控水55 d,大鸳鸯锦、胭脂蜜、红月、蓝樱、状元红、国旗红、玉蝴蝶、紫萼与CK组比较差异显著。
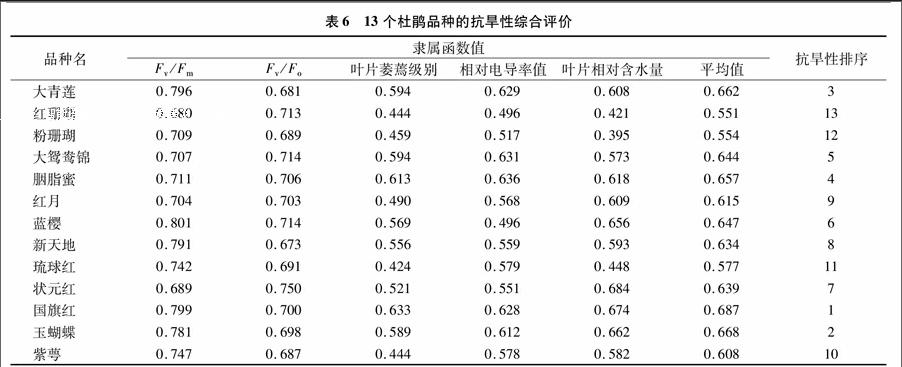
2.513个杜鹃品种抗旱性综合评价
由表6可知,各品种平均隶属函数值在0.551~0.687之间,其中国旗红、玉蝴蝶、大青莲、胭脂蜜的隶属函数值相对较大,分别为0.687、0.668、0.662、0.657,琉球红、红珊瑚、粉珊瑚的隶属函数平均值较小,为0.577、0.551、0.554,剩余杜鹃品种隶属函数值介于上述品种之间。说明国旗红、玉蝴蝶、大青莲、胭脂蜜抗旱性最强,琉球红、红珊瑚、粉珊瑚抗旱性最弱。
3结论与讨论
逆境条件下植物外部形态发生明显变化,叶片变化最为明显,在干旱胁迫下会发生运动,如叶片萎蔫、方位改变和叶角变化等[14]。众多研究者采用叶片萎蔫等级来鉴定植株在干旱胁迫下的叶片受害程度,且级别越高,受害程度越大[10,15-16]。本研究中,各品种的萎蔫程度随干旱胁迫程度增加而增大,这与叶片含水量降低有直接关系。叶片相对含水量可以准确反映植物体内的水分状况,在持续控水条件下,土壤水分含量降低,杜鹃进行新陈代谢和蒸腾作用消耗大量的水分,杜鹃的叶片相对含水量出现一定幅度下降。含水量降低,改变了原生质膜透性,原生质膜是细胞内外的一层屏障,可以有效地防御水分胁迫等逆境引起的伤害,从而维持细胞结构的稳定性。植物处于干旱胁迫下时,细胞膜透性增大,稳定性降低,大量离子外渗,叶片细胞膜外渗液的电导率增大,细胞膜的选择透性改变或丧失,从而导致细胞膜损伤[17-18]。本试验中,各品种叶片细胞膜外渗液的电导率随干旱胁迫加剧而增加,且抗旱性较强的品种的相对电导率变化较小。
叶绿素荧光参数能够对植物体内的光合机构运转情况进行无损伤诊断,可以反映逆境胁迫下PSⅡ反应中心的受损程度[19]。Li等将叶绿素荧光参数作为干旱胁迫品种比较的主要依据,认为水分胁迫会对植株叶片的Fv/Fm产生影响[20]。Fv/Fm值一般恒定为0.80~0.85,当植物受到环境胁迫时,Fv/Fm值会发生显著变化,因此,它是研究植物光合作用和生理生化的一个使用最广的荧光参数[21]。本研究发现杜鹃在15~35 d控水干旱胁迫下,各品种Fv/Fo和Fv/Fm下降幅度较小,与CK差异不显著,说明中度干旱胁迫对其还未产生伤害。这一测定结果还可能与10月份的杭州天气有关,其温度在12~25 ℃,湿度在60%~90%,阴雨天气占2/3左右,植株在高湿度环境中,蒸腾作用减弱,失水较少。在重度干旱胁迫下,13个杜鹃品种的Fv/Fm值才显著下降,且各品种下降幅度不一,国旗红的Fv/Fm值为0.771,表明受伤害程度较小,玉蝴蝶、大青莲的值也在0.60以上,表现出较强的抗旱能力。
综合各指标隶属函数值比较13个品种抗旱性强弱,由强到弱依次为国旗红>玉蝴蝶>大青莲>胭脂蜜>大鸳鸯锦>蓝樱>状元红>红月>新天地>紫萼>琉球红>粉珊瑚>红珊瑚。在园林植物应用中,结合植物观赏特性,择优选择较耐旱的杜鹃品种应用于实际中,有利于后期对植物的水肥管理和栽培养护。
參考文献:
[1]余树勋. 杜鹃花[M]. 北京:金盾出版社,1992.
[2]黄茂如. 杜鹃花[M]. 上海:上海科学技术出版社,1998.
[3]方瑞征,闵天禄. 杜鹃属植物区系的研究[J]. 云南植物研究,1995,17(4):359-379.
[4]柯世省,杨敏文. 水分胁迫对云锦杜鹃抗氧化系统和脂类过氧化的影响[J]. 园艺学报,2007,34(5):1217-1222.
[5]张晓勤,吴克利,薛大伟. 湿害对不同大麦基因型抗氧化酶系统的影响[J]. 浙江大学学报(农业与生命科学版),2009,35(3):315-320.
[6]李波,吴月燕,崔鹏. 水分胁迫对两种基因型杜鹃生理生化特性的影响[J]. 浙江农业学报,2011,23(5):988-994.
[7]周廣,孙宝腾,张乐华,等. 井冈山杜鹃叶片抗氧化系统对高温胁迫的响应[J]. 西北植物学报,2010,30(6):1149-1156.
[8]Hsiao T C. Plant responses to water stress[J]. Ann Rev Plant Physiol,1973,24:519-570.
[9]柯世省,金则新. 干旱胁迫与复水对夏腊梅幼苗光合生理特性的影响[J]. 植物营养与肥料学报,2007,13(6):1166-1172.
[10]田治国,王飞,张文娥,等. 万寿菊属不同品种初花期抗旱特性分析[J]. 西北植物学报,2011,31(7):1390-1399.
[11]李合生,孙群,赵世杰,等. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:184-185.
[12]薛瑞,周广奇,胡新文,等. 柱花草种质抗旱性综合评价[J]. 中国农学通报,2009,25(11):224-233.
[13]朱新广,王强,张其德,等. 冬小麦光合功能对盐胁迫的响应[J]. 植物营养与肥料学报,2002,8(2):177-180.
[14]Navas M L,Garnier E. Plasticity of whole plant and leaf trait in Rubia peregrine in response to light,nutrient and water availability[J]. Acta Oecologica-International Journal of Ecology,2002,23(6):375-383.
[15]周招娣,张日清,马锦林,等. 6个油茶物种苗期抗旱性的初步研究[J]. 经济林研究,2014,32(2):53-57.
[16]王晓娟,周兰英. 干旱胁迫对红花檵木生长及生理特性的影响[J]. 四川农业大学学报,2015,33(1):22-32.
[17]Bohnert H J,Jebsen R G. Strategies for engineering water-stress tolerance in plants[J]. Trends in Biotechnology,1996,14(3):89-97.
[18]Munns R. Comparative physiology of salt and water stress[J]. Plant Cell and Environment,2002,25(2):239-250.
[19]Misra A N,Srivastava A,Strasserr J,et al. Utilization of fast chlorophyll a fluorescence technique in assessing the saltion sensitivity of mung bean and Brassica seedlings[J]. Journal of Plant Physiology,2001,158(9):1173-1181.
[20]Li L,van Staden J. Effcets of plant growth regulators on the antioxidant system in callus of two maize cultivars subjected to water stress[J]. Plant Growth Regulation,1998,24(1):55-56.
[21]张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.杜玉玲,潘晨慧,李丹阳,等. 利用隶属函数值法对7种一、二年生花卉耐盐性的综合评价[J]. 江苏农业科学,2017,45(6):105-111.
doi:10.15889/j.issn.1002-1302.2017.06.026

